各类元素离子半径最全版
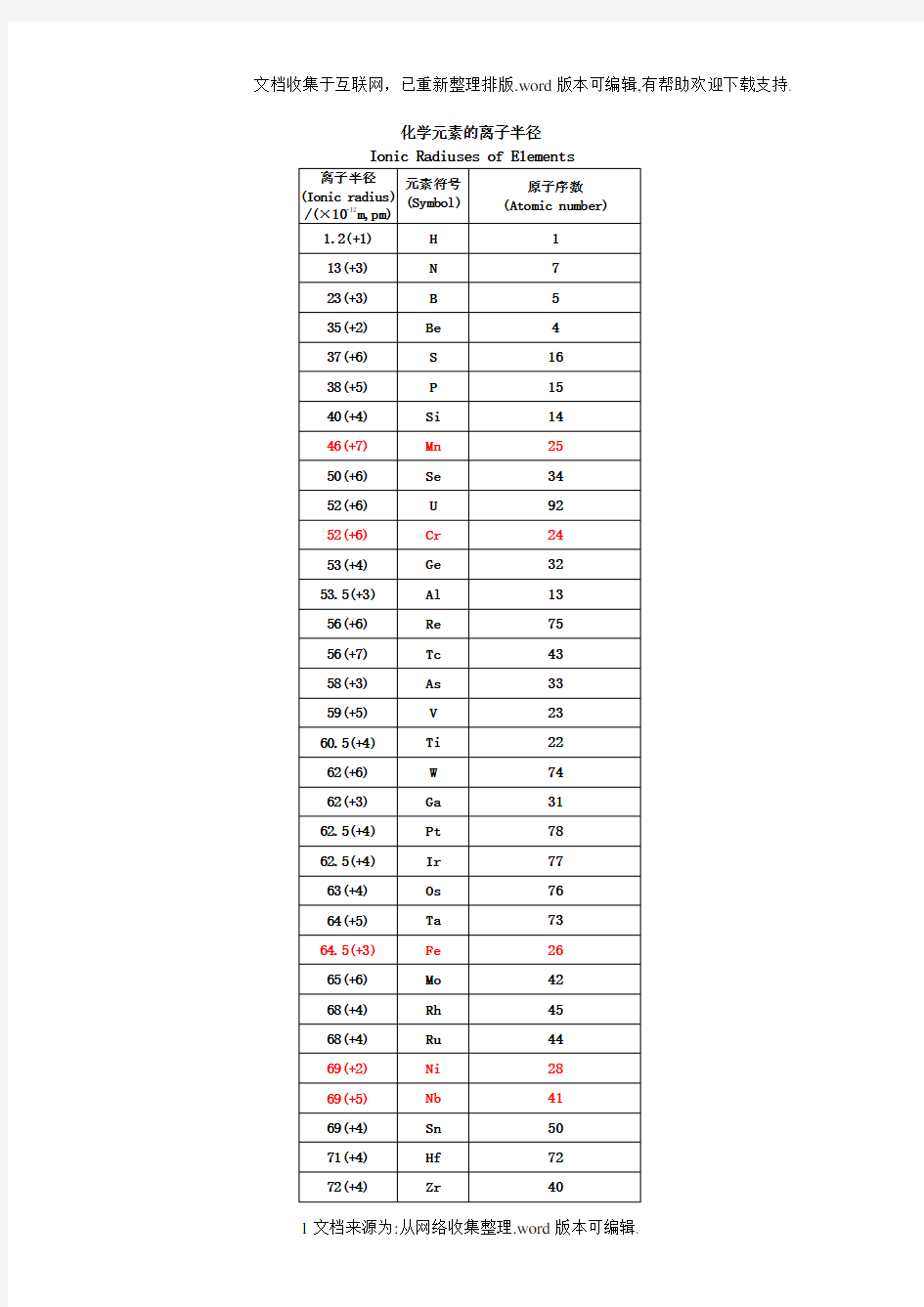

化学元素的离子半径Ionic Radiuses of Elements
离子半径方法总结
离子半径方法总结 导读:离子半径方法总结 一种是同一周期内元素的微粒,阴离子半径大于阳离子半径,如硫离子>铝离子,与原子半径的顺序相反;另一种是具有相同电子层结构的离子(单核),核电荷数越小,半径越大,这里也只有阴离子半径大于阳离子半径符合,如氧离子或氟离子半径>钠离子或镁离子或铝离子,但是记住氧离子半径>氟离子,钠离子>镁离子,与原子半径顺序一致。 (1)同一元素的微粒,电子数越多,半径越大。如钠原子>钠离子,氯原子(2)同一周期内元素的微粒,阴离子半径大于阳离子半径。如氧离子>锂离子 (3)同类离子与原子半径比较相同。如钠离子>镁离子>铝离子,氟离子(4)具有相同电子层结构的离子(单核),核电荷数越小,半径越大。如氧离子>氟离子>钠离子>镁离子>铝离子硫离子>氯离子>钾离子>钙离子 (5)同一元素高价阳离子半径小于低价阳离子半径,又小于金属的原子半径。如铜离子硫原子>四价硫>六价硫 离子的最外层电子数相同,原子序数越大,半径反而越小, 若离子的最外层电子层数不同,则层数越多半径越大,例如卤素和碱金属,卤素离子比下一周期的碱金属要大,比同周期也要大,但一般不作比较。
同一元素的不同离子半径(都为正电荷或都为负电荷时)又如何比较 根据氧化性还原性比较,例如:Fe3+氧化性强于Fe2+,所以半径更小 【离子半径方法总结】 1.学习方法的总结 2.练琴方法大总结 3.清理总结写作方法 4.导数大题方法总结 5.bga焊接方法总结 6.求极限方法总结 7.英语做题方法总结 8.英语“强调”方法总结 上文是关于离子半径方法总结,感谢您的阅读,希望对您有帮助,谢谢
离子半径
数称号 3 锂Li +1 76 4 铍Be +2 45 5 硼 B +3 27 6 碳 C +4 16 7 氮N ?34146 +3 16 +5 13 8 氧O ?2 140 9 氟 F ?1 133 +7 8 11 钠Na +1 102 12 镁Mg +2 72 13 铝Al +3 53.5 14 硅Si +4 40 15 磷P +3 44 +5 38 16 硫S ?2 184 +4 37 +6 29 17 氯Cl ?1 181 +5 12 +7 27 19 钾K +1 138 20 钙Ca +2 100 21 钪Sc +3 74.5 22 钛Ti +2 86 +3 67 +4 60.5 23 钒V +2 64 +4 58 +5 54 24 铬Cr +2 73 ls +2 80 hs
数称号 +3 61.5 +4 55 +5 49 +6 44 25 锰Mn +2 67 +3 58 ls +3 64.5 hs +4 53 +54 33 +64 25.5 +7 46 26 铁Fe +2 61 ls +2 78 hs +3 55 ls +3 64.5 hs +4 58.5 +64 25 27 钴Co +2 65 ls +2 74.5 hs +3 54.5 ls +3 61 hs +4 53 28 镍Ni +2 69 +3 56 ls +3 60 hs +4 48 ls 29 铜Cu +1 77 +2 73 +3 54 ls 30 锌Zn +2 74 31 镓Ga +3 62 32 锗Ge +2 73 +4 53 33 砷As +3 58
数称号 +5 46 34 硒Se ?2 198 +4 50 +6 42 35 溴Br ?1 196 +34sq 59 +5431 +7 39 37 铷Rb +1 152 38 锶Sr +2 118 39 钇Y +3 90 40 锆Zr +4 72 41 铌Nb +3 72 +4 68 +5 64 42 钼Mo +3 69 +4 65 +5 61 +6 59 43 锝Tc +4 64.5 +5 60 +7 56 44 钌Ru +3 68 +4 62 +5 56.5 +74 38 +84 36 45 铑Rh +3 66.5 +4 60 +5 55 46 钯Pd +12 59 +2 86 +3 76 +4 61.5
离子半径数据
离子半径数据 (除注明外均为六配位,非六配位时以上标标注,如+34。ls=低自旋,hs=高自旋。[2]) 原子序数元素名称元素符号离子半径 pm 3 锂Li +1 76 4 铍Be +2 45 5 硼 B +3 27 6 碳 C +4 16 ?34 146 7 氮N +3 16 +5 13 8 氧O ?2 140 9 氟 F ?1 133 +7 8 11 钠Na +1 102 12 镁Mg +2 72 13 铝Al +3 53.5 14 硅Si +4 40
离子半径数据 (除注明外均为六配位,非六配位时以上标标注,如+34。ls=低自旋,hs=高自旋。[2]) 原子序数元素名称元素符号离子半径 pm 15 磷P +3 44 +5 38 ?2 184 16 硫S +4 37 +6 29 ?1 181 17 氯Cl +5 12 +7 27 19 钾K +1 138 20 钙Ca +2 100 21 钪Sc +3 74.5 +2 86 22 钛Ti +3 67 +4 60.5 +2 64 23 钒V +4 58 +5 54 +2 73 ls +2 80 hs 24 铬Cr +3 61.5 +4 55 +5 49
离子半径数据 (除注明外均为六配位,非六配位时以上标标注, 如+34。ls =低自旋,hs =高自旋。[2]) 原子序数 元素名称 元素符号 离子半径 pm +6 44 +2 67 +3 58 ls +3 64.5 hs 25 锰 Mn +4 53 +54 33 +64 25.5 +7 46 +2 61 ls +2 78 hs 26 铁 Fe +3 55 ls +3 64.5 hs +4 58.5 +64 25 +2 65 ls +2 74.5 hs 27 钴 Co +3 54.5 ls +3 61 hs +4 53 +2 6 9 +3 56 ls 28 镍 Ni +3 60 hs +4 48 ls 29 铜 Cu +1 7 7 +27
离子半径
一、原子或离子半径大小比较 电子层数相同条件下,电子层越多,半径越大。 判断的依据核电荷数相同条件下,核电荷数越多,半径越小。 最外层电子数相同条件下,最外层电子数越多,半径越大。 微粒半径的比较1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外) 2、同同周期元素的离子半径 3同主族元素的原子半径随核电荷数的增大而增大。 具体规律4、同主族元素的离子半径随核电荷数的增大而增大 5、电子层结构相同的离子半径随核电荷数的增大而减小。 6、同一元素不同价态的微粒半径,价态越高离子半径越小 比较下列微粒的半径大小 ①比较Na原子与Mg原子的原子半径大小②比较Na原子与Li原子的原子半径大小③比较Na与Na+的半径大小④比较Cl-与Cl的半径大小 ⑤比较Fe、Fe2+与Fe3+的半径大小⑥比较Na+与Mg2+半径大小 ⑦比较O2-与F-半径大小⑧写出下列微粒的半径由大到小的顺序:F-、O2-、Na+、Mg2+⑨在Na、K、O、N、C.Li、F、H八种元素中,原子半径由小到大的顺序为____ ____ ⑩下列化合物中,阳离子与阴离子半径比最小的是()A.NaF B.LiI C.CsF D.LiF 二、有关的微粒电子层结构 1.下列微粒中,电子层结构完全相同的一组是()A.S2-、Cl-、K+B.Cl-、Br-、I-C.Na+、 Mg2+、F-D.O2-、Mg2+、Cl- 2.下列各组微粒具有相同的质子数和电子数的是 A.OH-、H2O、F-B.NH3、NH4+、NH2-C.H3O+、NH4+、NH2-D.HCl、F2、H2S 3.A和B是前三周期的元素,它们的离子A2+和B3+具有相同的核外电子层结构,下列说法正确的是A.原子半径:A>B B.原子序数:A>B C.离子半径:A2+>B3+D.质量数:A>B 4.A元素的阳离子和B元素的阴离子具有相同的电子层结构。下列叙述正确的是 A.原子半径:AB C.原子最外层上电子数:B>A D.A的正价与B的负价的绝对值相等 5.已知元素X、Y的核电荷数分别是a和b,且它们的离子X m+和Y n-的核外电子排布相同,则下列关系式中正确的是 A.a=b+m+n B.a=b-m+n C.a=b+m-n D.a=b-m-n 6.a、b、c三种元素的原子序数均小于20,a、b两元素的阳离子和c元素的阴离子都有相同的电子层结构,a原子的半径大于b原子的半径,则三种元素的原子序数的关系是()A.a>b>c B.b >a>c C.c>b>a D.a>c>b 7.A.B均为原子序数1~20的元素,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数是 A.n+4 B.n+6 C.n+8 D.n+10 三、元素性质递变规律 1、下列各组元素中,按最高正价递增顺序排列的是()A.C.N、O、F B.K、Mg、C.S C.F、
化学离子半径比较专题讲解及习题(含答案)
离子半径比较专题 一、规律方法总结 1、微粒半径大小的比较一般要掌握以下规律: (1).对原子来说:①同周期元素的原子(稀有气体除外),从左到右原子半径逐渐▁▁ ; ②同主族元素的原子,从上到下原子半径逐渐▁▁▁▁。 ③稀有气体元素的原子半径▁▁▁同周期元素原子半径。 (2).对离子来说:除符合原子半径递变规律外,经常使用的比较原则是: ①同种元素的原子和离子相比较,阳离子比相应原子半径▁▁,阴离子比相应原子半 径▁▁; ②电子层结构相同的粒子(如O F Na Mg Al 223--+++、、、、),随着核电荷数的▁▁ ▁▁,离子半径▁▁▁▁。 2、微粒半径大小判断简易规律: (1)、同元素微粒:r 阳离子 ? r 原子 ? r 阴离子 (2)、同主族微粒:电子层数越多,半径越大 (3)、电子层数相同的简单微粒:核电荷数越大,半径越小 3、判断三部曲 第一步... 先看电子层数,因为其半径大小的决定因素是电子层数。电子层数越多,其半径越大。 第二步... 在电子层数相同的情况下看核电荷数,因为核电荷数的多少是影响半径大小的次要因素。而核电荷数越多,其半径越小。 第三步... 在电子层数和核电荷数相同的情况下看电子数,核外电子数是影响半径大小的最小因素。核外电子数越多,其半径越大。 值得注意的是此三步不可颠倒。 4、填空 1)、同周期原子半径随原子序数的递增而 r(Na) r(Mg) r(Al) r(Si) r(P) r(S) r(Cl) 2)、同主族原子半径随原子序数的递增而 r(Li) r(Na) r(K) r(Rb) r(F) r(Cl) r(Br) r(I) 3)、同周期阳(阴)离子半径随原子序数的递增而 。 r(Na +) r(Mg 2+) r(Al 3+) r(P 3-) r(S 2-) r(Cl -) 4)、同主族阳(阴)离子半径随原子序数的递增而 r(Li +) r(Na +) r(K +) r(F -) r(Cl -) r(Br -) r(I -) 5)、同种元素的原子、离子,其电子数越多半径就 r(Fe 3+) r(Fe 2+) r(Fe) r(Cl -) r(Cl) 6)、电子层结构相同的离子,核电荷数越大,离子的半径 r(O 2-) r(F -) r(Na +) r(Mg 2+) r(Al 3+) 二、例题部分 例1:下列化合物中,阴离子和阳离子的半径之比最大的是( )
离子半径大小的比较规律
离子半径大小的比较规 律 Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT
粒子半径大小的比较规律 1.同种元素粒子半径大小比较: 同种元素原子形成的粒子,核外电子数越多,粒子半径越大。阳离子半径小于相应原子半径。如r(Na+)
元素周期律——原子、离子半径比较
元素周期律——原子、离子半径比较 原子半径比较 同周期从左到右依次减小,同主族从上到下依次增大(稀有气体除外) 1、为什么原子半径同周期从左到右依次减小? 同周期元素的原子,电子层数一样,随核电荷数的增大,原子核对核外电子的吸引增强,原子半径逐渐减小。(核外电子数增加了,吸得越紧了) 2、为什么原子半径同主族从上到下依次增大? 同一主族元素,从上到下,原子核的质子逐渐增多,核外电子数也逐渐增多,核外排布的电子层也逐渐增多,电子层的多少影响原子的半径大小,电子层的增多,意味着原子直径的增大,所以同一主族元素,原子半径从上到下逐渐增大。 离子半径比较 (1)同一元素的微粒,电子数越多,半径越大。 如:钠原子>钠离子,氯原子<氯离子 (2)同一周期内元素的微粒,阴离子半径大于阳离子半径。 如:氧离子>锂离子(电子层影响) (3)同类离子与原子半径比较相同。 如:钠离子>镁离子>铝离子,氟离子<氯离子<溴离子 (4)具有相同电子层结构的离子(单核),核电荷数越小,半径越大。 如:氧离子>氟离子>钠离子>镁离子>铝离子;硫离子>氯离子>钾离子>钙离子 (5)同一元素高价阳离子半径小于低价阳离子半径,又小于金属的原子半径。(越负越勇)如:铜离子<亚铜离子<铜原子负二价硫>硫原子>四价硫>六价硫 比较微粒(原子、离子)半径大小的依据——“三看规则” 一看电子层数:在电子层数不同时,电子层数越多,半径越大; 二看核电荷数:在电子层数相同时,核电荷数越大,半径越小; 三看电子数:在电子层数和核电荷数都相同时,电子数越多,半径越大.(同种元素,非金属)1.根据表1信息,判断以下叙述正确的是___C__. 表1 部分短周期元素的原子半径及主要化合价 A.R6+比R2-半径大 B.单质与稀盐酸反应的速率为L<Q C.M与T形成的化合物具有两性 D.M3+比T2-的半径小 2、已知短周期元素的离子aAm+、bBn +、cCm-、dDn-(m<n)都具有相同的电子层结构,则下列叙述正确的是( D )
