例1 将钙离子选择电极和饱和甘汞电极插入100

例 1:铁(Ⅱ)浓度为5.0×10-4 g·L-1的溶液,与1,10-邻二氮杂菲反应,生成橙红色络合
物.该络合物在波长508 nm ,比色皿厚度为2cm 时,测得A=0.190 。计算1,10-邻二氮杂菲亚铁的a 及ε。(已知铁的相对原子质量为55.85)
解:根据朗伯比耳定律 A = a b c 得: a = A/ b c = 0.190/(2×5.0×10-4)=190 L·g-1·cm-1 ε = M a = 55.85×190 = 1.1×104 L·mol-1·cm-1
例 2 :某有色物质溶液的浓度为4.5×10-3g·L-1,在530nm 波长下用2.0cm 的吸收池所
测得的吸光度为0.300,试计算(a )吸收系数;(b)使用5cm 的吸收池时溶液的百分透光度。 解:(a )a=A/bc=0.300/2.0×4.5×10-3=33.3L·g-1·cm-1 (b )T=10-ab ’c=10-A ’
T%=10-ab ’c ×100%=10-A ’×100%=17.81%
例.某钢样含镍约
0.12%,用丁二酮肟光度法(ε=1.3×104L·mol-1 ·cm-1)进行测定。试
样溶解后,转入100mL 容量瓶中,显色,再加入水稀释至刻度。取部分试液于波长470nm 处用1cm 吸收池进行测量,如果希望此时的测量误差最小,应称取试样多少?(镍: 58.69)
解: A= ε b C C=A/ ε b
将A=0.434 b=1 ε=1.3×104 L·mol-1 ·cm-1 代入上式
C=0.434/ 1.3×104 =3.34 ×10-5 mol · L-1 设应称取试样 Wg ,
则:W × 0.12% =100 × 10-3 × 3.34 ×10-5 ×58.69 W=0.16g
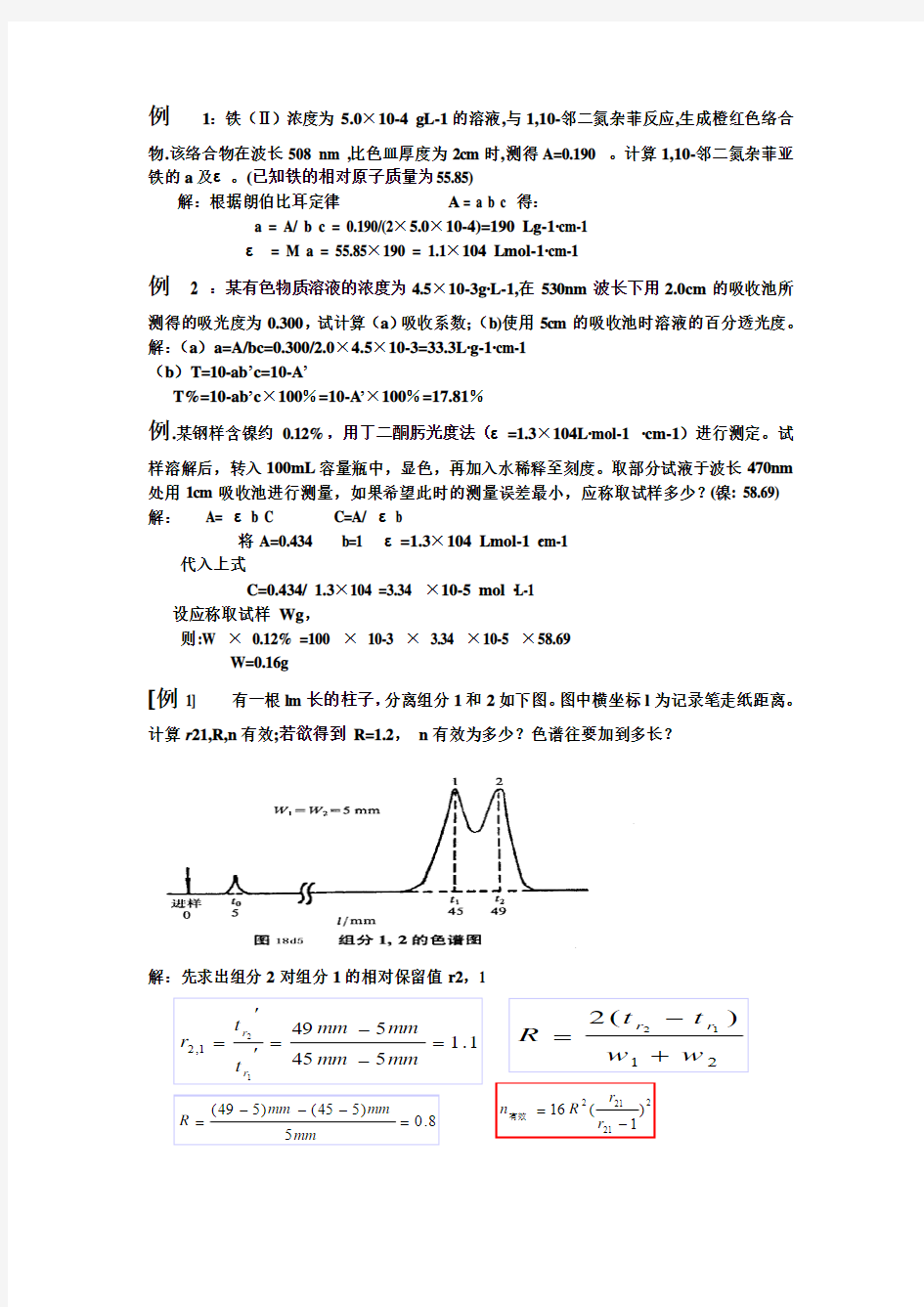
[例1] 有一根lm 长的柱子,分离组分1和2如下图。图中横坐标l 为记录笔走纸距离。
计算r 21,R,n 有效;若欲得到 R=1.2, n 有效为多少?色谱往要加到多长?
解:先求出组分2对组分1的相对保留值r2,1
1
.15455491
21,2=--=
''=
mm
mm mm mm t t r r r 2
1)(212w w t t R r r +-=
8
.05)545()549
(=---=
mm
mm
mm R
若使R2 = 1.2,所需塔板数可计算,即:
L2 = 2.25 m △L = 2.25 – 1 = 1.25 m
[例] 已知一色谱柱在某温度下的速率方程的A = 0.08cm; B = 0.65cm2/s; C = 0.003s, 求最佳线速度u 和最小塔板高H.
解: 欲求 u 最佳和H 最小,要对速率方程微分,即 dH/du =d(A+B/u+Cu)/du
=-B/u2+C =0 而,最佳线速: u 最佳=(B/C)1/2
最小板高: H 最小=A+2(BC)1/2 可得u 最佳=(0.65/0.003)1/2=14.7cm/s
H 最小=0.08+2(0.65×0.003)1/2=0.1683cm
[例3]已知物质A 和B 在一个30.0cm 柱上的保留时间分别为16.40和17.63min.不被保留组分通过该柱的时间为1.30min.峰宽为1.11和1.21min,计算: (1)柱分辨率;
(2)(3)塔板高度;
解: (1) (2) nA=16[(16.40-1.3)/1.11]2=2961
nB=16[(17.63-1.3)/1.21]2=2914 nav=(2961+2914)/2=2.9×103 (3) H=L/n=30.0/2.9×103=1.34×10-2cm
1. 用气相色谱法分析二甲苯氧化母液中间二甲苯含量,称取样品0.1250g ,加入正壬烷内
标0.06258g ,间二甲苯的校正因子为0.96,正壬烷校正因子为1.02,间二甲苯的峰面积为3.5cm2,正壬烷峰面积为12cm2。求样品中间二甲苯的百分含量。 解: 根据内标法计算公式,间二甲苯的百分含量χi 为 χi(%)=msAi fi /As fsm ×100% =(0.0625×3.5×0.96)/(0.1250×12×1.02)×100% =13.73%
2. 分析试样中邻二甲苯、对二甲苯和间二甲苯三个组分,对其他组分不进行定量分析,若
选用甲苯为内标物,称取试样质量为0.4385g ,甲苯质量为0.0530g ,相对校正因子及各组分色谱峰面积如下: 有效有效有效H r r R L H r r R L r r R n ?-=?-=-=2
212122
2221212112
21212
)1
(16)1(16)
1
(
16 2
12
12
2
1)(
L L n n R R =
=
块
有效2488)1
(
162
2121
2
=-=r r R n
解Pi% = mi/m×100% = Ai fi ms/AS fs m×100%
计算得到m邻二甲苯%=39.6%;m对二甲苯%=24.8%;m间二甲苯%=10.2%例1:用pNa玻璃膜电极(K Na+,K+=0.001)测定pNa=3的试液时,如试液中含有pK=2的钾离子,则产生的误差是多少?
解: 误差%=(K Na+,K+×a K+ )/a Na+×100%
=(0.001×10-2)/10-3×100% =1%
例2 某硝酸根电极对硫酸根的选择系数:K NO-3,SO42-=4.1×10-5,用此电极在1.0mol/L
硫酸盐介质中测定硝酸根,如果要求测量误差不大于5%,试计算可以测定的硝酸根的最低活度为多少?
解:KNO3-,SO42-×(a SO42- )zi/zj /a NO3- ≤5%
a NO3- ≥4.1×10-5×1.01/2/ 5%
a NO3- ≥8.2×10-4mol/L。
测定的硝酸根离子的活度应大于8.2×10-4mol/L。
例1将钙离子选择电极和饱和甘汞电极插入100.00mL水样中,用直接电位法测定水样中
的Ca2+。25℃时,测得钙离子电极电位为-0.0619V(对SCE),加入0.0731mol/L的Ca(NO3)2标准溶液1.00mL,搅拌平衡后,测得钙离子电极电位为-0.0483 V(对SCE)。试计算原水样中Ca2+的浓度?
解:由标准加入法计算公式
S = 0.059 / 2
Δc=(V s c s)/V o=1.00×0.0731/100
ΔE=-0.0483-(-0.0619)=0.0619-0.0483=0.0136 V
c x=Δc(10ΔE/s-1)-1=7.31×10-4(100.461-1)-1
=7.31×10-4×0.529=3.87×10-4 mol/L
试样中Ca2+ 的浓度为3.87×10-4mol/L。
例在0.1000mol/L Fe2+溶液中,插入Pt电极(+)和SCE(-),在25℃测得电池电动势
0.395V,问有多少Fe2+被氧化成Fe3+?
解: SCE‖a(Fe3+ ) ,a( Fe2+ ) |Pt
E = E铂电极-E甘汞
= 0.77 + 0.059 lg([Fe3+]/[Fe2+])-0.2438
lg([Fe3+]/[Fe2+])=(0.395+0.243-0.771)/0.059
= -2.254
设有X % 的Fe2+ 氧化为Fe3+,则:
lg([Fe3+]/[Fe2+]) = lg X /(1-X)=-2.254
X/(1-X)=0.00557;
X=0.557%
即有约0.56%的Fe2+被氧化为Fe3+
大气固定污染源氟化物的测定离子选择电极法方法确认
大气固定污染源氟化物的测定离子选择电极法 HJ/T67-2001方法确认 1.目的 通过离子选择电极法测定吸收液中氟离子的浓度,分析方法检出限、回收率及精密度,判断本实验室的检测方法是否合格 2.适用范围 本标准适用于大气固定污染源有组织排放中氟化物的测定。不能测定碳氟化物,如氟利昂。 3. 职责 3.1 检测人员负责按操作规程操作,确保测量过程正常进行,消除各种可能影响试验 结果的意外因素,掌握检出限、方法回收率与精密度的计算方法。 3.2 复核人员负责检查原始记录、检出限、方法回收率及精密度的计算方法。 3.3技术负责人负责审核检测结果及检出限、方法回收率、精密度分析结果 4.分析方法 4.1 测量方法简述 4.1.2 样品的采集和保存 污染源中尘氟和气态氟共存时,采样烟尘采样方法进行等速采样,在采样管的出口串联三个装有75ml吸收液的大型冲击式吸收瓶,分别捕集尘氟和气态氟。 若污染源中只存在气态氟时,可采用烟气采样方法,在采集管出口串联两个装有50ml吸收液的多孔玻板吸收瓶,以0.5~2.0L/min的流速采集5~20min。 采样管与吸收瓶之间的连接管,选用聚四氟乙烯管,并应尽量短。 注:连接管液可使用聚乙烯塑料管和橡胶管。 采样点数目,采样点位设置及操作步骤,按GB/T 16157-1996《固定污染源排气中颗粒物的测定和气态污染物采样方法》有关规定进行。采样频次和时间,按GB 16297-1996 《大气污染物综合排放标准》有关规定进行。 采样结束后,将滤筒取出,编号后放入干燥洁净的器皿中,并按照采样要求,做好记录。吸收瓶中的样品全部转移至聚乙烯瓶中,并用少量水洗涤三次吸收瓶,洗涤液并入聚乙烯瓶中。编号做好记录。采样管与连接管先用50ml吸收液洗涤,再用400ml 水冲洗,全部并入聚乙烯瓶中,编号做好记录。样品常温下可保存一周。 4.1.3 分析步骤 取6个50ml聚乙烯烧杯,按表1配制标准系列,也可根据实际样品浓度配制,
甘汞电极及盐桥的制备
甘汞电极及盐桥的制备 一甘汞电极甘汞电极是应用最广的一种参比电极,下面介绍实验室中常用的饱和甘汞电极的制法。 1、研磨法在小玻璃研钵中加入少量化学纯甘汞(Hg2Cl2),滴加几滴纯汞及饱和氯化钾溶液,小心研磨使成均匀灰白色糊状物。甘汞电极的形式很多,图Ⅲ-7-1(b)的形式结构简单,易于制作。为使铂丝电极与汞接触良好,可先使铂丝镀上一层汞齐。方法是先使铂丝在浓硫酸中浸几分钟,然后用去离子水洗净,用它作为阴极,另用一铂丝作阳极,在1%硝酸汞溶液(加几滴硝酸酸化) 中通2V直流电1 min,这时原来光亮的铂丝变为灰色,再用去离子水淋洗,用滤纸吸干(不能擦洗)。把铂丝电极装入电极管中,塞紧橡皮塞,用滴管从加料口加入干净汞,以把铂丝全部淹没为度。再用滴管取制好的甘汞糊放在汞上面,甘汞糊的上面再放饱和氯化钾的晶浆,最后加满饱和氯化钾溶液,严密塞紧加料口。滤纸卷成的塞7也必须塞紧。 图Ⅲ-7-1 甘汞电极目前市场上已有不少类型的商品甘汞电极1-汞;2-甘汞糊;3-氯化钾晶体;4-铂丝电极;5-饱和氯化钾溶液;出售。图Ⅲ-7-1(a)是有保护盐桥的217型饱和甘汞6-加料口;7-滤纸塞或多孔瓷电极。
2、电解法以1 molL-1HCl溶液作电解液,纯汞作阳极(由埋入汞中的铂丝作导线,此铂丝不能露出汞面,以免生成氧化汞),在盐酸溶液中插入另一铂电极作阴极。通电后汞表面即有甘汞生成,由搅拌器使汞面不断更新。维持电流密度在0、2~2 Adm-2对产物性能影响不大。由于大量细分散汞粒存在,使产物带灰黑色。将产物澄清,小心除去上层清液,先用去离子水洗净至酸性消失,再用饱和氯化钾溶液洗涤,得到的糊状物用前述方法放在汞面上。 为了避免溶液沿玻璃壁的毛细管渗透,影响电极电位和使盐液沿壁爬行,可设法使玻璃表面变为憎水的。为此可将玻璃件先烘至lOO℃,再用含硅油1%的四氯化碳处理表面,然后在180℃左右烘2h,冷后用四氯化碳萃出未与器壁结合的硅油。二盐桥的制备室温下,将30ml饱和氯化钾或硝酸钾的水溶液中加入约0、2-0、3g的琼脂,加热使其完全溶解,稍冷倒入盐桥中,完全冷却凝固后,即可使用。不用时,应将盐桥两端浸入饱和溶液中保存。制作鲁金毛细管盐桥时,将毛细管端堵住,从上部支管由盐桥另一端吸入琼脂,也可以将饱和盐溶液直接灌入盐桥玻璃管中,两端用裹紧的滤纸塞紧。
离子选择电极国标
GB/T 14669-93 空气质量氨的测定离子选择电极法 推荐使用美国Thermo Scientific Orion 9512HPBNWP 高性能氨气敏电极 GB/T 7484-87 水质氟化物的测定离子选择电极法 推荐使用美国Thermo Scientific Orion 9609BNWP 氟离子选择电极 GB/T 22104-2008 土壤质量氟化物的测定离子选择电极法 推荐使用美国Thermo Scientific Orion 9609BNWP 氟离子选择电极 GB/T 15555.11-1995 固体废物氟化物的测定离子选择电极法 推荐使用美国Thermo Scientific Orion 9609BNWP 氟离子选择电极 GB/T 6730.28-2006 铁矿石氟含量的测定离子选择电极法 推荐使用美国Thermo Scientific Orion 9609BNWP 氟离子选择电极 GB/T 15433-1995 环境空气氟化物的测定石灰滤纸·离子选择电极法 HJ 480-2009 环境空气氟化物的测定滤膜采样氟离子选择电极法 推荐使用美国Thermo Scientific Orion 9609BNWP 氟离子选择电极 GB/T 13083-2002 饲料中氟的测定离子选择电极法 推荐使用美国Thermo Scientific Orion 9609BNWP 氟离子选择电极 GB 10267.1-1988 金属钙分析方法氯离子选择性电极法测定氯 推荐使用美国Thermo Scientific Orion 9617BNWP氯离子选择电极 GB/T 2465-1996 硫铁矿和硫精矿中氟含量的测定离子选择电极法 推荐使用美国Thermo Scientific Orion 9609BNWP 氟离子选择电极 GB\T 6730.64-2007 铁矿石水溶性氯化物含量的测定离子选择电极法 推荐使用美国Thermo Scientific Orion 9617BNWP氯离子选择电极 GB/T 20166.2-2006 稀土抛光粉化学分析方法氟量的测定离子选择电极法推荐使用美国Thermo Scientific Orion 9609BNWP氟离子选择电极 GB/T 6730.64-2007 铁矿石水溶性氯化物含量的测定离子选择电极法 推荐使用美国Thermo Scientific Orion 9609BNWP氟离子选择电极 GB//T 1872-1995 磷矿石和磷精矿中氟含量的测定离子选择性电极法 推荐使用美国Thermo Scientific Orion 9609BNWP 氟离子选择电极 WS/T 89-1996 尿中氟化物的测定离子选择电极法 推荐使用美国Thermo Scientific Orion 9609BNWP氟离子选择电极 GB/T 14506.12-93 硅酸盐岩石化学分析方法离子选择性电极法测定氟量
离子选择电极法测定天然水中
离子选择电极法测定天然水中F- 实验题目:离子选择电极法测定天然水中F- 一、实验目的 1.掌握电位法的基本原理。 2.学会使用离子选择电极的测量方法和数据处理方法。 二、实验原理氟离子选择电极是以氟化镧单晶片为敏感膜的电位指示电极,对溶液中的氟离子具有良好的选择性。氟电极与饱和甘汞电极组成的电池可表示为:在式中,为25℃时电极的理论响应斜率,其它符号具有通常意义。 由于用离子选择电极测量的是溶液中离子的活度,而通常定量分析需要测量的是离子的浓度,不是活度。所以实验中必须控制试液的离子强度。如果测量试液的离子强度维持一定,则上述方程可表示为: E(电池) = K + (F,外) 用氟离子选择电极测量F-时,最适宜pH范围为~。pH值过低,易形成HF,影响F-的活度;但pH值过高,易引起单晶膜中La3+的水解,形成La(OH)3,影响电极的响应。故通常用pH为6的柠檬酸盐缓冲溶液来控制溶液的pH。柠檬酸盐还可消除A13+、Fe3+的干扰。 三、主要仪器及试剂 主要仪器:pH/mV计、电磁搅拌器、搅拌磁子、氟离子选择电极、饱和甘汞电极、50mL容量瓶、100mL、250mL烧杯、1mL、10mL、25 mL移液管 试剂:氟离子标准溶液:L; 柠檬酸钠缓冲溶液:L(用1:1盐酸中和至pH≈6)
四、实验步骤 1、将氟电极和甘汞电极分别与离子计或pH/mV计相接,开启仪器开关,预热仪器。 2、清洗电极:取去离子水50~60mL至100mL的烧杯中,放入搅拌磁子,插入氟电极和饱和甘汞电极。开启搅拌器,2~3min后,若读数大于-370mV,则更换去离子水,继续清洗,直至读数小于-370mV。 3、工作曲线法 (1) 标准溶液的配制及测定 用移液管准确移取浓度为L的氟离子标准溶液、、、、、于6个50mL容量瓶中,各加入mol/L的柠檬酸盐缓冲溶液,用去离子水稀释至刻度,摇匀。将上述标准溶液分别倒出部分于250mL烧杯中,放入搅拌磁子,插入已经洗净的电极,开动电磁搅拌器,一直搅拌,待读数不变稳定2min后,读取电位值。按顺序从低至高浓度依次测量,每测量1份试液,无需清洗电极,只需用滤纸沾去电极上的水珠。测量结果列表记录于表1中。 (2) 水样的测定 取水样,置于50mL容量瓶中,加L柠檬酸钠缓冲溶液,用去离子水稀释至刻度并摇匀。倒出部分水样于250mL烧杯中,放入搅拌磁子,插入干净的电极,开动电磁搅拌器,按操作4.3.1方法读取稳定电位值。记录在表1中。 五、实验数据及其处理 1、处理及工作曲线的绘制: 表1
实验 4 水中氟化物的测定--离子选择电极法
实验四水中氟化物的测定—离子选择电极法水中氟化物的含量是衡量水质的重要指标之一,生活饮用水水质限值为 1.0mg·L-1 。测定氟化物的方法有氟离子选择电极法、离子色谱法、比色法和容量滴定法,前两种方法应用普遍。本实验采用氟离子选择电极法测定游离态氟离子浓度,当水样中含有化合态(如氟硼酸盐)、络合态的氟化物时,应预先蒸馏分离后测定。 一.实验目的和要求 1.掌握用离子活度计或pH计、晶体管毫伏计及离子选择电极测定氟化物的原理和测定方法,分析干扰测定的因素和消除方法。 2.复习教材第二章中的相关内容;在预习报告中列出被测原电池,简要说明测定方法原理和影响测定的因素。 二.仪器 1.氟离子选择电极(使用前在去离子水中充分浸泡)。 2.饱和甘汞电极。 3.精密pH计或离子活度计、晶体管毫伏计,精确到 0.1mV。 4.磁力搅拌器和塑料包裹的搅拌子。 5.100mL、50mL容量瓶。 6.10.00mL、 5.00mL移液管或吸液管。 7.100mL聚乙烯杯。
三.试剂 所用水为去离子水或无氟蒸馏水。 1.氟化物标准贮备液: 称取 0.2210g基准氟钠(NaF)(预先于105~110℃烘干2h或者于500~650℃烘干约40min,冷却),用水溶解后转入1000mL容量瓶中,稀释至标线,摇匀。贮存在聚乙烯瓶中。此溶液每毫升含氟离子100μg。 2.乙酸钠溶液: 称取15g乙酸钠(CH 3COONa)溶于水,并稀释至100mL。 3.盐酸溶液:2mol·L-1。 4.总离子强度调节缓冲溶液(TISAB): 称取 58.8g二水合柠檬酸钠和85g硝酸钠,加水溶解,用盐酸调节pH至5~6,转入1000mL容量瓶中,稀释至标线,摇匀。 5.水样①,②。 四.测定步骤 1.仪器准备和操作: 按照所用测量仪器和电极使用说明,首先接好线路,将个开关置于“关”的位置,开启电源开关,预热15min,以后操作按说明书要求进行。 2.氟化物标准溶液制备:
氯离子选择性电极实验预习答案
关于氯离子选择性电极以下叙述错误的是_______________. A. 借助氯离子选择性电极可以通过简单的电动势测定方法来确定溶液中氯离 子的浓度。 B. 其膜片组成为氯化银和硫化银。 C. 用塑料管作为电极管,以全固态工艺制成。 D. 氯离子选择性电极膜表面一般都镀有铂黑,减少电极极化。 参考答案:D 关于氯离子选择性电极的作用机理,以下叙述错误的是______________. A. 当氯离子选择性电极和含氯离子溶液接触时,就会发生离子聚合反应。 B. 氯离子选择性电极是以氯化银作为电化学活性物质的。 C. 当氯离子选择性电极和含氯离子溶液接触时,电极膜表面建立起具有一定电 势梯度的双电层。 D. 当氯离子选择性电极和含氯离子溶液接触时,在电极与溶液之间产生电势 差。 参考答案:A 得出电动势与氯离子浓度的对数值成线性关系这一结论的条件有______________. A. 氯离子选择性电极必须作为正极。 B. 氯离子的活度系数近似为常数。 C. 借助每种缓冲溶液来维持待测液的离子强度约为常数。 D. 温度保持不变。 参考答案:BCD 得出电动势与氯离子浓度的对数值成线性关系这一结论后可解决如下哪些问题 ______________. A. 可以计算出氯离子选择性电极的选择性系数。 B. 了解氯离子选择性电极的性能。
C. 可以测得干扰离子的浓度。 D. 测得未知无干扰溶液中氯离子浓度。 参考答案:BD 实验中氯离子选择性电极必须接正极。 正确错误 参考答案:错误 实验数据处理时要明确实验时氯离子选择性电极接正极还是负极。 正确错误 参考答案:正确 实验数据处理时浓度单位可以依据实际情况灵活选取。 正确错误 参考答案:正确 实验数据处理时浓度不同仅仅影响直线部分的截距。 正确错误 参考答案:正确 以下关于选择性系数的叙述错误的是________________. A. 选择性系数不受其他因素影响,是一常数。 B. 选择性系数与测定方法、测定条件以及电极制作工艺有关。 C. 选择性系数与计算时所用的公式有关。 D. 常用选择性系数来表示离子选择性电极的好与坏。 参考答案: A 以下关于选择性系数的叙述错误的是__________________. A. 通常把选择性系数大于者认为无明显干扰。 B. 测定选择性系数最简单的方法是分别溶液法。 C. 写出选择性系数的同时应注明测定方法及测定条件。 D. 选择性系数越小电极的选择性越好。
离子选择电极法测定氟离子
,氟离子选择电极一般在 离子选择电极法测定氟离子 一.头验目的 1. 了解氟离子选择电极的构造及测定自来水中氟离子的实验条件; 2. 掌握离子计的使用方法。 二.实验原理 氟离子选择电极使目前最成熟的一种离子选择电极。将氟化镧单晶封在塑料管的一端,管内装O.1mol/L NaF和O.1mol/L NaCI溶液,以Ag-AgCI电极为参比电极,构成氟离子选择电极。用氟离子选择电极测定水样时,以氟离子选择电极作指示电极,以饱和甘汞电极作为参比电极,组成的测量电池为: 氟离子选择电极丨试液II SCE 如果忽略液接电位,电池的电动势为: E= i? - 0.0592 log 即电池的电动势与试液中氟离子活度的对数成正比1? 10-6moL.L-1范围符合能斯特方程式。 1. 氟离子选择电极具有较好的选择性 阴离子::OH -LaF3 + 3OH = La(OH) 3 + 3F - 阳离子:Fe 3+、Al3+、Sn(W)(易与F-形成稳定配位离子) 2. 氟离子选择电极法测定的是溶液中离子的活度,因此,必须加入大量支持电解质, 如NaCl控制试液的离子强度。 3. 用总离子强度调节缓冲液控制试液pH和离子强度以及消除干扰。通常用乙酸缓冲溶液控制溶 液的pHo用柠檬酸钠进行掩蔽。 三、仪器与试剂 离子计或pH计;氟离子选择电极;饱和甘汞电极;电磁搅拌器;容量瓶(100 mL7 只); 烧杯(100 mL6 个);10 mL移液管(2 个);F-标准溶液(0.1000 mol/L);离子强度调节缓冲液(TISAB) 四、实验步骤 1氟离子选择电极的准备:氟离子选择电极在使用前,应在含10-4moL.L-1 F- 或更低浓度 氟 离 子 选 择 膜 电 极 Au-AyCI 内参比电 极 内多比 氟化麴 单晶膜
离子选择电极的应用
离子选择电极的应用 班级;2013应用化学(专转本)姓名:程楚楚学号:2013070499004 摘要:离子选择电极分析方法一类电化学传感体,由于离子选择性电极选择性好,灵敏度高及使用简便并且能直接测定液体试样,应用范围广,原则上可以制取各种离子的选择电极。且离子选择电极测量迅速,检验简便,不破坏溶液条件,不进行分离操作。离子选择电极在的电位对溶液中所给定的离子活度的对数呈线性关系,对某一定离子有特殊的选择性非常适合在食品中进行检验。,在药物检测中也经常被使用。 离子选择电极分析方法一类电化学传感体,是化学领域中的一种常用的分析手段。由于离子选择性电极选择性好,灵敏度高及使用简便并且能直接测定液体试样,使溶液的颜色和浊度一般不影响测试结果;对复杂样品无需预处理。所需仪器设备简单,操作方便,有利于连续与自动分,因此发展非常迅速,目前在愈来愈多的领域都有所应用,许多商品化的离子选择电极在临床分析、环保、空间探测、生命科学、自动化装置、食品和药物分析等多个领域得到广泛应用。本文我们主要谈一谈离子选择电极在食品与药品中的应用。 1.离子选择电极在食品中的应用 由于离子选择性电极的适应范围广,原则上可以制取各种离子的选择电极。且离子选择电极测量迅速,检验简便,不破坏溶液条件,不进行分离操作。非常适合在食品中进行检验。通常人们用离子选择电极测定食品中的钾、钙、铜、氟、铅等离子的测定。 1.1在钾离子中的应用 测定食品中钾离子的含量对于临床医学有重要,当血清中的浓度超过一定浓度时,心脏会停止跳动。因此准确滴测定食品总钾离子的含量具有重要意义。目前用流动注射与全固相钾离子选择性电极联用测定食品、疫血清样品中钾含量得到数据让大部分人满意,为测定钾离子含量的常用方法。 1.2在钙离子种的应用 钙是人体内极其重要的元素,从饮食中摄入钙质是人体获取钙的主要途径。目前,钙的测定方法有质谱法、发射光谱法、分光光度法、化学滴定法和电位滴定法。常量钙测定的经典方法为化学滴定法,方法成熟,操作简便,但是对于颜色较深及混浊的样品,终点难以观察,有一定的局限性。但以钙离子选择性电极为指示电极,甘汞电极为参比电极,EGTA标准溶液为滴定剂( 与钙离子形成络和物),用电位滴定法测定有色或混浊饮料中的钙含量,由电位突跃判断滴定终点,用二阶微商法计算EGTA标准溶液的消耗量,只需要突跃点前后四个数据即可。查阅一些相关的文献得到,许多专家在用离子选择电极测定钙离子含量的方面都得到了人满意的结果。[1] 1.3在铜离子中的应用 铜能参与酶的催化功能,使脂肪和磷酯氧化,使含糖的食品加速分解,铜也是有机体必需
钙离子选择性电极测定奶粉中钙的方法探讨
钙离子选择性电极测定奶粉中钙的方法探讨 钙为人体必需营养元素,缺钙能引起多种疾病,因而食品中含钙的问题引起了大家的重视。以往测定钙元素有原子吸收分光光度法和络合滴定法等。在原吸法测定中,对高浓度样品,如强化食品的测定,需进行多次稀释,给结果带来了一定的误差。在滴定法中,所用的试剂多,有些且有毒,并且滴定终点难控制和需调节pH范围,对测定同样带来了一定的难度。本文选择了用钙离子选择性电极对钙进行测试,结果令人较满意。 1材料与方法 1.1方法原理 当钙离子选择性电极与饱和甘汞电极组成电池后,可以通过测定其电位E(mv)计算出钙离子的浓度。 1.2仪器和试剂 1.2.1仪器 全自动电位滴定仪;钙离子选择性电极;甘汞电极。 1.2.2标准溶液 2.4972g于烧杯中,加入20mL水,滴加1+1盐酸溶 取经105~110℃干燥恒重的CaCO 3 冷却,移入1000ml容量瓶中,定容至刻度。此溶液当然Ca浓度为1.00mg 解。煮沸,挥去CO 2, /mL。 1.2.3试剂 1mol/L三乙醇胺盐酸溶液(总离子强度调节剂):取浓三乙醇胺33mL,加人4mol/l HC1 5mL,用水稀释至250mL。 1.3实验方法 1.3.1标准曲线制作 精密吸取上述标准液0.1,0.5,0.75,1.0,1.5mL分别于50mL容量瓶中。各加入5mL三乙醇胺盐酸液,加水至刻度。其钙液浓度分别为 5.0×10-5,2.5×10-4,3.7×10-4,5.0×10-4,7.5×10-4,将上述溶液逐个从稀至浓测定电极电位E(mv)。 1.3.2样品处理 称取约1.0g样品于坩埚中,小心炭化至无烟。放入550℃高温炉内煅烧4h后,加1+1 HC110ml,并滴加HN0 数滴,加热微沸,不至于干涸。取下冷却。于100ml容量瓶中用水定 3 容。 1.3.3样品测定
离子选择性电极法测定水中氟离子
离子选择性电极法测定溶液中氟离子 一、实验目的 1、了解电位分析法的基本原理。 2、掌握电位分析法的操作过程。 3、掌握用标准曲线法测定水中微量氟离子的方法。 4、了解总离子强度调节液的意义和作用。 二、实验原理 一般氟测定最方便、灵敏的方法是氟离子选择电极。氟离子选择电极的敏感膜由LaF 3单晶片制成,为改善导电性能,晶体中还掺杂了少量0.1%~0.5% 的EuF 2和1%~5%的CaF 2。膜导电由离子半径较小、带电荷较少的晶体离子氟 离子来担任。Eu 2+、Ca 2+代替了晶格点阵中的La 3+,形成了较多空的氟离子点阵,降低了晶体膜的电阻。 将氟离子选择电极插入待测溶液中,待测离子可以吸附在膜表面,它与膜上相同离子交换,并通过扩散进入膜相。膜相中存在的晶体缺陷,产生的离子也可以扩散进入溶液相,这样在晶体膜与溶液界面上建立了双电层结构,产生相界电位,氟离子活度的变化符合能斯特方程: --=F a F RT K E lg 303.2 氟离子选择电极对氟离子有良好的选择性,一般阴离子,除OH -外,均不干扰电极对氟离子的响应。氟离子选择电极的适宜pH 范围为5-7。一般氟离子电极的测定范围为10-6~10-1mol /L 。水中氟离子浓度一般为10-5mol /L 。 在测定中为了将活度和浓度联系起来,必须控制离子强度,为此,应该加入惰性电解质(如KNO 3)。一般将含有惰性电解质的溶液称为总离子强度调节液 (total Ionic strength adjustment buffer ,TISAB)。对氟离子选择电极来说,它由KNO 3、柠檬酸三钠溶液组成。 用离子选择电极测定离子浓度有两种基本方法。方法一:标准曲线法。先测定已知离子浓度的标准溶液的电位E ,以电位E 对lgc 作一工作曲线,由测得的未知样品的电位值,在E-lgc 曲线上求出分析物的浓度。方法二:标准加人法。首先测定待分析物的电位E1,然后加人已知浓度的分析物,记录电位E2,通过能斯特方程,由电位E1和E2可以求出待分析物的浓度。本实验测定氟离子采用标准曲线法。 三、仪器与试剂 氟离子选择电极一支;饱和甘汞电极一支;恒温水浴锅一台。100mL 烧杯若干个,50mL 容量瓶若5个,25mL 移液管、10mL 移液管,1mL 和10mL 有分刻度的移液管各一支,100mL 容量瓶一个。 NaF(基准试剂);KNO 3(分析纯);柠檬酸三钠(分析纯);NaOH(分析纯)。 氟标准溶液0.5g/L :称取于120°C 干燥2小时并冷却的NaF 1.106g 溶于去离子水中,而后转移至1000 mL 容量瓶中,稀释至刻度,摇匀,保存在聚乙烯塑料瓶中备用。 氟标准溶液0.2g/L :移取0.5g/L 氟离子标准溶液20mL 稀释到50mL 。实验前随配随用,用完倒掉洗净容量瓶。 依照上述方法依次配制0.01g/L 、0.04g/L 的氟标准溶液。
各类参比电极的适用范围
各类参比电极的适用范围 各类参比电极的适用范围 用具有适当输入阻抗的直流电压表、测试线和一支稳定的参比电极,例如饱和铜/硫酸铜参比电极(CSE)、银/氯化银电极(Ag/AgCl)或饱和氯化钾(KCL)甘汞电极,就可以进行管道对电解质电位测量。当电解质是土壤或淡水时,一般用CSE测量,但它不适用于海水中。当在高氯环境下使用CSE时,在确认读数的有效性之前,必须对CSE的稳定性进行检查。银/氯化银电极通常用于海水环境中,饱和氯化钾甘汞电极更多的用于实验室中。然而,多面聚合物胶质饱和KCL甘汞电极也可使用,但需要适当增加对环境的接触面积。 各类参比电极的适用范围 用具有适当输入阻抗的直流电压表、测试线
和一支稳定的参比电极,例如饱和铜/硫酸铜参比电极(CSE)、银/氯化银电极(Ag/AgCl)或饱和氯化钾(KCL)甘汞电极,就可以进行管道对电解质电位测量。当电解质是土壤或淡水时,一般用CSE测量,但它不适用于海水中。当在高氯环境下使用CSE时,在确认读数的有效性之前,必须对CSE的稳定性进行检查。银/氯化银电极通常用于海水环境中,饱和氯化钾甘汞电极更多的用于实验室中。然而,多面聚合物胶质饱和KCL甘汞电极也可使用,但需要适当增加对环境的接触面积。 各类参比电极的适用范围 用具有适当输入阻抗的直流电压表、测试线和一支稳定的参比电极,例如饱和铜/硫酸铜参比电极(CSE)、银/氯化银电极(Ag/AgCl)或饱和氯化钾(KCL)甘汞电极,就可以进行管道对电解质电位测量。当电解质是土壤或淡水时,一般用CSE测量,但它不适用于海水中。当在高氯环境下使用CSE时,在确
认读数的有效性之前,必须对CSE的稳定性进行检查。银/氯化银电极通常用于海水环境中,饱和氯化钾甘汞电极更多的用于实验室中。然而,多面聚合物胶质饱和KCL甘汞电极也可使用,但需要适当增加对环境的接触面积。 各类参比电极的适用范围 用具有适当输入阻抗的直流电压表、测试线和一支稳定的参比电极,例如饱和铜/硫酸铜参比电极(CSE)、银/氯化银电极(Ag/AgCl)或饱和氯化钾(KCL)甘汞电极,就可以进行管道对电解质电位测量。当电解质是土壤或淡水时,一般用CSE测量,但它不适用于海水中。当在高氯环境下使用CSE时,在确认读数的有效性之前,必须对CSE的稳定性进行检查。银/氯化银电极通常用于海水环境中,饱和氯化钾甘汞电极更多的用于实验室中。然而,多面聚合物胶质饱和KCL甘汞电极也可使用,但需要适当增加对环境的接触面积。
离子选择电极
三、离子选择电极(Membrane potential and ISE)和膜电位 1. 膜电位及其产生 膜电极(Membrane potential and ISE),具有敏感膜且能产生膜电位的电极。膜电位产生于被分隔两边不同成分的溶液,测量体系为: 参比电极1|溶液1|膜|溶液2|参比电极2 膜电极特点:仅对溶液中特定离子有选择性响应(离子选择性电极)。 膜电极的关键:选择膜的敏感元件。 敏感元件构成:特殊组分的玻璃、单晶、混晶、液膜、高分子功能膜及生物膜等。 膜电极组成的半电池,没有电极反应; 相界间没有发生电子交换过程。 表现为离子在相界上的扩散,造成双电层存在,产生界面电位差。该类主指离子选择性电极。?膜电位: = 膜内扩散电位和膜与电解质溶液形成的内外界面的Donnan电位的代数和。 膜电位=扩散电位(膜内) + Donnan电位(膜与溶液之间) (1)扩散电位:液液界面或固体膜内,因不同离子之间或离子相同而浓度不同而发生扩散即扩散电位。其中,液液界面之间产生的扩散电位也叫液接电位。 特点:这类扩散是自由扩散,正负离子可自由通过界面,没有强制性和选择性。 (2)Donnan电位: 选择性渗透膜或离子交换膜,它至少阻止一种离子从一个液相扩散至另一液相或与溶液中的离子发生交换。这样将使两相界面之间电荷分布不均匀——形成双电层——产生电位差——Donnan 电位。 这类扩散具强制性和选择性。 2. 离子选择性电极 ISE 原电极 晶体膜 均相膜如F-,Cl-,Cu2+ 非均相膜如硅橡胶膜 非晶体膜刚性基质如PH,PNa 流动载体带正电荷如NO3-,ClO4-,BF4- 带负电荷如Ca2+, Mg2+ 中性如K+ 敏化电极气敏电极如CO2, NH4+电极 生物电极如酶电极,生物组织电极
最新离子选择电极法测定氟离子
离子选择电极法测定氟离子 一、实验目的 1.了解氟离子选择电极的构造及测定自来水中氟离子的实验条件和方法。 2.掌握离子计的使用方法。 二、实验原理 氟离子选择电极是目前最成熟的一种离子选择电极。将氟化镧单晶(掺入微量氟化铕(Ⅱ)以增加导电性)封在塑料管的一端,管内装0.1 moL·L-1NaF和0.1 moL·L-1NaCl溶液,以Ag-AgCl电极为参比电极,构成氟离子选择电极。用氟离子选择测定水样时,以氟离子选择电极作指示电极,以饱和甘汞电极作参比电极,组成的测量电池为:氟离子选择电极︱试液‖SCE 如果忽略液接电位,电池的电动势为: 即电池的电动势与试液中氟离子活度的对数成正比,氟离子选择电极一般在1~10-6mol·L-1范围符合能斯特方程式。 氟离子选择电极性能: ①选择性 阴离子: OH- LaF 3 + 3OH-= La(OH) 3 + 3F- 阳离子: Fe3+、Al3+、Sn(Ⅳ) ( 易与F-形成稳定配位离子) ②支持电解质------控制试液的离子强度。 ③总离子强度调节缓冲液-----控制试液pH和离子强度以及消除干扰。 三、仪器与试剂 离子计或pH计,氟离子选择电极, 饱和甘汞电极,电磁搅拌器, 容量瓶(100 mL 7只),烧杯(100 mL 2个), 10 mL移液管 F-标准溶液(0.1000 mol·L-1); 离子强度调节缓冲液(TISAB) 四、基本操作 1. 氟离子选择电极的准备
使用前浸泡于10-4mol·L-1 F-或更低F-溶液中浸泡活化。使用时,先用去离子水吹洗电极,再在去离子水中洗至电极的纯水电位,一般在300 mV左右。 2. 线性范围及能斯特斜率的测量通常由稀至浓分别进行测量。 3. 自来水中氟含量的测定。 五、实验步骤 1. 氟离子选择电极的准备: 2. 线性范围及能斯特斜率的测量: 在5只100 mL容量瓶中,用10 mL移液管移取0.100 moL·L-1 F-标准溶液于第一只100 mL容量瓶中,加入TISAB 10 mL,去离子水稀释至标线,摇匀,配成1.00×10-2mol·L-1 F-溶液;在第二只100 mL容量瓶中,加入1.00×10-2 mol·L-1 F-溶液10.00 mL和TISAB 10 mL,去离子水稀释至标线,摇匀,配成1.00×10-3mol·L-1 F-溶液。按上述方法依次配制1.00×10-6~1.00×10-4 mol·L-1 F-标准溶液。将适量F-标准溶液(浸没电极即可)分别倒入5只塑料烧杯中,放入磁性搅拌子,插入氟离子选择电极和饱和甘汞电极,连接好离子计或酸度计,开启电磁搅拌器,由稀至浓分别进行测量,在仪器指针不再移动或数字显示在±1 mV内,读取电位值。再分别测定其他F-浓度溶液的电位值。 3. 氟含量的测定: (1) 试液的制备自来水样可在实验室直接取样。 (2) 标准曲线法准确吸取自来水样50.0 mL于100 mL容量瓶中,加入TISAB 10 mL,去离子水稀释至标线,摇匀。全部倒入一烘干的烧杯中,按上述实验方法测(此溶液继续做下一步实验),平行测定三份。 定电位值,记为E 1 (3) 标准加入法在实验②测量后,再分别加入1.00 mL 1.00×10-3mol·L-1 F- 。 溶液①后,再测定其电位值,记为E 2 (4) 空白试验以去离子水代替试样,重复测定。 六、数据处理 标准曲线,确定该氟离子选择电极的线性范围及实际能斯特响1. 绘制E~logC F- 应斜率。并从标准曲线,查出被测试液F-浓度(c ),计算出试样中氟含量。 x
常用参比电极注意事项
银-氯化银电极(Ag-AgCl)的使用维护及注意事项 一、氯化银电极的介绍及主要用途 银-氯化银电极是由表面覆盖有氯化银的金属银浸入在含有氯离子溶液中构成的电极,氯化银电极可表示为Ag/AgCl/Cl-,电极反应为AgCl+e=Ag+Cl-。常用的内充溶液是KCL溶液,通常有0.1mol/LKCl,1mol/L KCl和饱和KCl三种类型。因离子析出的原因,为了保持内充溶液稳定,以饱和的KCL溶液使用zui为普遍。因氯化银电极电势稳定,重现性好,相比甘汞电极在升温的情况下更为稳定,因此在中性溶液的测试中,使用相当广泛。 二、主要技术数据 1、内阻:≤10KΩ 2、25°C时标准电位:+0.2224V 3、高仕睿联氯化银电极盐桥充装溶液:饱和KCL 4、液络部流速:≥1滴/10min 三、使用维护及注意事项 1、氯化银电极使用前请先拔去液接部位的胶皮套方可使用. 2、测量时盐桥溶液应充满盐桥,保证电极形成回路,盐桥内溶液高于被测样品溶液的液面,以免测试溶液反方向渗透而改变盐桥溶液的成份。 3、氯化银电极内盐桥溶液中不可含有较大气泡,以免阻断电子测量回路;若含有气泡时,可握紧电极轻甩几下,或竖起电极用手指轻弹,使气泡上浮。 4、不宜用于和氯化银电极有反应的介质的测量。因AgCl电极盐桥溶液为KCL溶液,对氯离子有规避的实验体系,不可使用该电极;并且氯化银电极应应用于中性溶液的测试中,在酸性体系或者碱性体系中很容易造成电极的损坏。如不可避免要使用甘汞电极测试,建议使用双接点银氯化银电极,以阻隔测试溶液对该电极核心部位的影响。 5、氯化银电极应经常清洗并更换盐桥溶液,对一般性的附着玷污应及时清洗。更换盐桥溶液时,可将玻璃管拔出,抽出原盐桥溶液,再将新溶液注入。 6、在拿去电极帽时,请勿将电极长时间(大于数分钟)暴露在空气中,否则玻璃管中的溶液将会渗漏并且挥发变干,这样有可能会影响电极性能。电极短期不用时,请将电极液络部浸入相对应浓度的KCL溶液中保存,如果长期不用请先更换新的盐桥溶液再密封避光保存。 7、氯化银电极使用温度:建议在室温条件下使用,温度≤60°C。 8、氯化银电极等参比电极皆不宜超声清洗。
离子选择电极法题库及答案
离子选择电极法 (一)氟化物 分类号:G12-1 主要内容 ①环境空气氟化物的测定滤膜采样氟离子选择电极法(HJ480-2009) ②环境空气氟化物的测定石灰滤纸氟离子选择电极法(HJ481-2009) ③大气固定污染源氟化物的测定选择电极法(HJ/T67-2001) 一、填空题 1.环境空气中的无机气态氟化物以、等形式存在,颗粒物中有时也含有一定量的无机氟化物。①② 答案:氟化氢四氟化硅 2.滤膜采样氟离子选择电极法测定环境空气中氟化物时,将乙酸—硝酸纤维微孔滤膜放入磷酸氢二钾浸渍液中浸湿后沥干,摊放在大张定性滤纸上,于℃下烘干,装入塑料袋中,密封好放入中备用。② 答案:40 干燥器 3.大气固定污染源的氟化物系指气态氟和尘氟的总和。《大气固定污染源氟化物的测定选择电极法》(HJ/T67-2001)中的气态氟用溶液吸收,尘氟指溶于的、与颗粒物共存的氟化物。③ 答案:氢氧化钠盐酸溶液 4.根据《大气固定污染源氟化物的测定选择电极法》(HJ/T67-2001)测定大气固定污染源中氟化物时,污染源中尘氟和气态氟共存时,采用烟尘采样方法进行,在采样管的出口串联三个装有75m1吸收液的吸收瓶,分别捕集尘氟和气态氟。③ 答案:等速采样大型冲击式 5.根据《大气固定污染源氟化物的测定选择电极法》(HJ/T67-2001)测定大气固定污染源中的氟化物,污染源中只存在气态氟时,可采用方法,在采样管出口串联两个装有50m1吸收液的多孔玻璃吸收瓶,以 L/mln的流速采集5~20min。③答案:烟气采样 0.5~2.0 6.离子选择电极法测定环境空气中氟化物时,测定体系中的高价阳离子[例如三价铁离子、
离子选择电极法测定氟离子
实验报告 实验课程:仪器分析 学生姓名:崔清玥 学号: 专业班级:化学(创新)1301 实验名称:离子选择电极法测定氟离子
一.实验目的 1.了解氟离子选择电极的构造及测定自来水中氟离子的实验条件; 2.掌握离子计的使用方法。 二.实验原理 氟离子选择电极使目前最成熟的一种离子选择电极。将氟化镧单晶封在塑料管的一端,管内装L NaF和L NaCl溶液,以Ag-AgCl电极为参比电极,构成氟离子选择电极。用氟离子选择电极测定水样时,以氟离子选择电极作指示电极,以饱和甘汞电极作为参比电极,组成的测量电池为: 氟离子选择电极︱试液‖SCE 如果忽略液接电位,电池的电动势为: 即电池的电动势与试液中氟离子活度的对数成正比,氟离子选择电极一般在1~10-6范围符合能斯特方程式。 1.氟离子选择电极具有较好的选择性 阴离子: : OH- LaF3 + 3OH-=La(OH)3 + 3F- 阳离子: Fe3+、Al3+、Sn(Ⅳ) ( 易与F-形成稳定配位离子) 2.氟离子选择电极法测定的是溶液中离子的活度,因此,必须加入大量支持 电解质,如NaCl控制试液的离子强度。 3.用总离子强度调节缓冲液控制试液pH和离子强度以及消除干扰。通常用 乙酸缓冲溶液控制溶液的pH。用柠檬酸钠进行掩蔽。 三、仪器与试剂 离子计或pH计;氟离子选择电极;饱和甘汞电极;电磁搅拌器;容量瓶(50mL 7只);烧杯(100 mL 6个);10 mL移液管(2个);F-标准溶液mol/L);离子强度调节缓冲液(TISAB) 四、实验步骤 1.氟离子选择电极的准备: 氟离子选择电极在使用前,应在含10-4-1 F 或更低浓度的F-溶液中浸泡(活化)约30 min。 2.线性范围及能斯特斜率的测量:
离子选择性电极
Thermo Scientific Orion是全球研制出第一支离子电极-钙离子电极的制造商,公司发展40年来已开发30多种具有专利技术的离子电极,为众多行业广泛使用,成为同业中最著名的离子电极制造商。Orion的许多离子电极分析方法已被众多国家的政府组织列为相关行业中的标准方法,例如:牙膏中氟化物的测定(国家牙膏标准GB 8372-2008)。当今采用离子电极从事物质研究分析最可信赖的首先品牌。 离子选择性电极的应用 离子选择性电极是一种简单、迅速、能用于有色和混浊溶液的非破坏性分析工具,一般不需进行化学分离,不要求复杂的仪器,可以分辨不同离子的存在形式,能测量少到几微升的样品,所以十分适用于野外分析和现场自动连续监测。与其他分析方法相比,它在阴离子分析方面特别具有竞争能力。电极对活度产生响应这一点也有特殊意义,使它不但可用作络合物化学和动力学的研究工具,而且通过电极的微型化已被告用于直接观察体液甚至细胞内某些重要离子的活度变化。离子选择性电极的分析对象十分广泛,它已成功地应用于环境监测、水质和土壤分析、临床化验、海洋考察、工业流程控制以及地质、冶金、农业、食品和药物分析等领域。 各行业离子电极应用 土壤:硝酸根(9707BNWP),钙(9720BNWP),钠(8611BNWP),钾(9719BNWP),溴(9635BNWP),氯(9617BNWP),氨氮(9512HPBNWP),氟(9609BNWP),硼 动物饲料:氨氮(9512HPBNP,9512BNWP),钙(9720BNWP),氯(9617BNWP),氟(9609BNWP),碘(9653BNWP),钠(8611BNWP),钾(9719BNWP),硝酸盐(9707BNWP) 植物组织:硝酸根(9707BNWP),氯(9617BNWP),氟(9609BNWP),碘(9653BNWP),氰(9606BNWP),钙(9720BNWP),钠(8611BNWP),钾(9719BNWP) 肥料:氨氮(9512HPBNP,9512BNWP),钾(9719BNWP),氟(9609BNWP) 水产养殖:氨(9512HPBNP,9512BNWP),硝酸根(9707BNWP),水硬度(9332BNWP) 生物培养基:钙(9720BNWP),二氧化碳(9502BNWP),氨氮(9512HPBNP,9512BNWP) 医学牙釉:钙(9720BNWP),氟(9609BNWP) 加工过的肉类、鱼类:氯(9617BNWP),硝酸根(9707BNWP),氟(9609BNWP) 牛奶、乳制品:氯(9617BNWP),氟(9609BNWP),碘(9653BNWP) 软饮料、果汁:氯(9617BNWP),氟(9609BNWP),二氧化碳(9502BNWP),余氯(9770BNWP) 葡萄酒、啤酒、运动饮料:钾(9719BNWP),钠(8611BNWP),二氧化碳(9502BNWP),氟(9609BNWP),溴(9635BNWP),钙(9720BNWP),余氯(9770BNWP) 蔬菜:罐头中的硝酸盐(9707BNWP),冲洗水中的氯(9617BWNP) 地质、矿山:氟(9609BNWP)、钙(9720BNWP) 冶金、电镀:氟(9609BNWP),铝,铜(9629BNWP),自由氯(9770BNWP),总氰(9606BNWP),氟硼酸盐(9305BN),硝酸盐(9707BNWP),氯(9617BNWP) 造纸:钠(8611BNWP),氯(9617BWNWP),钙(9720BNWP),氨水(9512HPBNP,9512BNWP) 制药:维生素和牙膏中的氟(9609BNWP) 污水处理:硝酸根(9707BNWP),氨氮(9512HPBNP,9512BNWP),余氯(9770BNWP),ORP(9179BNWP)
例1 将钙离子选择电极和饱和甘汞电极插入100
例 1:铁(Ⅱ)浓度为5.0×10-4 g·L-1的溶液,与1,10-邻二氮杂菲反应,生成橙红色络合 物.该络合物在波长508 nm ,比色皿厚度为2cm 时,测得A=0.190 。计算1,10-邻二氮杂菲亚铁的a 及ε。(已知铁的相对原子质量为55.85) 解:根据朗伯比耳定律 A = a b c 得: a = A/ b c = 0.190/(2×5.0×10-4)=190 L·g-1·cm-1 ε = M a = 55.85×190 = 1.1×104 L·mol-1·cm-1 例 2 :某有色物质溶液的浓度为4.5×10-3g·L-1,在530nm 波长下用2.0cm 的吸收池所 测得的吸光度为0.300,试计算(a )吸收系数;(b)使用5cm 的吸收池时溶液的百分透光度。 解:(a )a=A/bc=0.300/2.0×4.5×10-3=33.3L·g-1·cm-1 (b )T=10-ab ’c=10-A ’ T%=10-ab ’c ×100%=10-A ’×100%=17.81% 例.某钢样含镍约 0.12%,用丁二酮肟光度法(ε=1.3×104L·mol-1 ·cm-1)进行测定。试 样溶解后,转入100mL 容量瓶中,显色,再加入水稀释至刻度。取部分试液于波长470nm 处用1cm 吸收池进行测量,如果希望此时的测量误差最小,应称取试样多少?(镍: 58.69) 解: A= ε b C C=A/ ε b 将A=0.434 b=1 ε=1.3×104 L·mol-1 ·cm-1 代入上式 C=0.434/ 1.3×104 =3.34 ×10-5 mol · L-1 设应称取试样 Wg , 则:W × 0.12% =100 × 10-3 × 3.34 ×10-5 ×58.69 W=0.16g [例1] 有一根lm 长的柱子,分离组分1和2如下图。图中横坐标l 为记录笔走纸距离。 计算r 21,R,n 有效;若欲得到 R=1.2, n 有效为多少?色谱往要加到多长? 解:先求出组分2对组分1的相对保留值r2,1 1 .15455491 21,2=--= ''= mm mm mm mm t t r r r 2 1)(212w w t t R r r +-= 8 .05)545()549 (=---= mm mm mm R
