铅酸蓄电池的原理与性能

铅酸蓄电池的原理与性能
、铅酸蓄电池的工作原理
蓄电池是一种化学电源,它的构造可以是各式各样的,可是从原理上讲所有的电池都 是由正极、负极、电解质、隔离物和容器组成的,其中 正负两极的活性物质和电解质起电化反应, 对电池产生电流
起着主要作用,如图 4-1所示。
在电池内部,正极和负极通过电解质构成电池的内电 路,在电池外部接通两
极的导线和负荷构成电池的外电路。
在电极和电解液的接触面有电极电位产生, 不同的两极
活性物质产生不同的电极电位, 有着较高电位的电极叫做正 极,有着较低
电位的电极叫做负极, 这样在正负极之间产生
了电位差,当外电路接通时,就有电流从正极经过外电路流 向负极,再由负
极经过内电路流向正极, 电池向外电路输送
电流的过程,叫做电池的放电。
在放电过程中,两极活性物质逐渐消耗, 负极活性物质 放出电子而被
氧化,正极活性物质吸收从外电路流回的电子而被还原,这样负极电位逐渐 升高,正极电位逐渐降低,两极间的电位差也就逐渐降低,而且由于电化反应形成新的化 合物增加了电池的内阻,使电池输出电流逐渐减少,直至不能满足使用要求时,或在外电 路两电极之间端电压低于一定限度时,电池放电即告终。
电池放电以后,用外来直流电源以适当的反向电流通入,可以使已形成的新化合物还 原成为原来的活性物质,而电池又能放电,这种用反向电流使活性物质还原的过程叫做充 电。
蓄电池可以反复多次充电、放电,循环使用,使用寿 命长,成本较低,能输出较大的 能量,放电时电压下降很慢。
1. 电动势的产生
铅蓄电池的正极是二氧化铅
(PbQ ),负极是绒状铅
(Pb ),它们是两种不同的活性物质,故和稀硫酸
(ESQ )起
化学作用的结果也不同。在未接通负载时,由于化学作用 使正极板上缺少电子,
负极板上却多余电子, 如图4-2所 示,两极间就产生了一定的电位差。
7.负荷
图4-1 电池构造示意图
1.电解质
2.负极
3.容量
4.正极
5.隔离物
6.导线
图4-2 铅蓄电池电势产生过程
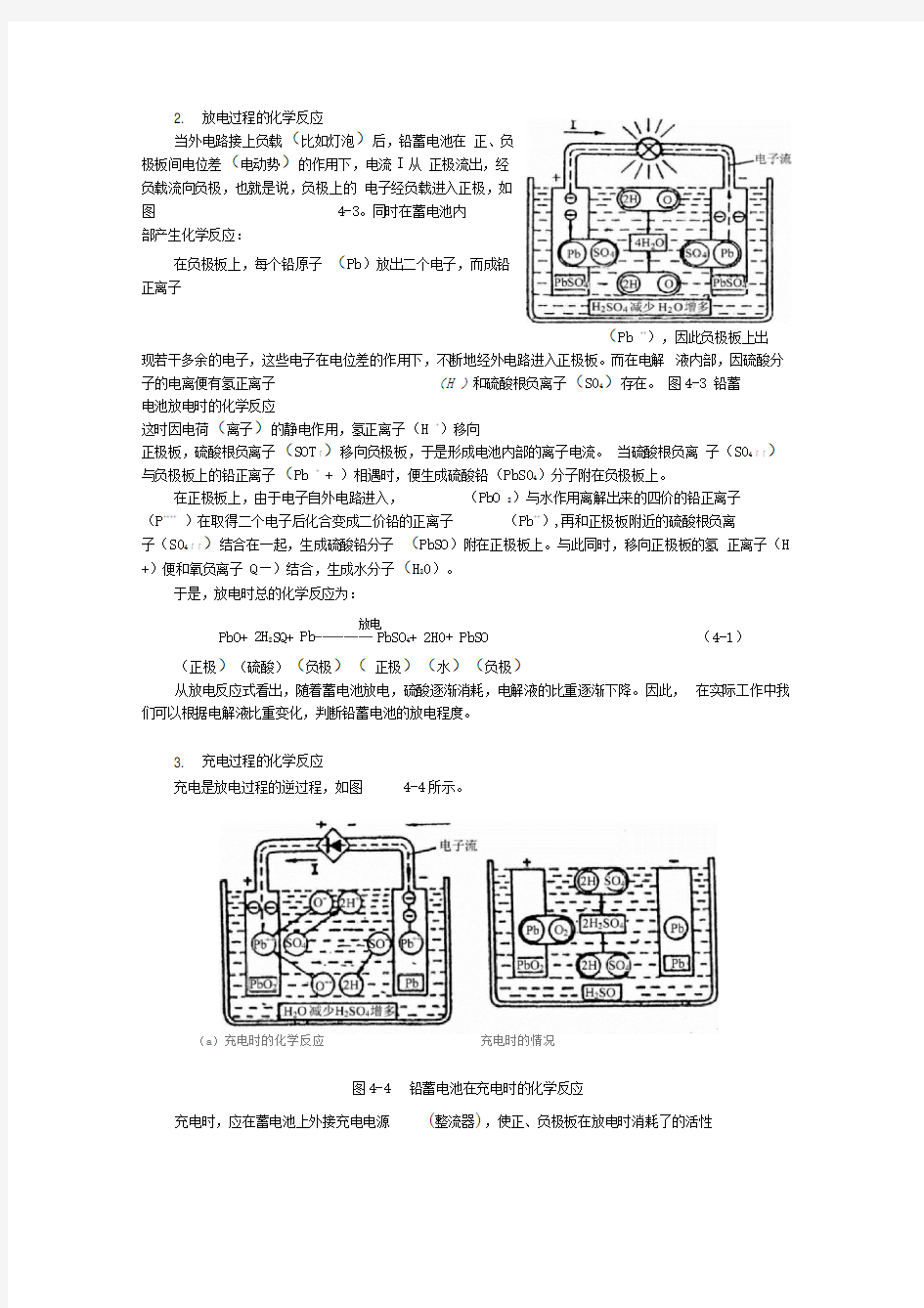
2. 放电过程的化学反应
当外电路接上负载(比如灯泡)后,铅蓄电池在正、负
极板间电位差(电动势)的作用下,电流I从正极流出,经
负载流向负极,也就是说,负极上的电子经负载进入正极,如
图4-3。同时在蓄电池内
部产生化学反应:
在负极板上,每个铅原子(Pb)放出二个电子,而成铅
正离子
(Pb ++),因此负极板上出
现若干多余的电子,这些电子在电位差的作用下,不断地经外电路进入正极板。而在电解液内部,因硫酸分子的电离便有氢正离子(H )和硫酸根负离子(S04)存在。图4-3 铅蓄
电池放电时的化学反应
这时因电荷(离子)的静电作用,氢正离子(H +)移向
正极板,硫酸根负离子(SOT「)移向负极板,于是形成电池内部的离子电流。当硫酸根负离子(S04「「)与负极板上的铅正离子(Pb + + )相遇时,便生成硫酸铅(PbS04)分子附在负极板上。
在正极板上,由于电子自外电路进入,(PbO 2)与水作用离解出来的四价的铅正离子
(P++++)在取得二个电子后化合变成二价铅的正离子(Pb++),再和正极板附近的硫酸根负离
子(S04「「)结合在一起,生成硫酸铅分子(PbSO)附在正极板上。与此同时,移向正极板的氢正离子(H +)便和氧负离子Q—)结合,生成水分子(H20)。
于是,放电时总的化学反应为:
放电
PbO+ 2H2SQ+ Pb-------- PbSO4+ 2H0+ PbSO (4-1)
(正极)(硫酸)(负极)(正极)(水)(负极)
从放电反应式看出,随着蓄电池放电,硫酸逐渐消耗,电解液的比重逐渐下降。因此,在实际工作中我
们可以根据电解液比重变化,判断铅蓄电池的放电程度。
3. 充电过程的化学反应
充电是放电过程的逆过程,如图4-4所示。
(a)充电时的化学反应充电时的情况
图4-4 铅蓄电池在充电时的化学反应
充电时,应在蓄电池上外接充电电源(整流器),使正、负极板在放电时消耗了的活性
物质还原,并把外加的电能转变为化学能储存起来。
在充电电源作用下,外电路的电流I自蓄电池的正极板流入,经电解液和负极板流出。
于是,电源从正极板中不断取得电子输送给负极板,促使正、负极板上的硫酸铅(PbSO)不
断进入电解液而被游离,因此在电池内部产生如下的化学反应:
在负极板上,因获得了电子,所以二价的铅离子(Pb + +)被中和为铅(Pb),并以固体状
态附在负极板上。
在正极板上失去的电子,则由电解液中位于极板附近处于游离状态的二价铅离子(Pb++) 不断放出二个电子来补充。当它变成四价铅离子(Pb ++++)以后,再和水中的氢氧根离子(10H) 结合,生成过渡状态的而且可离解的物质(Pb(OH) 4)和游离状态的氢离子(H +)。 (Pb(OH) 4)又继续被分解为二氧化铅(PbO2)和水。
在电流作用下向负极板移动,同时向正极板移动,两种离子因静电引力而结合成硫酸。
于是,充电时总的化学反应式为:
充电
PbSO 4+ 2H2O+ PbSO---------- PbQ+ 2fSQ+ Pb (4-2)
(正极)(水)(负极)(正极)(硫酸)(负极)
从充电反应式看出,当蓄电池充电后,两极上原来被消耗的活性物质复原了,同时电解液中的硫酸成分增加,水分减少,电解液的比重升高,因此,在实际工作中可根据电解液比重变化,来判断铅蓄电池的充电的程度。
、铅酸蓄电池容量
蓄电池的容量不是恒定的常数,它与极板活性物质的多少、充电程度、放电电流的大小、放电时间长短、电液比重和温度高低等有关。使用中放电率和电液温度影响较大。
1、电池容量与极板尺寸及有效物质的关系:
极板愈薄,活性物质利用率愈高,电池容量就大;极板面积愈大,有效物质充分利用,容量则大;有效物质颗粒间存在微孔,使电解液接触有效物质的真实面积增大数百甚至几千倍。由于正极板上的有效物质利用率约为45 %,低于负极板上有效物质利用率50%的数
值,故电池容量以正极板容量为标称单位。正极板厚,浓差极化影响大,电解液向深处扩散困难,有效物质利用率变低。
有效物质的利用率即是被利用的有效物质数量与有效物质总量之比。
2. 使用因素对容量的影响:
(1) 放电率影响:一般以10小时放电率的容量作为蓄电池的正常额定容量。放电率低于正常放电率时,可得较大的容量;反之,容量则变小。铅酸蓄电池因放电率引起的放电一变化见下面表4-1。
铁锂电池与铅酸对比
铁锂电池与铅酸对比
磷酸铁锂电池和密封阀控式铅酸蓄电池的比较 一、产品性能比较和系统组成比较 磷酸铁锂电池和铅酸电池性能比较详见表4。 表4 磷酸铁锂电池和铅酸电池性能比较 电池性能 说明 磷酸铁锂电池 铅酸电池 单体电压 (V ) 3.2 2 重量比能量 (wh/kg ) 110~130 30~50 体积比能量 (wh/L ) 180~220 80~120 循环寿命 1C100%充放 ≥1000次 250~350次 高温性能 循环寿命变化 45℃为25℃时减半 35℃为25℃时减半 低温性能 -20℃容量保持率 50% 55% 自放电 常温搁置28天 4% 5% 充放电效率 >99% 80% 耐过充性能 一般 好 安全性 优 优 环保 无污染 污染 磷酸铁锂蓄电池与铅酸蓄电池在-48V 直流电源系统的组成比较如表5所示。 表1 磷酸铁锂电池组和铅酸电池组参数比较 组单体组单体组单体组单体浮充均充铅酸电池40~572448243.2 1.854.0 2.2556.4 2.35 1.13 1.18铁锂电池40~571651.2 3.243.2 2.755.2 3.4557.6 3.6 1.08 1.13铁锂电池 40~57 1548 3.243.2 2.88 54.0 3.6 56.4 3.76 1.13 1.18 电池设备工作范围只数 标称电压(V)电压比值放电终止电压(V)浮充电压(V) 均充电压(V) 资料显示: ? 充满电后4.0V 的磷酸铁锂蓄电池静置15分钟后回落到3.4V ,电池开 口电压3.4V 。 ? 单体工作电压为2.0V~4.2V 。 ? 在3.65V 以下可以充电性能稳定。 ? 单体电池放电时,3.0V 以下电压下降很快。 综合以上信息,建议48V 直流系统的蓄电池组只数选择16只的配置方案。 二、基站应用方案比较及投资比较 磷酸铁锂电池应用在基站中,主要考虑到不同放电率对该种电池放电容量的影响较小,以及耐受较宽的环境温度。以下将针对基站的功耗、后备时间进行电池容量选择的分析。
铅酸蓄电池的原理与性能
铅酸蓄电池的原理与性能 一、铅酸蓄电池的工作原理 蓄电池是一种化学电源,它的构造可以是各式各样的,可是从原理上讲所有的电池都是由正极、负极、电解质、隔离物和容器组成的,其中 正负两极的活性物质和电解质起电化反应,对电池产生电流 起着主要作用,如图4-1所示。 在电池内部,正极和负极通过电解质构成电池的内电 路,在电池外部接通两极的导线和负荷构成电池的外电路。 在电极和电解液的接触面有电极电位产生,不同的两极 活性物质产生不同的电极电位,有着较高电位的电极叫做正 极,有着较低电位的电极叫做负极,这样在正负极之间产生了电位差,当外电路接通时,就有电流从正极经过外电路流向负极,再由负极经过内电路流向正极,电池向外电路输送电流的过程,叫做电池的放电。 在放电过程中,两极活性物质逐渐消耗,负极活性物质 1.电解质 2.负极 3.容量 4.正极 5.隔离物 6.导线 7.负荷 图4-1 电池构造示意图 放出电子而被氧化,正极活性物质吸收从外电路流回的电子而被还原,这样负极电位逐渐升高,正极电位逐渐降低,两极间的电位差也就逐渐降低,而且由于电化反应形成新的化合物增加了电池的内阻,使电池输出电流逐渐减少,直至不能满足使用要求时,或在外电路两电极之间端电压低于一定限度时,电池放电即告终。 电池放电以后,用外来直流电源以适当的反向电流通入,可以使已形成的新化合物还原成为原来的活性物质,而电池又能放电,这种用反向电流使活性物质还原的过程叫做充电。 蓄电池可以反复多次充电、放电,循环使用,使用寿 命长,成本较低,能输出较大的 能量,放电时电压下降很慢。 1.电动势的产生 铅蓄电池的正极是二氧化铅(PbO2),负极是绒状铅 (Pb),它们是两种不同的活性物质,故和稀硫酸(H2SO4)起 化学作用的结果也不同。在未接通负载时,由于化学作用 使正极板上缺少电子,负极板上却多余电子,如图4-2所图4-2 铅蓄电池电势产生过程示,两极间就产生了一定的电位差。 2.放电过程的化学反应 当外电路接上负载(比如灯泡)后,铅蓄电池在 正、负极板间电位差(电动势)的作用下,电流Ⅰ从 正极流出,经负载流向负极,也就是说,负极上的 电子经负载进入正极,如图4-3。同时在蓄电池内 部产生化学反应:
蓄电池修复技术原理与方法
蓄电池修复技术原理与方法 蓄电池修复技术原理与方法 电池又称化学电源,是能为用电器提供直流电源的装置,化学电源是通过氧化--还原的电化学反应,将化学能转化为电能.一次电池是一次性应用的电池,二次电池是可多次反复使用的电池,因此这里的二次实际上是多次的意思.二次电池又称为可充电电池或蓄电池. 相对于零电平或某一基准电平幅值为正的脉冲叫正极性脉冲,简称正脉冲,反之,则为负脉冲.正负脉冲按一定占空比出现的称组合脉冲.二十世纪以来,随着人们对负脉冲的认识的不断提高,负脉冲的应用范围不断扩大,在许多领域都得到了广泛的应用,如:能源.医疗.勘探.等. 我公司经过多年努力研制出微电脑语音系列修复机.微电脑快系列速充电站.对各种废旧蓄电池的修复与维护具有良好的效果.下面以铅酸蓄电池和锂离子电池为例.介绍一下微电脑语音系列修复机.微电脑快系列速充电站对蓄电池的维护与修复原理: 基础部分 一. 铅酸蓄电池 铅酸蓄电池是蓄电池的一种.以其低廉的价格(镉镍电池的六分之一~~`~~五分之一), 良好的高倍率放电性能,应用非常广泛,如汽车、摩托车、火车、轮船、通信以及UPS等均需运用.铅酸蓄电池主要由正极板、负极板、电解液、容器、极柱、隔膜、可导电的物质等组成. (一) 正极板(正极活性物质) 正极板活性物质的主要成分是二氧化铅.具有较强的氧化性,放电时,与硫酸发生反应生成硫酸铅,并吸收电子,二氧化铅有两种类型晶格,一种是α—Pb02 另一种是β—Pb02.这两种二氧化铅活性物质差别很大,它们在正极板所起的作用也不相同.?—Pb02 给出的容量是α—PbO2 的1.5~~~3倍.而α—Pb02具有较好的机械强度,它的存在,正极板活性物质不宜软化脱落,只有α—Pb02 和 βα—PbO2 的比例达到0.8时,铅蓄电池会表现出良好的性能 . 正极活性物质在放电状态下,与电解质硫酸发生反应生成硫酸铅与水.其反应式如下:Pb02+3H++HSO4-+2e==PbSO4+2H2O 充电时,在外线路的作用下转化为ρbO2与H2SO4放电时,二氧化铅的ρb4+接受了负极送来的电子形成ρb+2与溶液中的硫酸根离子结合生成ρbSO4 .当硫酸铅达到一定量时,变成沉淀物附着在极板上.充电时硫酸铅中的铅离子 的电子被外线路带走转化为 二氧化铅.将水中 氢离子留在溶液中.氧离子与铅离子结合生成二氧化铅进入晶格,形成正极活性物质. (二)负极板(负极活性物质) 在铅酸蓄电池里,为了供负极活性物质充分与电解液发生反应,故将铅制成多孔海棉状,又称为海绵铅,在放电时,铅给出外线路电子形成 Pb+2 与溶液的硫酸根 结合生成硫酸铅,充电时,部分PbSO4首先溶解成Pb2+与SO4.Pb+2接受电子还原成铅进入负极活性物质晶格. ( 三)电解液
铅酸蓄电池的结构和工作原理
铅酸蓄电池的结构和工作原理 (一)铅酸蓄电池的结构 铅酸蓄电池主要由正极板组?负极板组?隔板?容器和电解液等构成,其结构如下图所示: 1.极板 铅酸蓄电池的正?负极极板由纯铅制成,上面直接形成有效物质,有些极板用铅镍合金制成栅架,上面涂以有效物质?正极(阳极)的有效物质为褐色的二氧化铅,这层二氧化铅由结合氧化的铅细粒构成,在这些细粒之间能够自由地通过电解液,将正极材料磨成细粒的原因是可以增大其与电解液的接触面积,这样可以增加反应面积,从而减小蓄电池的内阻?负极(阴极)的有效物质为深灰色的海绵状铅?在同一个电池内,同极性的极板片数超过两片者,用金属条连接起来,称为极板组
或极板群?至于极板组内的极板数的多少,随其容量(蓄电能力)的大小而异?为了获得较大的蓄电池容量,常将多片正?负极板分别并联,组成正?负极板组,如下图所示: 安装时,将正?负极板组相互嵌合,中间插入隔板,就形成了单格电池?在每个单格电池中,负极板的片数总要比正极板的片数多一片,从而使每片正极板都处于两片负极板之间,使正极板两侧放电均匀,避免因放电不均匀造成极板拱曲? 2.隔板 在各种类型的铅酸蓄电池中,除少数特殊组合的极板间留有宽大的空隙外,在两极板间均需插入隔板,以防止正?负极板相互接触而发生短路?这种隔板上密布着细小的孔,既可以保证电解液的通过,又可
以阻隔正?负极板之间的接触,控制反应速度,保护电池?隔板有木质?橡胶?微孔橡胶?微孔塑料?玻璃等数种,可根据蓄电池的类型适当选定?吸附式密封蓄电池的隔板是由超细玻璃丝绵制作的,这种隔板可以把电解液吸附在隔板内,吸附式密封蓄电池的名称也是由此而来的? 3.容器 容器是用来盛装电解液和支撑极板的,通常有玻璃容器?衬铅木质容器?硬橡胶容器和塑料容器四种?容器用于盛放电解液和极板组,应该耐酸?耐热?耐震?容器多采用硬橡胶或聚丙烯塑料制成,为整体式结构,底部有凸起的肋条以搁置极板组?壳内由间壁分成3个或6个互不相通的单格,各单格之间用铅质联条串联起来?容器上部使用相同材料的电池盖密封,电池盖上设有对应于每个单格电池的加液孔,用于添加电解液和蒸馏水以及测量电解液密度?温度和液面高度? 4.电解液 铅酸蓄电池的电解液是用蒸馏水稀释高纯浓硫酸而成的?它的密度高低视铅蓄电池类型和所用极板而定,一般在15℃时为1.200~1.300g/cm3?蓄电池用的电解液(稀硫酸)必须保持纯净,不能含有危害铅酸蓄电池的任何杂质?电解液的作用是给正?负电极之间流动的离子创造一个液体环境,或者说充当离子流动的介质?电解液的相对密度对蓄电池的工作有重要影响,相对密度大,可减少结冰的危险并提
铅酸蓄电池原理和种类
铅酸蓄电池原理和种类 储能电池及器件是太阳能光伏发电系统不可缺少的存储能电能的部件,其主要功能是存储光伏发电系统的电能,并在日照量不足,夜间以及应急状态下为负载供电。常用的储能电池有铅酸蓄电池、碱性蓄电池、锂电池、超级电容,它们分别应用于不同场合或者产品中。目前应用最广是铅酸蓄电池,从19世纪50年代开发出来至今,已经有160余年的历史,目前衍生出很多种类,如富液铅酸电池、阀控密封铅酸电池、胶体电池,铅碳电池等。 一、工作原理及基本结构 铅酸电池是用铅和二氧化铅作为电池负极和正极活性物质,以稀硫酸为电解质的化学储能装置,具有电能转换效率高、循环寿命长、端电压高、安全性强、性价比高、安装维护简单等特点,目前是各类储能、应急供电、启动装置中首选的化学电源。铅酸电池的主要构成包括: 1.极板:正负极板均是以特殊的合金板栅涂敷上活性物质所得,极板在充放电时存储和释放能量,确保电池的容量和性能可靠。 2.隔板:是置放于电池正负极中间的一个隔离介质,防止电池正负极直接接触而短路的装置,不同类型的铅酸电池隔板材质不同,阀控类电池主要以AGM、PE、PVC 为主。 3.电解液:铅酸电池的电解液是用蒸馏水配制的稀硫酸,电解液在充放电时起到在正负极间传输离子的作用,因而电解液必须要没有杂质。 4.容器(电池壳盖):电池包覆的容器,电解液和极板均在容器内,主要起支撑作用,同时防止内部物质外溢,外部物质进入内部结构污染电池。 二、种类及优势 铅酸电池的工作原理就是通过电化学反应,电能和化学能之间相互转化,电极主要由铅及其氧化物制成,电解液是硫酸溶液的一种蓄电池。英语:Lead-acid battery 。 放电状态下,正极主要成分为二氧化铅,负极主要成分为铅。 充电状态下,正负极的主要成分均为硫酸铅。 铅酸蓄电池种类较多,应用在光伏储能系统中,比较多的有三种,富液型铅酸蓄电池、阀控式密封铅酸蓄电池、铅碳蓄电池等等。 2.1 富液型铅酸蓄电池
第一章 铅酸蓄电池的常识
第一章铅酸蓄电池的常识 1. 电池的构成 任何一种电池均有四个主要的部件组成:两个不同材料的电极、电解液、隔膜和外壳。 对于铅酸蓄电池来说,正极活性物质是二氧化铅(PbO2,暗红色),负极活性物质是铅(Pb,灰色),正负极集流体都是板栅,电解质是硫酸(H2SO4)。 动力电池:隔膜是聚氯乙烯(PVC),外壳是聚丙烯(PP)。 起动电池:隔膜是聚丙烯(PP)或聚乙烯(PE),外壳是聚丙烯(PP)。 阀控式密封电池:隔膜是玻璃纤维(AGM),外壳是ABS(丙烯腈-丁二烯-苯乙烯三元共聚物)。 2. 铅酸蓄电池的工作原理 PbO2 + Pb+2H2SO4 =2PbSO4 + 2H2O 随着放电的进行,硫酸不断减少,与此同时电池中又有水生成,这样就使电池中的电解液浓度不断降低;反之,在充电时,硫酸将不断生成,因此电解液浓度将不断增加。 3. 铅酸蓄电池的电性能 电池的开路电压:电池在断路时(即没有电流通过两极时),电池两极的电极电位之差,称为电池的开路电压。 电池的开路电压只取决于所组成电池的电极材料与电解液的活度和放电的温度,与电池的几何形状和尺寸大小无关。在电解液密度一定的范围内,铅酸电池的开路电压与电解液的密度有下列关系:开路电压=d+0.85,d是在电池电解液的温度下电解液的密度(g/cm3)。 根据铅酸电池中进行的反应可知,放电时随着PbO2和Pb的消耗,H2SO4也消耗,即随着放电的进行,H2SO4减少,水增加,则酸的密度降低。因此可以根据电池的开路电压估计电池的荷电状态,也可以根据电池的开路电压估计电解液的密度。 电池的内阻:是指电流通过电池内部受到的阻力,又叫全内阻。 它包括欧姆内阻和极化内阻。电池的欧姆内阻包括电极本身的电阻、电解质溶液的电阻、离子通过隔膜微孔时受到的阻力和正负极与隔离层的接触电阻等。 欧姆内阻还与电池的几何尺寸、装配的紧密程度和电池的结构等因素有关,一般电池装配越紧密、电极间距离越小,欧姆内阻就越小;对于同一类的相同结构的电池,几何尺寸大的其欧姆内阻比几何尺寸小的电池要小。 因为内阻的存在,电池的工作电压总是小于开路电压。 电池的放电电压:又称为电池的工作电压或电池的负荷电压,是指电池在放电时电池两端的电压,也可以说是电流通过外线路时,电池两电极之间的电位差。 电池放电电压的变化与放电制度有关,即放电曲线的变化还受着放电制度的影响,放电制度包括放电的电流强度I(或放电电流密度i)、放电温度T放和放电的终止电压V终。放电电流越大,工作电压下降越快;放电温度增加,放电曲线变化比较平缓,温度越低,曲线变化越大;放电终止电压是电池放电时电压下降到不能继续放电的最低工作电压,这是人为规定的。一般原则是,在低温、大电流放电时,终止电压选择要低一些;而小电流放电时,终止电压选择应稍高些。 电池的充电电压:是指电池在充电时,外电源加在电池两端的电压,充电电压随时间的变化曲线叫做充电曲线。随着充电的进行,充电电压会不断上升,对于铅酸电池,在充电后期主要进行水的分解,电池电压会稳定下来。如果采用大电流充电,则充电电压上升较快,最终达到较高的电压值。 电池的容量:是指在一定的放电制度下(即在一定的I放、T放、V终)电池所给出的电量,常用C表示,单位为安培?小时(Ah)。电池在恒流放电时,可以用C=It来计算电池的容量。对于一个做好的电池来说,影响其容量的因素是放电制度,i放越大,电池放出的容量越小;随着放电温度的增高,电池放出的容量也增大;一般是V终越高,电池放出的容量越小。
铅酸蓄电池结构详解
铅酸蓄电池结构详解 一、蓄电池的功用 蓄电池种类较多,根据电解液不同,有酸性和碱性之分。由于铅酸蓄电池阻小,电压稳定,在短时间能供给较大的起动电流,而且结构简单,价格较低,所以在汽车拖拉机上被广泛采用。 蓄电池为一可逆直流电源,在汽车拖拉机上与发电机并联,它的主要作用是:(1)发动机起动时,蓄电池向起动机和点火装置供电。起动发动机时,蓄电池必须在短时间(5~10s)给起动机提供强大的起动电流(汽油机为200~600A。柴油机有的高达1000A)。 (2)在发电机不发电或电压较低发动机处于低速时,蓄电池向点火系及其它用电设备供电,同时向交流发电机供给他激励磁电流。 (3)当用电设备同时接入较多,发电机超载时,蓄电池协助发电机共同向用电设备供电。 (4)当蓄电池存电不足,而发电机负载又较少时,可将发电机的电能转变为化学能储存起来,即充电。 (5)蓄电池还有稳定电网电压的作用。当发动机运转时,交流发电机向整个系统提供电流。蓄电池起稳定电器系统电压的作用。蓄电池相当于一个较大的电容器,可吸收发电机的瞬时过电压,保护电子元件不被损坏。延长其使用寿命。 二、蓄电池的构造 车用12V蓄电池均由6个单格电池串联而成,每个单格的标称电压为2V,串联成12V的电源,向汽车拖拉机用电设备供电。
蓄电池主要由极板、电解液、格板、电极、壳体等部分组成。 1.极板 极板分为正极板和负极板两种。蓄电池的充电过程是依靠极板上的活性物质和电解液中硫酸的化学反应来实现的。正极板上的活性物质是深棕色的二氧化铅(PbO2),负极板上的活性物质是海绵状、青灰色的纯铅(Pb)。 正、负极板的活性物质分别填充在铅锑合金铸成的栅架上,加入锑的目的是提高栅架的机械强度和浇铸性能。但锑有一定的副作用,锑易从正极板栅架中解析出来而引起蓄电池的自行放电和栅架的膨胀、溃烂,从而影响蓄电池的使用寿命。 负极板的厚度为1.8mm,正极板为2.2mm,为了提高蓄电池的容量,国外大多采用厚度为1.1~1.5mm的薄型极板。另外,为了提高蓄电池的容量,将多片正、负极板并联,组成正、负极板组。在每单格电池中,负极板的数量总比正极板多一片,正极板都处于负极板之间,使其两侧放电均匀,否则因正极板机械强度差,单面工作会使两侧活性物质体积变化不一致,造成极板弯曲。 2.隔板 为了减少蓄电池的阻和体积,正、负极板应尽量靠近但彼此又不能接触而短路,所以在相邻正负极板间加有绝缘隔板。隔板应具有多孔性,以便电解液渗透,而且应具有良好的耐酸性和抗碱性。 隔板材料有木质、微孔橡胶、微孔塑料以及浸树脂纸质等。近年来,还有将微孔塑料隔板做成袋状,紧包在正极板的外部,防止活性物质脱落。 3.壳体
最全面铅酸蓄电池常见故障和机理分析快点动力
最全面铅酸蓄电池常见故障和机理分析 快点动力新能源 1、反极的现象及原因 铅酸蓄电池的反极系指蓄电池的正负极发生了改变,反极现象反映在两个方面,一是由于铅蓄电池在装配组装时某单格电池极群组接反或整个电池极群组接反。这种情况下会出现铅酸蓄电池灌完酸用电压表测量端电压时其端电压值小于各单体蓄电池额定电压之和的现象或出现端电压为负的现象。另一方面是铅蓄电池在容量放电时在多个串联使用中,由于某个蓄电池(或某单体蓄电池)容量较低或完全丧失容量。在放电时这个电池很快被放完电被其它电池进行反充电,使原来的负极变成正极,原来的正极变成负极,端电压出现负值的现象。 对于前一种反极故障,在测量蓄电池端电压时(多个单体电池组成的蓄电池)都可发现,若有一个单体电池反极,不仅失去该电池的2 V电压,而且还要增加2 V反电压,端电压要降低4V左右。例如,对于额定电压为12 V的电池,如测量其端电压为8 V左右,说明有1个单格电池反极。如测量其端电压为4 V左右说明有2个单格反极,如测量其端电压为-4 V左右说明有4个单格反极,如测量其端电压为-12 V说明6个单格均反极。 对于后一种反极故障,其端电压值(负值)随放电情况而不同。一般在检测时,对于这种情况要及时将蓄电池从放电线路中摘除下来,以免对蓄电池有所损坏。 2、短路现象及原因 铅酸蓄电池的短路是指铅酸蓄电池内部正负极群相连。铅酸蓄电池短路现象主要表现在以下几个方面: (1)开路电压低,闭路电压(放电)很快达到终止电压。 (2)大电流放电时,端电压迅速下降到零。 (3)开路时,电解液密度很低,在低温环境中电解液会出现结冰现象。 (4)充电时,电压上升很慢,始终保持低值(有时降为零)。 (5)充电时,电解液温度上升很高很快。 (6)充电时,电解液密度上升很慢或几乎无变化。 (7)充电时不冒气泡或冒气出现很晚。 造成铅酸蓄电池内部短路的原因主要有以下几个方面: (1)隔板质量不好或缺损,使极板活性物质穿过,致使正、负极板虚接触或直接接触。 (2)隔板窜位致使正负极板相连。 (3)极板上活性物质膨胀脱落,因脱落的活性物质沉积过多,致使正、负极板下部边缘或侧面边缘与沉积物相互接触而造成正负极板相连。 (4)导电物体落入电池内造成正、负极板相连。 (5)焊接极群时形成的“铅流”未除尽,或装配时有“铅豆”在正负极板间存在,在充放电过程中损坏隔板造成正负极板相连。 3、极板硫酸化现象及原因 极板硫酸化系是在极板上生成白色坚硬的硫酸铅结晶,充电时又非常难于转化为活性物质的硫酸铅。铅酸酸蓄电池极板硫酸化后主要有以下几种现象。
电动汽车电池的分类及性能参数
电动汽车电池的分类及性能参数 电池的分类 电动汽车用电池为化学电源,它的分类方法很多。按电解液分为: a.碱性电池。即电解液为碱性水溶液的电池; b.酸性电池。即电解液为酸性水溶液的电池; c.中性电池。即电解液为中性水溶液的电池; d.有机电解质溶液电池。即电解液为有机电解质溶液的电池。 按活性物质的存在方式分为: a.活性物质保存在电极上。可分为一次电池(非再生式,原电池)和 二次电池(再生式,蓄电池); b.活性物质连续供给电极。可分为非再生燃料电池和再生燃料电池。按电池的某些特点分为: a.高容量电池; b.免维护电池; c.密封电池; d.燃结式电池; e.防爆电池; f.扣式电池、矩形电池、圆柱形电池等。 尽管由于化学电源品种繁多,用途广泛,外形差别大,使上述分类方法难以统一,但习惯上按其工作性质及存贮方式不同,一般分为四类: a. 一次电池
一次电池,又称“原电池”,即放电后不能用充电的方法使它复原的电池。换言之,这种电池只能使用一次,放电后电池只能被遗弃了。这类电池不能再充电的原因,或是电池反应本身不可逆,或是条件限制使可逆反应很难进行。如: 锌锰干电池 Zn│NH4Cl·ZnCl2│MnO2(C) 锌汞电池 Zn│KOH│HgO 银锌电池 Zn│KOH│Ag2O b.二次电池 二次电池,又称“蓄电池”,即放电后又可用充电的方法使活性物质复原而能再次放电,且可反复多次循环使用的一类电池。这类电池实际上是一个化学能量贮存装置,用直流电将电池充足,这时电能以化学能的形式贮存在电池中,放电时,化学能再转换为电能。如:铅酸电池 Pb│H2SO4│PbO2 镍镉电池 Cd│KOH│NiOOH 镍氢电池 H2│KOH│NiOOH 锂离子电池 LiCoO2│有机溶剂│6C 锌空气电池 Zn│KOH│O2(空气) c.贮备电池 贮备电池,又称“激活电池”,是正、负极活性物质和电解液不直接接触,使用前临时注入电解液或用其他方法使电池激活的一类电池。这类电池的正、负极活性物质的化学变质或自放电,因与电解液的隔离而基本上被排除,从而使电池能长时间贮存。如:镁银电
铅酸蓄电池的原理与性能
. 铅酸蓄电池的原理与性能 一、铅酸蓄电池的工作原理 蓄电池是一种化学电源,它的构造可以是各式各样的,可是从原理上讲所有的电池都是由正极、负极、电解质、隔离物和容器组成的,其中正负两极的活性物质和电解质起电化反应,对电池产生电流起着主要作用,如图4-1所示。 在电池内部,正极和负极通过电解质构成电池的内电路,在电池外部接通两极的导线和负荷构成电池的外电路。 在电极和电解液的接触面有电极电位产生,不同的两极活性物质产生不同的电极电位,有着较高电位的电极叫做正极,有着较低电位的电极叫做负极,这样在正负极之间产生了电位差,当外电路接通时,就有电流从正极经过外电路流向负极,再由负极经过内电路流向正极,电池向外电路输送电流的过程,叫做电池的放电。 在放电过程中,两极活性物质逐渐消耗,负极活性物质 1.电解质 2.负极 3.容量 4.正极 5.隔离物 6.导线 7.负荷 图4-1 电池构造示意图 放出电子而被氧化,正极活性物质吸收从外电路流回的电子而被还原,这样负极电位逐渐升高,正极电位逐渐降低,两极间的电位差也就逐渐降低,而且由于电化反应形成新的化合物增加了电池的内阻,使电池输出电流逐渐减少,直至不能满足使用要求时,或在外电路两电极之间端电压低于一定限度时,电池放电即告终。 电池放电以后,用外来直流电源以适当的反向电流通入,可以使已形成的新化合物还原成为原来的活性物质,而电池又能放电,这种用反向电流使活性物质还原的过程叫做充电。 蓄电池可以反复多次充电、放电,循环使用,使用寿命长,成本较低,能输出较大的能量,放电时电压下降很慢。 1.电动势的产生 铅蓄电池的正极是二氧化铅(PbO 2),负极是绒状铅(Pb),它们是两种不同的活性物质,故和稀硫酸(H 2SO 4)起化学作用的结果也不同。在未接通负载时,由于化学作用 使正极板上缺少电子,负极板上却多余电子,如图4-2所 图4-2 铅蓄电池电势产生过程 示,两极间就产生了一定的电位差。 2.放电过程的化学反应 当外电路接上负载(比如灯泡)后,铅蓄电池在正、负极板间电位差(电动势)的作用下,电流Ⅰ从正极流出,经负载流向负极,也就是说,负极上的电子经负载进入正极,如图4-3。同时在蓄电池内部产生化学反应:
(整理)铅酸蓄电池的性能检测
铅酸蓄电池的性能检测 一、容量 电池容量是指在规定条件下测得的并由制造商宣称的电池容量值。实际上是在规定 温度下,以一定电流放电一定时间,当达到规定的终止电压时,所能给出的电量,用C 表示,以安时(Ah)为单位。 ⑴起动电池的容量 a. 额定储备容量,用Cr.n表示,其值应符合GB/T 5008.2-2008标准的规定。 b. 实际储备容量,用Cr.e表示,其值应在第3次或之前的储备容量试验时,达到额定储备容量用Cr.n。 c. 20h率额定容量,用C20表示,其值应符合GB/T 5008.2-2008标准的规定。 d. 实际容量,用Ce表示,其值应在第3次或之前的容量试验时,应不低于额定容量C20的95%。 ⑵牵引电池的容量 a. 额定容量,用C5表示,在30℃温度下放电5h,放电电流是C5/5(A),放电至单体电压1.70V,所给出的电量(Ah),其值应符合GB/T 7403.1-2008标准的规定。 b. 实际容量,用Ce表示,在规定条件下,电池所能放出的电量(Ah),其值应在第1次容量试验时应不低于额定容量C5的85%。实际容量在前10次容量试验内至少有1次 达到额定容量。 ⑶内燃机车用排气式电池的容量 电池的额定容量以C5表示,其值应在第6次循环内达到电池标称容量值,应符合GB/T 7404.1-2008标准的规定。 ⑷内燃机车用阀控密封式电池的容量 电池的额定容量以C5表示,其值应在第6次循环内达到电池标称容量值,应符合GB/T 7404.2-2008标准的规定。
⑸铁路客车用电池的容量 a. 额定容量,用C10、C5、C1表示,其容量值在进行容量试验时要达到额定值,在3次试验中有1次合格为合格,应符合GB/T 13281-2008标准的规定。 b. 实际容量,用Ce表示,即在规定条件下测得的电池实际放电容量。 c. 低温容量,用Cd表示,电池在零下40℃环境中静置8h,以I10(A)电流放电至单体电压1.60V,计算其容量,低温容量Cd与常温容量C10、C5、C1的比值不少于0.4(>40%)。 ⑹固定型防酸式电池的容量 C10容量在第1次循环不低于0.90C10,第5次循环应达到C10;C1和1.0C容量分别在第7次、第9次循环达到额定值,应符合GB/T 13337.1-2008标准的规定。 ⑺固定型阀控密封式电池的容量 C10容量在第1次循环不低于0.95C10,第3次循环应达到C10、C3、C1,应符合GB/T 19638.1-2008的规定。 ⑻小型阀控密封式电池的容量 C20容量应符合GB/T 19639.2-2008的规定。实际容量Ce在第5次充/放循环内应不低于C20。 ⑼电动道路车辆用电池的容量 a. 额定容量,用C3表示,第1次放电容量应不低于0.85C3,第10次放电容量或之前放电容量应达到C3,应符合GB/T 18332.1-2008的规定。 b. 低温容量,用Cd表示,电池在零下18℃环境中静置24h,以I3(A)电流放电至单体电压1.40V,其容量应不低于0.5C3。 ⑽电动助力车用密封式电池的容量 a. 额定容量,用C2表示,应在第3次循环内达到。 b. 实际容量,用Ca表示,应符合GB/T 22199-2008的规定。
铅酸蓄电池的工作原理
铅酸蓄电池的工作原理 1、铅酸蓄电池电动势的产生: A)铅酸蓄电池充电后,正极板是二氧化铅(PbO2),在硫酸溶液中水分子的作用下,少量二氧化铅与水生成可离解的不稳定物质——氢氧化铅(Pb(OH)2),氢氧根离子在溶液中,铅离子(Pb)留在正极板上,故正极板上缺少电子。 B)铅酸蓄电池充电后,负极板是铅(Pb),与电解液中的硫酸(H2SO2)发生反应,变成铅离子(Pb+2),铅离子转移到电解液中,负极板上留下多余的两个电子(2e)。可见,在未接通外电路时(电池开路),由于化学作用,正极板上缺少电子,负极板上多余电子,两极板间就产生了一定的电位差,这就是电池的电动势。 2、铅酸蓄电池放电过程的电化反应: A)铅酸蓄电池放电时,在蓄电池的电位差作用下,负极板上的电子经负载进入正极板形成电流I ,同时在电池内部进行化学反应。 B)负极板上每个铅原子放出两个电子后,生成的铅离子(Pb+2)与电解液中的硫酸根离子(SO4-2)反应,在极板上生成难溶的硫酸铅(PbSO4)。 C)正极板的铅离子(Pb+4)得到来自负极的两个电子(2e)后,变成二价铅离子(Pb+2)与电解液中的硫酸根离子(SO4-2)反应,在极板上生成难溶的硫酸铅(PbSO4)。正极板水解出的氧离子(O2)与电解液中的氢离子(H+)反应,生成稳定物质水. D)电解液中存在的硫酸根离子和氢离子在电力场的作用下分别移向电池的正负极,在电池内部形成电流,整个回路形成,蓄电池向外持续放电。 E)放电时H2SO4浓度不断下降,正负极上的硫酸铅(PbSO2)增加,电池内阻增大(硫酸铅不导电),电解液浓度下降,电池电动势降低。 F)化学反应式为: 正极活性物质电解液负极活性物质正极生成物电解液生成物负极生成物↓ ↓ ↓ ↓ ↓ ↓ PbO2 + H2SO4 + Pb → PbSO4 + 2H2O + PbSO4 氧化铅稀硫酸铅硫酸铅水硫酸铅 3、铅酸蓄电池充电过程的电化反应 A)充电时,应在外接一直流电源(充电极或整流器),使正、负极板在放电后生成的物质恢复成原来的活性物质,并把外界的电能转变为化学能储存起来。 B)在正极板上,在外界电流的作用下,硫酸铅被离解为二价铅离子(Pb )和硫酸根负离子(SO4 ̄2)由于外电源不断从正极吸取电子,则正极板附近游离的二价铅离子(Pb )不断放出两个电子来补充,变成四价铅离子(Pb ),并与水继续反应,最终在正极极板上生成二氧化铅(PbO )。 C)在负极板上,在外界电流的作用下,硫酸铅被离解为二价铅离子(Pb )和硫酸根负离子(SO4 ̄2),由于负
铅酸蓄电池的主要性能指标
铅酸蓄电池的主要性能指标 1. 铅酸蓄电池的主要性能指标 (1)安全性能 安全性能指标不合格的蓄电池是不可接受的,其中影响最大的是爆炸和漏液。爆炸和漏液的发生主要与蓄电池的内压、结构、工艺设计(比如安全阀失效)及应当禁止的不正确操作有关。 (2)额定容量 为了蓄电池的容量,定义了蓄电池的额定容量。额定容量是蓄电池制造的时候,规定蓄电池在一定的放电条件下应该放出的最低限度的电量,其单位为Ah。使用条件不同,蓄电池能够放出的容量也不同。规定的蓄电池放电条件为: ①蓄电池放电电流。一般所说的就是放电率,针对蓄电池放电电流的大小分别有时间率和电流率。放电时间率是指在一定的放电条件下放电到终止电压的时间长短。依据IEC标准,放电率分别为20小时率、10小时率、5小时率、3小时率、2小时率、1小时率、0.5小时率等。蓄电池的额定容量用C来表示,以不同的放电率得到的蓄电池的容量会不同。 ②放电终止电压。放电电流不同,终止放电电压也不相同。随着放电的进行,蓄电池的端电压会逐步下降。在25℃条件下放电到能够再次反复充电使用的最低电压称为放电终止电压。放电率不同,放电终止电压也不相同。一般为10小时率放电的终止电压多数为1.8V/单格,以2小时率方电的终止电压一般为1.75V/单格。低于这个电压时,虽然可以放出稍微多一点的电量,但是容易形成再次充电的容量下降,所以除非特殊情况,不要放电到终止电压。 ③放电温度。需电池在低温时的放电容量小,高温时的容量大,为了统一放电容量就规定了放电温度。 ④蓄电池的实际容量。蓄电池的实际容量反应蓄电池实际存储电量的多少,单位用安时表示(Ah)表示。同样安时数越大,则蓄电池的容量就越大,电动自行车的续行里程就越远。在使用过程中,蓄电池的实际容量会逐步衰减。国家标准规定新出厂的蓄电池的实际容量大于额定容量者为合格蓄电池。如现在市场上电动自行车的蓄电池,以恒定电流5A放电要超过2h,相当于电动自行车在平坦的路上连续行驶2h以上。 影响蓄电池容量的因素有极板的构造、充放电电流的大小、电解液的温度及密度等,其中以充放电电流和温度的影响最大。如充放电流过大,将使极板上的活性物质变化处于表面,容量则降低很多。蓄电池的放电电流不同,所能够放出的容量也不相同,放电电流越大,能够放出的电量越小。例如电动自行车常用的电流为5A,使用标称10Ah的蓄电池就是2小时率放电,如果采用10小时率放电,可以达到12Ah。这样,该蓄电池如果按照2小时率标称应该是10Ah,如果按照10小时率标称就是12Ah.所以评价蓄电池的容量不仅仅要看蓄电池的标称容量,还要看蓄电池的放电率。电动自行车蓄电池往往标称为10Ah,同一个蓄电池也可以标12Ah和14Ah。再比如,14Ah的许电车也可以标为17Ah。还有一些蓄电池标为20Ah,蓄电池容量标称值大了,但是其容量没有明显的变化。 (3)内阻 蓄电池的内阻是指电流流过蓄电池内部时所受的阻力,铅酸蓄电池的内阻很小,需要用专门的仪器才可以测得到比较准确的结果。一般所指的蓄电池内阻是充电态内阻,即蓄电池充满电时的内阻。与之对应的是放电态内阻,并且不太稳定。蓄电池的内阻越大,蓄电池自身消耗掉的能量越多,其使用效率越低。内阻很大的蓄电池在充电时发热很厉害,使蓄电池的温度急剧上升,对蓄电池和充电器的影响都很大。随着蓄电池使用次数的增多,由于电解液的消耗及蓄电池内部化学物质活性的降低,蓄电池的内阻会有不同程度的增大,质量越差的蓄电池增大的越快。 蓄电池内部阻抗会因放电量增加而增大,尤其是在放电终止时阻抗最大,主要因为放电的进行使得极板内产生不良导体硫酸铅以及电解液比重下降,故放电后务必马上充电。若任其持续放电,则硫酸铅形成安定的白色结晶(即硫化现象)后,即使充电,极板的活性物质亦无法恢复原状,从而将缩短蓄电池的使用寿命。 温度的下降将导致电解液流动性变差,极板收缩,化学变化迟缓,蓄电池内阻增加。从30℃开始,若温度下降1℃,容量将下降1%左右,其内阻也有所增大。所以在严寒地区,气温在-20℃以下时容量已下降至60%,内阻增大,常感到蓄电池电力不足。在严寒地区易出现过量放电,而在温带地区则经常出现过量充电的问题。所以要使用好蓄电池,必须根据当地的气候条件,针对实际情况,掌握其使用规律。蓄电池的充电必须根据不同情况选择适当的方法并正确的使用充电设备,这样才能提高蓄电池的容量,延长蓄电池的使用寿命。 铅酸蓄电池的内阻与镍氢蓄电池及锂离子蓄电池相比较小,即蓄电池容量下降2/3后,仍能提供较大的电流,而电源电压基本稳定,波动较小。而镍氢蓄电池及锂离子蓄电池就不同了。以36V/9Ah锂离子蓄电池为例,当容量下降到原来的1/3后,电流输出为12A时,电压就会有4~5V的波动,即有电流输出时为31V,无电流输出时接近35V。这样在电动自行车应用中,骑行时会出现运行不平稳,时而有输出时而无输出的现象。 (4)循环寿命 循环寿命是指蓄电池可经历的重复充放电次数。蓄电池的寿命和容量成反比关系,循环寿命还与充放电条件密切相关,一般充电电流越大(充电速度越快),循环寿命越短。 寿命是表示蓄电池容量衰减速度的一项指标,随着使用的深入,蓄电池容量的衰减是不可避免的,当容量衰减到某规定值时,
铅酸电池工作原理
铅酸电池工作原理 (1)阀控式密封铅酸蓄电池在充放电过程中的化学反应如下: 放电 PbO 2 + 2H 2SO 4 + PbSO 4 + 2H 2O + PbSO 4 充电 (二氧化铅) (硫酸) (海绵状铅) (硫酸铅) (水) (硫酸铅) 解决方案 防止因过充电导致水分解而引起电解液的减少 实现电池的密封 (3)活性物质 设计正、负极板活物质在充电过程中的异步复原反应,即当正极板活物质完全充电恢复后,负极板活物质还未完全转变为海绵状铅,这样,充电末期当正极开始产生氧气时,负极板还未变成完全充电状态,可以最大限度抑制氢气的产生。 (4)隔板:设计隔板达到以下4个主要目的 ① 保持正、负极板绝缘; ② 吸附电解液,保持电解液不流动及负极板处于湿润状态; ③ 高孔隙度,使正极产生的氧气容易通过到达负极板; ④ 隔板中加入适量粗纤维,保持隔板长时间具备良好的弹性。 (5)充电末期电极反应 正极产生的氧气,与负极活物质和稀硫酸进行反应,使负极板的一部分处于去极化状态,从吸收正极产生的氧气而消耗的海绵状铅的量 负极板充电生成海绵状铅的量 二者达到平衡状态时,便实现了电池的密封 当 与? ?
而抑制了氢气的产生。 充电末期的电极反应如下: A、正极板的反应(产生氧气) ①2H2O →O2+ 4H++ 4e- (通过隔板移向负极板表面) B、负极板的反应 ②2Pb + O2→2PbO (海绵状铅与氧气发生反应) ③2PbO + 2H2SO4→2PbSO4+ 2H2O (PbO与电解液发生反应) ④2PbSO4 + 4H+ + 4e-→2Pb + 2H2SO4(PbSO4的还原) (参与②的反应)(参与③的反应) C、负极板的总反应:O2+ 4H++ 4e-→2H2O 总之,充电过程产生的氧气能够迅速与负极板上充电状态下的活物质发生反应变成水,结果基本没有水份的损失,密封成为可能。 2、电池生产流程
蓄电池的主要性能指标
蓄电池的主要性能指标 The Standardization Office was revised on the afternoon of December 13, 2020
1. 铅酸蓄电池的主要性能指标 (1)安全性能安全性能指标不合格的蓄电池是不可接受的,其中影响最大的是爆炸和漏液。爆炸和漏液的发生主要与蓄电池的内压、结构、工艺设计(比如安全阀失效)及应当禁止的不正确操作有关。 (2)额定容量为了蓄电池的容量,定义了蓄电池的额定容量。额定容量是蓄电池制造的时候,规定蓄电池在一定的放电条件下应该放出的最低限度的电量,其单位为Ah。使用条件不同,蓄电池能够放出的容量也不同。规定的蓄电池放电条件为:①蓄电池放电电流。一般所说的就是放电率,针对蓄电池放电电流的大小分别有时间率和电流率。放电时间率是指在一定的放电条件下放电到终止电压的时间长短。依据IEC标准,放电率分别为20小时率、10小时率、5小时率、3小时率、2小时率、1小时率、小时率等。蓄电池的额定容量用C来表示,以不同的放电率得到的蓄电池的容量会不同。 ②放电终止电压。放电电流不同,终止放电电压也不相同。随着放电的进行,蓄电池的端电压会逐步下降。在25℃条件下放电到能够再次反复充电使用的最低电压称为放电终止电压。放电率不同,放电终止电压也不相同。一般为10小时率放电的终止电压多数为单格,以2小时率方电的终止电压一般为单格。低于这个电压时,虽然可以放出稍微多一点的电量,但是容易形成再次充电的容量下降,所以除非特殊情况,不要放电到终止电压。 ③放电温度。需电池在低温时的放电容量小,高温时的容量大,为了统一放电容量就规定了放电温度。④蓄电池的实际容量。蓄电池的实际容量反应蓄电池实际存储电量的多少,单位用安时表示(Ah)表示。同样安时数越大,则蓄电池的容量就越大,电动自行车的续行里程就越远。在使
铅酸蓄电池原理
密封阀控式铅酸蓄电池原理简介 要想很好的对密封阀控式铅酸蓄电池进行维护,首先要了解它的原理,以便于有的放矢。1860年法国人普兰特(G.Plante)将中间用橡胶条隔开的两块铅皮浸在稀硫酸中经过正向反向地反复充电,所得的产品能以比当时任何一次电池更大的电流放电,这就是世界上第1个铅酸蓄电池。铅酸蓄电池经过100多年的发展,已有各种类型和各种用途的专用电池,但不论何种铅酸 蓄电池,其原理都是一致的。 在正极上: PbO2+4H++SO42-+2e → PbSO4+2H2O ……. ① 在负极上: Pb+ SO42- → PbSO4 +2e ….......② 从整体上看,蓄电池放电反应方程式为: PbO2+ Pb + 2H2SO4 → 2 PbSO4 + 2H2O ……..③ 此反应为放出能量的过程,只要条件具备,可快速自发地进行。二氧化铅和铅作为活性物 质分别存在于正负极上,其放电反应后分别在正负极上生成了硫酸铅,所以称此为双极硫酸盐 化理论。反应过程中释放出能量(电能和热能)。蓄电池充电反应方程式即①~③的逆反应。 上世纪70年代,创制出了第1个贫液式结构的密封阀控式铅酸蓄电池。密封阀控式铅酸蓄电池以其少维护、安全、清洁等特点迅速在各个领域被使用。在我国从上世纪90年代初开始,密封阀控式铅酸蓄电池迅速代替开口式蓄电池占领绝大部分市场。密封阀控式铅酸蓄电池实现其密封的原理是,当电池充电开始产生气体后,从正极析出的氧气到达负极,在负极上发生化合反应,方程式如下: 在正极上: H2O →1/2O2 +2H+ + 2e ….. ….④ 在负极上: PbSO4 +2e → Pb+SO42- …..….⑤ 在负极上: Pb+ 1/2O2 +2H++ SO42- → PbSO4+H2O …..….⑥ 从以上反应原理可以看出,蓄电池在正常充放电时,内部电解液会发生分解-化合循环反应,这样可以保证电解液不会损失。但要想实现这个原理,还要注意一点,电池在充入电解液板要保
铅酸蓄电池基本知识
一.铅酸蓄电池的基本知识 1.1什么是铅酸蓄电池? 以铅和酸作为化学反应物质制成的蓄电池叫做铅酸蓄电池。它是一种直流电源,充电时将电能转变成化学能,放电时将储存的化学能转变成电能的一种装置。 1.2铅酸蓄电池的优缺点 铅酸蓄电池在常用体系的蓄电池中电压最高为2.0V。其二是它的廉价性,其三是高倍率放电性能良好,高低温性能良好可在-40—60°C的条件下工作。易于浮充使用没有“记忆”效应等。当然铅蓄电池也具有某些难以克服的缺点,首先是它的寿命比较短,在放电状态下长期保存会导致电极的不可逆硫酸盐化。在某些结构的电池中由于氢的析出有爆炸的危险等。 1.3 铅酸蓄电池的分类 铅酸电池具有广泛的用途按照极板的结构可分为涂膏式、管式和形成式。按荷电状态可分为干荷电态和湿荷电态几种。(我们公司代理的GS电池为湿荷电态,VHB为干荷电态)按电池盖和排气栓结构可分为排气式、防酸隔爆式、防酸消氢式和阀控密封式。 1.4铅酸蓄电池的一般结构 构成蓄电池的主要部件是负极板、正极板、隔板、电解液、电池槽此外还有一些零件如端子、连接条、排气栓等。 1.5牵引用铅酸蓄电池的结构设计 ●负极板构造 牵引用蓄电池的负极板比正极板多一块,一般采用格栅型设计并涂上海绵状的Pb膏即涂膏式,这样能满足电池的大负荷工作。其板栅像铁丝网原则上与汽车蓄电池相同,但常使用厚极板,高度较高。所以活性物质的利用率较低一般在35%左右。 ●正极板构造 正极板有两种类型,即管式和涂膏式。(我司代理的GS和VHB牵引蓄电池其正极板均采用管式结构)管式正极板的结构是用一导电骨架与一模仿极平的顶部集流条和许多圆柱骨芯焊在一起构成的。骨芯数目由极板尺寸决定,骨芯外边套有惰性玻璃纤维管套,其内部填充pbo2(pbo2在填充之前已经和H2SO4充分反应过) ●管式正极板的优越性 1.)在使用寿命期间活性物质保持在管中,不发生脱落。 2.)极板孔率提高,有利于活性物质利用率的提高。 3.)铅合金的骨架由于被活性物质包围,其腐蚀速率降低。使得充放电循环达1500次以上。而相同厚度的 板栅涂膏式极板在腐蚀作用下只有800次。 ●隔板 作用是防止电池的正负极板接触造成短路。我们采用聚丙烯PE材料,其韧性好,又有很好的渗透性,保证电池内部离子的有效传递。 ●电解液 电解液为稀硫酸,我们使用的是符合德国DIN标准的酸液,其杂质含量很小,能有效防止电池的自放电,增强电池的使用效率,延长电池使用寿命。 ●单体壳体 采用抗冲性能好,难以产生裂痕和破损的合成树脂制成。 ●注液塞 电池充电时无需打开盖子就能将气体排出(充电时产生的H2和O2),同时也防止在工作过程中电解液剧烈翻腾溅出而产生危险。打开注液塞就可以测量电解液的比重和温度。 ●电池单体间的联结 电池单体之间的联结分为铅片焊接式、螺接式和插接式。铅片焊接式技术保证电池单体间的良好联结,铅联结片外面盖有塑料盖加以保护,防止短路。螺接式电池单体间的联结采用可绕曲的电缆连接,电缆中间是铜
