抗血管生成药物体外活性筛选实验

抗血管生成药物体外活性筛选实验
血管生成(Angiogenesis)是指从已有的毛细血管或毛细血管后静脉发展而形成新的血管,主要包括:激活期血管基底膜降解;血管内皮细胞的激活、增殖、迁移;重建形成新的血管和血管网,是一个涉及多种细胞的多种分子的复杂过程。血管形成是促血管形成因子和抑制因子协调作用的复杂过程,正常情况下二者处于平衡状态,一旦此平衡打破就会激活血管系统,使血管生成过度或抑制血管系统是血管退化。部分新生血管出现于炎症、创伤修复、肿瘤生长、增殖型糖尿病视网膜病变和动脉粥样硬化等病理情况中。
服务项目:
按照客户的要求对化合物进行体外抗血管生成活性筛选实验。 服务内容:
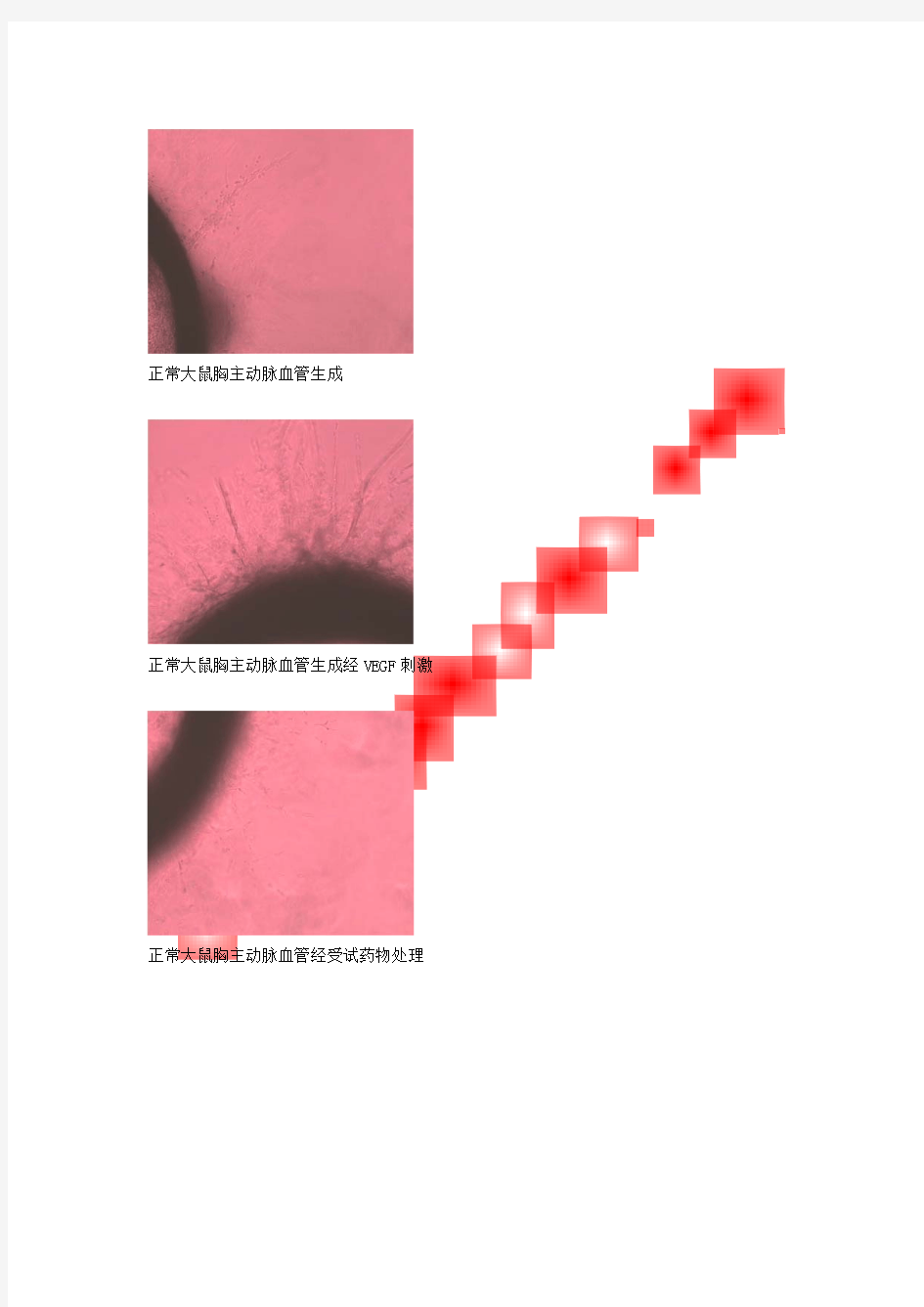
正常大鼠胸主动脉血管生成
正常大鼠胸主动脉血管生成经VEGF 刺激
正常大鼠胸主动脉血管经受试药物处理
肿瘤抗血管生成药物的毒副反应及其机理-综述
文献综述 肿瘤抗血管治疗相关的毒副反应及其机制的探讨 大量分子靶向药的临床应用,使肿瘤患者,特别是晚期肿瘤患者,可以选择比化疗药物疗效有优势,而且毒副作用更小的药物。但是,任何药物都不是万能的,许多靶向药物也具有或多或少的副作用,而且很多副作用产生的机理需要临床医生去掌握。本文就临床常见的抗血管生成的分子靶向药物,如贝伐单抗(Bevacizumab,Avastin),舒尼替尼(sunitinib malate, SU11248, 索坦)和索拉菲尼(sorafenib,BAY 43-9006,多吉美),范德他尼ZD6474、V andetanib),沙利度胺(thalidomide), 雷利度胺(lenalidomide)等药物的常见毒副反应及其可能的机制做一概述。 1、凝血功能紊乱:出血和血栓 人体正常血管内皮具有保持血管完整性,维持正常凝血和抗凝的功能。然而,一些炎症(如直接或者间接由肿瘤细胞引起的炎症)可能打乱这一平衡,使之向血栓形成前的状态发展。而在微血管内部,内皮细胞功能的破坏可能打乱促凝和抗凝之间的平衡,从而影响血管的完整性和血液的流动。 一项包含12617例患者的荟萃分析发现,在所有实体瘤的患者中,不同严重程度出血事件的发生率为30.4% ,其中严重出血事件的患者为3.5%。然而,使用贝伐单抗的患者,与对照组相比,发生出血事件的相对危险度(RR)是2.48 。而RR也与贝伐单抗的剂量成正比,每周剂量5mg和2.5 mg的患者,其相对危险度分别为3.02和2.01。严重出血的风险也增加(RR=1.91)[1]。1级鼻出血是贝伐单抗引起的最常见的出血事件。在舒尼替尼治疗的晚期转移性肾癌患者中,轻微的鼻出血和和其它部位的出血事件发生率为26%[2]。另外,很多抗血管生成的药物的使用过程中,都发生了一定比例的静脉血栓事件。如在对沙利度胺治疗多发性骨髓瘤的研究中,有学者报道了7%-34%的血栓发生率[3-4]; 而在贝伐单抗的临床应用中,也报导静脉血栓和动脉血栓事件的报道[5-7]。一项荟萃分析发现:在使用贝伐单抗的患者中,不同程度的血栓事件发生率以及重度血栓事件的发生率分别为11.9%和6.3%,其中包括致死性血栓事件[8]。对于年龄超过65岁,既往发生过血栓事件的患者,使用贝伐单抗发生动脉血栓事件的风险
晚期NSCLC抗血管生成药物的治疗--推荐意见更新CSCO 2020
晚期NSCLC抗血管生成药物的治疗--推荐意见更新CSCO 2020 肺癌是目前我国乃至全世界致死率最高的恶性肿瘤之一。2018 年我国约有 77.4 万的新增肺癌病例,约有 69 万人死于肺癌。非小细胞肺癌(NSCLC)是肺癌中最常见的组织学类型,占比超过 80%。 在驱动基因阴性NSCLC 治疗决策演变的过程中,抗血管生成药物一直处于十分重要的位置。在2020 年CSCO 学术年会上,来自上海交通大学附属胸科医院的储天晴教授和大家分享了「晚期NSCLC 抗血管生成药物的治疗专家共识」-- 推荐意见更新。 主要就三大类抗血管生成药:抗VEGF/VEGFR 的大分子单抗,小分子多靶点抑制剂以及重组人血管内皮抑素的推荐使用意见进行了梳理。抗血管生成药物用于晚期NSCLC 的临床证据及推荐意见更新 由于药物可及性及临床适应症的限制,故今年指南更新与既往证据级别推荐相比采用了与CSCO 统一的等级推荐,I 级推荐主要为普适性的诊治措施。
晚期NSCLC 一线治疗及一线后维持治疗 一线治疗主要更新要点: ①对于驱动基因突变阴性,PS 0-1 分的晚期非鳞NSCLC 患者,推荐阿替利珠单抗联合贝伐珠单抗、卡铂及紫杉醇方案作为一线治疗选择(II 级推荐,1A 类证据,新增)。 ②有EGFR 敏感型突变的晚期非鳞NSCLC 患者中,贝伐珠单抗联合其他TKI(吉非替尼)可作为一线治疗选择(II 级推荐,2B 类证据,新增)。 ③ EGFR 敏感突变经TKI 治疗发生疾病进展后,且无证据提示T790M 突变的患者,或伴T790M 突变经奥希替尼治疗失败后的患者排除其他靶向药物治疗机会后,推荐使用阿替利珠
血管生成素:抗血管生成药物的新靶点
血管生成素:抗血管生成药物的新靶点 生意社11月7日讯阿瓦斯丁是目前市场上抗血管生成生物药物的典范,该人源化单克隆抗体靶向作用于血管内皮生长因子。尽管美国食品药品管理局最近撤销了阿瓦斯汀治疗乳腺癌的适应证,但此药在世界各地仍广泛用于治疗大肠癌、脑癌、肺癌和肾细胞癌。而且,抗血管生成药物也可用于其他疾病的适应证,例如,雷珠单抗是 1
一种来自于贝伐单抗的单克隆抗体片段,已被批准用于治疗湿性年龄相关性黄斑变性。拜耳和Regeneron公司联合开发的湿性AMD药物Eylea,也是一种VEGF受体1和2的胞外结构域融合人IgG1的Fc部分组成的重组融合蛋白。 随着对抗血管生成药物研究的不断深入,科学家发现,血管生成素有望成为抗血管生成药物的新靶点。 血管生成素途径受到关注 开发更安全和更有效的抗血管生成药物一直是制 2
药行业努力的方向。血管生成素途径近年来受到越来越多的关注,有望改变VEGF通路已作为重要靶点的现状。对几种血管生成素家族成员的研究已经确定,血管生成素1和血管生成素2与其酪氨酸蛋白激酶受体TIE-2已成为研究热点。血管生成素-TIE通路被认为是一个特别有吸引力的治疗干预系统,因为其重要性不仅表现在对血管生成和血管内环境稳定上,同时也是血管生成和炎症通路的重要环节。 3
ANG-1和ANG-2是TIE-2受体酪氨酸激酶的功能性配体。ANG-1表达于许多类型的细胞,如周皮细胞、平滑肌细胞和成纤维细胞,作为TIE-2激动型配体。ANG-1介导的TIE-2激活可导致血管内皮细胞通透性和血管发育稳定性下降。另外,ANG-2由血管内皮细胞表达,可阻断ANG-1介导的TIE-2激活,作为TIE-2的拮抗剂发挥作用。ANG-2上调与不同类型的癌症转移和恶化相关。 而且,血管生成疾病都发现了ANG-2上调的现象。 4
最新抗肿瘤血管生成药品
目前,威胁人们生命的恶性肿瘤发病率逐年上升,医学专家们一直在寻找能遏制癌细胞的新药,最新研究结果显示:Avastin(贝伐单抗)能抑制多种恶性肿瘤的生长和转移,并很少产生化疗常见的副作用。 血管生成对正常成人的作用有限,只出现在伤口愈合和胚胎发育的过程中。在血管生成过程中,VEGF(表皮生长因子)蛋白刺激血管的生长、存活和修复。为了获取维持生长所必需的营养和氧气,肿瘤形成自己的血管。这种肿瘤形成新生血管的过程称肿瘤血管生成,而肿瘤血管生成对于肿瘤生长和扩散(转移)到机体其他部位是一个必不可少的过程。Avastin是一种抗体,能特异性结合并抑制VEGF(促进肿瘤血管生成的关键因素),从而有利于控制肿瘤的生长和转移。 Avastin使肿瘤周围的小血管收缩,有利于阻断肿瘤生长所需的氧气和营养供应。肿瘤形成的新生血管还不成熟,易渗漏。因新生血管具有这种异常通透性,可妨碍抗癌药物的治疗,如化疗。而Avastin能促使已有的成熟血管改变形状,使总体治疗策略的疗效得到最大限度的发挥。另外,Avastin抑制新生血管的生长,进一步限制了肿瘤的血液供应。 目前为止,超过500000名患者接受过Avastin治疗。针对Avastin治疗不同阶段(晚期或早期)的各种肿瘤(包括结肠直肠癌、乳腺癌、肺癌、脑癌、胃癌、卵巢癌、前列腺癌等),全球正开展一个综合性的临床研究项目,含450多项临床试验。 在欧洲,Avastin已获准用于四种常见癌症晚期阶段的治疗,包括结肠直肠癌、乳腺癌、肺癌和肾癌。这几种癌症每年导致近300万人死亡。在美国,Ava stin是获得FDA批准的首个抗血管生成药物,用于乳腺癌、结肠直肠瘤、恶性胶质瘤的治疗。 最新抗肿瘤血管生成药品 公司名称:陕西西安盛合治公司 联系人:袁媛女士 ( 业务员 )
抗血管生成靶向药物治疗腹水研究进展
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 抗血管生成靶向药物治疗腹水研究进展【ANTICANCER RESEARCH】抗血管生成靶向药物治疗腹水研究进展 2019-12-26 医加加编译 NCI 恶性腹水的定义是:液体和肿瘤细胞积存在腹腔中。 恶性腹水的病理和生理学特征: 恶性腹水中有粘附肿瘤细胞和非粘附肿瘤细胞。 粘附肿瘤细胞有间叶细胞的特征,非粘附细胞有上皮细胞的特征,表达上皮细胞粘附分子和细胞角蛋白。 小鼠腹腔内注射入粘附细胞和非粘附细胞,结果发现注射非粘附细胞的小鼠在 12-14 周内发展成恶性腹水,而注射粘附细胞的小鼠20 周内也没有出现肿瘤细胞。 有研究发现非粘附上皮细胞可以增加肿瘤干细胞 mRNA 的表达。 因此,针对腹水里上皮细胞的靶向药物有可能使患者获益。 这也就解释了卡妥索单抗为什么可以治疗卵巢癌,因为它可以选择性的杀死上皮肿瘤细胞。 恶性腹水的探索: 上皮卵巢癌是世界第八大妇科恶性肿瘤,在发达国家上皮卵巢癌是妇科肿瘤引起死亡的主要原因。 主要特征是肿瘤扩散到腹腔,引起恶性腹水,并且在早期患者没有明显的症状。 世界范围内每年大约有 20 万新发病例,因为诊断时患者已处于 1/ 5
晚期,每年有 12 万人死亡。 大约 70%的初诊患者在 III 期或 IV 期。 大部分病人会出现腹部、胃肠道、尿道或骨盆的疼痛,这些症状很少能引起临床医生的注意,这也就导致发现时已是晚期。 关于卵巢癌的亚型,大约有 90-95%的卵巢癌是腺癌,卵巢腺癌是一种快速侵袭性的恶性肿瘤。 目前,手术是一种标准治疗方法,辅助以卡铂、紫杉醇治疗。 与原发腹膜癌或输卵管癌治疗方法一样。 但是大部分病人最后都会发展成耐药。 因此就需要探索新的治疗方法,手术联合辅助化疗大约能延长患者 30%的 OS。 恶性腹水不仅在卵巢癌中常见,其他种类的实体瘤也易发生。 治疗卵巢癌恶性腹水的方法还没有达成专家共识。 根据 NCI 的意见,恶性腹水的定义是: 液体和肿瘤细胞积存在腹腔中。 另外还有高水平的乳酸脱氢酶,表明肿瘤细胞具有高度的增殖能力并引起疾病快速进展。 复发的卵巢癌患者中大约 10%的是由恶性腹水引起的。 传统的恶性腹水治疗方法包括: 限盐、利尿、放射性同位素、穿刺和分流,然而这些方法会引起明显的毒副反应。 像肿瘤药一样,恶性肿瘤细胞也会扩散到腹腔,恶性肿瘤在腹
