实验七_ds区金属(铜、银、锌、镉汞)
ds区金属(铜、银、锌、镉、汞)
一.目的要求
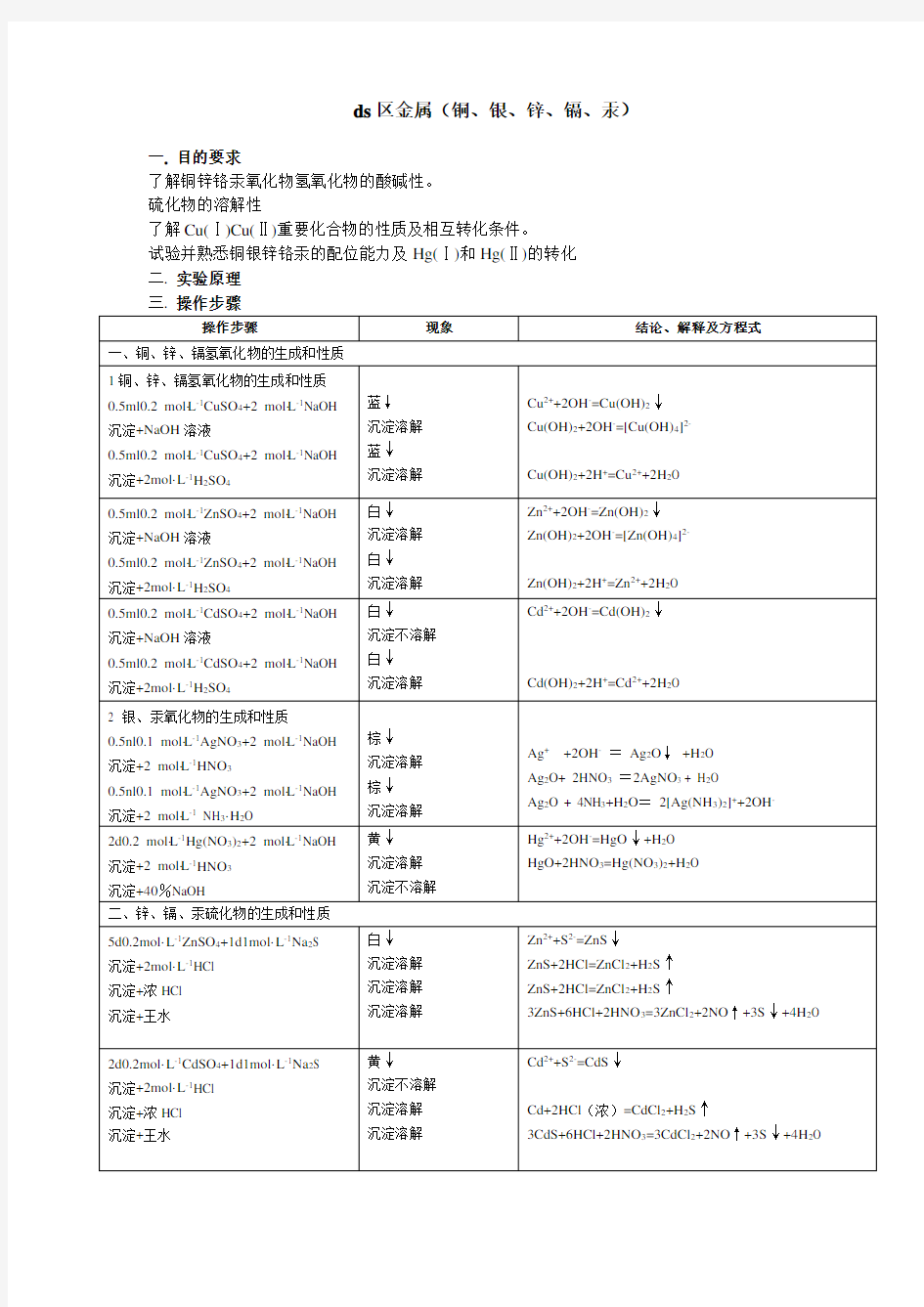
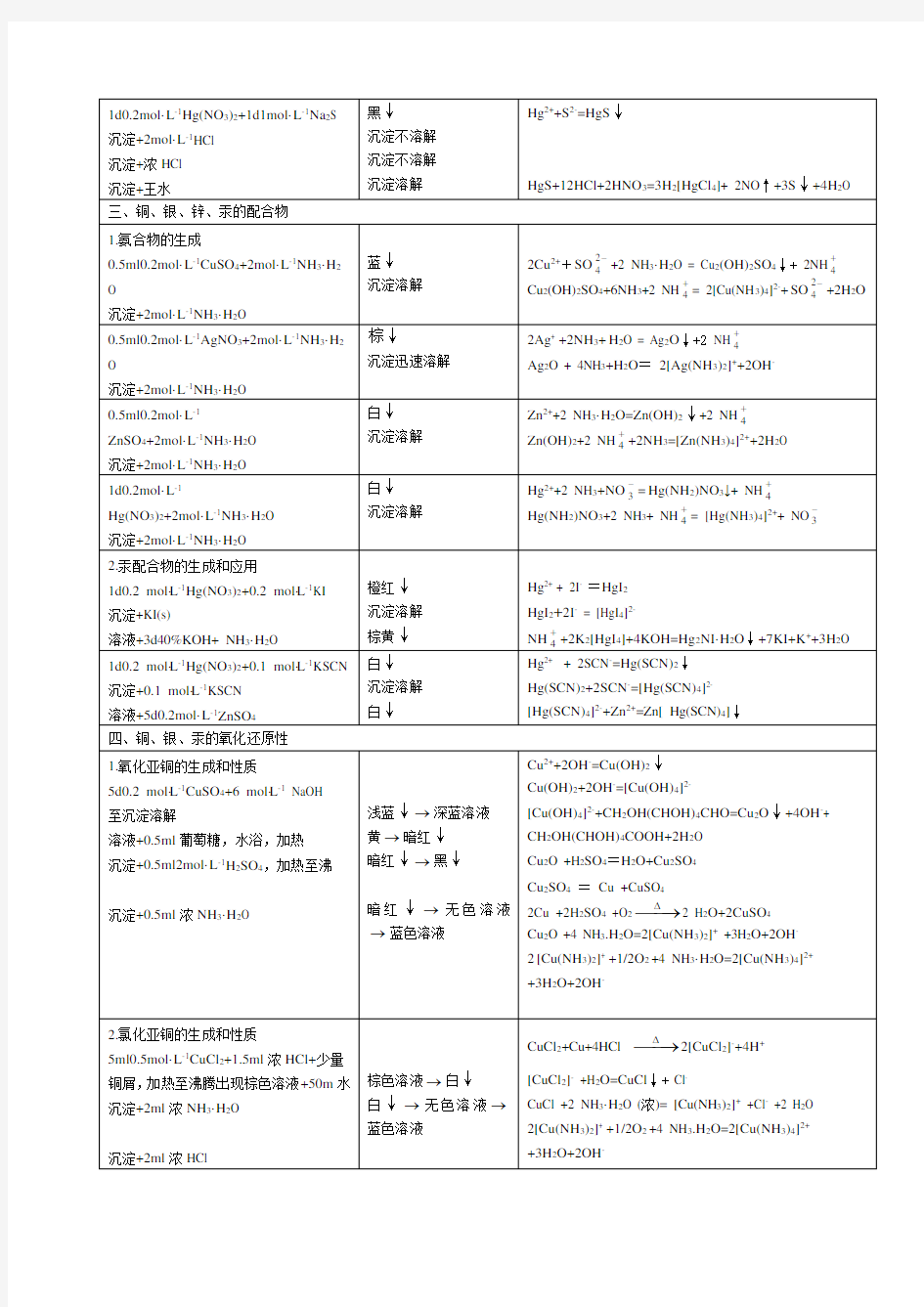
了解铜锌铬汞氧化物氢氧化物的酸碱性。
硫化物的溶解性
了解Cu(Ⅰ)Cu(Ⅱ)重要化合物的性质及相互转化条件。
试验并熟悉铜银锌铬汞的配位能力及Hg(Ⅰ)和Hg(Ⅱ)的转化
二.实验原理
三.操作步骤
铜、银、锌、镉、汞
铜、银、锌、镉、汞 实验目的 1.试验并了解ds 区元素的氢氧化物(或氧化物)的酸碱性及对热稳定性 2.了解铜、银、锌、镉、汞的金属离子形成配合物的特征 3.了解Cu(Ⅱ)与Cu(Ⅰ),Hg(Ⅱ)与Hg(Ⅰ)的相互转化条件 4.了解铜、银、锌、镉、汞的离子鉴定 实验提要 ds区元素包括铜、银、锌、镉和汞。它们的价电子层结构分别为(n-1)d10ns1和(n-1)d10ns2。在化合物中常见的氧化值。铜为+2 和+1,银为+1,锌和镉为+2,汞为+2 和+1。这些元素的简单阳离子具有或接近18e的构型。在化合物中与某些阳离子有较强的相互极化作用,成键的共价成分较大。多数化合物较难溶于水,对热稳定性较差,易形成配位化合物,化合物常显不同的颜色。 例如,这些元素的氢氧化物均较难溶于水,且易脱水变成氧化物。银和汞的氢氧化物极不稳定。常温下即失水变成Ag2O(棕黑色)和HgO(黄色)。黄色HgO加热则生成桔红色HgO变体。 Cu(OH)2、Zn(OH)2和Cd(OH)2在常温下较稳定,但受热亦会失水成氧化物。浅蓝色Cu(OH)2在80℃失水成棕黑色CuO,白色Zn(OH)2在125℃开始失水成黄色(冷后为白色)的ZnO,白色Cd(OH)2在250℃变成棕红色的CdO。 Zn(OH)2呈典型的两性氢氧化物,Cu(OH)2呈较弱的两性(偏碱),Cd(OH) 2和Hg(OH)2(HgO)呈碱性,而AgOH为强碱性。Cu2+、Ag+、Zn2+、Cd2+、Hg2+与Na2S溶液反应都生成难溶的硫化物,即CuS(黑色),Ag2S(黑色),ZnS(白色),CdS (黄色)和HgS(黑色)。其中HgS可溶于过量的Na2S,与S2?生成无色的HgS22?配离子。若在此溶液中加入盐酸又生成黑色HgS沉淀。此反应可作为分离HgS的方法。根据ZnS、CdS、Ag2S、CuS和HgS溶度积大小,ZnS可溶于稀酸,CdS溶于6mol?L?1HCl 溶液,Ag S和2 CuS溶于氧化性的HNO3,而HgS溶于王水。 ds区元素阳离子都有较强的接受配体的能力,易与H2O、NH3、X?、CN?、SCN?和en等形成配离子。例如Cu(en)22+、Ag(SCN)2?、Zn(H2O)42+、Cd(NH3)42+和HgCl42?等。Hg2+与I?反应先生成桔红色HgI2沉淀,加入过量的I?则生成无色的HgI42?配离子,它和KOH的混合溶液称为奈斯勒试剂,该试剂能有效地检验铵盐的存在。Cu2+、Ag+、Zn2+、
重金属可能导致各种各样的病症
重金属污染可引起的疾病 定义: 含有汞、镉、铬、铅及砷等生物毒性显著的重金属元素及其化合物对环境的污染。 重金属污染指由重金属或其化合物造成的环境污染。主要由采矿、废气排放、污水灌溉和使用重金属制品等人为因素所致。因人类活动导致环境中的重金属含量增加,超出正常范围,并导致环境质量恶化。2011年4月初,我国首个“十二五”专项规划——《重金属污染综合防治“十二五”规划》获得国务院正式批复,防治规划力求控制5种重金属。 重金属污染指由重金属或其化合物造成的环境污染。如日本的水俣病是由汞污染污染所引起。其危害程度取决于重金属在环境、食品和生物体中存在的浓度和化学形态。重金属污染主要表现在水污染中,还有一部分是在大气和固体废物中。 主要特点 重金属污染与其他有机化合物的污染不同。不少有机化合物可以通过自然界本身物理的、化学的或生物的净化,使有害性降低或解除。而重金属具有富集性,很难在环境中降解。目前我国由于在重金属的开采、冶炼、加工过程中,造成不少重金属如铅、汞、镉、钴等进入大气、水、土壤引起严重的环境污染。如随废水排出的重金属,即使浓度小,也可在藻类和底泥中积累,被鱼和贝类体表吸附,产生食物链浓缩,从而造成公害。水体中金属有利或有害不仅取决于金属的种类、理化性质,而且还取决于金属的浓度及存在的价态和形态,即使有益的金属元素浓度超过某一数值也会有剧烈的毒性,使动植物中毒,甚至死亡。金属有机化合物(如有机汞、有机铅、有机砷、有机锡等)比相应的金属无机化合物毒性要强得多;可溶态的金属又比颗粒态金属的毒性要大;六价铬比三价铬毒性要大等等。 重金属在人体内能和蛋白质及各种酶发生强烈的相互作用,使它们失去活性,也可能在人体的某些器官中富集,如果超过人体所能耐受的限度,会造成人体急性中毒、亚急性中毒、慢性中毒等,对人体会造成很大的危害,例如,日本发生的水俣病(汞污染)和骨痛病(镉污染,等公害病,都是由重金属污染引起的。
无机化学实验二十一 ds区元素(铜银锌镉汞)的性质
实验11 ds区元素(铜、银、锌、镉、汞)的性质 一、实验目的 1、掌握铜、锌氢氧化物的酸碱性; 2、掌握铜、银、锌、汞的配合物的生成和性质; 6、掌握铜、银、锌、汞离子的分离与鉴定方法。 二、实验原理 IB IIB Cu Zn Cu(+2,+1)Zn(+2) Ag Cd Ag(+1)Cd(+2) Au Hg Au(+1,+3)Hg(+2,+1) 蓝色的Cu(OH) 2 呈现两性,在加热时易脱水而分解为黑色的CuO。AgOH在常温下极易脱水而转化为棕 色的Ag 2O。Zn(OH) 2 呈两性,Cd(OH) 2 显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色 的Hg 2 O(I)。 易形成配合物是这两副族的特性,Cu 2+ 、Ag + 、Zn 2+ 、Cd 2+ 与过量的氨水反应时分别生成[Cu(NH 3 ) 4 ] 2+ 、 [Ag(NH 3) 2 ] + 、[Zn(NH 3 ) 4 ] 2+ 、[Cd(NH 3 ) 4 ] 2+ 。但是Hg 2+ 和Hg 2 2+ 与过量氨水反应时,如果没有大量的NH 4 + 存在, 并不生成氨配离子。如: HgCl 2 +2NH 3 =Hg(NH 2 )Cl↓白+2 NH 4 Cl Hg 2Cl 2 +2NH 3 =Hg(NH 2 )Cl↓白+Hg↓黑+NH 4 Cl (观察为灰色) Cu 2+ 具有氧化性,与I-反应,产物不是CuI 2 ,而是白色的CuI:Cu 2+ +I- =2CuI↓白+I 2 将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2 ]-的溶液。将溶液稀释,得白色CuCl 沉淀: Cu +Cu 2+ +4Cl-=2[CuCl 2 ]- [CuCl 2 ]-←稀释→CuCl↓白+Cl- 卤化银难溶于水,但可利用形成配合物而使之溶解。例如: AgCl +2NH 3 =[Ag(NH 3 ) 2 ] + +Cl- 红色HgI 2 难溶于水,但易溶于过量KI中,形成四碘合汞(II)配离子: HgI 2 +2I- =[HgI 4 ] 2- 黄绿色Hg 2I 2 与过量KI反应时,发生歧化反应,生成[HgI 4 ] 2- 和Hg: Hg 2I 2 +2I- =[HgI 4 ] 2- +Hg↓黑 三、实验内容 1、氧化物的生成和性质
土壤重金属铜污染现状分析
Hans Journal of Soil Science 土壤科学, 2019, 7(3), 181-185 Published Online July 2019 in Hans. https://www.360docs.net/doc/e39221115.html,/journal/hjss https://https://www.360docs.net/doc/e39221115.html,/10.12677/hjss.2019.73022 Status of Heavy Metal Copper Pollution in Soil Na Wang 1,2 1Shaanxi Provincial Land Engineering Construction Group Co., Ltd., Xi’an Shaanxi 2Institute of Land Engineering and Technology, Shaanxi Provincial Land Engineering Construction Group Co., Ltd., Xi’an Shaanxi Received: Jun. 5th, 2019; accepted: Jun. 25th, 2019; published: Jul. 2nd, 2019 Abstract This paper reviews the distribution of copper pollution in China, the main sources of pollution and its pollution hazards (the harm to animals and plants, the damage to soil microbes and enzymes, the combined pollution of copper and other pollutants), pointing out that copper is essential for the human body. Trace elements, but high copper poses a threat to the entire ecosystem; secondly, the mechanism of action of copper with different composite pollutants or the same complex pol-lutants on animals and plants is different. Therefore, this paper provides a corresponding theo-retical basis for the selection of copper composite pollution control measures. Keywords Heavy Metal Copper, Composite Pollution, Influence 土壤重金属铜污染现状分析 王娜1,2 1陕西省土地工程建设集团有限责任公司,陕西西安 2陕西地建土地工程技术研究院有限责任公司,陕西西安 收稿日期:2019年6月5日;录用日期:2019年6月25日;发布日期:2019年7月2日 摘要 本文综述了我国铜污染的分布情况,主要污染来源以及其污染危害(对动植物危害、对土壤微生物及酶的危害、铜与其他污染物复合污染危害),指出铜虽然是人体必不可少的微量元素,但是高铜对整个生态系统均构成了威胁;其次,铜与不同复合污染物或同一复合污染物对动植物的作用机理都不尽相同。因此,
地下水-铜铅锌镉镍和铬的测定 无火焰原子吸收光谱法
FHZDZDXS0030 地下水铜铅锌镉镍和铬的测定无火焰原子吸收光谱法 F-HZ-DZ-DXS-0030 地下水—铜铅锌镉镍和铬的测定—无火焰原子吸收光谱法 1 范围 本方法适用于地下水中铜、铅、锌、镉、镍和铬的测定。 最低检测量:铜、铅、锌、镍和铬均为0.2ng,镉为0.02ng。 最低检测浓度分别为:铜0.11μg/L、铅0.11μg/L、锌0.29μg/L、镉0.009μg/L、镍0.13μg/L、铬0.08μg/L。 2 原理 含有铜、铅、锌、镉、铬和镍离子的水样进入石墨炉原子化器,在2000℃~3000℃的高温下,金属离子变成原子蒸气,当被测元素的空心阴极灯发出的特征谱线辐射通过原子蒸气层时,使产生选择性吸收。在一定条件下,特征谱线光强度的变化与试样中被测元素的浓度成正比。借此,可确定试样中被测元素的浓度。 3 试剂 除非另有说明,本法所用试剂为分析纯试剂,水为二次亚沸蒸馏水。 3.1 硝酸(ρ1.42g/mL),超纯试剂。 3.2 硝酸溶液(1+99):1mL硝酸(ρ1.42g/mL,超纯试剂)加99mL亚沸蒸馏水。 3.3 铜、铅、锌、镉、镍标准贮备溶液:分别称取0.1000g金属铜、铅、锌、镉、镍(光谱纯,99.999%)于5个200mL烧杯中,各加入10mL硝酸溶液(1+1),低温溶解,溶解后微沸以除去氮的氧化物。冷却后,分别移入5个1000mL容量瓶中,用二次亚沸蒸馏水稀释至刻度,摇匀。这5份溶液1.00mL分别含0.10mg铜、铅、锌、镉、镍。 3.4 铬标准贮备溶液:称取0.2829g已预先经120℃烘干2h,在干燥器中冷至室温的重铬酸钾(K2Cr2O7,基准试剂)于200mL烧杯中,用二次亚沸蒸馏水溶解,移入1000mL容量瓶中,并稀释至刻度,摇匀。此溶液1.00mL含0.10mg铬。 3.5 铜、铅、锌、镉、镍、铬标准溶液:分别吸取10.00mL铜、铅、锌、镉、镍、铬标准贮备溶液(0.10mg/mL)于6个1000mL容量瓶中,用硝酸溶液(1+99)稀释至刻度,摇匀。这6份溶液1.00mL分别含1.00μg铜、铅、锌、镉、镍和铬。 3.6 镉标准溶液:准确移取10.00mL镉标准溶液(1.00μg/mL)于100mL容量瓶中,以硝酸溶液(1+99)稀释至刻度,摇匀。此溶液1.00mL含0.10μg镉。 4 仪器设备 4.1 具石墨炉及背景扣除装置的原子吸收光谱仪。 4.2 铜、铅、锌、镉、镍和铬的空心阴极灯。 4.3 仪器参数 4.3.1 测量波长:铜、铅、锌、镉、镍和铬分别为:324.8、283.3、213.9、228.8、232.0和359.3nm。
火焰原子吸收分光光度法测定环境水中的铜锌铅镉等有害元素
火焰原子吸收分光光度法测定环境水中的铜锌铅镉等有害元素 [摘要]本文采用火焰原子吸收分光光度法直接测定水样的铜、锌、铅、镉等有害元素的含量,其结果符合要求,易于操作,值得推广。 [关键字]原子吸收分光光度法铜锌铅镉水 0 前言 铜、锌、铅、镉等重金属元素会危害人体健康及生态环境。人的肌体如果受到有害金属的侵入就会让一些酶丧失活性而出现不同程度的中毒症状,不同的金属种类、浓度产生的毒性不一样。 铜是人体必须的微量元素,缺少铜元素就会发生贫血等情况,但过量掺入也会危害人体。铜对水生生物影响甚大,电镀、五金加工、工业废水等都是铜的主要污染源;适量的锌有益于人体,但影响鱼类及其他水生生物。另一方面,锌会抑制水的自净过程。冶金、颜料、工业废水是锌的主要污染来源;铅对人体及动物都是有毒的,其存在于人体有可能会使人出现贫血、神经机能失调等症状。蓄电池、五金、电镀工业废水等都是铅的主要污染源;镉的毒性也非常强,积累在人的肝肾里面会损害肾脏等内脏器官,引发骨质疏松。电镀、采矿、电池等是镉的主要污染源。 所以为了防止环境污染采取行之有效的分析方法检测铜、锌、铅、镉等重金属元素的含量具体特殊意义。 一般时候,江、河、水库及地下水仅含有非常少的铜、锌、铅、镉等金属元素,对于测定水样采用火焰原子吸收分光光度法进行检测很难检验出来,一般要采用富集的方法如用鳌合萃取或离子交换等方法才进行检测,但是这些方法比较复杂,容易受到干扰、测算量也比较大,测算效果达不到预期。将水样进行10倍的富集浓缩,采用火焰原子吸收分光光度法可以对测样里面的铜、铅、锌、镉等微量元素进行直接测定,这种方法容易操作、精密度及准确度也比较理想,环境监测实验室常常用这种方法监测江、河、水库及地下水的铜、锌、铅、镉等金属元素。 1 实验 1.1 关键仪器及试剂介绍 (1)采用GGX—600型的原子吸收仪,由北京科创海光光学仪器厂生产;(2)采用:北京瑞利普光电器件厂生产的铜、铅、锌、镉空心阴极灯;(3)准备浓度为每升1000毫克的铜、铅、锌、镉标准混合储备液。采用1000 mL容量瓶装入优级硝酸进行加热溶解光谱纯1.0000 g的铜、铅、锌、镉,均匀摇晃;(4)采用千分之二的的优级硝酸溶液稀释铜、铅、锌、镉标准混合储备液制成浓度为
各种重金属污染的原因
各种重金属污染的原因 汞 人类活动造成水体汞污染,主要来自氯碱、塑料、电池、电子等工业排放的废水。煤和石油的燃烧、含汞金属矿物的冶炼和以汞为原料的工业生产所排放的废气,是大气中汞的主要来源;施用含汞农药和含汞污泥肥料,是土壤中汞的主要来源;氯碱工业、塑料工业、电池工业和电子工业等排放的废水,是水体中汞的主要来源。 人为源排放指的是因人类活动引起的汞排放,包括汞的使用、物质当中含有汞杂质以及废物处理引起的汞排放三大类。对汞排放的污染源构成及各污染源的相对重要性有比较一致性的认识,认为:向大气中的汞排放主要源于化石燃料燃烧,尤其是煤炭的燃烧,而燃煤电厂是大气中全球汞排放的最大的源。 主要来源于仪表厂、食盐电解、贵金属冶炼、化妆品、照明用灯、齿科材料、燃煤、水生生物等。 铜 矿山及湿法冶炼 主要污染来源是铜锌矿的开采和冶炼、金属加工、机械制造、钢铁生产等。冶炼排放的烟尘是大气铜污染的主要来源。电镀工业和金属加工排放的废水中含铜量较高。
铅 铅对环境的污染,一是由冶炼、制造和使用铅制品的工矿企业,尤其是来自有色金属冶炼过程中所排出的含铅废水、废气和废渣造成的。二是由汽车排出的含铅废气造成的,汽油中用四乙基铅作为抗爆剂(每公斤汽油用1~3克),在汽油燃烧过程中,铅便随汽车排出的废气进入大气。目前世界上已有两亿多辆汽车,每年排出的总铅量达40万吨,成为大气的主要铅污染源。主要来源于各种油漆、涂料、蓄电池、冶炼、五金、机械、电镀、化妆品、染发剂、釉彩碗碟、餐具、燃煤、膨化食品、自来水管等。 锌 主要污染源有锌矿开采、冶炼加工、机械制造以及镀锌、仪器仪表、有机会合成和造纸等工业的排放。汽车轮胎磨损以及煤燃烧产生的粉尘、烟尘中均含有锌及化合物,工业废水中锌常以锌的羟基络合物存在。 镉 电镀、采矿、冶炼、染料、电池和化学工业等排放的废水。镉广泛应用于电镀工业、化工业、电子业和核工业等领域。镉是炼锌业的副产品,主要用在电池、染料或塑胶稳定剂,它比其它重金属更容易被农作物所吸附。相当数量的镉通过废气、废水、废渣排入环境,
水质 铜、锌、铅、镉的测定--原子吸收分光光度法
1 适用范围 本标准规定了测定水中铜、锌、铅、镉得火焰原子吸收分光光度法。 本标准分为两部分。第一部分为直接法,适用于测定地下水、地面水与废水中得铜、锌、铅、镉;第二部分为螯合萃取法,适用于测定地下水与清洁地面水中低浓度得铜铅、镉。 2定义 2、1溶解得金属,未酸化得样品中能通过0、45um滤膜得金属成分。 2、2金属总量:未经过滤得样品经强烈消解后测得得金属浓度,或样品中溶解与悬浮得两部分金属浓度得总量。 3试剂与材料 除非另有说明,分析时均使用符合国家标准得分析纯试剂;实验用水,GB/T 6682,二级。 3、1硝酸:ρ(HNO3)=1、42 g/mL,优级纯。 3、3 硝酸:ρ(HNO3)=1、42 g/mL,分析纯。。 )=1、67 g/mL,优级纯。 3、3 高氯酸:ρ(HClO 4 3、4燃料:乙炔,用钢瓶气或由乙炔发生器供给,纯度不低于99、6%。 3、5 氧化剂:空气,一般由气体压缩机供给,进入燃烧器以前应经过适当过滤,以除去其中得水、油与其她杂质。 3、6硝酸溶液:1+1。 用硝酸(3、2)配制。 3、7 硝酸溶液:1+499。 用硝酸(3、1)配制。 3、8 金属储备液:1、000g/L。 称取1、000g光谱纯金属,准确到0、001g,用硝酸(3、1)溶解,必要时加热,直至溶解完全,然后用水稀释定容至1000mL。 3、9中间标准溶液。 用硝酸溶液3、7稀释金属贮备液3、8配制,此溶液中铜、锌、铅、镉得浓度分别为50、00、10、00、100、00、10、00mg/L。
4 采样与样品 4、1用聚乙烯塑料瓶采集样品。采样瓶先用洗涤剂洗净,再在硝酸溶液3、6中浸泡,使用前用水冲洗干净。分析金属总量得样品,采集后立即加硝酸3、1酸化至PH=1~2,正常情况下,每1000mL样品加2ml硝酸3、1。 4、2试样得制备 分析溶解得金属时,样品采集后立即通过0、45um滤膜过滤,得到得滤液再按4、1中得要求酸化。 5适用范围 5、1测定浓度范围与仪器得特性有关。 5、2 地下水与地面水中得共存栗子与化合物在常见浓度下不干扰测定。但当钙得浓度高于1000 mg/L时,抑制镉得吸收,浓度为2000mg/L时,信号抑制达19%。铁得含量超过100mg/L时,抑制锌得吸收。当样品中含盐量很高,特征谱线波长又低于350nm时,可能出现非特征吸收。如高浓度得钙因产生背景吸收,使铅得测定结果偏高。 5原理 将样品或消解处理过得样品直接吸入火焰,在火焰中形成得原子对特征电磁辐射产生吸收,将测得得样品吸光度与标准溶液得吸光度进行比较,确定样品中被测元素得浓度。 6仪器 一般实验室仪器与:原子吸收分光光度计及相应得辅助设备,配有乙炔-空气燃烧器;光源选用空心阴极灯或无极放电灯。仪器操作参数可参照厂家得说明进行选择。 注:实验用得玻璃或塑料器皿用洗涤剂洗净后,在硝酸溶液3、6中浸泡,使用前用水冲洗干净。 7步骤 7、1 校准 7.1.1 参照下表1,在100mL容量瓶中,用硝酸溶液3、7稀释中间标准溶液3、9,配制至少4个工作标准溶液,其浓度范围应包括样品中被测元素得浓度。 表1
重金属污染
重金属污染
重金属污染特点及防治措施 ⑴铅污染 铅是可在人体和动物组织中积蓄的有毒金属。主要来源于各种油漆、涂料、蓄电池、冶炼、五金、机械、电镀、化妆品、染发剂、釉彩碗碟、餐具、燃煤、膨化食品、自来水管等。它是通过皮肤、消化道、呼吸道进入体内与多种器官亲和,主要毒性效应是贫血症、神经机能失调和肾损伤,易受害的人群有儿童、老人、免疫低下人群。铅对水生生物的安全浓度为0.16mg/L,用含铅0.1~4.4mg/L的水灌溉水稻和小麦时,作物中铅含量明显增加。 (2)铜污染 指铜(Cu)及其化合物在环境中所造成的污染。主要污染来源是铜锌矿的开采和冶炼、金属加工、机械制造、钢铁生产等。冶炼排放的烟尘是大气铜污染的主要来源。含铜废水灌溉农田,使铜在土壤和农作物中累积,会造成农作物尤其是水稻和大麦生长不良,污染粮食籽粒。铜是生命所必需的微量元素,但过量的铜对人和动、植
物都有害。冶炼过程中,铜及其化合物的烟尘随烟道气进入大气,造成污染。铜的化合物以一价或二价状态存在。在天然水中,溶解的铜量随pH 值的升高而降低。pH值6~8时,溶解度为50~500微克/升。pH值小于7时,以碱式碳酸铜[Cu2(OH)2CO3]的溶解度为最大;pH值大于7时,以氧化铜 (CuO)的溶解度为最大,此时,溶解铜的形态以Cu2+,CuOH+为主;pH值升高至8时,则Cu(CO3)卆逐渐增多。水体中固体物质对铜的吸附,可使溶解铜减少,而某些络合配位体的存在,则可使溶解铜增多。世界各地天然水样品铜含量实测的结果是:淡水平均含铜 3微克/升,海水平均含铜0.25微克/升。 在冶炼、金属加工、机器制造、有机合成及其他工业的废水中都含有铜,其中以金属加工、电镀工厂所排废水含铜量最高,每升废水含铜几十至几百毫克。这种废水排入水体,会影响水的质量。水中铜含量达0.01毫克/升时,对水体自净有明显的抑制作用;超过 3.0毫克/升,会产生异味;超过15毫克/升,就无法饮用。若用含铜废水灌溉农田,铜在土壤和农作物中累积,会 造成农作物特别是水稻和大麦生长不良,并会污
从湿法炼锌锑盐净化钴渣中回收钴_锌_镉_铜解读
39 技术 从湿法炼锌锑盐净化钴渣中回收 钴、锌、镉、铜 □文/刘庆杰贾玲李广海中冶葫芦岛有色金属集团公司技术中心 摘要:在湿法炼锌工艺中,采用锑盐除钴法产出的净化钴渣经过酸性浸出后,锌、镉、钴等有价金属进入溶液,铜进入浸出渣。浸出液经过双氧水氧化除铁、低温锌粉置换除铜后,用α-亚硝基-β-萘酚的碱性溶液进行沉钴,沉钴渣经过酸洗除杂后,进行氧化焙烧而得粗Co 3O 4。该工艺,经济效益明显。 Puri ? cation of Salt from the Hydrometallurgy of C obalt Antimony Slag Recovery of Cobalt, Zinc, cadmium, Copper 湿法炼锌的除钴方法有砷盐除钴法、黄药除钴法、β-萘酚除钴法和锑盐除钴法。砷盐除钴法有剧毒的砷化氢气体产生,同时铜镉渣被砷污染而使回收流程复杂化;黄药除钴法由于在生产的过程中有恶臭气体产生,作业环境恶劣;β-萘酚除钴法在国外应用较多,如日本的彦岛、安中等冶炼厂,国内的紫金矿业在处理高钴锌精矿采用β-萘酚除钴法;锑盐除钴法除杂能力强,作业环境好,其应用越来越广泛。目前,国内采用锑盐除钴法的湿法炼锌企业中,净化钴渣的处理通常采用稀酸进行选择性的浸出,即将净化钴渣中的锌浸出进入溶液而将钴留在渣中。稀酸选择性浸出工艺的不足之处在于:选择性比较差,锌钴分离不彻底;浸出渣中含锌、镉高,其中浸出渣中含锌高达20%以上,需采用回转窑处理回收这部分锌、镉;经过回转窑处理,铜、钴进入窑渣中,不能有效回收。研究如何从净化钴渣中综合回收锌、镉、铜、钴等有价金属,是一项紧迫的任务。 一、基本原理
Revise-实验20-铜、银、锌、镉、汞
ds区元素(铜、银、锌、镉、汞) 一、实验目的与要求: 1.了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性。 2. 掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件。 3. 熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化。 二、教学重点与难点: 了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性,熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化;掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件, 三、教学方法与手段:讲授法;演示法 四、教学课时: 4课时 五、课的类型:实验课 一、铜、银、锌、镉、汞氧化物或氢氧化物的生成和性质 1、铜、锌、镉氧化物的生成和性质 向三支试管分别盛有0.5ml 0.2mol.L-1CuSO4、ZnSO4、CdSO4溶液的试管中滴加新配制的2mol.L-1NaOH溶液,观察溶液颜色及状态。将沉淀分成两份, 一份加硫酸另一份加NaOH溶液,观察现象。 Cu2++2OH-===Cu(OH)2↓ (蓝色沉淀) 蓝色沉淀,溶解于酸,微溶于过量的碱,得到深蓝色溶液[Cu(OH)4]2-。Cu(OH) 2两性偏碱,所以需强碱使之生成配离子。 Zn2++2OH-=== Zn(OH)2↓ (白色沉淀) 白色沉淀, 溶解于酸和过量的碱,典型的两性化物。 Cd 2++2OH-===Cd(OH)2↓白色沉淀,溶于酸, 不溶于碱。 碱性) Cd(OH)2 + NaOH (6M)= 不反应 (Cd(OH) 2 2. 银、汞氧化物的生成和性质 (1)、氧化银的生成和性质
取0.5ml 0.1mol.L-1AgNO3溶液,滴加新配制的2mol.L-1的NaOH溶液,观察沉淀的颜色和状态。洗涤并离心,将沉淀分成两份,一份加入HNO3,另一份加入氨水,观察现象。 Ag++OH-===AgOH↓白色沉淀 2AgOH===Ag2O+H2O 黑色沉淀 Ag2O+2HNO3===2AgNO3+H2O Ag2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2O 氢氧化银不稳定,很容易被氧化成黑色的Ag2O,此黑色沉淀溶于硝酸得到银离 子,加入氨水得到银氨络合溶液。Ag2O微溶于水,溶液呈微碱性。它的△f H m很小, 不稳定,加热易分解,具有氧化性。 (2)、氧化汞的生成和性质 取0.5ml 0.2mol l-1的Hg(NO3)2溶液,滴加新配置的2mol.L-1的NaOH溶液,观察溶液颜色和状态。将沉淀分成两份一份2mol.L-1的HNO3,另一份加40%的NaOH溶液,观察现象。 Hg2++OH-===Hg(OH)2↓白色沉淀==HgO↓+H2O HgO+2HNO3==Hg(NO3)2+H2O HgO+NaOH(40℅)-----不溶解 补充:Hg22++2OH-=Hg↓+HgO↓+H2O (歧化反应) 沉淀不稳定,脱水得到HgO红色/黄色沉淀,沉淀溶于酸不溶于碱。HgO有黄色和红 色变体,结构相同,颜色差别因其颗粒大小不同所致, 黄色晶粒细小, 红色颗粒较大。 二、锌、镉、汞硫化物的生成和性质 向三支试管分别盛有0.5ml0.2mol.L-1CdSO4、ZnSO4、CdSO4溶液的离心试管中滴加新配制的1mol.L-1Na2S溶液,观察溶液颜色及状态。 Cd2++S2-===CdS 黄色沉淀 Zn2++S2-===ZnS 白色沉淀 Hg2++S2-===HgS 黑色沉淀 ZnS + 2HCl === ZnCl2 +H2S (ZnS能溶于 0.1mol/L的稀HCl) CdS + 2HCl === CdCl2 + H2S (CdS不溶于稀酸,但能溶于浓酸中) 3HgS + 12HCl + 2HNO3 === 3H2[HgCl4] + 3S↓+ 2NO↑+ 4 H2O 3HgS+12Cl-+2NO3-+8H+=3[HgCl4]2-+3S+2NO+4H2O HgS不溶于浓酸,在浓硝酸中也难溶,但它能溶于王水。所有的沉淀都能够溶 于王水中。这反映出三种沉淀的K sp存在差异。 将沉淀离心分离分成三份:一份加入 2 mol.L-1的盐酸,另一份加入浓盐酸,再一份加入王水。
土壤铜镉污染的电动力学修复实验
万方数据
万方数据
万方数据
万方数据
土壤铜镉污染的电动力学修复实验 作者:胡宏韬, 程金平, Hu Hongtao, Cheng Jinping 作者单位:胡宏韬,Hu Hongtao(上海应用技术学院化学工程系,上海,200235), 程金平,Cheng Jinping(上海交通大学环境科学与工程学院,上海,200240) 刊名: 生态环境学报 英文刊名:ECOLOGY AND ENVIRONMENTAL SCIENCES 年,卷(期):2009,18(2) 被引用次数:15次 参考文献(18条) 1.郑燊燊,申哲民,陈学军,王文华电动修复Cd污染土壤的DBLM模型[期刊论文]-农业环境科学学报 2007(2) 2.TROMBLY J Electrochemical remediation takes to the field 1994(06) https://www.360docs.net/doc/e39221115.html,GEMAN R Electro-reclamation Applications in the Netherlands 1993(13) 4.ACAR Y B;ALSHAWABKEH A N Principles of electrokinetic remediation 1993(13) 5.张锡辉,王慧,罗启仕电动力学技术在受污染地下水和土壤修复中新进展[期刊论文]-水科学进展 2001(2) 6.龙新宪,杨肖娥,倪吾钟重金属污染土壤修复技术研究的现状与展望[期刊论文]-应用生态学报 2002(6) 7.周加祥,刘铮铬污染土壤修复技术研究进展[期刊论文]-环境污染治理技术与设备 2000(4) 8.沈振国,陈怀满土壤重金属污染生物修复的研究进展[期刊论文]-农村生态环境 2000(2) 9.KIM S O;MOON S H;KIM K W Removal of heavy metals from soils using enhanced electrokinetic soil processing 2001 10.GENC A;CHASE G;FOOS A Electrokinetic removal of manganese from fiver sediment 2009 11.GIDARAKOS E;GIANNIS A Chelate agents enhanced electrokinetic remediation for removal cadmium and zinc by conditioning catholyte pH 2006 12.周东美,仓龙,邓昌芬络合剂和酸度控制对土壤铬电动过程的影响[期刊论文]-中国环境科学 2005(1) 13.仓龙,周东美施加不同电压对铬污染黄棕壤电动过程的影响[期刊论文]-土壤学报 2005(6) 14.王业耀,孟凡生铬(Ⅵ)污染高岭土电动修复实验研究[期刊论文]-生态环境 2005(6) 15.孟凡生,王业耀电动修复铬污染土壤的实验研究[期刊论文]-环境科学与技术 2005(4) 16.陆小成,黄星发,程炯佳,徐泉,郑正,毕树平模拟土壤组分高岭土和蒙脱石中Cu(Ⅱ)污染的电动修复研究[期刊论文]-中国科技论文在线 2007(8) 17.丁飒,罗亚田重金属污染土壤的电动修复研究[期刊论文]-武夷科学 2007(1) 18.胡宏韬;张小良;柳云龙地表污染渗滤液对地下环境的污染机理 2006 本文读者也读过(10条) 1.胡宏韬.Hu Hongtao铜污染土壤电动修复研究[期刊论文]-环境工程学报2009,3(11) 2.陈芳.王超.CHEN Fang.WANG Chao铬(Ⅵ)污染污泥电动修复的影响因素研究[期刊论文]-广州化工2010,38(4) 3.冯婷婷.李泽琴.廖振宇.刘婉.FENG Tingting.LI Zeqin.LIAO Zhenyu.LIU Wan电动修复土壤中重金属污染的改良方法[期刊论文]-广东微量元素科学2008,15(3) 4.胡宏韬.程金平.HU Hong-tao.CHENG Jin-ping土壤锌污染修复实验研究[期刊论文]-环境科学与技术 2009,32(10) 5.句炳新土壤中镉的吸附行为及其对电动修复效果的影响[学位论文]2006 6.孟凡生.王业耀.陈锋.Meng Fansheng.Wang Yeyao.Chen Feng施加电压对铬污染土壤电动修复的影响[期刊论文]-环境工程学报2007,1(3)
验证报告 - 环境空气铜锌镉铬锰镍
环境空气铜、锌、镉、铬、锰及镍的测定 原子吸收分光光度法 一、方法来源 《环境空气铜、锌、镉、铬、锰及镍的测定原子吸收分光光度法》由《空气和废气监测分析方法》(第四版) 国家环境保护总局(2003年)发布。 二、方法验证 本标准所用量器除另有说明外均应为符合国家标准的A级玻璃量器2.1仪器与设备 2.1.1总悬浮颗粒物采样器:大流量采样器或中流量采样器。 2.1.2马弗炉 2.1.3 铂坩埚或裂解石墨坩埚:20-30ml。 2.1.4原子吸收分光光度计:具有火焰、石墨炉原子化器。 2.2试剂及材料 2.2.1 过氯乙烯滤膜。 2.2.2 硝酸、盐酸、氢氟酸:优级纯。 2.2.3 0.7%(V/V)硫酸溶液:用优级纯硫酸配制。 2.2.4 1%(V/V)硝酸溶液:用优级纯硝酸配制。 2.2.5 硝酸溶液C(HNO3)=0.16mol/L。 2.2.6 5%(m/V)抗坏血酸溶液:称取5.0g抗坏血酸,溶解于水中并稀释至100ml。临用时配制。 2.2.7甲基异丁酮。 2.2.8碘化钾溶液C(KI)=1.0mol/L。 2.2.9 铜、锌、镉、铬、锰及镍标准储备液:称取上述金属(99.99%)
各0.5000g,分别用(1+1)盐酸溶液5.0ml、硝酸5.0ml溶解,移入500ml容量瓶中,用水稀释至标线,摇匀。上述溶液每毫升含相应元素1.00mg。贮于聚乙烯塑料瓶中,冰箱内保存。 2.2.10铜、锌、镉、铬、锰及镍标准使用液:临用时,吸取10.00ml 标准储备液于100ml容量瓶中,滴加1.0ml硝酸,用水稀释至标线。此溶液每毫升含铜、锌、镉、铬、锰及镍各元素100ug 2.3实验内容 2.3.1试样的制备 硫酸--灰化法:取适量样品滤膜于铂坩埚或裂解石墨坩埚中,加入0.7%硫酸溶液2ml,使样品充分润湿,浸泡1h,然后在电热板上加热,小心蒸干。将坩埚置于马弗炉中400℃±10℃加热4h,至有机物完全烧尽。停止加热,待炉温降至300℃以下时,取出坩埚,冷至室温,加4-6滴氢氟酸,摇动使其中残渣溶解。在电热板上小心加热至干,再加7-8滴硝酸,继续加热至干,用0.16mol/L硝酸溶液将样品定量转移至10ml容量瓶中,并稀释至标线,摇匀,即为待测样品溶液。 取同批号、等面积的空白滤膜制备空白样。 2.4分析步骤 2.4.1校准曲线的绘制 2.4.1.1 将铜、锌、镉、铬、锰及镍标准使用液分别稀释为0、0.20、0.40、0.60mg/L使用液。 2.4.1.2 按照仪器工作条件测定吸光度,以吸光度对各元素的浓度(ug/ml),绘制标准曲线(或由仪器自动绘制标准曲线)。 得到校准曲线如下所示:
水质_铜、锌、铅、镉实施细则
水质 铜、锌、铅、镉分析检测实施细则 本标准规定了测定水中铜、锌、铅、镉的原子吸收光谱法。 本标准分为两部分。第一部分为直接法,适用于测定地下水、地面水和废水 中的铜、锌、铅、镉; 第二部分螯合萃取法,适用于测定地下水和清洁地面水中低浓度的铜、铅、镉。 原子吸收分光光度法 1定义 溶解的金属:未酸化的样品中能通过0.45μg 滤膜的金属成分。 金属总量:未经过滤的样品经强烈消解后测得的金属浓度,或样品中溶解和悬浮的两部分金 属浓度的总量。 2采样和样品 2.1用聚乙烯塱料瓶采集样品。采样瓶先用洗涤剂洗净,再在硝酸溶液(5.6)中浸泡,使用前用 水冲洗干净。分析金属总量的样品,采集后立即加硝酸(5.1)酸化至PH1~2,正常情况下,每1000 ml 样品加2硝酸(5.1)。 2.2 试样的制备 分析溶解的金属时,样品采集后立即通过0.45μm 滤膜过滤,得到的滤液再按(2.1)中的要求酸化。 直接法 3适用范围 3.1测定浓度范围与仪器的特性有关,表1列出,般仪器的测定范围。 因产生背景吸收,使铅的测定结果偏高。 1987 - 08 01 实施 元 素 浓度范围,mg/L 铜 0.05 ?5 锌 0.05-1 铅 0.2 镉 0.05 ?1 3.2地下水和地面水中的共存离子和化合物在常见浓度下不干扰测定。但当钙的浓度高于1000mg/l 时,抑制镉的吸收,浓度为2000mg/l 时,信号抑制达19%。铁的含量超过100mg/l 时,抑制锌的 吸收。当样品中含盐量很高,特征谱线波长又低于时,可能出现非特征吸收。 如高浓度的钙,
4 原理 将样品或消解处理过的样品直接吸入火焰,在火焰中形成的原子对特征电磁辐射产生吸收,将测 得的样品吸光度和标准溶液的吸光度进行比较,确定样品中被测元素的浓度。 5试剂 除非另有说明,分析时均使用符合国家标准或专业标准的分析纯试剂、去离子水或同等纯度的水。 硝酸 1.42mg/ml,优级纯。 硝酸1.42g/ml ,分析纯。 高氯酸 1.67g/ml ,优级纯。 燃料:乙炔,用钢瓶气或由乙炔发生器供给,纯度不低于99.6%。 氧化剂:空气,一般由气体压缩机供给,进入燃烧器以前应经过适当过滤,以除去其中的水、 油和其他杂质。 1 + 1硝酸溶液。 用硝酸(5.2)配制。 1 + 499硝酸溶液。 用确酸(5.1)配制。 金属贮备液:1.000g/l 。 称取1.0008光谱纯金属,准确到0.0018,用硝酸(5.1)溶解,必要时加热,直至溶解完全,然 后用水稀释定容至1000ml 。 中间标准溶液。 用硝酸溶液稀释金属贮备液化(5.8)配制,此溶液中铜、锌、铅、镉的浓度分别为50.00、 10.00、100.0 和 10.00mg/l 。 6 仪器 一般实验室仪器和: 原子吸收分光光度计及相应的辅助设备,配有乙炔-空气燃烧器; 灯。仪器操作参数可参照厂家的说明进行选择。 注,实验用的玻璃或塑料器皿用洗涤剂洗净后,在硝酸溶液(5.6)中浸泡 7步骤 7.1 校准 7.1.1 参照表2丨在100ml 容量瓶中,用硝酸溶液5(5.7)稀释中间标准溶液(5.9),配制至少4个 工作标准溶液,其浓度范围应包括样品中被测元素的浓度。 光源选用空心阴极灯或无极 放电 ,使用前用水冲洗干净。 中间标准溶液( 5.9)加人体积mL 0.50 1.00 3.00 5.00 10.0 工作标准溶液浓度mg/l 铜 0.25 0.50 1.50 2.50 5.00 锌 0.05 0.10 0.30 0.50 1.00
镉污染报告
镉污染报告 目录 1 镉污染现状分析 (1) 1.1 镉污染的来源 (1) 1.2 主要的镉污染类型 (1) 1.3 中国至今发生的镉事件 (2) 1.4 浙江省镉污染现状 (3) 1.4.1 浙江土壤镉污染地区 (3) 1.4.2 镉污染检测与研究 (3) 1.4.3 现行的监督 (5) 2 世界各国的标准 (6) 3 我国现行的问题 (7) 4 对策、建议 (7) 4.1 控制源头 (7) 4.2 应对污染措施 (8) 4.3 流通环节 (9) 4.4 监控环节 (9) 4.5 保障措施 (9) 4.6 惩罚措施 (10)
1 镉污染现状分析 1.1镉污染的来源 目前,根据中国的发展现状,镉污染的主要来源有(1)工业化结果:大规模的开矿,不合理的金属加工和不达标的污染物排放;(2)农业结果:主要形式有施用含有镉的农药和不合理的施用化肥、农用塑料薄膜的使用;(3)城市化结果:在城乡结合带处置城市垃圾;(4)商业化结果:含污染物的电子产品等充斥着整个市场,进口国外垃圾;(5)日常生活产生的镉污染:吸烟以及使用含镉的用品。1.2 主要的污染类型 1.2.1 土壤污染 据统计全世界每年向环境中释放的镉达到30000吨左右,其中82%-94%的镉会进入到土壤中。我国有关农田土壤镉污染的调查工作开始于20世纪70年代中后期,至今未见镉污染总体状况的资料报道。1980年中国农业环境报告中指出我国农田土壤中镉污染耕地面积为93332 hm。1989年有报道称,我国11个灌区遭受镉污染农田面积大120002 hm。2003年报道称我国镉污染耕地面积为1.33万公顷,并有11处污染区土壤镉含量达到了生产“镉米”的程度,每年生产5万吨。最近的估算称,中国镉污染耕地达到8000万亩左右,近10%被污染耕地含镉量超标26倍,黄河水系、淮河干流、滦河的镉超标率都在16%以上。 1.2.2 食品污染——稻米污染 在1992年时全国已经有不少地区出现生产“镉米”的现象。 在2007年,南京农业大学农业资源与生态环境研究所教授潘根兴和他的研究团队,在全国华东、东北、华中、西南、华南和华北6个地区的县级以上市场中,随机采购大米样品91个,结果表明10%左右的市售大米镉超标。研究还表明,中国稻米重金属污染以南方籼米为主,尤以湖南、江西等省份最为严重。 2011年,据《新世纪》周刊报道中的抽样调查显示,中国多地市场上约10%的大米中镉含量超标。主要是水稻受污染。据统计,现如今,中国已经有八千万亩种植水稻的耕地受到了金属镉的污染。 下图(图1)为中国大米污染不完全分布图,展示了中国受镉污
从铜镉渣中析出铜锌镉的氧化氨浸工艺
第31卷 第2期 吉首大学学报(自然科学版)Vol.31 No.2 2010年3月J ournal of J is ho u Uni ver s i t y (Nat ural Sci ence Editio n)Mar.2010 文章编号:100722985(2010)022******* 从铜镉渣中析出铜锌镉的氧化氨浸工艺 3 刘海洋,颜文斌,石爱华,高 峰 (吉首大学化学化工学院,湖南吉首 416000) 摘 要:针对传统氨浸工艺浸出率较低现状,采用氧化氨浸工艺浸出回收铜镉渣中的镉、锌和铜.为了确定氧化氨浸工艺的最佳浸出条件,采用正交实验的方法研究了铜镉渣氧化氨浸的影响因素.结果表明:在氨水浓度3.7mol/L ,铵离子浓度5.0mol/L 和(N H 4)2S 2O 8浓度30g/L 、液固比6∶1的条件下,镉、铜的浸出率达到99%,同时锌的浸出率达到96%,浸出率明显高于传统氨浸方法. 关键词:铜镉渣;氧化氨浸;镉;锌;铜 中图分类号:TF813 文献标识码:B 近年来我国冶锌工业发展迅速,湿法炼锌厂每年都会产出大量的铜镉渣.铜镉渣中一般含Cd 5%~10%,Cu 1.5%~5%,Zn 28%~50%,仍具有极高的利用价值[1].但因资金和技术条件所限,这些铜镉渣未能得到有效处理,不仅浪费了大量资源,影响企业的经济效益,对环境也有一定污染.随着经济的发展和对资源的需求量增大,当一次资源日渐贫竭时,利用二次资源则成为必然.如果铜镉渣中主要有价金属全部回收利用,必然能产生可观的经济效益和社会效益. 通过湿法回收铜镉渣中的有价金属常用酸浸法[224]和氨浸法[528].酸浸法在酸浸时进入浸出液的杂质多,需进行一系列的净化除杂处理,工艺流程长,操作复杂,成本高.氨浸法所得浸出液杂质少,净化除杂容易,工艺流程短,过程简单.但使用氨水和碳酸铵作为浸出剂时浸出率不高,尤其是渣中的金属铜不易浸出.为此,笔者研究在氨水和碳酸铵体系中加入氧化剂,从而提高浸出率的工艺. 1 实验原料及方法 1.1实验原料 本实验所采用的原料为湘西某企业生产产生的铜镉渣,锌主要以Zn 和ZnO ,ZnSO 4的形式存在,铜和镉主要以单质及其氧化物的形式存在.其主要化学组成见表1. 表1 铜镉渣主要化学组成(质量分数) % Zn Cd Cu Fe Pb Co Ni 40.9 6.430.98 1.230.990.0030.011.2实验试剂及设备 实验试剂:氨水、碳酸铵、过硫酸铵等,均为分析纯试剂. 实验装置:集热式恒温加热磁力搅拌器、烧杯、表面皿、量筒等. 1.3实验方法及流程 将铜镉渣磨细至200目占90%以上备用,按不同浓度要求用碳酸铵、氨水和蒸馏水配制浸出剂并标定好备用.实验规模为为每次30g ,考察的因素有氨水浓度、碳酸铵浓度、液固比、氧化剂浓度、时间等. 3收稿日期:2009212224 基金项目:湖南省教育厅资助科研项目(08C717);湖南省科技计划项目(2008GK 3003) 作者简介刘海洋(62),男,河南新蔡人,吉首大学化学化工学院硕士研究生,主要从事矿产资源加工与利用研究通讯作者颜文斌,教授,主要从事无机材料及矿产资源加工与利用研究:197:.
