基础化学电子教案习题解答(第十二章)

思考题与习题
一、选择填
1.下列化合物酸性最强的____D_____,酸性最弱的是___A_____。
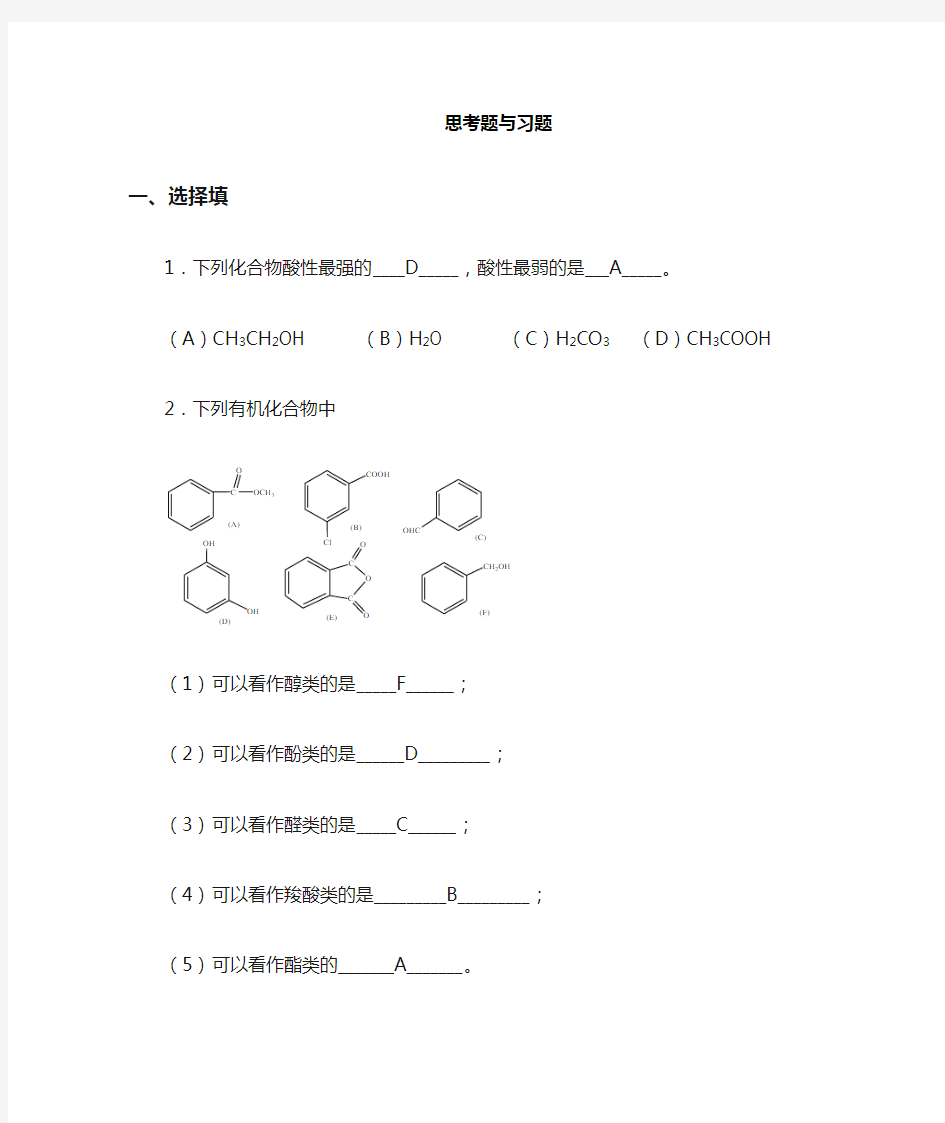
(A )CH 3CH 2OH (B )H 2O (C )H 2CO 3 (D )CH 3COOH 2.下列有机化合物中
OH
OH
C
C
O O O
C
OCH 3
O COOH
CH 2OH
OHC
(E)
(A)
(B)(C)(D)
(F)
(1) 可以看作醇类的是_____F______;
(2) 可以看作酚类的是______D_________; (3) 可以看作醛类的是_____C______;
(4) 可以看作羧酸类的是_________B_________; (5) 可以看作酯类的_______A_______。
3.下列各组物质中,只用溴水可鉴别的是___C_____。
(A )苯、乙烷 (B )乙烯、乙烷、乙炔
(C )乙烯、苯、苯酚 (D )乙烷、乙苯、1,3-己二烯 4.下列反应属于取代反应的是____C_____。 (A)乙炔通入酸性高锰酸钾溶液; (B)苯在镍催化剂中的加氢反应; (C)苯酚和溴水作用生成白色沉淀;
(D)乙醇在铜的催化作用下,经加热生成乙醛;
5.能与三氯化铁溶液发生显色反应的是____C______。 (A )乙醇 (B )甘油 (C )苯酚 (D )乙醚
6.下列溶液中,通入过量的CO 2后,溶液变浑浊的是_____A______。
(A )苯酚钠 (B )C 2H 5OH (C)NaOH (D)NaHCO 3 7.下列化合物中不与格氏试剂反应的是 。
(A )乙酸 (B )乙醛 (C )乙醚 (D )水
8.下列物质中,既能使高锰酸甲溶液褪色,又能使溴水褪色,还能与NaOH 发生中和反应的物质是_____A______。
(A )CH 2=CHCOOH (B )C 6H 5-CH 3 (C )C 6H 5-COOH (D )H 2S 9.下列反应中不属于水解反应的是______A______。
(A )丙酰胺和Br 2,NaOH 共热 (B )皂化 (C )乙酰氯在空所中冒白雾 (D )乙酐与H 2O 共热
10.下列物质久置空气中,能被氧化变质的是_____C_____。 (A )福尔马林 (B )碳酸 (C )油脂 (D )氯仿
二、判断正误。正确的划“√”,错误的划“ⅹ”。 1.分子中含有苯环和羟基的化合物一定是酚。( × )
2.酚与酸进行酯化反应时,与醇不同,通常采用酸酐或酰氯与酚或酚钠作用制备酚酯。( √ )
3.硝基苯酚的三个异构体之间,溶解度有明显的差别,邻位异构体大于间位和对位异构体。( × )
4.苯酚的磺化反应,随着反应温度不同,可得到不同的产物,一般高温主要得到邻羟基苯磺酸。 ( × )
5.酚羟基中C -OH 键牢固,所以很难直接脱水,酚醚一般用威廉姆逊合成法,即由酚钠和卤代烃作用生成的。( √ )
6.用锌汞齐(Zn-Hg )和浓盐酸作还原剂,可将醛、酮的羰基直接还原成醇。( × ) 7.能够发生银镜反应的都是醛类。( × )
8.仲胺与亚硝酸反应生成具有致癌作用的氮亚硝基胺。( √ )
9.酰胺与次氯酸钠或次溴酸钠的碱溶液作用时,失去羰基而形成少一个碳原子的伯胺。( √ ) 10.酰胺由于分子间可以通过氨基上的氢原子形成氢键,这种分子间的氢键缔合作用比羧酸间的强,所以,酰胺的沸点比分子量相近的羧酸的沸点高。( √ )
三、填空
1.写出下列化合物的结构
丙三醇
H 2H 2
OH OH OH ,叔丁醇 C CH 3
CH 3
3
OH
,
2-甲基环己醇 OH
CH 3
, 间苯二酚
OH
OH
邻羟基苯乙醚
OC 2H 5OH
,对氨基苯胺
NH 2
NH 2
,
间羟基苯甲醛
CHO
OH
,2-甲基丁二醛 OHC
CH CH 2CHO CH 3
邻羟基苯乙酸
OH COOH
,乙酰苯胺
NH 2
O
,
乙酐 CH 3
O
CH 3O
O ,对甲基苯甲酸乙酯 COOC 2H 5
H 3C
2.完成下列反应 CH 3CH 2
CH 2
(1)CH 3CH
2OH
CH 3CH 3
C
NH 2
O 34
24
2
(2)CH 3CH 2
C
NH
2
O
CH 3CH 2C
N +H 2O
(3)CH 3
Cl O
+CH
3CH 2OH
3
OC 2H 5O
+H 2O
(4)CH 3CH 2CHO +CH 3CH 2干燥HCl
32CH 3CH 2CHOCH 2CH 3
CH 3CH 2CH
OC 2H 5OC 2H 5
(5)H 3C
O
OC 2H 5
H +
322+
C
O
OCH 2CH 2CH 3
CH 3
C 2H 5OH
(6)
OH
24OH
SO 3H
SO 3H
OH
NO 2
NO 2
NO 2
(7)CH 3
CH
CH 3C CH 3
CH
3
CH 3
C C
CH 3
CH 3CH 3
(8)CH 3
CHO
H 2O
CH 3
H
CH 2CHO OH CH 3
CH CH CHO
(9)
CHO
+
CH 2OH
(10)CH 2COOH +SOCl
2
2Cl
O
(11)
COONa +CH 3CH 2Cl
O
+
C
O
O O
CH 2CH 3
NaCl
(12)CH 3CH 2CH
C H
CH 2
COOH
3CH 2CH
CH CH 2CH 2OH
四、简答题
1.蒸馏乙醚之前,为什么用淀粉碘化钾试纸检验是否含有过氧化物?如有如何除去? 答:乙醚在放置时能被空气中的氧气氧化成过氧化合物,过氧化合物的沸点比较高,受热后爆炸,所以在蒸馏之前要用淀粉碘化钾试纸检验是否有过氧化物存在,若白色的淀粉碘化钾试纸变蓝色,则说明有过氧化物存在。加入适量的还原剂如FeSO4与含有过氧化物的乙醚,使其完全反应,以除去过氧化物。
2.低级直链饱和一元醇为无色透明有酒精气味的液体,三个碳及以下的低级醇能与水混溶。自丁醇开始,在水中的溶解度相应减小;高级醇甚至不溶于水,而能溶于石油醚等烃类溶剂,为什么?
答:醇分子间有氢键键合,但随着分子内碳原子数的增多,羟基在分子中占的比例下降,氢键的作用渐弱,高级醇的极性很弱所致。 3.用化学方法区别下组化合物。
(1)CH 2=CHCH 2OH 、CH 3CH 2CH 2OH 、CH 3CH 2CH 2Br 解答:
CH 2CHCH 2
CH 3CH 2CH 2OH CH 3CH 2CH 2Br
高锰酸钾溶液颜色褪去的是
无明显现象的是 CH 3CH 2Br CH 2CHCH
2OH
能使溴水褪色的是无明显现象的是CH 2CHCH 2CH
3CH 2CH 2
(2)苯甲醚、邻甲苯酚、苯甲醇 解答:
苯甲醚苯甲醇
有颜色变化的是邻甲苯酚
无明显现象的是
苯甲醚
苯甲醇
有气体产生的是苯甲醇无明显现象的是苯甲醚
(3)苯甲醚、甲苯、对甲苯酚 解答:
苯甲醚甲苯
对甲苯酚
无明显现象的是
有颜色反应发生的是对甲苯酚
苯甲醚
甲苯
(4)1-溴丁烷、正丁醇、正丁醚 解答: 1-
正丁醇
正丁醚
有气体放出的是正丁醇
无明显现象的是
正丁醚
1-溴丁烷
有沉淀生成的是1-溴丁烷无明显现象的是正丁醚
(5)丙酸和甲酸
解答:
丙酸
甲酸
有银镜生成的是甲酸
(6)苯甲醇、苯甲酸和邻羟基苯甲酸
解答: 苯甲醇苯甲酸有气体逸出的是
无明显现象的是苯甲醇
苯甲酸
有颜色变化的是邻羟基苯甲酸无明显现象的是苯甲酸
4.如何检验环己醇中是否含有少量的苯酚?
答:取少量待检验的环己醇,加入适量的溴水,若有沉淀生成则说明环己醇中含有少量的苯酚杂质。 五、综合题
1.用指定原料合成指定产物,其它试剂可任选。 (1) 从正丙醇制备丙酰氯; 解:
CH 3CH 2CH 2OH
KMnO 4/H
+
CH 3CH 2COOH
PCl 5
CH 3CH 2O
Cl
(2) 从乙烯制备乙酸酐 解:
CH 2CH H 2O 34
CH 3CH 2OH
K 2Cr 2O 3H 2SO 4
CH 3P 2O 5CH 3
CH 3O
O
O
+H 2O
(3) 从乙醇制备丙酸乙酯 解: CH 3CH 2OH
HBr
CH 3CH 2Br
NaCN
CH 3CH 2H +
/ H 2O
24
CH 3CH 2COOC 2H 5
(4) 从正丁醇制备正戊酸 解:
CH 3CH 2CH 2CH 2OH HBr
CH 3CH 2CH 2CH 2NaCN
CH
3CH 2CH 3CH 2CH 2CH 2
(5) 从2-戊酮制备正丁酸 解:
CH 3
CH 2CH 2CH 3
O
NaOH + Br 2
CHBr 3
+CH 3CH 2
CH 3CH 2CH 2
2.某物质A 的分子式为C 5H 12O ,与钠反应放出氢气。它经氧化后的产物是B ,分子式为C 5H 10O ,B 物不与钠作用放出氢气。A 物在170℃下与浓硫酸作用主要产物为C 物质。C 物质经K 2Cr 2O 7—H 2SO 4处理得到丙酮和乙酸。写出A ,B ,C 的结构式及题中有关反应式。 解:经推测知A 、B 、C 、D 的构造式分别为:
CH 3
H
CH(CH 3)2
HO 、CH 3CH(CH 3)2
O
、CH 3CH
C CH 3
CH 3
反应过程为:
A
Na
[O ]H 2SO 4CH 3CH(CH 3)2NaO
CH 3
C CH(CH 3)2
O
CH 3CH
C CH 3
CH 3K 2Cr 2O 7-H 2SO 4
CH 3COOH +CH 3
C
CH 3
O
3.有一未知的酯,分子式为C 5H 10O 2,酸性水解生成酸(A )和醇(B ),用PBr 3(或HBr )处理(B )生成溴代烷(C ),当(C )用KCN 处理,则生成(D ),酸性条件下水解(D ),生成酸(A ),写出(A )、(B )、(C )、(D )的结构式及发生的反应方程式。
解:依题意推知A 、B 、C 、D 的构造式分别为:
CH 3CH 2COOH 、CH 3CH 2OH 、CH 3CH 2Br 、CH 3CH 2CN 反应过程为:
CH3CH2COOC2H5H2O/H+
CH3CH2COOH+CH3CH2OH
(A)(B)
CH3CH2OH
(B)HBr
CH3CH2Br KCN CH
3
CH2CN
(C)(D)
H2O/H+
CH3CH2COOH
高考化学基础复习测试题(带答案)
一、选择题(本题包括10小题,每小题5分,共50分) 1.下列概念分类标准正确的是( ) A.强碱和弱碱:每个分子能电离的OH-数目 B.强电解质和弱电解质:溶液导电能力强弱 C.浊液、胶体、溶液:分散剂粒径大小 D.氧化剂、还原剂:在化学反应中元素化合价变化 解析:碱的强弱分类是根据碱溶于水后,能否完全电离出OH-,能完全电离的碱为强碱,不能完全电离的碱为弱碱,A项错误.强电解质与弱电解质划分的标准是溶于水的电解质是否完全电离,与其水溶液的导电能力的强弱无直接关系,B项错误.划分分散系的标准是根据分散质粒子直径大小,与分散剂无关,C项错误.在氧化还原反应中,元素化合价升高的物质作还原剂,元素化合价降低的物质作氧化剂,D项正确. 答案:D 2.(2011?佛山模拟)生物学家借助新的显微技术,成功观察到小于200纳米的粒子.下列分散系中,分散质粒子半径最小的是( ) A.雾B.蛋白质溶液 C.石灰乳D.KNO3溶液 解析:在分散系中溶液的分散质粒子最小,又因为蛋白质属于大分子,故D符合. 答案:D 3.(2011 ?济南模拟)下列事实与胶体性质无关的是( ) A.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
B.将植物油倒入水中用力搅拌形成油水混合物 C.一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路 D.氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 解析:烟尘是气溶胶,其中的胶粒带电,在直流电作用下可产生电泳现象,使烟尘沉降而除去;蛋白质溶液是胶体,能发生丁达尔现象;在氢氧化铁胶体中滴入稀硫酸,先发生胶体的聚沉,然后氢氧化铁与酸反应而溶解;将植物油倒入水中用力搅拌形成的油水混合物是乳浊液,不是胶体. 答案:B 4.(2011?抚顺重点高中协作模拟)磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,可用于潜水艇推进器等.制备某种磁流体时,将等物质的量的硫酸亚铁溶液和硫酸铁溶液混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,所得磁流体黑色粒子直径在5.5~36 nm之间.下列说法正确的是( ) A.所得的分散系属于悬浊液 B.所得的分散系中的分散质为Fe2O3 C.给分散系通电时阳极周围黑色不变 D.该分解系能产生丁达尔效应 解析:根据粒子直径为5.5~36 nm,判断该分散系属于胶体,A错误;Fe2O3是红色物质,B错误;磁流体是胶体,通直流电发生电泳现象,阴阳极周围黑色会发生改变,C错误;该分散系是胶体,有丁达尔效应. 答案:D 5.(2011?哈尔滨质检)将饱和FeCl3溶液滴入沸水并煮沸一段时间,可得到红褐
基础生物化学复习题目及答案
第一章核酸 一、简答题 1、某DNA样品含腺嘌呤15、1%(按摩尔碱基计),计算其余碱基的百分含量。 2、DNA双螺旋结构就是什么时候,由谁提出来的?试述其结构模型。 3、DNA双螺旋结构有些什么基本特点?这些特点能解释哪些最重要的生命现象? 4、tRNA的结构有何特点?有何功能? 5、DNA与RNA的结构有何异同? 6、简述核酸研究的进展,在生命科学中有何重大意义? 7、计算(1)分子量为3 105的双股DNA分子的长度;(2)这种DNA一分子占有的体积;(3)这种DNA一分子占有的螺旋圈数。(一个互补的脱氧核苷酸残基对的平均分子量为618) 二、名词解释 变性与复性 分子杂交 增色效应与减色效应 回文结构 Tm cAMP Chargaff定律 三、判断题 1 脱氧核糖核苷中的糖苷3’位没有羟基。错 2、若双链DNA 中的一条链碱基顺序为pCpTpGpGpC,则另一条链为pGpApCpCpG。错 3 若属A 比属B 的Tm 值低,则属A 比属B 含有更多的A-T 碱基对。对 4 原核生物与真核生物的染色体均为DNA 与组蛋白的复合体。错 5 核酸的紫外吸收与pH 无关。错 6 生物体内存在的核苷酸多为5’核苷酸。对 7 用碱水解核苷酸可以得到2’与3’核苷酸的混合物。对 8 Z-型DNA 与B-型DNA 可以相互转变。对 9 生物体内天然存在的DNA 多为负超螺旋。对 11 mRNA 就是细胞种类最多,含量最丰富的RNA。错 14 目前,发现的修饰核苷酸多存在于tRNA 中。对 15 对于提纯的DNA 样品,如果测得OD260/OD280<1、8,则说明样品中含有蛋白质。对 16 核酸变性或降解时,存在减色效应。错 18 在所有的病毒中,迄今为止还没有发现即含有RNA 又含有DNA 的病毒。对 四、选择题 4 DNA 变性后(A) A 黏度下降 B 沉降系数下降C浮力密度下降 D 紫外吸收下降 6 下列复合物中,除哪个外,均就是核酸与蛋白质组成的复合物(D) A 核糖体 B 病毒C端粒酶 D 核酶 9 RNA 经NaOH 水解的产物为(D) A 5’核苷酸B2’核苷酸C3’核苷酸 D 2’核苷酸与3’核苷酸的混合物 10 反密码子UGA 所识别的密码子为(C) A、ACU B、ACT C、UCA D TCA 13 反密码子GψA 所识别的密码子为(D) A、CAU B、UGC C、CGU D UAC
【优质】轴机械基础电子教案
机械基础电子教案(2学时) 第8章支承零部件 8.1 轴 [课程名称] 轴 [教材版本] 栾学钢主编。机械基础(多学时)。北京:高等教育出版社,2010 栾学钢主编。机械基础(少学时)。北京:高等教育出版社,2010 [教学目标与要求] 一、知识目标 1、了解轴的结构、分类、常用材料。 2、理解轴上零件的轴向和周向固定方法,熟悉轴的结构工艺性。 二、能力目标 1、能够合理选择轴的材料。 2、能够正确分析轴上结构设计的目的。 三、素质目标 1、了解轴的功用和轴的常用材料。 2、能结合实际分析轴上各结构的功用。 四、教学要求 1、熟悉传动轴、心轴和转轴的区别,及轴的常用材料。 2、了解轴上零件的轴向和周向固定方法,及结构工艺性。 [教学重点] 1、直轴的分类、功用和轴的常用材料。 2、轴的结构要求及轴向和周向固定方法。 [难点分析] 轴上零件的固定方法,特别是结构工艺性。 [教学方法] 讲授法、实物教具演示、互动法、归纳法
[学生分析] 1、学生的实际知识较少,对于轴上零件的固定方法不易理解,尤其是 结构工艺性更难懂,教学时应当配以课件或加工实况、实物,或生产安装的教学录像帮助学生理解轴的结构。 [教学资源] 1、机械基础网络课程。北京:高等教育出版社,2010 2、吴联兴主编。机械基础练习册。北京:高等教育出版社,2010 3、课件、教具、实物。 [教学安排] 教学步骤:讲授与教具或实物演示交叉进行,配以课件或加工实况录像,穿 插互动、提问与设问,最后小结。2学时(90分钟) [教学过程] 一、导入新课(10分钟) 机械零件是组成及其的最基本单元,生产中必须按图纸的工艺要求生产出 每一个合格零件,然后再组装成构件和机器。因此必须熟悉常用零件的功用、结构特点和加工工艺,才能生产出适应机器使用要求的零件。常用零件分为通用零件和专用零件。专用零件指某些机器上特有的零件,如直升飞机上的螺旋桨,轮船上的螺旋桨,内燃机上的曲轴等。通用零件是指在各种设备上都共同具有的零件,如螺钉、螺帽、轴承、齿轮等。本课程只讲通用零件的结构、特点。通用零 件有部分是标准件,即可以在市场上买到的,不必要自己组织生产;而有一部分必须自己生产,但他们具有统一的标准和规格。 教师可演示实物,如有可能播放生产录像,了解零件的生产过程。强调学 习本章内容要注意贴近实际,联系生产。 二、新课(75分钟) 1、轴的功用与分类特点 轴是机器中最重要的零件之一,主要起支承轴上零件并传递运动和转矩的作用。这里注意运动和转矩的区别。 轴的分类主要分清传动轴、心轴和转轴,一般的轴多为转轴,可举学生能见到的例来说明。如书上所举的例子,或如下:
基础化学试题及答案
填空选择3 1、下列各组物质可能共存的是( A )。 A..Cu2+、Fe2+、Sn4+、Ag B. Cu2+、Fe2+、Ag+、Fe C Cu2+、Fe3+、Ag+、Fe D Fe3+、Fe2+、Sn4+、I- 2、通常配制FeSO4溶液时,加入少量铁钉,其原因与下列反应中的哪一个无关?( D ) A.O2(aq)+4H+(aq)+4e==2H2O(l) B. Fe3+(aq)+e== Fe2+(aq) C. Fe(s)+2Fe3+(aq)==3Fe2+(aq) D. Fe3+(aq)+3e== Fe(s)3、已知Φ°(Fe3+/ Fe2+)=0.771V,K稳(Fe(CN)63-)=1.0×1042,K稳(Fe(CN) 64-)=1.0×1035,则Φ°Fe(CN) 6 3-/ Fe(CN) 6 4-)=(A )。 A、0.36V B、1.19V C、-0.36V D、0.77V 4、若两电对在反应中电子转移分别为1和2,为使反应完成程度达到99.9%,两电对的条件电势之差ΔΦ°至少应大于( B)。 A、0.09V B、0.27V C、0.36V D、0.18V 5、影响氧化还原反应方向的因素有( B )。 A、压力 B、温度 C、离子强度 D、催化剂 6、在 1 mol·L-1 H2SO4介质中,Φ°(Ce4+/ Ce3+)=1.44VΦ°,(Fe3+/ Fe2+)=0.65V,以Ce4+滴定Fe2+时,最适宜的指示剂为( B )。 A、二苯胺碘酸纳[Φ°(In)=0.84V] B、邻二氮菲-亚铁[Φ°(In)=1.06V] C、硝基邻二氮菲-亚铁[Φ°(In)=1.25V] D、邻苯氨基苯甲酸[Φ°(In)=0.89V] 7、用K2Cr2O7法测定Fe时,若SnCl2量加入不足,则导致测定结果( B)。 A、偏高 B、偏低C、不变 D、无法判断 8、碘量法要求在中性或弱酸性介质中进行滴定,若酸度太高,将会( D)。 A、反应不定量B、I2易挥发C、终点不明显 D、I-被氧化,Na2S2O3被分解 9、标定Na2S2O3的基准物是下述哪一种?( B ) A、H2C2O4·H2O B、K2Cr2O7 C、As2O3D、Fe 10、用KMnO4滴定Fe2+之前,加入几滴MnSO4的作用是( A)。 A、催化剂 B、诱导反应剂 C、氧化剂 D、配合剂 11、用法扬司法测定Cl-时,用曙红为指示剂,分析结果会(B)。 A、偏高B、偏低 C、准确 12、在PH=4时,用莫尔法测定Cl-时,分析结果会( A)。 A、偏高 B、偏低 C、准确 13、化合物Ag2CrO4在0.001 mol·L-1的AgNO3溶液中的溶解度比在0.001 mol·L-1的KCrO 4液中的溶解度( B )。 A、较大 B、较小 C、一样 14、常温下,AgCl的溶度积为1.8×10-10,Ag2CrO4的溶度积为1.1×10-12,,CaF2的溶度积为2.7×10-11,(1)三种物质中溶解度最大的是( C),(2)三种物质中溶解度最小的是(A ) A、AgCl B、Ag2CrO4 C、CaF2 15、在沉淀形成过程中,与待测离子的半径相近的杂质离子常与待测离子一道与构晶离子形成( B )。
九年级化学电子版教案
绪言化学使世界变得更加绚丽多彩 此部分内容从学生的角度提出了许多饶有趣味且又带有一定想象力的美好愿望,指出这些美好愿望“正在通过化学家的智慧和辛勤的劳动逐步实现”,从而激发学生学习化学的兴趣,使学生感受到化学学习的价值,并产生希望了解化学的强烈愿望。 教材从具体事例出发,先是引导学生了解化学是一门使世界变得更加绚丽多彩的自然科学,它主要研究物质的组成、结构、性质以及变化规律;接着教材以丰富多彩的图画和简明的语言,概述了人类认识化学、利用化学和发展化学的历史和方法,以及化学与人类进步和社会发展的关系,向学生展示了化学的魅力和学习化学的价值。 知识与技能 了解化学是研究物质的组成、结构、性质以及变化规律的自然科学,知道化学与人类进步和社会发展的密切关系。 过程与方法 引导学生通过资料搜集、展示等,逐步形成良好的学习习惯和学习方法,提高学生获取信息、表达信息的能力。 情感、态度与价值观 激发学生亲近化学、热爱化学并渴望了解化学的情感。 重点对学生进行情感、态度和价值观等方面的熏陶和培养。激发学生渴望了解化学的情感,认识化学学习的价值,从而产生学习化学的兴趣。 难点了解什么是化学。 多媒体、NaOH溶液(用啫喱水瓶盛装好)、用酚酞试液写有“化学大世界”字样的纸(表面为白纸)。 一、导入新课 请三名学生分别上台表演: 甲:(展示A、B两种无色液体)请大家猜测,如果把这两种液体混合在一起会有什么现象呢? (在同学们各抒己见后) 甲:[向盛有A液体(稀盐酸)的试管中滴加B液体(AgNO3溶液)。] (在同学们惊讶的目光中) 甲:我表演的节目叫“清水变牛奶”,可是不能喝! 乙:这有什么稀奇,我也会表演(展示C、D两种无色液体),我也请大家猜一猜,如果把它们混在一起会有什么现象呢? (在同学们各抒己见后) 乙:[向盛有C液体(NaOH溶液)的烧杯内,逐滴滴入D液体(无色酚酞)。] (在同学们期待的目光中) 乙:我的节目叫“我为液体添色彩”。
生物化学《基础生物化学》试题考试卷模拟考试题.docx
《《基础生物化学》试题》 考试时间:120分钟 考试总分:100分 遵守考场纪律,维护知识尊严,杜绝违纪行为,确保考试结果公正。 1、DNA 是遗传物质,而 RNA 则不是。( ) 2、天然氨基酸都有一个不对称α -碳原子。( ) 3、蛋白质降解的泛肽途径是一个耗能的过程,而蛋白酶对蛋白质的水解不需要 ATP 。( ) 4、酶的最适温度是酶的一个特征性常数。( ) 5、糖异生途径是由相同的一批酶催化的糖酵解途径的逆转。( ) 姓名:________________ 班级:________________ 学号:________________ --------------------密----------------------------------封 ----------------------------------------------线-------------------------
6、哺乳动物无氧下不能存活,因为葡萄糖酵解不能合成 ATP。() 7、DNA聚合酶和RNA聚合酶的催化反应都需要引物。() 8、变性后的蛋白质其分子量也发生改变。() 9、tRNA的二级结构是倒 L型。() 10、端粒酶是一种反转录酶。() 11、原核细胞新生肽链 N端第一个残基为 fMet,真核细胞新生肽链 N端为Met。()
12、DNA复制与转录的共同点在于都是以双链 DNA为模板,以半保留方式进行,最后形成链状产物。() 13、对于可逆反应而言,酶既可以改变正反应速度,也可以改变逆反应速度。() 14、对于任一双链 DNA分子来说,分子中的 G和C的含量愈高,其熔点( Tm)值愈大。() 15、DNA损伤重组修复可将损伤部位彻底修复。() 16、蛋白质在小于等电点的 pH溶液中,向阳极移动,而在大于等电点的 pH 溶液中将向阴极移动。() 17、酮体是在肝内合成,肝外利用。()
化学基础试题 会考专用
化学试题 一、选择题 1.下列表示物质结构的化学用语或说法正确的是() A.20278Pt和19878Pt的质子数相同,互称为同位素 B.8个中子的碳原子的符号:12C C.H2O2中氧元素的化合价是-2 D.Cl-离子的结构示意图: 2.根据原子序数,下列各组原子能以离子键结合的是() A.2与8 B.6与16 C.8与14 D.9与11 3.设N A为阿伏伽德罗常数,下列叙述正确的是() A.24g镁原子最外层电子数为N A B.1mol甲烷分子所含质子数为10N A C.1mol乙烯分子中的共价键是4N A D.标准状况下,22.4L乙醇的分子数为N A 4.苯加溴水后,溴水层颜色变浅,这是由于() A.溴挥发了 B.发生了取代反应 C.发生了萃取 D.发生了加成反应 )X Y Z A.X,Y,Z中X的单质最稳定 B.Y的氢化物为HY C.X能生成HXO D.能发生ZO2+2H2Z=3Z+2H2O的反应 6.下列说法正确的是() A.NH4Cl中含有共价键,所以NH4Cl是共价化合物 B.阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小 C.失电子难的原子获得电子的能力一定强 D.含有离子键的化合物必是离子化合物 7.下列有关有机物的说法正确的是() https://www.360docs.net/doc/e55674760.html,l4可由CH4发生加成反应制得 B.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液制得 C.糖类、蛋白质、油脂均属于天然高分子化合物 D.苯不能使酸性高锰酸钾溶液褪色,因此苯不能发生氧化反应 8.下列有关有机物的说法正确的是( ) A.用聚氯乙烯塑料袋包装食品 B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 C.乙烯的结构简式为CH2CH2 D.检验乙醇中少量的水:加无水硫酸铜 9.下列实验能达到预期目的的是() A.向蛋白质溶液中加氯化钡溶液以提纯蛋白质 B.向淀粉中加稀硫酸加热,冷却后再加新制的氢氧化铜悬浊液加热检验淀粉是否水解
化学习题电子教案
化学习题
在总浓度为0.10mol/L的银-硫代硫酸络合物的溶液中,当Ag(S2O3)35-型体的浓度等于Ag(S2O3)-型体浓度的1000倍时,溶液中游离S2O32-和 Ag(S2O3)-型体的浓度各为多少? (已知 Ag+-S2O32-形成逐级络合物的累积稳定常数b1=109.0, b2=1013. 2 在1L NH3-NH4Cl的缓冲溶液中, 含0.10 mol Zn2+-EDTA络合物, 溶液的pH=9.0,[NH3]=0.10 mol/L,计算Zn2+的浓度。已知lgK(ZnY)=16.5; 锌氨络离子的lgb1 -lgb4分别为2.27,4.61,7.01,9.06; pH=9.0时lga Y(H) =1.3。 3 在pH=5.0的缓冲溶液中, 以2×10-2mol/L EDTA滴定相同浓度的Cu2+溶液,欲使终点误差在±0.1%以内。试通过计算说明可选用PAN指示剂。 已知: pH=5.0时PAN的pCu t=8.8, a Y(H)=106.6, lgK(CuY)=18.8。 4 用0.0200 mol/L EDTA滴定pH=10.0每升含有0.020 mol游离氨的溶液中的Cu2+ [c(Cu2+)=0.0200 mol/L], 计算滴定至化学计量点和化学计量点前后0.1% 时的pCu'和pCu值。[lgK(CuY)=18.8; pH=10.0时 lga Y(H)=0.5, lga Cu(OH)=0.8; Cu-NH3络合物的各级累积常数 lgb1~lgb4: 4.13、7.61、10.48、12.59] 5 计算pH=10.0时, 以铬黑T作指示剂, 用0.0200 mol/L EDTA溶液滴定0.0200 mol/L Ca2+的终点误差。 [pH=10.0时 lga Y(H)=0.5、pCa t(铬黑T)=3.8, lgK(CaY)=10.7] 6 试计算在pH=10.0的氨性缓冲溶液中, 设化学计量点时[NH3]=0.10 mol/L, 用0.0200 mol/L EDTA溶液滴定0.0200 mol/L Zn2+溶液时,化学计量点的pZn和 pZn'值。 [lgK(ZnY)=16.5; pH=10.0时 lga Y(H)=0.5, lga Zn(OH)=2.4, Zn(NH3)42+的lgb1~lgb4分别是2.37、4.81、7.31、9.46] 7 于pH=10.0时, 以0.0100 mol/L EDTA溶液滴定50.00 mL同浓度的某金属离子M2+, 已知在此条件下滴定反应进行完全。当加入EDTA溶液49.95 mL和50.05 mL时,化学计量点前后的pM值改变2个单位。计算络合物MY2-的稳定常数K(MY)值。 (不考虑M2+的其它副反应,已知pH=10.0时, lga Y(H)=0.5)
基础生物化学习题及答案
《基础生物化学》习题 练习(一)蛋白质 一、填空 1.蛋白质具有的生物学功能是 、 、 、 、 、 、 和 等。 2.蛋白质的平均含氮量为 ,这是蛋白质元素组成的重要特点。 3.某一食品的含氮量为1.97%,该食品的蛋白质含量为 %。 4.组成蛋白质的氨基酸有 种,它们的结构通式为 ,结构上彼 此不同的部分是 。 5.当氨基酸处于等电点时,它以 离子形式存在,这时它的溶解 度 ,当pH>pI 时,氨基酸以 离子形式存在。 6.丙氨酸的等电点为6.02,它在pH8的溶液中带 电荷,在电场中向 极移动。 7.赖氨酸的pk 1(-COOH)为2.18,pk 2(3H N +-)为8.95,pk R (εH N + -)为10.53,其 等电点应是 。 8.天冬氨酸的pk 1(-COOH)为2.09,pk 2(3H N +-)为9.82,pk R (β-COOH)为3.86, 其等电点应是 。 9.桑格反应(Sanger )所用的试剂是 ,艾德曼(Edman )反应 所用的试剂是 。 10.谷胱甘肽是由 个氨基酸组成的 肽,它含有 个肽键。 它的活性基团是 。 11.脯氨酸是 氨基酸,与茚三酮反应生成 色产物。 12.具有紫外吸收能力的氨基酸有 、 和 。 一般最大光吸收在 nm 波长处。 13.组成蛋白质的20种氨基酸中,含硫的氨基酸有 和 两种。 能形成二硫键的氨基酸是 ,由于它含有 基团。 14.凯氏定氮法测定蛋白质含量时,蛋白质的含量应等于测得的氨素含量乘 以 。 二、是非 1.天氨氨基酸都具有一个不对称性的α-碳原子。( ) 2.蛋白质分子中因含有酪氨酸,色氨酸和苯丙氨酸,所以在260nm 处有最大吸 收峰。( ) 3.自然界中的氨基酸都能组成蛋白质。( ) 4.蛋白质在280nm 处有紫外吸收是因为其中含有—SH —的氨基酸所致。( )
化学实验的基础知识试题
化学实验基本知识试题 6. a. 红色 b. 兰色 c. 无色 d. 7. 通常所说的浓硫酸的浓度为: a. 50% b. 75% c. 98% d. 100% 8. 1ng 为: a. 1X10 -3g b. 1X10 -6g c. 1X10 9. 摄氏 100o C 为: 绿褐色 (d ) (c ) -9 g d. 1X10 -12g (c ) a. 373.15K b. 273.15K c. 125K d. 473.15K 10. 有效数字 1.0079 、 32.06 和 26.017 相加,结果为: a. 59.0849 b. 59.09 c. 59.1 d. 59.085 11. 若需配置1M 的NaOH 溶液0.5L ,则需NaOH 固体: a. 10 g b. 20 g c. 30 g d. 40 g (b ) 12 . 若需配置1N 的KOH 溶液0.5L,则需KOH 固体: a. 10 g b. 28 g c. 56 g d. 33 g (b ) 13. 浓度为 98%,密度为 1.84g/cm -3 的硫酸的摩尔浓度为: a. 18.4 M b. 12.8 M c. 9.8 M d. 49 M (a ) 14. 实验试剂瓶的标签颜色为: a. 棕色 b. 蓝色 c. 红色 d. 绿色 (a ) 15. 化学纯试剂瓶的标签颜色为: a. 棕色 b. 蓝色 c. 红色 d. 绿色 (b ) 16. 分析纯试剂瓶的标签颜色为: a. 棕色 b. 蓝色 c. 红色 d. 绿色 (c ) 一、 单选题 1. 碱式滴定管内不宜装下列物质: a. 氧化剂 b. 还原剂 c. 水 d. 碱液 2. 酸式滴定管的下端具有: a. 玻璃珠 b. 橡皮管 c. 玻璃活塞 d. 其它 a ) c ) 3. 1升水的质量为 1000g 时的温度为: a. 0 o C b. 10 o C c. 25 o C d. 3.98 o C 4. 砂心漏斗不能用过滤下列液体: a. 水 b. 碱液 c. 酸液 d. 盐溶液 d ) b ) 5. 配置铬酸洗液时,加入浓硫酸应: a. 尽快地加 b. 缓慢的加 c. 无所谓 d. 静止时加入 b ) 洗液用到什么颜色时,就不能使用了 a ) b )
化学基础试题A
选择题(A)(B)(C)(D) 1.用酸性高锰酸钾溶液不能鉴别下列哪组物质() (A)丁烷和1,3-丁二烯(B) 丁烷和1-丁炔(C)乙烷和乙烯(D) 丙烷和环丙烷2.下列不是有机化合物的是() (A) C2H5OH (酒精) (B) (NH4)2CO3(碳酸铵) (C) (NH2)2CO (尿素) (D)CH3COOH(醋酸) 3.下列化合物能发生银镜反应的是() (A) CH3COCH3(B)CH3COOH (C)CH3CHO (D)CH3CH2OH (A) 丙酮(B) 乙醛(C) 乙醇(D)乙酸4.下列化合物中酸性最强的是() (A) H2O (B)CH3CH2OH (C)C6H5OH (D)CH3COOH (A) 乙醇(B) 水(C) 苯酚(D)乙酸 5.下列物质中沸点最高的是() (A) 乙醇(B) 甲醚(C) 乙酸(D)乙醛 (A) CH3CH2OH (B) CH3OCH3(C) CH3COOH (D)CH3CHO 6.下列化合物发生水解反应活性最强的是() (A) 酸酐(B) 酯(C) 酰胺(D) 酰卤 (A)(CH3CO)2O (B)CH3COOC2H5(C)CH3CONH2(D)CH3COCl 7.乙醇、丙醇混合后与浓硫酸共热,若反应生成醚类化合物,可能生成几种醚() (A) 2 (B) 3 (C) 4 (D) 5 8.禁止用工业酒精配制饮料酒,是因为工业酒精中含有少量的有毒的() (A) 甲醇(B) 乙二醇(C) 丁醇(D) 甘油 9.“来苏儿”的组成中有() (A) 苯酚(B) 乙醇(C) 甲酚(D) 甘油 10.以下各组化合物不为同分异构体的是()
基础化学电子教案要求
实验 化学反应速率与活化能 一、教学要求: 1、掌握浓度、温度和催化剂对化学反应速率的影响; 2、学习测定过二硫酸铵与碘化钾反应的反应速率的方法; 3、利用实验数据会计算反应级数、反应速率常数和反应的活化能。 二、预习内容: 1、化学反应速率的表示方法; 2、浓度、温度和催化剂对化学反应速率的影响理论基础; 3、反应速率常数的意义; 4、化学反应活化能的意义 5、速率常数与活化能的关系; 6、如何使用作图法求反应的速率常数、反应级数和反应的活化能; 7、计时秒表的使用; 8、恒温水浴槽的使用; 三、基本操作: 四、实验原理: 在水溶液中过二硫酸铵与碘化钾反应为: (NH 4)2S 2O 8 + 3KI === (NH 4)2SO 4 + K 2SO 4 + KI 3 其离子反应为: S 2O 82- + 3I - === SO 42- + I 3- (1) 反应速率方程为: n I m O S c kc r --?=28 2 式中r 是瞬时速率。若-28 2O S c 、-I c 是起始浓度,则r 表示初速率(v 0)。在实验中只能测定出在一段 时间内反应的平均速率。 t c r O S ??-= - 28 2 在此实验中近似地用平均速率代替初速率: t c c kc r O S n I m O S ??-= =- - -28 2 28 20 为了能测出反应在△t 时间内S 2O 82-浓度的改变量,需要在混合(NH 4)2S 2O 8 和KI 溶液的同时,加入一定体积已知浓度的Na 2S 2O 3溶液和淀粉溶液,这样在(1)进行的同时还进行着另一反应: 2S 2O 32- + I 3- === S 4O 62- + 3I - (2) 此反应几乎是瞬间完成,(1)反应比(2)反应慢得多。因此,反应(1)生成的I 3-立即与S 2O 32-反应,生成无色S 4O 62-和I -,而观察不到碘与淀粉呈现的特征蓝色。当S 2O 32-消耗尽,(2)反应不进行,(1)反应还在进行,则生成的I 3-遇淀粉呈蓝色。 从反应开始到溶液出现蓝色这一段时间△t 里,S 2O 32-浓度的改变值为: )O S )O S )O S O S c c c c 始始终(((23 223 223 223 2][----=--=? 再从(1)和(2)反应对比,则得:
机械基础教案(职高)电子教案
章节 名称 TOPIC 1平面机构运动副和运动简图 授课 形式 讲授 课 时 1 班 级 中专0101 教学 目的 掌握常用的运动副类型 教学 重点 低副和高副 教学 难点 辅助 手段 课外 作业 课后 体会 一、运动副 使两物体直接接触而又能产生一定相对运动的联接,称为运动副。 根据运动副中两构接触形式不同,运动副可分为低副和高副。 1.低副:低副是指两构件之间作面接触的运动副。按两构件的相对运动情况,可分为: (1)转动副:两构件在接触处只允许作相对转动。由滑块与导槽组成的运动副。 (2)移动副:两构件在接触处只允许作相对移动。由滑块与导槽组成的运动副。 3)螺旋副:两构件在接触处只允许作—定关系的转动和移动的复合运动。丝杠与螺母组成的运动副。 2.高副:高副是两构件之间作点或线接触的运动副。 二、自由度 —个作空间运动的构件具有六个独立的运动,即沿X、Y、Z轴的移动和绕X、Y、Z轴的转动,构件的这种独立的运动称为构件的自由度。 一个作平面运动的自由构件,可以产生三个独立运动,即沿X、Y、Z轴的移动及绕A点(极点)的转动,所以具有三个自由度。 (a)转动副(b) 移动副(c) 螺旋副 图6—1 (a)(b) (c) 图6—2
当两个作平面运动的构件组成运动副之后,由于受到约束,相应的自由度也随之减少。转动副约束了沿X、Y轴向移动的自由度,保留了—个转动的自由度。移动副约束了沿一轴方向的移动和在平面内两个转动自由度,保留了沿另—轴方向移动的自由度。高副则只约束了沿接触处公法线方向移动的自由度,保留了绕接触处的转动和沿接触处共切线方向移动的两个自由度。 所以在平面机构中,每个低副引入两个约束,使构件失去两个自由度。 每个高副引入一个约束,使构件失去一个自由度。 三、平面机构的运动简图 绘制平面机构运动简图的目的 绘制平面机构运动简图的目的在于:撇开与机构运动无关的外部形态,把握机构运动性质的内在联系,揭示机构的运动规律和特性。 机构的相对运动只与运动副的数目、类型、相对位置及某些尺寸有关,而与构件的横截面尺寸、组成构件的零件数目、运动副的具体结构无关。 用线条表示构件,用简单符号表示运动副的类型,按一定比例确定运动副的相对位置及与运动有关的尺寸,这种简明表示机构各构件运动关系的图形称机构运动简图。 只表示机构的结构及运动情况,不严格按比例绘制的简图称为机构示意图。
基础化学试题及答案
填空选择3 1、下列各组物质可能共存的是( A )。 A..Cu2+、Fe2+、Sn4+、Ag B. Cu2+、Fe2+、Ag+、Fe C Cu2+、Fe3+、Ag+、Fe D Fe3+、Fe2+、Sn4+、I- 2、通常配制FeSO4溶液时,加入少量铁钉,其原因与下列反应中的哪一个无关?(D) A.O2(aq)+4H+(aq)+4e==2H2O(l) B. Fe3+(aq)+e== Fe2+(aq) C. Fe(s)+2Fe3+(aq)==3 Fe2+(aq) D. Fe3+(aq)+3e== Fe(s) 3、已知Φ°(Fe3+/ Fe2+)=0.771V,K稳(Fe(CN)63-)=1.0×1042,K稳(Fe(CN)64-)=1.0×1035,则Φ°Fe(CN)63-/ Fe(CN)64-)=(A)。 A、0.36V B、1.19V C、-0.36V D、0.77V 4、若两电对在反应中电子转移分别为1和2,为使反应完成程度达到99.9%,两电对的条件电势之差ΔΦ°至少应大于(B)。 A、0.09V B、0.27V C、0.36V D、0.18V 5、影响氧化还原反应方向的因素有( B )。 A、压力 B、温度 C、离子强度 D、催化剂 6、在1 mol·L-1 H2SO4介质中,Φ°(Ce4+/ Ce3+)=1.44VΦ°,(Fe3+/ Fe2+)=0.65V,以Ce4+滴定Fe2+时,最适宜的指示剂为(B)。 A、二苯胺碘酸纳[Φ°(In)=0.84V] B、邻二氮菲-亚铁[Φ°(In)=1.06V] C、硝基邻二氮菲-亚铁[Φ°(In)=1.25V] D、邻苯氨基苯甲酸[Φ°(In)=0.89V] 7、用K2Cr2O7法测定Fe时,若SnCl2量加入不足,则导致测定结果(B)。 A、偏高 B、偏低 C、不变 D、无法判断 8、碘量法要求在中性或弱酸性介质中进行滴定,若酸度太高,将会(D)。 A、反应不定量 B、I2易挥发 C、终点不明显 D、I-被氧化,Na2S2O3被分解 9、标定Na2S2O3的基准物是下述哪一种?( B ) A、H2C2O4·H2O B、K2Cr2O7 C、As2O3 D、Fe 10、用KMnO4滴定Fe2+之前,加入几滴MnSO4的作用是( A )。 A、催化剂 B、诱导反应剂 C、氧化剂 D、配合剂 11、用法扬司法测定Cl-时,用曙红为指示剂,分析结果会(B)。 A、偏高 B、偏低 C、准确 12、在PH=4时,用莫尔法测定Cl-时,分析结果会(A)。 A、偏高 B、偏低 C、准确 13、化合物Ag2CrO4在0.001 mol·L-1的AgNO3溶液中的溶解度比在0.001 mol·L-1的K CrO4液中的溶解度( B )。 A、较大 B、较小 C、一样 14、常温下,AgCl的溶度积为1.8×10-10,Ag2CrO4的溶度积为1.1×10-12,,CaF2的溶度积为 2.7×10-11,(1)三种物质中溶解度最大的是(C),(2)三种物质中溶解度最小的是(A) A、AgCl B、Ag2CrO4 C、CaF2 15、在沉淀形成过程中,与待测离子的半径相近的杂质离子常与待测离子一道与构晶离子形成( B )。 A、吸留形成 B、混晶形成 C、包藏形成 D、后形成 16、将黄铁矿分解后,其中的硫沉淀为BaSO4,若以BaSO4的量换算黄铁矿中FeS2的铁量,则换算因素为(C)。 A、2M(FeS2)/M(BaSO4) B、M(FeS2)/M(BaSO4) C、M(FeS2)/2M(BaSO4)
轴机械基础电子教案
轴机械基础电子教案 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
机械基础电子教案(2学时) 第8章支承零部件 8.1 轴 [课程名称] 轴 [教材版本] 栾学钢主编。机械基础(多学时)。北京:高等教育出版社,2010 栾学钢主编。机械基础(少学时)。北京:高等教育出版社,2010 [教学目标与要求] 一、知识目标 1、了解轴的结构、分类、常用材料。 2、理解轴上零件的轴向和周向固定方法,熟悉轴的结构工艺性。 二、能力目标 1、能够合理选择轴的材料。 2、能够正确分析轴上结构设计的目的。 三、素质目标 1、了解轴的功用和轴的常用材料。 2、能结合实际分析轴上各结构的功用。 四、教学要求 1、熟悉传动轴、心轴和转轴的区别,及轴的常用材料。 2、了解轴上零件的轴向和周向固定方法,及结构工艺性。
[教学重点] 1、直轴的分类、功用和轴的常用材料。 2、轴的结构要求及轴向和周向固定方法。 [难点分析] 轴上零件的固定方法,特别是结构工艺性。 [教学方法] 讲授法、实物教具演示、互动法、归纳法 [学生分析] 1、学生的实际知识较少,对于轴上零件的固定方法不易理解,尤其是结构工艺性更难懂,教学时应当配以课件或加工实况、实物,或生产安装的教学录像帮助学生理解轴的结构。 [教学资源] 1、机械基础网络课程。北京:高等教育出版社,2010 2、吴联兴主编。机械基础练习册。北京:高等教育出版社,2010 3、课件、教具、实物。 [教学安排] 教学步骤:讲授与教具或实物演示交叉进行,配以课件或加工实况录像,穿插互动、提问与设问,最后小结。2学时(90分钟) [教学过程] 一、导入新课(10分钟) 机械零件是组成及其的最基本单元,生产中必须按图纸的工艺要求生产出每一个合格零件,然后再组装成构件和机器。因此必须熟悉常用零件的功用、结构特点和加
化学电子版教案(第一到第三单元)
绪言 化学使世界变得更加绚丽多彩 同学们,知道我在这节课学习什么学科吗? 对!化学,其实化学对于我们大家一点都不陌生.知道全世界最高的科学奖项是什么吗? 诺贝尔奖! 对!非常正确.可是,大家可能还不知道,诺贝尔本身是一个化学家. 同学们油然起敬. 有的同学心里在想,那化学它研究那些东西呢? 同学们作思考状. 稍作停顿,我们初中化学就像一幢12层楼的房子(12单元). 同学们马上翻书. 孩子们,当我们从妈妈的肚子钻出来,来到这个世界上,所做的第一件事是什么? 是哭! 为什么哭呢? 茫然. 原来呀,当我们一来到这个地球上,不小心吸了一大口物质,但我们又不知道那是什么,于是我们就被吓哭了. 笑. (1)我们吸的第一种物质是什么呢? 空气! 空气的成分是什么?是一种物质,还是多种物质呢? 茫然. 还有,我们知道水是生命之源,我们每天要喝的水是由什么组成的呢?化学要研究的物质的组成. (2)现在我告诉你,等到我们学习到第六单元的时候,你们就知道:你妈妈戴的钻戒和我们的铅笔芯的组成,是一模一样的,那孩子们,你愿意拿妈妈的钻戒来老师这里换大把的铅笔吗? 笑摆头. 既然钻戒和铅笔芯的组成相同,它们的价值为什么有这么大的差异呢?以后我们会知道:原来它们的结构不相同,化学要研究物质的结构. (3)在医院里危重病人都要立即进行输氧,为什么医生没有给病人输煤气呢? 笑. 原来呀,氧气才能供给呼吸,而煤气有毒,会使人中毒死亡,化学要研究物质的性质. (4)我们观察一下就不难发现,在我们家里用途最广的金属是铁,它是怎样从铁矿石中冶炼出来的呢?在我们使用的过程中又很容易出现什么现象呢? 生锈! 物质的变化是化学要研究的. 一、化学的研究对象:物质(既要研究自然界中本来就存在的物质,例如空气,水。还要研究自 然界中本来不存的的物质,例如衣服,我们的祖先……,火,祖先先吃生肉后发现钻木取火)那我们究竟研究物质的什么呢? 二、什么是化学 化学是在分子和原子的层次上研究物质的组成、结构、性质以及变化规律的一门科学。 三、化学的发展史 1、古代化学 火——孔雀石——陶器——铜器——造纸——火药——酒——染料等 2、近代化学 (1)道尔顿和阿伏加德罗创立的的原子论和分子学说奠定了近代化学的基础,使化学成为一门独立的科学。 (2)原子论和分子学说的内容:物质是由原子和分子构成分子的破裂和原子的重新组合是化学变化的基础。 (3)1869年,俄国的化学家门捷列夫发现了元素周期律并编制出元素周期表,物质的种类繁多(3000多种) 但组成物资的基本成分是元素只有100多种,初中阶段只需记住32种元素即可。 3、现代化学 (1 )高科技——纳米技术 (2)绿色化学又叫环境友好化学,其核心就是使更多的化学生产工艺和产品向着环境友好的发展。 教科书62页
机械基础《常见热处理》电子教案
项目二常见热处理 课题常见热处理 【教学目标与要求】 一、知识目标 1. 掌握退火、正火、淬火和回火的含义和不同点。 二、能力目标 1)能够掌握退火、正火、淬火和回火的工艺区别及其对钢性能的影响。 2)理解钢的常见热处理工艺的应用。 三、素质目标 了解热处理对金属材料性能的影响。 四、教学要求 1)熟悉热处理对金属材料性能的影响。 2)熟悉退火、正火、淬火和回火的含义及热处理工艺的区别和应用场合。 3)了解表面淬火的目的和常用方法。 【教学重点】 1)退火、正火、淬火和回火的工艺区别及性能特点。 2)表面热处理的作用和常用方法。 【难点分析】 加热温度和保温冷却方式的变化为什么会对金属材料的性能产生大的影响?
【分析学生】 回火的工艺区别学生不好理解,需要将加热最高温度、保温时间和冷却速度三个方面来比较它们之间的不同。 【教学思路设计】 1)突出热处理的目的及回火的工艺区别。 2)表面淬火是提高材料表面硬度的主要方法,要记住常用的淬火方法。 【教学安排】 2学时(80分钟) 【教学过程】 一、钢的热处理 热处理是对金属材料采用适当的方式进行加热、保温和冷却,以获得所需要的性能的工艺。钢经过热处理后,能有效地改善使用性能和工艺性能,提高产品的质量,延长使用寿命。如菜刀、斧子加热后速放入水中冷却可以提高刃口的硬度和耐磨性,使刃口变得锋利。 钢的热处理分为整体热处理和表面热处理两类。整体热处理可以分为退火、正火、淬火和回火。 1. 退火 将钢件加热到适当温度并保持一定时间,然后缓慢冷却的工艺称为退火。例如,用45钢制造的齿轮加热到830 C左右,然后在炉中缓慢冷却,可消除锻造成形产生的内应力,细化晶粒,降低硬度,为切削加工创造条件。
医用化学基础试题(答案)
2015级《医用化学基础》期末考试试题答案 班级:学号:姓名:成绩: 注:H 1, C 12, N 14, O 16, Na 23, Mg 24 S 32, Cl 35.5 1. 最稳定原子的最外层含有 A 4个电子B6个电子 C 8个电子 D 18个电子 2. K 和K+在下列各项中相同的是 A 电荷数 B 电子数 C 质子数 D 性质 3.下列原子中,原子半径最大的是 A Li B Be C N D C 4. n个电子层可能有的最多电子数为 A n B 2n C n2 D 2n2 5. 摩尔是 A 物质的质量单位 B 微粒个数单位 C 6.02×1023个微粒集体 D “物质的量”的单位 6.下列说法正确的是 A 摩尔是一个基本物理量 B 水的摩尔质量是18 C 1mol H2的质量是2 g D 1mol O的质量是32g 7. 同温、同压下,物质的量相同的两种气体具有相同的 A 体积 B 质量 C 原子个数 D 密度 8 .1g下列气体在标准状况下占体积最大的是 A N2 B NH3 C Cl2 D CO2 9 .Na的摩尔质量是 A 23 B 23 g C 23 mol D 23 g/mol 10. 500ml生理盐水的质量浓度为 A 9 g/L B 0.9 g/L C 4.5 g/L D 45 g/L 11.下列物质中,物质的量为0.2mol的是 A 2.2 g CO2 B 3.6 g HO2 C 3.2 g O2 D 49 g H2SO4 12.与溶液渗透压大小有关的因素是 A 溶质的性质B溶质的颗粒总数 C 溶剂的性质D溶质颗粒的大小 13.溶液在稀释前后,下列哪一项保持不变 A 溶质的体积 B 溶质的量C溶液的浓度D溶剂的量 14. 5.3g Na2 CO3可配制0.1mol/L的溶液()毫升 A 100 B 500 C 1000 D 2000 15. 下列物质属于强电解质的是 A 氨水 B 醋酸 C 硫酸 D 水 16. 医学中用乙醇作消毒剂,杀菌效果最好的浓度是 A 95% B 75% C 60% D 50% 17. 同一系列的所有化合物 A 具有相同的分子式 B 仅有两种元素 C 具有相同的物理性质 D 具有相同的通式和相似的结构 18.苯的硝化反应属于
基础生物化学练习题
基础生物化学练习题 类型一、英文缩写缩写符号翻译为中文名称 Tm;EMP;TPP;FAD;Met;UDPG;NADP+;.SSB;.TCA;ACP;Gly;. PPP;NAD+;FAD;Glu;UDPG;ATP;PRPP;TCA;CoASH;Asp;FMN;dATP;BCCP;PEP;GSH ;CoA-SH ;Km ;Cyt C;Gln;FAD;cAMP;BCCP ;PI ;GSSG;ACP;Tm ;Cyt b;NADP+;FAD ;ADPG ;TPP ;mRNA ;cAMP;GSH ;ACP ;Ser;ATP;FMN;UDPG;ACP;tRNA;GSH;Km;TPP;FH4 ;UDPG;ACP ;dGTP;.cAMP;Ser;CAP;fMet;TPP;EMP;GSH;dA TP;cAMP;Trp;DNFB 。 类型二、解释下列名词 酰胺平面;变构效应;全酶;诱导酶;生物氧化;转氨基作用;SD序列;不对称转录;氨基酸的等电点;必需氨基酸;别构效应;高能化合物;酶原激活;解链温度(Tm);冈崎片段;中心法则;肽键;盐析;核酸的Tm值;增色效应;同工酶;联合脱氨基作用;脂肪酸的β—氧化;不对称转录;操纵子;氨基酸的pI;EMP途径;酶原;生物氧化;半保留复制;转氨基作用;逆转录;酶原激活;蛋白质的超二级结构;最适温度;三羧酸循环;转氨基作用;酶的共价修饰;中心法则;电子传递链;酶原;蛋白质结构域;最适PH;糖酵解;肽键;半不连续复制;冈崎片段;简并性;呼吸链;氨基酸的等电点;变构酶;DNA变性;不饱和脂肪酸;电泳;氧化磷酸化;肽平面;蛋白质的一级结构;增色效应;退火;核苷酸;必需脂肪酸;前导链;底物水平磷酸化;酶;电子传递链;蛋白质的α-螺旋;糖酵解;转氨基作用;翻译;生物氧化;蛋白质的二级结构;解偶联剂;核苷酸;变构酶;Km值;氧化磷酸化作用;生糖氨基酸;暗修复作用;多核糖体;肽键;透析;糖异生作用;蛋白质的构型;单体酶和单纯酶;操纵子;共价调节酶;前馈激活;底物水平磷酸化。 类型三、填空题 1构成蛋白质20种常见的氨基酸中,没有旋光性的是,中性pH下带负电荷的是和。 2. 维持蛋白质二级结构的作用力主要是。 3. tRNA的二级结构是四环四臂的型,它的三级结构呈倒型。 4.蛋白质溶液在nm附近有最大吸收峰,核酸溶液在nm附近有最大吸收峰。 5.催化相同的化学反应,但酶蛋白的分子结构及化学组成不同的一组酶称为。 6.ATP的产生有主要两种方式,一种是___ _____ _,另一种是。 7.脂肪酸的β氧化主要发生在(哪种细胞器)中,脂肪酸活化是ATP水解成和提供能量合成脂酰辅酶A,脂肪酸的β氧化的产物是乙酰CoA,氢的受体为NAD+和。 8. DNA复制时,连续合成的链称为________链;不连续合成的链称为_______链。 9. 核酸通过密码子编码氨基酸,每3个核苷酸编码一个氨基酸。64个密码中,其中起始密 码子是,终止密码子有UAA,UAG和。 10. 在电镜下观察蛋白质合成时有多个核糖体在同一条mRNA同时合成蛋白,这一结构被称 为。 11.构成蛋白质20种常见的氨基酸中,唯一的亚氨基酸的是,含有硫的氨基酸是
