MicroRNA调节蛋白表达paper
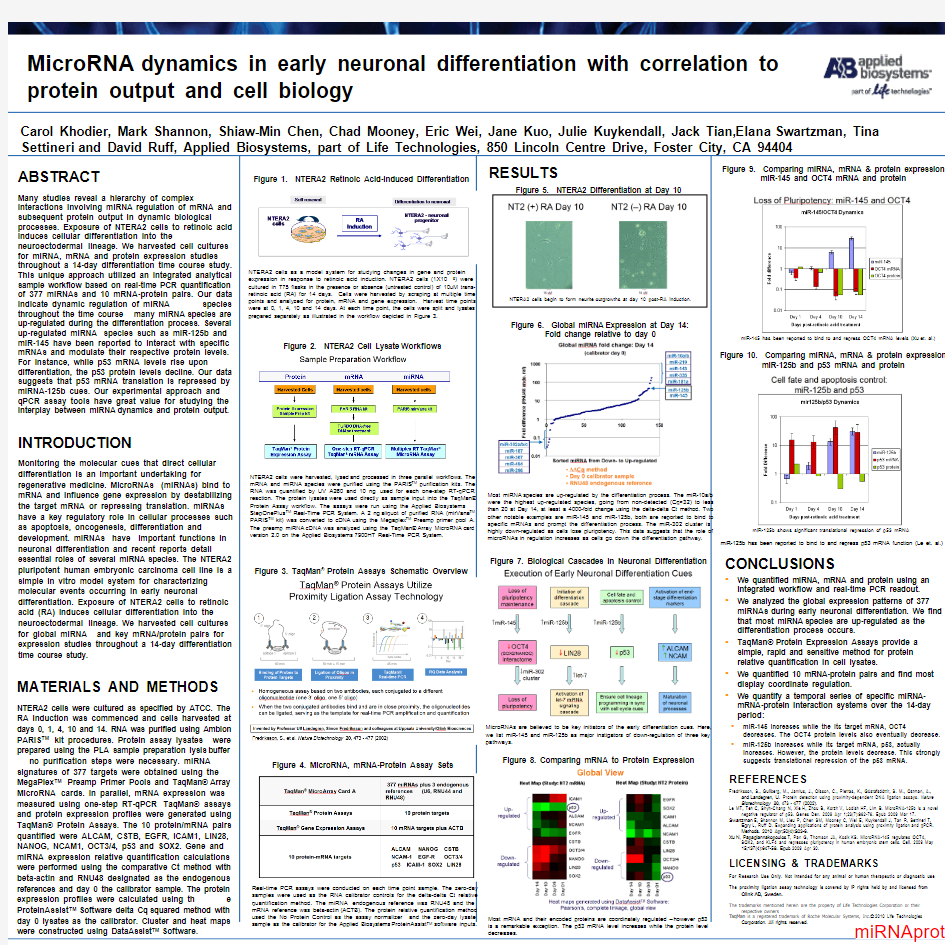
ABSTRACT
Many studies reveal a hierarchy of complex
interactions involving miRNA regulation of mRNA and
subsequent protein output in dynamic biological
processes. Exposure of NTERA2 cells to retinoic acid
induces cellular differentiation into the
neuroectodermal lineage. We harvested cell cultures
for miRNA, mRNA and protein expression studies
throughout a 14-day differentiation time course study.
This unique approach utilized an integrated analytical
sample workflow based on real-time PCR quantification
of 377 miRNAs and 10 mRNA-protein pairs. Our data
indicate dynamic regulation of miRNA species
throughout the time course –many miRNA species are
up-regulated during the differentiation process. Several
up-regulated miRNA species such as miR-125b and
miR-145 have been reported to interact with specific
mRNAs and modulate their respective protein levels.
For instance, while p53 mRNA levels rise upon
differentiation, the p53 protein levels decline. Our data
suggests that p53 mRNA translation is repressed by
miRNA-125b cues. Our experimental approach and
qPCR assay tools have great value for studying the
interplay between miRNA dynamics and protein output.
REFERENCES
Fredriksson, S., Gullberg, M., Jarvius, J., Olsson, C., Pietras, K., Gústafsdóttir, S. M., ?stman, A.,
and Landegren, U.Protein detection using proximity-dependent DNA ligation assays. Nature
Biotechnology20, 473 -477 (2002).
Le MT, Teh C, Shyh-Chang N, Xie H, Zhou B, Korzh V, Lodish HF, Lim B. MicroRNA-125b is a novel
negative regulator of p53. Genes Dev. 2009 Apr 1;23(7):862-76. Epub2009 Mar 17.
Swartzman E, Shannon M, Lieu P, Chen SM, Mooney C, Wei E, Kuykendall J, Tan R, Settineri T,
Egry L, Ruff D. Expanding applications of protein analysis using proximity ligation and qPCR.
Methods. 2010 Apr;50(4):S23-6.
Xu N, Papagiannakopoulos T, Pan G, Thomson JA, Kosik KS. MicroRNA-145 regulates OCT4,
SOX2, and KLF4 and represses pluripotency in human embryonic stem cells. Cell. 2009 May
15;137(4):647-58. Epub2009 Apr 30.
LICENSING & TRADEMARKS
For Research Use Only.Not intended for any animal or human therapeutic or diagnostic use
The proximity ligation assay technology is covered by IP rights held by and licensed from
Olink AB, Sweden.
The trademarks mentioned herein are the property of Life Technologies Corporation or their
respective owners
TaqMan is a registered trademark of Roche Molecular Systems, Inc.?2010 Life Technologies
Corporation. All rights reserved.
Figure 9. Comparing miRNA, mRNA & protein expression
miR-145 and OCT4 mRNA and protein
CONCLUSIONS
?We quantified miRNA, mRNA and protein using an
integrated workflow and real-time PCR readout.
?We analyzed the global expression patterns of 377
miRNAs during early neuronal differentiation. We find
that most miRNA species are up-regulated as the
differentiation process occurs.
?TaqMan?Protein Expression Assays provide a
simple, rapid and sensitive method for protein
relative quantification in cell lysates.
?We quantified 10 mRNA-protein pairs and find most
display coordinate regulation.
?We quantify a temporal series of specific miRNA-
mRNA-protein interaction systems over the 14-day
period:
?miR-145 increases while the its target mRNA, OCT4
decreases. The OCT4 protein levels also eventually decrease.
?miR-125b increases while its target mRNA, p53, actually
increases. However, the protein levels decrease. This strongly
suggests translational repression of the p53 mRNA. MicroRNA dynamics in early neuronal differentiation with correlation to
protein output and cell biology
Carol Khodier, Mark Shannon, Shiaw-Min Chen, Chad Mooney, Eric Wei, Jane Kuo, Julie Kuykendall, Jack Tian,Elana Swartzman, Tina
Settineri and David Ruff, Applied Biosystems, part of Life Technologies, 850 Lincoln Centre Drive, Foster City, CA 94404
INTRODUCTION
Monitoring the molecular cues that direct cellular
differentiation is an important undertaking for
regenerative medicine. MicroRNAs(miRNAs) bind to
mRNA and influence gene expression by destabilizing
the target mRNA or repressing translation. miRNAs
have a key regulatory role in cellular processes such
as apoptosis, oncogenesis, differentiation and
development. miRNAs have important functions in
neuronal differentiation and recent reports detail
essential roles of several miRNA species. The NTERA2
pluripotent human embryonic carcinoma cell line is a
simple in vitro model system for characterizing
molecular events occurring in early neuronal
differentiation. Exposure of NTERA2 cells to retinoic
acid (RA) induces cellular differentiation into the
neuroectodermal lineage. We harvested cell cultures
for global miRNA and key mRNA/protein pairs for
expression studies throughout a 14-day differentiation
time course study.
Figure 8. Comparing mRNA to Protein Expression
Figure 1. NTERA2 Retinoic Acid-induced Differentiation
Figure 7. Biological Cascades in Neuronal Differentiation
Most miRNA species are up-regulated by the differentiation process. The miR-10a/b
were the highest up-regulated species, going from non-detected (Cq>32) to less
than 20 at Day 14, at least a 4000-fold change using the delta-delta Ct method. Two
other notable examples are miR-145 and miR-125b, both are reported to bind to
specific mRNAs and prompt the differentiation process. The miR-302 cluster is
highly down-regulated as cells lose pluripotency. This data suggests that the role of
microRNAs in regulation increases as cells go down the differentiation pathway.
Figure 4. MicroRNA, mRNA-Protein Assay Sets
MicroRNAs are believed to be key initiators of the early differentiation cues. Here,
we list miR-145 and miR-125b as major instigators of down-regulation of three key
pathways.
MATERIALS AND METHODS
NTERA2 cells were cultured as specified by ATCC. The
RA induction was commenced and cells harvested at
days 0, 1, 4, 10 and 14. RNA was purified using Ambion
PARIS TM kit procedures. Protein assay lysates were
prepared using the PLA sample preparation lysis buffer
–no purification steps were necessary. miRNA
signatures of 377 targets were obtained using the
MegaPlex TM Preamp Primer Pools and TaqMan?Array
MicroRNA cards. In parallel, mRNA expression was
measured using one-step RT-qPCR TaqMan?assays
and protein expression profiles were generated using
TaqMan?Protein Assays. The 10 protein/mRNA pairs
quantified were ALCAM, CSTB, EGFR, ICAM1, LIN28,
NANOG, NCAM1, OCT3/4, p53 and SOX2. Gene and
miRNA expression relative quantification calculations
were performed using the comparative Ct method with
beta-actin and RNU48 designated as the endogenous
references and day 0 the calibrator sample. The protein
expression profiles were calculated using th e
ProteinAssist TM Software delta Cq squared method with
day 0 lysates as the calibrator. Cluster and heat maps
were constructed using DataAssist TM Software.
NTERA2 cells as a model system for studying changes in gene and protein
expression in response to retinoic acid induction. NTERA2 cells (1X106) were
cultured in T75 flasks in the presence or absence (untreated control) of 10uM trans-
retinoic acid (RA) for 14 days. Cells were harvested by scraping at multiple time
points and analyzed for protein, mRNA and gene expression. Harvest time points
were at 0, 1, 4, 10 and 14 days. At each time point, the cells were split and lysates
prepared separately as illustrated in the workflow depicted in Figure 3.
Figure 2. NTERA2 Cell Lysate Workflows
Figure 5. NTERA2 Differentiation at Day 10
NTERA2 cells begin to form neurite outgrowths at day 10 post-RA induction.
NTERA2 cells were harvested, lysed and processed in three parallel workflows. The
mRNA and miRNA species were purified using the PARIS TM purification kits. The
RNA was quantified by UV A260 and 10 ng used for each one-step RT-qPCR
reaction. The protein lysates were used directly as sample input into the TaqMan?
Protein Assay workflow. The assays were run using the Applied Biosystems
StepOnePlus TM Real-Time PCR System. A 2 ng aliquot of purified RNA (mirVana TM
PARIS TM kit) was converted to cDNA using the Megaplex TM Preamp primer pool A.
The preamp miRNA cDNA was analyzed using the TaqMan?Array MicroRNA card
version 2.0 on the Applied Biosystems7900HT Real-Time PCR System.
Figure 3. TaqMan?Protein Assays Schematic Overview
RESULTS
Real-time PCR assays were conducted on each time point sample. The zero-day
samples were used as the RNA calibrator controls for the delta-delta Ct relative
quantification method. The miRNA endogenous reference was RNU48 and the
mRNA reference was beta-actin(ACTB). The protein relative quantification method
used the No Protein Control as the assay normalizer and the zero-day lysate
sample as the calibrator for the Applied Biosystems ProteinAssist TM software inputs.
Figure 6. Global miRNA Expression at Day 14:
Fold change relative to day 0
Figure 10. Comparing miRNA, mRNA & protein expression
miR-125b and p53 mRNA and protein
Most mRNA and their encoded proteins are coordinately regulated –however p53
is a remarkable exception. The p53 mRNA level increases while the protein level
decreases.
miR-145 has been reported to bind to and repress OCT4 mRNA levels (Xu et. al.)
miR-125b has been reported to bind to and repress p53 mRNA function (Le et. al.)
miR-125b shows significant translational repression of p53 mRNA
miRNAprot
蛋白质泛素化研究进展—探索蛋白修饰的秘密
蛋白质泛素化研究进展——探索蛋白修饰的秘密 泛素是一种含76个氨基酸的多肽,存在于除细菌外的许多不同组织和器官中,具有标记待降解蛋白质的功能。被泛素标记的蛋白质在蛋白酶体中被降解。由泛素控制的蛋白质降解具有重要的生理意义,它不仅能够清除错误的蛋白质,还对细胞周期调控、DNA修复、细胞生长、免疫功能等都有重要的调控作用。 2004年,以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose就因发现泛素调节的蛋白质降解而被授予2004年诺贝尔化学奖。正是因为泛素调节的蛋白质降解在生物体中如此重要,因而对它的开创性研究也就具有了特殊意义。目前,在世界各地的很多实验室中,科学家不断发现和研究与这一降解过程相关的细胞新功能。现在,研究人员已发现泛素具有多种非蛋白水解功能,包括参与囊泡转运通路、调控组蛋白修饰以及参与病毒的出芽过程等。 鉴于蛋白质降解异常与许多疾病,例如癌症、神经退行性病变以及免疫功能紊乱的发生密切相关,而基因的功能是通过蛋白质的表达实现的,因此,泛素在蛋白质降解中的作用机制如能被阐明将对解释多种疾病的发生机制和遗传信息的调控表达有重要意义。 《生命奥秘》本月专题将介绍泛素系统的来源、研究进展,并重点介绍以“泛素-蛋白酶”为靶位的抗癌疗法,希望能给相关领域的研究人员带来崭新的思路。 一、泛素样蛋白的来源及功能 1. 泛素样蛋白及其相关蛋白结构域 2. 泛素样蛋白连接后的结果 3. 泛素样蛋白修饰途径的起源 4. 前景展望 二、泛素化途径与人体免疫系统调节 1. 泛素修饰途径与NF-κB信号通路的关系 2. 泛素蛋白在天然免疫中的作用 3. 泛素化修饰途径在获得性免疫机制中的作用
(完整版)泛素化蛋白检测方法
泛素化蛋白检测方法 蛋白质泛素化简介蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76 个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3 酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7 个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48 位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63 位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB )将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD )所 识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90 种DUB 酶和20 种UBD ,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。E3 酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT 结构域的E3 酶和其它含有RING 结构域或RING 样结构域(比如U-box 或PHD 结构域)的E3 酶。这两种E3 酶都在免疫调控过程中起到了关键性的作用。 蛋白质泛素化的检测方法研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是 如何发生泛素化的,影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3 酶是什么? 然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应?对下游
泛素化蛋白检测方法[精华]
泛素化蛋白检测方法[精华] 泛素化蛋白检测方法 , 蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB)将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD)所识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。E3酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT结构域的E3酶和其它含有RING结构域或RING样结构域(比如U-box或PHD结构域)的E3酶。这两种E3酶都在免疫调控过程中起到了关键性的作用。 , 蛋白质泛素化的检测方法
研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么,或者说这一过程中的E3酶是什么, 然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应,对下游的信号通路有什么影响, 研究上述内容的实验方法和实验流程: 方法一:western blot and strip 通过WB检测所有发生泛素化的蛋白条带,拍照后,将膜strip。然后与特定蛋白的抗体和特定泛素化位点的抗体反应,显色拍照。通过阳性条带的对比来初步判断某一特定蛋白的特定位点发生了泛素化。【具体实验流程附后】方法二:western blot and immunoprecipitations 通过免疫共沉淀方法将某一特定蛋白以及与其结合的蛋白分离出来。分离出来的蛋白再进行SDS电泳和western blot分析。【具体实验流程附后】。这一方法可以明确具体哪个蛋白的哪个赖氨酸残基发生了泛素化修饰。 方法三:in vitro ubiquitination assay 将要研究的目的基因转染293细胞,使其大量表达。24h后提取并分离目的蛋白。在体外反应buffer中将我们要研究的蛋白A(被泛素化的那个蛋白)与UBE1,UbeH13-Uev 1 a heterodimer complex ,HA-ubiquitin以及我们要研究的蛋白 B(引起蛋白A泛素化的蛋白),共同进行孵育。将孵育后的产物进行IP和WB分析。【具体实验流程附后】。这一方法可以明确引起哪个蛋白是引起某蛋白发生泛素化修饰的E3连接酶。 方法四:in vitro ubiquitin-binding assay
泛素化蛋白检测办法
精心整理 泛素化蛋白检测方法 ● 蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶7个赖氨蛋白链(位赖氨酸)将泛素E2酶、600种E3E3E3E3酶都● 影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3酶是什么? 然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应?对下游的信号通路有什么影响? 研究上述内容的实验方法和实验流程: 方法一:westernblotandstrip 通过WB 检测所有发生泛素化的蛋白条带,拍照后,将膜strip 。然后与特定蛋白的抗体和特定泛素化位点的抗体反应,显色拍照。通过阳性条带的对比来初步判断某一特定蛋白的特定
位点发生了泛素化。【具体实验流程附后】 方法二:westernblotandimmunoprecipitations 通过免疫共沉淀方法将某一特定蛋白以及与其结合的蛋白分离出来。分离出来的蛋白再进行SDS电泳和westernblot分析。【具体实验流程附后】。这一方法可以明确具体哪个蛋白的哪个赖氨酸残基发生了泛素化修饰。 方法三:invitroubiquitinationassay 将要研究的目的基因转染293细胞,使其大量表达。24h后提取并分离目的蛋白。在体外反应buffer中将我们要研究的蛋白A(被泛素化的那个蛋白)与UBE1, A泛 。 SDS电
泛素化蛋白检测方法
泛素化蛋白检测方法 ●蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB)将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD)所识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。E3酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT结构域的E3酶和其它含有RING结构域或RING样结构域(比如U-box或PHD结构域)的E3酶。这两种E3酶都在免疫调控过程中起到了关键性的作用。 ●蛋白质泛素化的检测方法 研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3酶是什么?
恶性肿瘤骨转移的临床诊疗
恶性肿瘤骨转移的临床诊疗 恶性肿瘤骨转移的临床诊疗 2010年12月02日 自1980年代以来,姑息疗法已经成为一个独立的教育项目。中国姑息治疗的发展开始于1990年代早期。在过去的18年中,我们目睹了姑息治疗越来越多的资源分配,姑息疗法学术地位的建立,以及越来越多地关注并意识到姑息治疗在社会上的普遍需要。因此中国的医生提出了关于恶性肿瘤骨转移及骨相关并发症临床诊断与治疗的一些原则。为了与全世界分享我们的经验,经过了两年的准备,姑息治疗领域最高水平的专家联合撰写了这份关于恶性肿瘤骨转移及骨相关并发症临床诊断与治疗的共识。该综述不仅包括了世界上的进展,还提供了第一手的临床资料,特别是关于TCM与西医学结合的经验。我们希望这篇共识的发表能为姑息疗法在这一领域的发展做出贡献,从而使广大患者受益。(孙燕) 恶性肿瘤骨转移及骨相关疾病临床诊疗专家共识 恶性肿瘤骨转移的临床诊疗 概况 在晚期恶性肿瘤中骨组织是转移的常见部位。不断改善的恶性肿瘤治疗方法能有效延长生存时间,同时也增加了骨组织转移及骨骼系统并发症的发生率。在乳腺癌、肺癌、前列腺癌、胃癌、肾癌、甲状腺癌、子宫颈癌、骨和软组织癌等癌症患者中均常出现恶性骨转移。进行性恶性肿瘤骨转移的发生率为:乳腺癌65%-75%前列腺癌65%-75%鼻咽癌67%-75%肺癌30%-40%甲状腺癌60%黑色素瘤14%-45%肝癌13%-41%肾癌20%-25%结肠和直肠癌1%-7%胃癌13%及其它头颈部肿瘤25%[1-3]。70%-958的多发性骨髓瘤患者可能发展出骨相关疾病。 骨转移的确切机制目前还不清楚。当恶性肿瘤细胞转移至骨组织,会引发RANK/RANK系统失衡。目前这一现象被认为是骨组织破坏和转移的主要机制。恶性肿瘤细胞迁移至骨组织,释放溶骨介质,刺激成骨细胞和破骨细胞增生。激活的破骨
肿瘤侵袭和转移的恶性生物行为及分子干预
项目名称:肿瘤侵袭和转移的恶性生物行为及分子 干预 首席科学家:詹启敏中国医学科学院肿瘤医院肿瘤 研究所 起止年限:2009.1至2013.8 依托部门:教育部
一、研究内容1.细胞周期调控异常与肿瘤恶性增殖、侵袭相关分子机理 肿瘤是一种“细胞转导通路异常”性疾病,我们将通过分子生物学、细胞生物学、和动物模型相结合的研究技术,重点研究抑癌基因p53、BRCA1、Gadd45介导的信号通路与细胞周期蛋白Aurora-A、Cyclin B1、Plk1的相互作用,以及在细胞周期调控和肿瘤恶性表型形成中的生物学功能和分子机制。从而揭示细胞增殖失调与肿瘤侵袭转移的内在联系。 2.细胞凋亡和分化异常与肿瘤侵袭性生长的关系 细胞凋亡调控机制的异常与侵袭特性生长密切相关。促进细胞死亡的机制失活和抑制凋亡的分子的大量表达使癌症细胞存活延长,使基因突变的积累和癌变机会的增加,同时凋亡机制的异常导致肿瘤细胞具有抗药性。通过对细胞死亡新机制、肿瘤干细胞凋亡相关研究、细胞信号转导与凋亡调控等研究,深入探讨侵袭性生长的机制。 3.肿瘤干细胞和肿瘤微环境与肿瘤转移的内在关系 以恶性肿瘤干细胞特异性表型为突破口,从白血病干细胞延伸至实体瘤干细胞,研究其自我更新和分化的特性,探讨肿瘤转移的起始因素和关键分子生物学性质,认别恶性肿瘤干细胞与微环境或肿瘤“基质”间的相互作用机制,从而为特异性打击肿瘤干细胞作为彻底消除肿瘤转移潜能的一种新策略提供重要的理论基础。 4. 肿瘤血管和淋巴管新生介导的肿瘤转移机制 已鉴定肿瘤组织中血管表达Tim-3和淋巴管表达Sema4c等是沉默抗肿瘤免疫的重要活性分子,能通过与淋巴细胞的对话,诱导机体对肿瘤的免疫耐受,是
恶性肿瘤骨转移该如何治疗
恶性肿瘤骨转移该如何 治疗 Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
恶性肿瘤骨转移该如何治疗 全网发布:2011-06-23 21:36?发表者:?4378人已访问 骨是恶性肿瘤远处转移的好发部位之一。恶性肿瘤细胞转移至骨组织时,引起骨破坏和一系列的症状,最后导致病人生活质量的严重下降。转移性骨肿瘤出现骨痛可能与以下因素有关:(1)肿瘤细胞介导的化学物质刺激或细胞浸润,蔓延至骨膜或者扩散至神经组织而致持续性骨痛。(2)肿瘤的机械性压迫引起骨组织变薄所致;大的转移灶,骨皮质张力增加,引起骨痛。(3)骨转移癌灶部位炎症反应,炎症介质可激活和致敏关节感觉,从而招致疼痛加剧。在骨转移的治疗上要有以下认识:①恶性肿瘤病人出现骨转移是常见的现象;②骨转移产生的疼痛需要立即治疗;③单纯骨转移的病人生存期要长于内脏转移的病人;④骨转移病人症状的出现,要比肺转移及肝转移早,症状亦较之严重。 治疗上强调综合治疗,下面五种手段联合运用,环环相扣,相得益彰: (一) 药物治疗 疼痛的药物治疗应采取个体化按时给药的原则。给药途径有口服、通过皮肤、直肠、持续的皮下、静脉内注射和髓内注射方式。可合并使用抗药、皮质类固醇和抗惊厥药加强止痛疗效。根据原发肿瘤的生物学特征,可采用不同的化疗方案及激素治疗,如对乳腺癌、小细胞、恶性淋巴瘤、前列腺癌等所发生的骨转移,采用针对原发病灶治疗敏感的化疗方案,对骨转移灶也能起到治疗作用,而对激素类药物治疗有效的肿瘤,如乳腺癌、前列腺癌等应用内分泌治疗对骨转移灶也会有一定的疗效。双膦酸盐类药物如帕米膦酸二钠、唑来膦酸等是破骨细胞的强力抑制剂,抑制破骨细胞的活性并诱导破骨细胞凋亡,抑制破骨细胞及肿瘤细胞释放疼痛递质。孙辉等报道应用该类药物治疗骨转移瘤疼痛均达到80%以上的有效率。高钙血症会影响10%~40%的癌症患者。高钙血症的常见并发症状为厌食、恶
蛋白质的泛素化降解总结
仅作参考,如有抄袭,依法追究目录: 1.研究背景 2.泛素化降解途径 2.1泛素的基本结构 2.2泛素化的过程 2.3 E3酶对蛋白底物的识别 2.4 蛋白底物在26S蛋白酶体中的降解 3.研究的意义以及应用 4.研究展望
真核生物细胞中的蛋白质泛素化降解 摘要: 蛋白质是执行生命活动的基本分子,细胞中的蛋白质不断地处于合成、修饰与降解的代谢更新过程中。保持细胞正常的蛋白质代谢对于生命的正常功能至关重要。目前所知蛋白质的降解主要通过两种途径:溶酶体降解途径和泛素介导的蛋白酶体降解途径。溶酶体降解途径是一个非选择的蛋白质降解途径,主要降解通过摄粒作用或胞饮作用进入细胞内的外源蛋白质;而泛素介导的途径是一个受到严格的时空调控的特异性蛋白质降解途径。泛素系统广泛存在于真核生物中,是精细的特异性的蛋白质降解体系。泛素是一种序列保守的小分子蛋白质,蛋白质与泛素结合后,被蛋白酶体通过消耗ATP的方式降解。泛素系统由泛素、26S 蛋白酶体、多种酶(E1、E2、E3去泛素酶等)组成。其中E1和E2被称为泛素活化酶和泛素载体酶。泛素连接酶E3负责连接泛素与特异性底物,这样泛素化底物可以被26S蛋白酶体降解为若干肽段。泛素系统在真核生物中有非常重要的作用,通过降解蛋白质,调节细胞的分化、免疫,参与转录、分泌调控和细胞形成等,与人类的某些疾病有关。本文就泛素系统的组成、调控机制和研究进展做一介绍。 关键字:泛素系统;E3;26S蛋白酶体 正文: 1.研究背景 蛋白质在细胞内的降解是一个复杂的过程,但是又是一个高度有序的过程。真核生物中蛋白质的降解绝大多数都是由泛素系统完成。蛋白质首先是由泛素分子所特异性识别结合,在泛素分子的介导下,由泛素活化酶E1、泛素载体蛋白E2以及泛素连接酶E3特异性作用,与26S蛋白酶体作用,被切割成多肽。多聚泛素链可以还原成单体,循环使用。泛素与细胞的多种生命活动有关,例如细胞生长发育过程中组织抑制因子的选择性降解;细胞周期中,周期蛋白选择性降解等。许多疾病和泛素化的过程有关,利用泛素系统治疗疾病也成为了热点。 2.泛素蛋白酶系统 2.1泛素的基本结构 泛素是一种热稳定性蛋白,含有76个氨基酸,相对分子质量8.6kDa。结构保守,如图一是人和酵母细胞中泛素分子序列比对,我们可以看到,只有三个氨基酸的差别。 图一人和酵母的泛素分子序列比对
泛素化蛋白检测方法
泛素化蛋白检测方法 蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB)将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD)所识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB 酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。E3酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT结构域的E3酶和其它含有RING结构域或RING样结构域(比如U-box 或PHD结构域)的E3酶。这两种E3酶都在免疫调控过程中起到了关键性的作用。
蛋白质泛素化的检测方法 研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3酶是什么? 然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应?对下游的信号通路有什么影响? 研究上述内容的实验方法和实验流程: 方法一:western blot and strip 通过WB检测所有发生泛素化的蛋白条带,拍照后,将膜strip。然后与特定蛋白的抗体和特定泛素化位点的抗体反应,显色拍照。通过阳性条带的对比来初步判断某一特定蛋白的特定位点发生了泛素化。【具体实验流程附后】 方法二:western blot and immunoprecipitations 通过免疫共沉淀方法将某一特定蛋白以及与其结合的蛋白分离出来。分离出来的蛋白再进行SDS电泳和western blot分析。【具体实验流程附后】。这一方法可以明确具体哪个蛋白的哪个赖氨酸残基发生了泛素化修饰。 方法三:in vitro ubiquitination assay 将要研究的目的基因转染293细胞,使其大量表达。24h后提取并分离目的蛋白。在体外反应buffer中
肿瘤侵袭及转移
肿瘤侵袭及转移 北京大学医学部病理学系方伟岗良性肿瘤仅在原发部位生长扩大,而具有浸润性生长的恶性肿瘤,不仅可以在原发部位继续生长、蔓延(直接蔓延),而且还可以通过各种途径扩散到身体其他部位(转移)。肿瘤转移是恶性肿瘤最显著的生物学特性之一, 是临床肿瘤病人的主要死因. 一. 转移的基本概念: 肿瘤转移 (tumor metastasis) 是指肿瘤细胞脱离原发生长部位, 通过各种途径的转运, 在机体内远离原发部位的器官 / 组织继续增殖生长, 形成同样性质肿瘤 (转移瘤) 的过程. 在原发部位生长的肿瘤称为原发瘤(primary tumor),在远隔部位生长的肿瘤称为转移瘤(metastatic tumor).恶性肿瘤中,只有少数肿瘤不发生或很少发生转移,如皮肤的基底细胞癌、脑的恶性胶质细胞瘤。 肿瘤演进 (progression) 是经常遇到的一个概念, 它是指从良性肿瘤转变成恶性肿瘤所必须发生的一系列事件的综合, 至少包括: 失控性生长, 血管化, 抗药性, 浸润, 转移等. 浸润和转移是肿瘤演进的最后阶段. 二. 转移的基本过程: 肿瘤转移是一个复杂的多步骤连续过程, 其中至少包含以下步骤: 原发部位肿瘤细胞脱离原发瘤, 侵袭穿越基底膜并向周围间质浸润性生长, 穿越局部毛细血管 / 淋巴管壁进入管腔, 与血小板聚集或形成小瘤栓, 随血液 / 淋巴液运输到达靶器官毛细血管床, 与该部位的血管 / 淋巴管内皮细胞发生粘附, 穿越管壁和基底膜进入周围间质, 不断增殖形成转移瘤(图1). 肿瘤细胞的浸润 (invasion)是指肿瘤细胞脱离原发瘤, 侵袭穿越基底膜并向周围间质浸润性生长,但尚未进入局部毛细血管 / 淋巴管的阶段,和转移是相互联系的病理过程. 浸润是转移的前提, 但不一定发生转移; 而转移必定包括浸润过程. 三. 肿瘤转移的主要途径: 1.淋巴道转移: 淋巴道转移是癌转移的重要途径,少数肉瘤如滑膜肉瘤、恶性纤维组织细胞瘤也可发生淋
泛素化蛋白检测方法
泛素化蛋白检测方法 LG GROUP system office room 【LGA16H-LGYY-LGUA8Q8-LGA162】
泛素化蛋白检测方法 蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB)将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD)所识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。E3酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT结构域的E3酶和其它含有RING结构域或RING样结构域(比如U-box或PHD结构域)的E3酶。这两种E3酶都在免疫调控过程中起到了关键性的作用。 蛋白质泛素化的检测方法 研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3酶是什么? 然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应对下游的信号通路有什么影响
泛素化途径
这是一般蛋白质降解的一般泛素化途径,首先,在ATP供能的情况下,泛素的C末端与非特异性泛素激活酶E1的半胱氨酸残基共价结合,形成E1-泛素复合体。E1泛素复合体再将泛素转移给另一个泛素结合酶E2。E2则可以直接将泛素转移到靶蛋白赖氨酸残基的ε-氨基团上,在通常情况下,靶蛋白泛素化需要一个特异的泛素蛋白连接酶E3。当第一个泛素分子在E3的催化下连接到靶蛋白上以后,另外一些泛素分子相继与前一个泛素分子的赖氨酸残基相连,逐渐形成一条多聚泛素链。然后,泛素化的靶蛋白被一个相对分子质量很大的称为proteasome的蛋白质复合体逐步降解。多聚泛素也将解聚为单个泛素分子,重新被利用。 细胞周期各个时相的过渡需要细胞周期蛋白(细胞周期蛋白cyclin、细胞周期依赖激酶CDK, 及CDKs抑制蛋白等)其他蛋白质的降解,而这些蛋白的降解又与泛素化途径密不可分,因此泛素化途径与细胞周期有着十分密切的关系。 泛素(ubiquitin)是一种存在于大多数真核细胞中的小蛋白。它的主要功能是标记需要分解掉的蛋白质,使其被水解。当附有泛素的蛋白质移动到桶状的蛋白酶的时候,蛋白酶就会将该蛋白质水解。泛素也可以标记跨膜蛋白,如受体,将其从细胞膜上除去。泛素76个氨基酸组成,分子量大约8500道尔顿。它在真核生物中具有高度保留性,人类和酵母的泛素有96%的相似性,只差三个氨基酸。C-terminal是GG β-Grasp 需要被蛋白酶体降解的蛋白质会先被连接上泛素作为标记,即蛋白质上的一个赖氨酸与泛素之间形成共价连接。这一过程是一个三酶级联反应,即需要有由三个酶 闭锁小带(zonula occludens)又称紧密连接。它是由网格样的封闭索(sealing strand)连接而成的。封闭索是由相邻细胞膜内连接起来的膜蛋白构成。它是闭锁小带的封闭成分,由两排蛋白质颗粒紧密粘着、状似拉链,且不留细胞间隙。封闭索之间的细胞间隙约为 10-15nm。 闭锁小带具有封闭细胞间隙的作用,是阻碍物质扩散的屏障,使细胞和外部的体液分隔。闭锁小带在细胞层内具有透性屏障(permeability barrier)的功能,如小肠肠腔内保留大量的内含物,通过上皮细胞层选择性地输送营养物质,经过细胞间隙后再进入血液。经两组不同的特异性细胞膜进行运送,一组膜是位于上皮细胞的顶端表面,使分子泵入细胞内;另一组膜是位于细胞的基部和两侧,称基侧面,使分子从细胞的基侧面泵出。泵送过程有一定的方向,从细胞顶端泵入的分子不能扩散到细胞的基侧面,而从细胞的基侧面泵出的分子也不能扩散到细胞的顶端。这样,闭锁小带可以防止输送的分子漏出到肠腔,发挥透性障体的功能。 蛋白酶体(proteasomes) 是在真核生物和古菌中普遍存在的,在一些原核生物中也存在的一种巨型蛋白质复合物。在真核生物中,蛋白酶体位于细胞核和细胞质中。蛋白酶体的主要作用是降解细胞不需要的或受到损伤的蛋白质,这一作用是通过打断肽键的化学反应来实现。 从结构上看,蛋白酶体是一个桶状的复合物,包括一个由四个堆积在一起的环所组成的“核心”(右图中蓝色部分),核心中空,形成一个空腔。其中,每一个环由七个蛋白质分子组成。中间的两个环各由七个β亚基组成,并含有六个蛋白酶的活性位点。这些位点位于环的内表面,所以蛋白质必须进入到蛋白酶体的“空腔”中才能够被降解。外部的两个环各含有七个α亚基,可以发挥“门”的作用,是蛋白质进入“空腔”中的必由之路。
分子生物学---9蛋白质修饰(泛素化)
泛素化内稳态及信号 一:背景 1.细胞内蛋白酶解:80%-90%通过蛋白酶体降解,10%-20%通过自噬。 2.泛素: 由70个左右的氨基酸组成,本身有7个赖氨酸可被泛素化。细胞内广泛存在的一种蛋白。占细胞总蛋白1-2%,真核生物中高度保守。泛素内稳态取决于不断的改变。泛素化和去泛素化是一个动态平衡过程。 3.细胞内泛素化-蛋白酶体系统(U P S) (1)E3连接酶亚家族:
E3连接酶的功能影响细胞每个方面的活性,它的改变可以导致疾病。 (2)E3连接酶(大约600种)可以作为o n c o g e n e或者t u m o r s u p p r e s s o r (3)泛素信号:分类及功能
功能:细胞凋亡、D N A转录和修复、分化和生长、免疫应答和炎症,细胞表面受体和离子通道,血管新生,核糖体生物合成等等泛素信号异常:肿瘤、病毒感染、神经退行性疾病、发育畸形、细菌感染等。蛋白质降解受到抑制后,正常细胞会出现生长抑制,而肿瘤细胞则出现凋亡。 二、泛素内稳态及应激 1.细胞内泛素内稳态(老师上课说过这是可能的考点)
泛素内稳态:泛素合成 聚泛素链形成 聚泛素链组装 泛素降解 泛素应激:泛素增加、泛素减少 泛素减少:损害减数分裂、组织生长缺陷、突触发育及功能、胎儿肝脏发育细胞周期及耐逆性、增殖缺陷、扰乱造血系统、神经退化和代谢紊乱、细胞分化异常 泛素增加:延迟衰老、改变基因表达、热击的应答方式、促进细胞增殖和应激耐受、改变蛋白酶体构成、激活自噬 三、泛素信号和主要信号通路 1、N-e n d r u l e通路 泛素化蛋白酶体系统中最简单的规则:及蛋白质N端的特点决定蛋白质的半衰期,若N端为精氨酸或者赖氨酸的蛋白质寿命就很
E钙粘蛋白及其复合体与肿瘤的侵袭转移
E钙粘蛋白及其复合体与 肿瘤的侵袭转移 The pony was revised in January 2021
发育生物学综述 E-钙粘蛋白及其复合体与肿瘤的侵袭转移 姓名: 学号: 专业: E-钙粘蛋白及其复合体与肿瘤的侵袭转移 摘要:侵袭与转移是恶性肿瘤最基本的生物学特征,也是导致肿瘤治疗失败及患者死亡的主要原因。这一过程与肿瘤细胞间黏附功能的降低密切相关,由E-钙粘蛋白及其复合体是细胞间粘附分子的重要组成部分,在抑制肿瘤细胞侵袭转移过程中发挥及其重要的作用。 关键词:E-钙粘蛋白;复合体;肿瘤;侵袭转移 前言 肿瘤的转移是一个复杂的多个步骤的癌细胞与宿主细胞相互作用的连续过程,其分子机制主要包括以下几方面:①肿瘤细胞黏附特性的改变。此过程主要通过一些相关细胞间黏附分子(ICAM)的异常表达或缺失,引起肿瘤脱离原发灶,并发生过转移1;②肿瘤微环境的调整以及细胞外基质的水解。肿瘤微环境是指肿瘤发生发展过程中所处的内环境,包括纤维、基质、组织液和淋巴液等,基质主要是各种胶原成分,近年来的研究发现微环境不仅促进肿瘤增殖侵袭生存和耐药,而且还促进肿瘤转移2。另外,肿瘤细胞降解基质
蛋白质是局部侵袭和转移的必需步骤,同时降解的蛋白质对肿瘤细胞的增长生殖有促进作用;③肿瘤细胞的迁移和运动。肿瘤细胞还存在一种不依赖蛋白水解的单个细胞水平的变形运动3。 E-钙粘蛋白是一类介导同源细胞间粘附的钙离子依赖性跨膜糖蛋白。它是哺乳动物发育过程中第一个表达的钙粘蛋白,影响胚胎发育中细胞的分化,参与组织器官的形成。E-钙粘蛋白主要存在于人和动物上皮细胞,对于维持上皮细胞形态和组织完整性发挥重要作用,也抑制肿瘤的侵袭转移,影响原发肿瘤的早期生长和诱发肿瘤的增殖生长4。当其表达下调或功能障碍时,将使同种细胞失去粘附,对于上皮源性肿瘤而言,则意味着肿瘤具备侵袭生长的特点,并易从原发病灶脱落分离,向局部淋巴结转移或远处转移5。 1E-钙粘蛋白及其复合体概述 1.1E-钙粘蛋白结构及生物学特征 人类的E-钙粘蛋白编码基因定位于16号染色体q22.1附近,cDNA全长4.8kb,由16个外显子及15个内含子组成。E-钙粘蛋白由723—748个氨基酸组成,分子质量为80~124ku,分子中存在一个疏水基团,位于跨膜区,氨基末端位于细胞膜外,是钙离子的结合位点,对Ca2+有高度敏感性,其氨基末端位于细胞浆内,与激动蛋白相连。胞内区通过α、β、γ连接蛋白与微丝、中间丝、肌动蛋白相连接,形成复合体,使E钙粘蛋白被锚定于细胞骨架上,与相邻细胞形成稳定连接(如附图所示)6。 1.2E-钙粘蛋白复合物相关蛋白 E-钙粘蛋白表达降低的肿瘤易发生侵袭和转移,但近来发现一些E-钙粘蛋白表达较强的肿瘤其转移性仍较强,研究证实原因是连环蛋白表达减少。连环蛋白是一组与E-钙粘蛋
恶性肿瘤侵袭和转移的机理及分子阻遏
项目编号:2002CB513100 项目名称:恶性肿瘤侵袭和转移的机理及分子阻遏起止年月:2002年12月-2007年8月 项目首席科学家: 马丁华中科技大学同济医学院 詹启敏中国医学科学院肿瘤研究所 依托部门:教育部、卫生部 经费预算:3000万元
一、研究内容 恶性肿瘤正在成为危害人类健康的第一杀手。据最新流行病学调查资料显示:我国现有癌症病人300多万人,每年死于恶性肿瘤的患者约为130万人,每年有160万到200万新发的恶性肿瘤病例,并以3%的速度递增,给我国人民的生活和健康造成巨大威胁,给社会和家庭带来巨大的压力,一定程度上制约了我国经济的可持续发展。 确切证据表明,90%以上的恶性肿瘤患者最终死于肿瘤转移或复发。侵袭性生长和转移潜能是恶性肿瘤的顽固性和难治性的根本原因。就目前人类对肿瘤的认识水平和常规治疗手段尚无法从根本上清除恶性肿瘤,因此,阐明恶性肿瘤侵袭转移发生的关键机制,建立相应的阻断途径,尤其是在临床上去除原发肿瘤后到转移复发前的有限时限内,建立起一套行之有效的针对性阻断遏制手段尤为重要,也是根治肿瘤的希望所在。 既往肿瘤项目研究多侧重于肿瘤的发病学和病因学,这些探索固然重要,但忽略了恶性肿瘤危害人体健康的具体表现。因此,通过研究恶性肿瘤发展过程中的恶性行为,特别是侵袭和转移的基本生物特征,建立有效的阻遏手段或许更有实用价值。本项目的研究思路是:依据国家控制重大疾病对人类危害的基本国策,选择研究恶性肿瘤恶性表型的生物学特征,探索恶性肿瘤侵袭性生长和转移潜能的分子机理,着重确定肿瘤侵袭、转移的关键调节靶点,从相关基因、功能蛋白及活化因子等层次建立行之有效的分子阻遏手段,在遏制肿瘤危害性方面有所突破。本项目将注重研究恶性肿瘤的分子生物学特征,分析决定肿瘤侵袭和转移的关键要素,并设计针对性阻断手段加以遏制。主要研究内容阐述如下:1.细胞周期调控与肿瘤恶性增殖的关系及机理研究 肿瘤侵袭性生长的最根本原因之一是细胞周期调控机制的破坏。通过研究细胞周期调控与恶性增殖的关系,重点探讨p53、BRCA1在细胞周期G2-M监测点、中心体复制和细胞生长接触性抑制失调的相互关系和分子机理,揭示细胞周期调控机制破坏后基因组稳定性降低和细胞恶性增值的内在规律。 2.细胞凋亡和细胞分化与肿瘤侵袭性生长的关系
泛素化蛋白检测方法
泛素化蛋白检测方 法
泛素化蛋白检测方法 蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7个赖氨酸残基,因此它们之间也能够经过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。当前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63位赖氨酸残基相连,则靶蛋白能够发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即能够经过去泛素化酶(DUB)将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体能够被各种泛素蛋白结合结构域(UBD)所识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB 酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重
要的作用。E3酶是泛素修饰途径中决定底物特异性的关键酶,它能够分为两大类,即含有HECT结构域的E3酶和其它含有RING 结构域或RING样结构域(比如U-box或PHD结构域)的E3酶。这两种E3酶都在免疫调控过程中起到了关键性的作用。 蛋白质泛素化的检测方法 研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3酶是什么? 然后需要研究的是,这一蛋白质发生泛素化之后能够产生那些分子效应?对下游的信号通路有什么影响? 研究上述内容的实验方法和实验流程: 方法一:western blot and strip 经过WB检测所有发生泛素化的蛋白条带,拍照后,将膜strip。然后与特定蛋白的抗体和特定泛素化位点的抗体反应,显色拍照。经过阳性条带的对比来初步判断某一特定蛋白的特定位点发生了泛素化。【具体实验流程附后】 方法二:western blot and immunoprecipitations 经过免疫共沉淀方法将某一特定蛋白以及与其结合的蛋白分
