1_2_羟基苯甲酰基_3_甲基_4_取代苯_省略__吡唑啉酮及其中间体的合成_表
人名反应(类型整理)

人名反应1氧化:1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物4.Criegee臭氧化:烯烃臭氧化后水解成醛酮5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化13.Sarett氧化:CrO3·Py络合物氧化醇成醛酮14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇16.Wacker氧化:Pd催化剂下,烯烃氧化成酮还原:1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7.Gribble吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决8.Gribble二芳基酮还原:用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9.Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein-Ponndorf-Verley还原:用Al(OPr’)3/Pr’OH体系将酮还原为醇12.Midland还原:用B-3-α-蒎烯-9-BBN对酮进行不对称还原13.Noyori不对称氢化:羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原14.Rosenmund还原:用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基成烯反应:1.Boord反应:β-卤代烷氧基与Zn作用生成烯烃2.Chugaev消除:黄原酸酯热消除成烯3.Cope消除:胺的氧化物热消除成烯烃4.Corey-Winter olefin烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5.Doering-LaFlamme丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6.Horner-Wadsworth-Emmons反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting反应简单的多7.Julia-Lythgoe成烯反应:从砜合醛生成(E)-烯烃8.Peterson成烯反应:从α-硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting反应9.Ramberg-Backlund烯烃合成:Α-卤代砜用碱处理生成烯烃10.Witting反应:羰基用膦叶立德变成烯烃11.Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro-Stephens偶联:芳基炔合成,同Cadiot-Chodkiewicz偶联Eglinton反应:终端炔烃在化学计量(常常过量)Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联:Cu催化终端炔烃的氧化自偶联Gomberg-Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck反应:Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck反应Hiyama交叉偶联反应:Pb催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F -或者OH-之类的活化剂Pd(Ph3P)4,TBAF催化剂存在下发生的交叉偶联反应Kumada交叉偶联(Kharasch交叉偶联):Ni和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind-Srogl偶联:硫酸酯和有机硼酸之间经过Pd催化发生交叉偶联生成酮McMurry 偶联:羰基用低价Ti,如TiCl3/LiAlH4产生的Ti(0)处理得到双键,反应是一个单电子过程Negishi交叉偶联:Pd催化的有机Zn和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应:Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille偶联:Pd催化的有机Sn和有机卤,三氟磺酸酯之间的交叉偶联反应Stille-Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki偶联:Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann反应:芳基碘代物在Cu存在下的自偶联反应Wurtz反应:烷基卤经Na或Mg金属处理后形成碳碳单键Ymada偶联试剂:用二乙基氰基磷酸酯(EtO)2PO-CN活化羧酸缩合反应:Aldol缩合:羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和α-卤代酯和Zn反应得到β-酮酯Benzoin 缩合:芳香醛经CN-催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应:羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合:酯在碱催化下缩合为β-酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃,然后用BuLi处理生成终端炔烃Darzen缩水甘油酸酯缩合:碱催化下从α-卤代酯和羰基化合物生成α,β-环氧酯(缩水甘油醛)Dieckmann缩合:分子内的Claisen缩合Evans aldol反应:用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi-Thorpe缩合(2-吡啶酮合成):氰基乙酸乙酯和乙酰乙酸在氨存在下生成2-吡啶酮Henry硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch加成反应:过渡金属催化的CXCl3对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael加成:亲核碳原子对α,β-不饱和体系的共扼加成Mukaiyama醇醛缩合:Lewis酸催化下的醛和硅基烯醇醚之间的Aldol缩合Nozaki-Hiyama-KIshi反应:Cr-Ni双金属催化下的烯基卤对于醛的氧化还原加成Pechmann缩合(香豆素合成):Lewis酸促进的酸和β-酮酯缩合成为香豆素Perkin反应:芳香醛和乙酐反应合成肉桂酸Prins反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应:有机Zn试剂(从α-卤代酯来)对羰基的亲核加成反应Reimer-Tiemann反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser对Witting反应的修正:不稳定的叶立德和醛发生的Witting反应生成Z-烯烃,而改进的Schlosser反应可以得到E-烯烃Stetter反应(Michael-Stetter反应):从醛和α,β-不饱和酮可以得到1,4-二羰基衍生物。
各大类农药的结构分类情况新

各大类农药的结构分类情况按用途分大类按化学结构分类别除草剂有机磷类、磺酰脲类、咪唑啉酮类、嘧啶并三唑类、三嗪类、酰胺类、脲类、氨基甲酸酯类、吡啶类、苯氧乙酸类、二硝基苯胺类、芳氧苯氧丙酸酯类、二苯醚类、环己二酮类、羟基苯腈类、哒嗪类、其他结构类杀虫剂有机磷类、拟除虫菊酯类、氨基甲酸酯类、烟碱类、杀螨剂类、天然产物类、苯甲酰脲类、其他昆虫生长调节剂类、有机氯类、其他结构类杀菌剂三唑类、其他唑类、其他甾醇抑制剂类、吗啉类、二硫代氨基甲酸酯类、无机类、酞酰亚胺及苯腈类、其他多作用位点类、甲氧基丙烯酸酯类、苯并咪唑类、苯酰胺类、二甲酰脲类、酰胺类、嘧啶胺类、其他结构类其他植物生长调节剂、熏蒸剂除草剂有机磷类除草剂草甘膦、草铵膦、双丙胺膦、草硫膦抑草磷、莎稗磷双丙氨酰膦等18种磺酰脲类除草剂选择性除草剂烟嘧磺隆、苄嘧磺隆、甲磺隆、砜嘧磺隆、碘甲磺隆、噻吩磺隆、苯磺隆、氯嘧磺隆、甲酰胺磺隆、甲磺胺磺隆(甲基二磺隆)、吡嘧磺隆、磺酰磺隆、氟胺磺隆、氯磺隆、氟啶嘧磺隆、甲嘧磺隆、酰嘧磺隆、环氧嘧磺隆、唑吡嘧磺隆、氯吡嘧磺隆、环丙嘧磺隆、胺苯磺隆、醚苯磺隆、三氟啶磺隆、啶嘧磺隆、氟嘧磺隆、四唑嘧磺隆、氟磺隆、乙氧嘧磺隆、醚磺隆、三氟甲磺隆、丙苯磺隆(propoxycarbazone)、玉嘧磺隆、噻吩磺隆、咪唑磺隆、嘧磺隆、环胺磺隆、氟酮磺隆(flucarbazone)单嘧磺隆、单嘧磺酯、甲基碘磺隆钠盐、氟吡磺隆、氟唑磺隆、、甲硫嘧磺隆、三氟丙磺隆、iofensulfuron(开发代号BCS-AA10579)及一新型杀虫剂flupyradifurone(BYI02960),咪唑啉酮类除草剂乙酰乳酸合成酶抑制剂咪唑乙烟酸、咪唑烟酸、咪唑喹啉酸、咪草酸、甲氧咪草烟、甲基咪草烟嘧啶氧(硫)苯甲酸酯类和嘧啶并三唑类、双嘧啶吡唑啉酮类、吡唑啉类嘧草硫醚、环酯草醚(pyriftalid)、双草醚、嘧草醚、、嘧啶肟草醚、三唑并嘧啶磺草胺类氯酯磺草胺、双氯磺草胺、双氟磺草胺、唑嘧磺草胺、磺草唑胺、五氟磺草胺(penoxsulam),嘧苯胺磺隆(OrthOsulfamurOn,胺磺酰脲类)三嗪类除草剂抑制植物光合作用莠去津、苯嗪草酮、环嗪酮、嗪草酮、特丁津、西玛津、莠灭净、扑草净、氰草净、特丁净、特丁通、扑灭净、敌草净、乙嗪草酮、三嗪氟甲胺三嗪氟草胺等30个酰胺类除草剂酰胺类除草剂的作用机理一般是脂类合成抑制剂或细胞分裂与生长抑制剂、光合作用抑制剂、玉米大豆小麦田防除一年生禾本科杂草和某些阔叶杂草乙草胺、异丙甲草胺、丁草胺、二甲噻草胺、甲草胺、吡草胺、氟噻草胺、苯噻草胺、敌草胺、萘丙胺、二甲草胺、丙草胺、甲氧噻草胺、毒草胺、敌稗、picolinafen、beflubutamid、methamihop、pethoxamid、卡草胺、萘丙酰草胺、吡氟草胺、四唑酰草胺、氟吡草胺双苯酰草胺、氟丁酰草胺溴丁酰草胺、异丙草胺异恶草胺53个品种二硝基苯胺类除草剂均为选择性触杀型土壤处理剂,在播种前或播后苗前应用;杀草谱广,对一年生禾本科杂草高效,同时还可以防除部分一年生阔叶杂草;③易于挥发和光解,使用量相对较高,长期使用抗性严峻二甲禾灵、氟乐灵、乙丁烯氟灵、安磺灵、乙丁氟灵、双丁乐灵二甲戊乐灵芳氧苯氧丙酸酯类除草剂抑制乙酸辅酶A羧化酶,导致脂肪酸合成受阻面发挥作用噁唑禾草灵、炔草酯、吡氟禾草灵、吡氟氯禾灵、氰氟草酯、喔草酯、喹禾灵、喹禾糖酯、噻唑禾草灵、氟吡甲禾灵脲类除草剂光合作用抑制剂或细胞分裂抑制剂敌草隆、异丙隆、利谷隆、伏草隆、丁噻隆、杀草隆、甲基苯磺隆、绿麦隆、吡喃隆、氯溴隆、噁唑隆、苄草隆等42个氨基甲酸酯类及硫代氨基甲酸酯类除草剂:硫代氨基甲酸酯类除草剂的作用机理与酰胺类除草剂类似,均是脂类合成抑制剂,但不是ACC抑制剂。
三步缩合法合成2-苯基-1-羟基联三苯叉

有机化学Chinese Journal of Organic ChemistryNOTE*E-mail:****************.cnReceived May 6, 2014; revised May 27, 2014; published online June 3, 2014.Project supported by the National Natural Science Foundation of China (No. 21372150), the Natural Science Foundation of Shaanxi Province (No. 2014JQ2073) and the Fundamental Research Funds for the Central Universities (No. GK261001095).国家自然科学基金(No. 21372150)、陕西省自然科学基础研究计划(No. 2014JQ2073)和中央高校基本科研业务费专项资金(No. GK261001095)资助项目.Chin. J. Org. Chem. 2014, 34, 1875~1880 © 2014 Chinese Chemical Society & SIOC, CAS/ 1875DOI: 10.6023/cjoc201405008 三步缩合法合成2-苯基-1-羟基联三苯叉王文丽a 何 清a ,b 丁 茹a 贺 云a 张尊听*,a(a 陕西师范大学化学化工学院 教育部药用资源与天然药物化学重点实验室西北濒危药材资源开发国家工程实验室 西安 710062)(b 温州大学化学与材料工程学院 温州 325027)摘要 以邻羟基苯乙酮为原料, 与N ,N -二甲基甲酰胺-二甲基缩醛(DMF-DMA)分子间缩合合成(E )-3-二甲氨基-1-(2'-羟基苯基)-1-丙烯酮中间体(2); 中间体2与1,3-二苯基丙酮在以DMF 为溶剂, K 2CO 3存在下发生缩合反应生成4'-苯基-2,3'-羟基-1,1':2',1''-三联苯类化合物(3); 化合物3以乙腈-1% HCl (V ∶V =1∶1)为溶剂, 汞灯500 W 照射分子内脱水关环合成2-苯基-1-羟基联三苯叉类化合物(4). 三步缩合法合成2-苯基-1-羟基联三苯叉具有操作简单、无需氧化剂与催化剂、原子利用率高等优点. 采用FT-IR, 1H NMR, 13C NMR 和HRMS 对化合物3和4进行了表征. 关键词 4'-苯基-2,3'-羟基-1,1':2',1''-三联苯; 2-苯基-1-羟基联三苯叉; 光环化反应; 缩合反应Synthesis of 1-Hydroxy-2-phenyltriphenylene Derivatives byThree-Step CondensationWang, Wenli a He, Qing a ,b Ding, Ru a He, Yun a Zhang, Zunting *,a(a Key Laboratory of Ministry of Education for Medicinal Resources and Natural Pharmaceutical Chemistry , National Engineering Laboratory for Resource Development of Endangered Crude Drugs in Northwest of China and School of Chemistry and Chemical Engineering , Shaanxi Normal University , Xi'an 710062)(b College of Chemistry and Materials Engineering , Wenzhou University , Wenzhou 325027)Abstract (E )-3-(Dimethylamino)-1-(2-hydroxyphenyl)prop-2-en-1-ones (2) were synthesized by the condensation reaction of o -hydroxyacetophenones (1) and N ,N -dimethylformamide-dimethyl acetal (DMF-DMA). Using DMF as solvent and K 2CO 3as base, 4'-phenyl-(1,1':2',1''-terphenyl)-2,3'-diol (3) were synthesized via the condensation reaction of intermediate 2and 1,3-diphenylacetones. 3 were dissolved in the solution of acetonitrile-1% HCl (V ∶V =1∶1) and irradiated by 500 W mercury lamp, and 1-hydroxy-2-phenyltriphenylenes were obtained. This process to synthesize 4 has the advantages of simple opera-tion, high efficiency of the atomic, without oxidant and catalyst. Compounds 3 and 4 were confirmed by the method of FT-IR, 1H NMR, 13C NMR, HRMS.Keywords 4'-phenyl-(1,1':2',1''-terphenyl)-2,3'-diol; 1-hydroxy-2-phenyltriphenylene; photocyclization reaction; condensa-tion reaction联三苯叉衍生物因其特殊的电学和光物理性能在材料科学方面被视为多环芳香烃中最重要的化合物之一. 文献报道[1], 由于联三苯叉的激发三线态的能量较高, 可作为磷光发光元件主体材料的基本骨架. Schulte 等[2]合成了对称性烷基取代的联三苯叉化合物, 并发现此类化合物有很好的光导性能, 已应用于静电复印和激光印刷等领域[3,4]. Schmidt-Mende 等[5]也探索将小分子或聚合物的联三苯叉液晶作为传导材料, 成为纳米材料和技术的新热点. 在联三苯叉分子中引入羟基和硝基, 能合成一系列新型的多孔材料[6]. 1,2,4-三苯基联三苯叉(图1, a )可作为蓝色发光二极材料[7], 2-(4'-(芘-1"-基)苯基)联三苯叉(图1, b )可在研究有机薄膜能带边缘型光子晶体雷射中, 搭配有机高分子做为增益材料[8]. 联三苯叉也可作为母核用于荧光受体(图1, c )的设计中[9], 其溶有机化学1876 / © 2014 Chinese Chemical Society & SIOC, CAS Chin. J. Org. Chem. 2014, 34, 1875~1880胶还被用于测定铝离子浓度[10].2-(4-(pyren-1-yl)phenyl)triphenylene1,2,4-triphenyltriphenylene (a)(b)X XO OnX=N or R n=2or 3(c)图1 联三苯叉衍生物 Figure 1 Triphenylene derivatives联三苯叉衍生物合成方法主要有: 偶联法、过渡金属法、电化学法[11]. 偶联法比较广泛的用于合成联三苯叉类衍生物, 有以二烷氧基苯为原料加入金属氧化剂直接进行的三偶联法(Scheme 1, A)[12~14], 也有一个苯环与一个带两个苯环的中间体在钯催化下发生偶联反应合成联三苯叉(Scheme 1, B)[15], 但是金属氧化剂价格昂贵, 且很容易吸潮, 经常在用于实验室小样量的制备.RORORO OROR OR 1R133(A)(B)R = C n H 2n +1+Scheme 1早在1998年就有用催化剂量的过渡金属催化芳炔反应生成联三苯叉的报道[16]. 多取代苯在乙腈溶液中CsF 催化形成芳炔, 然后加入Pd(PPh 3)4可以得到联三苯叉, 产率较高, 然而CsF 易吸潮, 且具有毒性(Scheme 2, A). García-López 等[17]以邻位取代的芳基硼酸酯为原料, 在碱性条件下经Pd(dba)2催化, 形成金属络合的芳炔中间体进行三聚合合成联三苯叉类化合物, 该反应需要用到过渡金属催化剂, 产率中等(Scheme 2, B).R2R 2R1TMSOTfR 2R 2R2R 2R2R 2R1R 1R 1-Pd(PPh )(A)a R 1 = R 2 = Hb R 1 = H, R 2 = Fc R 1 = OMe, R 2 = HBpin XRRRR(B)Pd(dba)2 (5 mol%)DPEphos (5 mol%)o X = Br, OTfScheme 2电化学法比较适用于小规模反应, 先将二烷氧基苯用阳极氧化, 再用化学或电化学方法进行还原, 可以简便地合成六烷氧基联三苯叉[18], 产率中等.将1,1':2',1''-三联苯在碘单质的存在下, 1,2-环氧丙烷作去酸剂, 用紫外灯照射可发生光致并环反应得到联三苯叉, 其产率中等[19].2008年, Wan 等[20]研究了2-羟基-1,1':2',1''-三联苯的激发态分子内质子的转移情况, 发现其光照后生成了少量的光环化产物联三苯叉(Eq. 1).OHD 2O-CH 3CNOH DOHD++(1)本文以邻羟基苯乙酮(1)为原料, 与N ,N -二甲基甲酰胺-二甲基缩醛(DMF-DMA)反应生成(E )-3-二甲氨基- 1-(2'-羟基苯基)-1-丙烯酮(2), 化合物2与1,3-二苯基丙酮缩合合成4'-苯基-2,3'-羟基-1,1':2',1''-三联苯(3), 再将3光照后脱水环化合成2-苯基-1-羟基联三苯叉衍生物(4). 建立了一种三步缩合法合成联三苯叉衍生物的新方法(Scheme 3), 该方法具有操作简单、原子利用率高和不需要氧化剂等优点.Chinese Journal of Organic ChemistryChin. J. Org. Chem. 2014, 34, 1875~1880© 2014 Chinese Chemical Society & SIOC, CAS/ 1877OHONRPhPhO K 2CO 3, DMFOH ROHORDMFreflux, 4 h3124a R = OMe,b R = i-OPr,c R = H,d R = CH 3Scheme 31 结果与讨论1.1 化合物2的合成以化合物1为原料, 与DMF-DMA 在以DMF 为溶剂, 75 ℃水浴中反应可以一步缩合得到化合物2[21]. 产物不需要柱层析分离, 直接在乙醇中重结晶就可以得到纯品, 产物产率达到了85%~91%. 1.2 化合物3的合成在合成4'-苯基-2,3'-羟基-4-甲氧基-1,1':2',1''-三联苯 (3a )的反应中, 对反应体系碱的种类和用量、溶剂、温度等条件进行了优化(表1). 当2a /(PhCH 2)2CO/K 2CO 3物质的量比为1∶1∶1时, 在110 ℃时体系检测不到产物(Entry 1), 当在130 ℃时, 3a 产率为45% (Entry 2), 在回流温度时, 收得3a 产率72% (Entry 3).当碱为KOH 时, 3a 产率达到了68% (Entry 4), 以醋酸钠做碱, 3a 产率只有26% (Entry 5), 而使用K 2CO 3产率可达72% (Entry 3). 在碱的用量上, 当2a /(PhCH 2)2- CO/碱的物质的量比为1∶1∶1.5时, 3a 产率达到了81% (Entry 6), 物质的量比为1∶1∶2, 产物产率79% (Entry 7), 与 1.5倍物质的量比时没有太大变化, 因此, 2a /(PhCH 2)2CO/K 2CO 3的物质的量比为1∶1∶1.5.当选择DMF 为溶剂时, 产率达到了81% (Entry 6), 乙醇为溶剂时, 检测不到产物(Entry 8), 选择对二甲苯为溶剂, 产率达到34% (Entry 9), 而以乙二醇为溶剂时, 产物产率为49% (Entry 10). 因此确定最优反应条件为: DMF 作溶剂, K 2CO 3作碱, 反应物的物质的量比为1∶1∶1.5, 加热回流4 h.在合成4'-苯基-2,3'-羟基-1,1':2',1''-三联苯的反应中, 原料2的制备简单易得, Nairoukh 等[22]报道炔烃的环三聚反应得到2,3,6-三苯基苯类化合物, 该方法需要制备表1 化合物3a 的合成条件优化aTable 1 Optimization of reaction conditions on the synthesis of 3aOHO NOPhPhO OH OHOreflux, 4 h3a2aEntry Solvent BaseT /℃Molar ratio of 2a ∶(PhCH 2)2CO ∶baseYield b /%1 DMF K 2CO 3 110 1∶1∶1 Trace2 DMF K 2CO3 130 1∶1∶1 45 3 DMF K 2CO 3 Reflux 1∶1∶1 724 DMF KOH Reflux 1∶1∶1 685 DMF NaOMe Reflux 1∶1∶1 26 6 DMF K 2CO 3 Reflux 1∶1∶1.5 817 DMF K 2CO 3 Reflux 1∶1∶2 798 EtOH K 2CO 3 Reflux 1∶1∶1.5 N c9 p -XyleneK 2CO 3 Reflux 1∶1∶1.5 34 10EG K 2CO 3 150 1∶1∶1.5 49a反应条条件: 2a (2 mmol), 溶剂3 mL, 回流4 h. b 柱层析产率. c Not de-tected.二氧化硅溶胶-凝胶包封的RhCl 3作催化剂, 加入十二烷基苯磺酸钠作为表面活性剂, 合成路线较复杂. 与文献[22]相比本实验方法简单新颖, 不需要其它添加剂, 在碱性条件下经过一步缩合即可合成具有四个苯环的化合物, 操作简单, 产率70%~81%, 为构建四苯环芳烃类化合物提供了有效的合成策略. 1.3 化合物4的合成对2-苯基-1-羟基-7-甲氧基联三苯叉(4a )的合成条件进行了优化, 如表2所示. 将化合物3a 溶于乙腈-HCl (V ∶V =1∶1)混合溶液中配制成浓度为2.5×10-3 mol/L 的溶液, 氩气保护, 光照5 h. 当选用紫外灯254 nm 、金卤灯、氙灯300 W 时, 反应检测不到产物4a (Entries 1~3), 选用氙灯500 W 和汞灯300 W 时有痕量产物(Entries 4, 5), 而使用汞灯500 W 照射时, 产物4a 收率为19% (Entry 6).当使用乙醇-水(V ∶V =1∶1)体系, 光照5 h 后, 只有痕量产物生成(Entry 7). 选用2种浓度的盐酸(1%, 2%)与乙腈混合的体系, CH 3CN-1% HCl (V ∶V =1∶1)时体系中, 产物产率63%, 而在CH 3CN-2% HCl (V ∶ V =1∶1)体系中, 产物产率为61% (Entries 8, 9).CH 3CN-1% HCl (V ∶V =1∶1)为溶剂, 光照时间选择1, 3, 5和7 h, 结果发现1 h 时, 只有痕量产物生成, 3 h 时产率为52%, 而光照5 h 产率达到63% (Entry 8, 10, 11), 再延长时间至7 h (Entry 12), 发现产率并无明显提高且副产物增多.通过筛选, 确定了最佳反应条件: 光源为汞灯500有机化学1878 / © 2014 Chinese Chemical Society & SIOC, CASChin. J. Org. Chem. 2014, 34, 1875~1880表2 化合物4a 的合成条件优化aTable 2 Optimization of reaction conditions on the synthesis of 4aOH OHOOH 3a4aEntry Lamp Condition (V ∶V ) Time/h Y ield b /%1 UV254 CH 3CN-H 2O (1∶1) 5 N c2 MHL400W C H 3CN-H 2O (1∶1) 5 N3 XL300W CH 3CN-H 2O (1∶1) 5 N4 XL500W CH 3CN-H 2O (1∶1)5 Trace5 ML300W CH 3CN-H 2O (1∶1) 5 Trace6 ML500W CH 3CN-H 2O(1∶1) 5 197 ML500W C 2H 5OH-H 2O(1∶1) 5 Trace 8 ML500W CH 3CN-1% HCl (1∶1) 5 639 ML500W CH 3CN-2% HCl (1∶1) 5 61 10 ML500W CH 3CN-1% HCl (1∶1) 1 Trace 11 ML500W CH 3CN-1% HCl (1∶1) 3 5212 ML500W CH 3CN-1% HCl (1∶1) 7 62 a反应条件: 3a (676 mg, 2 mmol)溶于800 mL 溶剂(2.5×10-3 mol/L), 分装8份, 氩气保护下光照5 h. b 柱层析产率. c Not detected.W, 溶液为乙腈-1% HCl (V ∶V =1∶1), 在氩气保护下照射5 h.光化学反应是实现绿色化学目标的重要方法之一, 以3a ~3d 为原料, 在氩气保护下, 紫外光照射发生分子内脱水缩合合成产物4a ~4d , 反应不需要使用氧化剂、催化剂及光引发剂, 具有反应条件温和, 操作简单的优点.2 结论以化合物1为原料, 经过两步分子间缩合反应简便地合成了中间体3, 具有操作简单和原子利用率高的优点, 产率70%~81%; 中间体3再经一步分子内脱水关环得到化合物4, 该步采用光照法, 条件温和, 无需氧化剂和光敏剂等其他添加剂. 本文优化合成了一系列未见文献报道的中间体3和化合物4, 三步缩合反应主要副产物均为水, 利于产物纯化, 具有很好的实用性.3 实验部分3.1 仪器与试剂邻羟基苯乙酮和2-羟基-4-甲氧基苯乙酮(北京恒业中远化工有限公司, 纯度>97%), 2-羟基-4-甲基苯乙酮和2-羟基-4-异丙氧基苯乙酮(北京得力士化工有限公司, 纯度>98%), 1,3-二苯基丙酮[(PhCH 2)2CO, 美国Alfa Aesar 公司, 纯度>98%], N ,N -二甲基甲酰胺-二甲基缩醛(DMF-DMA, 常州宝康医药化工有限公司, 纯度>98%), 其它常用试剂为分析纯.X-5显微熔点测定仪(北京泰克仪器有限公司); Bruker Tensor 27-IR 红外光谱仪(德国Bruker 公司, KBr 压片); Bruker AM-300 M, 400 M 超导傅立叶数字化核磁共振仪(德国Bruker 公司, TMS 为内标); Bruker MAXIS 高分辨质谱(德国Bruker 公司); 光化学反应仪(西安比朗生物科技有限公司, 汞灯500 W).化合物的分离检测中, 薄层层析所用硅胶GF 254 (400目), 柱层析为硅胶H (200-300目), 两者均为青岛海浪化工厂生产, 检测用254和365 nm 紫外灯.3.2 实验方法 3.2.1 化合物2a ~2e 的合成分别称取4-甲氧基-2-羟基苯乙酮(1a )、4-异丙氧 基-2-羟基苯乙酮(1b )、2-羟基苯乙酮(1c )、4-甲基-2-羟基苯乙酮(1d )和5-氟-2-羟基苯乙酮(1e ) (0.05 mol)与DMF-DMA (11.9 g, 0.1 mol)于250 mL 圆底烧瓶中, 加入70 mL DMF, 将圆底烧瓶置于75 ℃水浴中反应1 h 后, TLC 检测至原料消耗完毕, 则反应结束. 将反应液冷却至室温倾倒在100 mL 饱和食盐水中, 有黄色固体析出. 将该黄色固体抽滤, 烘干得到2, 2a , 2b , 2c , 2d 和2e , 产率分别为85%, 83%, 87%, 91%和86%. 3.2.2 化合物3a ~3e 的合成将2 (2 mmol)、1,3-二苯基丙酮(420 mg, 2 mmol)和碳酸钾(414 mg, 3 mmol)用8 mL DMF 溶解后150 ℃ 回流反应4 h, 硅胶TLC 检测至原料反应完全, 停止反应. 将反应液倒入20 mL 饱和食盐水中, 使用10%盐酸调至约pH =6, 用乙酸乙酯萃取三次后有机相用无水MgSO 4干燥, 减压蒸馏得到粗品, 以石油醚/乙酸乙酯(V ∶V =20∶1)作洗脱剂, 经硅胶柱层析分离得到化合物3a ~3e .4'-苯基-2,3'-羟基-4-甲氧基-1,1':2',1''-三联苯(3a ): 浅黄色晶体, 产率81%. m.p. 189.7~190.6 ℃; 1H NMR (400 MHz, CDCl 3) δ: 7.55 (d, J =3.0 Hz, 1H), 7.53 (s, 1H), 7.39 (t, J =7.5 Hz, 2H), 7.32 (s, 1H), 7.30 (s, 1H), 7.21 (d, J =7.6 Hz, 2H), 7.18 (d, J =2.4 Hz, 1H), 7.14 (d, J =1.6 Hz, 1H), 7.12 (s, 1H), 6.96 (d, J =7.8 Hz, 1H), 6.73 (d, J =8.4 Hz, 1H), 6.27 (d, J =2.4 Hz, 1H), 6.23 (dd, J =8.4, 2.5 Hz, 1H), 4.67 (s, 2H), 3.63 (s, 3H); 13C NMR (101 MHz, CDCl 3) δ: 159.2, 149.4, 143.0, 130.4,127.8, 126.6, 121.9, 118.7, 118.7, 105.3, 99.6, 76.3, 76.0, 75.7, 54.2; IR (KBr) ν: 3685, 3498, 3412, 3278, 3027, 1745, 1552, 1492, 1445, 1403, 1332, 1209, 1179, 819, 763, 700, 562, 430 cm -1. HRMS (ESI) calcd for C 25H 20O 3 [M -H]- 368.1412, found 367.1298.Chinese Journal of Organic ChemistryChin. J. Org. Chem. 2014, 34, 1875~1880© 2014 Chinese Chemical Society & SIOC, CAS/ 18794'-苯基-2,3'-羟基-4-异丙氧基-1,1':2',1''-三联苯(3b ): 浅黄色晶体, 产率83%. m.p. 132.8~134.2 ℃; 1H NMR (400 MHz, CDCl 3) δ: 7.62 (d, J =7.6 Hz, 2H), 7.47 (t, J =7.4 Hz, 3H), 7.39 (t, J =7.3 Hz, 2H), 7.27 (s, 1H), 7.21 (d, J =8.6 Hz, 4H), 7.07 (t, J =8.8 Hz, 2H), 6.93 (d, J =7.5 Hz, 1H), 6.76 (d, J =8.5 Hz, 1H), 6.72 (d, J =7.4 Hz, 1H),5.37 (s, 1H), 5.01 (s, 1H); 13C NMR (101 MHz, d 6-DMSO) δ: 157.1, 155.3, 150.4, 138.9, 138.8, 137.3, 129.2, 128.0, 125.9, 123.1, 120.9, 105.4, 102.5, 68.7, 21.6; IR (KBr) ν: 3685, 3498, 3412, 3278, 3027, 1745, 1552, 1492, 1445, 1403, 1332, 1209, 1179, 819, 763, 700, 562, 430 cm -1. HRMS (ESI) calcd for C 27H 24O 3 [M -H]- 396.1725, found 395.1606.4'-苯基-2,3'-羟基-1,1':2',1''-三联苯(3c ): 浅黄色晶体, 产率79%. m.p. 135.2~136.8 ℃; 1H NMR (400 MHz, CDCl 3) δ: 7.62 (d, J =7.6 Hz, 2H), 7.47 (t, J =7.4 Hz, 3H), 7.39 (t, J =7.3 Hz, 2H), 7.27 (s, 1H), 7.21 (d, J =8.6 Hz, 4H), 7.07 (t, J =8.8 Hz, 2H), 6.93 (d, J =7.5 Hz, 1H), 6.76 (d, J =8.5 Hz, 1H), 6.72 (d, J =7.4 Hz, 1H), 5.37 (s, 1H), 5.01 (s, 1H); 13C NMR (101 MHz, d 6-DMSO) δ: 170.3, 154.4, 150.5, 138.9, 137.1, 131.1, 130.9, 130.7, 129.3, 128.7, 128.6, 128.5, 128.2, 127.7, 127.2, 126.7, 126.2, 122.8, 118.1, 115.0, 105.4; IR (KBr) ν: 3679, 3291, 3062, 2360, 2045, 1723, 1537, 1308, 900, 751, 557, 445 cm -1. HRMS (ESI) calcd for C 24H 18O 2 [M -H]- 338.1307, found 337.1190.4'-苯基-2,3'-羟基-4-氧基-1,1':2',1''-三联苯(3d ): 白色固体, 产率70%. m.p. 122.3~123.8 ℃; 1H NMR (400 MHz, CDCl 3) δ: 7.63 (s, 1H), 7.61 (s, 1H), 7.47 (t, J =7.6 Hz, 2H), 7.41~7.35 (m, 2H), 7.30 (d, J =7.2 Hz, 1H), 7.25 (s, 1H), 7.23 (d, J =3.6 Hz, 2H), 7.21 (s, 1H), 7.04 (d, J =7.8 Hz, 1H), 6.87 (d, J =8.1 Hz, 1H), 6.76 (s, 1H), 6.64 (d, J =8.2 Hz, 1H), 5.36 (s, 1H), 4.75 (s, 1H), 2.13 (s, 3H); 13C NMR (101 MHz, CDCl 3) δ: 151.2, 137.0, 136.8, 132.2, 130.5, 129.9, 129.8, 129.5, 129.3, 129.0, 128.4, 128.2, 126.8, 126.6, 126.4, 123.8, 123.2, 122.6, 118.9, 115.5, 21.9; IR (KBr) ν: 3685, 3551, 3498, 3412, 3278, 3027, 2279, 1745, 1552, 1492, 1445, 1403, 1332, 1276, 1209, 1179, 1106, 819, 763, 700, 617, 562, 430 cm -1. HRMS (ESI) calcd for C 25H 20O 2 [M -H]- 352.1463, found 351.1341.4'-苯基-5-氟-2,3'-羟基-1,1':2',1''-三联苯(3e ): 黄色固体, 产率83%. m.p. 107.6~108.4 ℃; 1H NMR (400 MHz, CDCl 3) δ: 7.59 (d, J =8.0 Hz, 1H), 7.45 (t, J =7.6 Hz, 1H), 7.37 (dd, J =7.6, 4.9 Hz, 1H), 7.31~7.22 (m, J =7.0, 6.1 Hz, 2H), 7.22~7.15 (m, 1H), 7.00 (d, J =7.8 Hz,0H), 6.75 (td, J =8.5, 3.0 Hz, 1H), 6.69~6.62 (m, 2H), 5.36 (s, 1H), 4.80 (s, 1H); 13C NMR (101MHz, CDCl 3) δ: 157.5, 155.2, 150.4, 148.6, 137.3, 135.2, 134.2, 130.4, 130.3, 129.3, 128.9, 128.8, 128.7, 128.2, 127.8, 122.4, 117.1, 116.9, 116.2, 116.1, 115.4, 115.2. IR (KBr) ν: 3786, 3719, 2876, 2765, 2394, 2347, 2006, 1444, 1368, 1284, 939, 709 cm -1. HRMS (ESI) calcd for C 25H 20O 2 [M -H]- 356.1213, found 355.1095. 3.2.3 化合物4a ~4d 的合成将化合物3 (2 mmol)溶于400 mL 乙腈溶液中, 搅拌至化合物完全溶解后加入400 mL 1%HCl 溶液, 使用100 mL 石英反应管分装8份, 氩气保护后500 W 汞灯照射5 h. 合并反应液并用10% NaOH 调至约pH =6, 用乙酸乙酯萃取三次, 有机相用无水MgSO 4干燥, 减压蒸馏得到粗品, 以石油醚/乙酸乙酯(V ∶V =80∶1)混合溶剂为洗脱剂, 硅胶柱层析分离得到白色固体4a ~4d . 而以3e 作为原料时, 发现光照后无相应化合物4e 生成, 表明当如果取代基为拉电子基团时, 光照无产物生成.2-苯基1-羟基-7-甲氧基-联三苯叉(4a ): 白色固体, 产率63%. m.p. 195.7~196.8 ℃; 1H NMR (400 MHz, CDCl 3) δ: 9.71 (d, J =7.3 Hz, 1H), 8.59 (s, 1H), 8.53 (d, J =8.9 Hz, 1H), 8.22 (d, J =8.3 Hz, 1H), 8.02 (d, J =12.5 Hz, 1H), 7.59 (s, 5H), 7.47 (d, J =7.8 Hz, 3H), 6.34 (s, 1H), 4.03 (s, 3H); 13C NMR (101 MHz, CDCl 3) δ: 159.10, 151.14, 136.98, 132.37, 131.86, 130.31, 130.04, 129.84, 129.74, 129.36, 128.33, 126.90, 126.47, 125.99, 125.51, 123.78, 122.80, 117.73, 115.91, 114.97, 105.58, 55.44; IR (KBr) ν: 3476, 2391, 2025, 1635, 1387, 1354, 1279, 1069, 764, 609 cm -1. HRMS (ESI) calcd for C 25H 18O 2 [M -H]- 350.1307, found 349.1180.2-苯基-1-羟基-7-异丙氧基联三苯叉(4b ): 白色固体, 产率51%. m.p. 121.4~122.6 ℃; 1H NMR (600 MHz, CDCl 3) δ: 9.72 (d, J =9.6 Hz, 1H), 8.61 (d, J =9.4 Hz, 1H), 8.53 (d, J =9.1 Hz, 1H), 8.23 (d, J =8.4 Hz, 1H), 8.09 (d, J =2.2 Hz, 1H), 7.66~7.63 (m, 2H), 7.63~7.55 (m, 4H), 7.49 (dd, J =14.7, 7.7 Hz, 2H), 7.26~7.23 (m, 1H), 6.34 (s, 1H), 4.94~4.63 (m, 1H), 1.48 (s, 6H); 13C NMR (101 MHz, CDCl 3) δ: 157.42, 151.11, 137.02, 132.43, 131.95, 130.31, 130.10, 129.86, 129.75, 129.35, 128.34, 126.88, 126.49, 125.88, 125.52, 123.67, 122.85, 117.68, 117.17, 114.97, 108.34, 70.24, 22.22; IR (KBr) ν: 3411, 3235, 2394, 2281, 2026, 1627, 1388, 1072, 773, 610 cm -1. HRMS (ESI) calcd for C 27H 22O 2 [M -H]- 378.1620, found 377.1489.有机化学1880 / © 2014 Chinese Chemical Society & SIOC, CAS Chin. J. Org. Chem. 2014, 34, 1875~18802-苯基-1-羟基联三苯叉(4c ): 白色固体, 产率43%. m.p. 161.7~162.6 ℃; 1H NMR (400 MHz, CDCl 3) δ: 9.70 (d, J =8.2 Hz, 1H), 8.73~8.59 (m, 3H), 8.33 (d, J =8.5 Hz, 1H), 7.60 (tt, J =12.6, 6.1 Hz, 8H), 7.50 (d, J =8.3 Hz, 2H), 6.33 (s, 1H); 13C NMR (101 MHz, CDCl 3) δ: 151.14, 136.87, 132.26, 130.42, 130.37, 130.10, 129.87, 129.84, 129.79, 129.27, 128.47, 128.28, 127.46, 127.18, 126.94, 126.81, 126.67, 123.84, 123.26, 122.82, 118.77, 115.49; IR (KBr) ν: 3411, 3233, 2394, 282, 2026, 1624, 1389, 1073, 775, 609, 476 cm -1. HRMS (ESI) calcd for C 24H 16O [M -H]- 320.1201, found 319.1075.2-苯基-1-羟基-7-甲基联三苯叉(4d ): 白色固体, 产率32%. m.p. 154.9~155.9 ℃; 1H NMR (400 MHz, CDCl 3) δ: 9.70 (d, J =9.4 Hz, 1H), 8.65 (d, J =9.1 Hz, 1H), 8.54 (d, J =8.4 Hz, 1H), 8.43 (s, 1H), 8.34 (d, J =8.5 Hz, 1H), 7.67~7.56 (m, 7H), 7.50 (dt, J =8.5, 4.2 Hz, 3H), 6.34 (s, 1H), 2.62 (s, 3H); 13C NMR (101 MHz, CDCl 3) δ: 150.33, 150.19, 137.59, 136.48, 134.63, 131.34, 130.43, 130.33, 129.39, 129.34, 129.13, 128.86, 128.74, 128.64, 128.41, 127.96, 127.61, 126.99, 122.68, 115.01, 20.37; IR (KBr) ν: 3691, 3497, 3412, 3270, 3026, 2037, 1747, 1552, 1492, 1444, 1403, 1332, 1274, 1209, 1182, 1106, 1073, 1008, 945, 886, 818, 764, 700, 565 cm -1. HRMS (ESI) calcd for C 25H 18O [M -H]- 334.1358, found 333.1489.辅助材料(Supporting Information) 提供了各化合物的氢谱、碳谱数据. 这些材料可以免费从本刊网站(/)上下载.References[1] Primi, D.; Fiordalisi, G.; Mantero, J. L.; Mattioli, S.; Sottini, A.;Bonelli, F.; Vaglini, L. WO 0028039, 2000 [Chem. Abstr. 2000,133, 1451].[2] Schulte, J. L.; Laschat, S.; Vill, V.; Nishikawa, E.; Finkelmann, H.;Nimtz, M. Eur. J. Org. Chem . 1998, 2499.[3] Breslow, R.; Jaun, B.; Kluttz, R. Q.; Xia, C. Z. Tetrahedron 1982,6, 863.[4] Fontes, E.; Heiney, P. A.; de Jeu, W. H. Phys. Rev. Lett . 1988, 61,1202.[5] Schmidt-Mende, L.; Fechtenkötter, A.; Müllen, K.; Moons, E.;Friend, R. H.; MacKenzie, J. D. Science 2001, 293, 1119.[6] Kawano, M.; Kawamichi, T.; Haneda, T.; Kojima,T.; Fujita, M. J.Am. Chem. Soc. 2007, 50, 15418.[7] Wettach, H.; Jester, S. S.; Colsmann, A.; Lemmer, U.; Rehmann,N.; Meerholz, K.; Höger, S. Synth. Met. 2010, 7~8, 691. [8] Huang, C.-J. M.S . Thesis , Tsinghua University, Xinzhu, Taiwan,2008 (in Chinese).(黄崇杰, 硕士论文, 国立清华大学, 新竹, 台湾, 2008.) [9] Li, Z.-W. M.S. Thesis , Tianjin University, Tianjin, 2012 (in Chi-nese).(李志伟, 硕士论文, 天津大学, 天津, 2012.) [10] Liu, J.-S. M.S. Thesis , Anhui Normal University, Wuhu, 2003 (inChinese).(刘金水, 硕士论文, 安徽师范大学, 芜湖, 2003.)[11] Mao, X.-H.; He, Z.-Q.; Zhang, C.-X. Chin. J. Org. Chem . 2006, 26,413 (in Chinese).(毛华香, 何志群, 张春秀, 有机化学, 2006, 26, 413.)[12] Cammidge, A. N.; Bushby, R. J. Hand Book of Liquid Crystals ,Vol. 2B, New York, 1998, Chapter VII.[13] Kumar, S.; Manickam, M. Chem. Commun . 1997, 17, 1615. [14] Kumar, S.; Varshney, S. K. Synthesis 2001, 0305.[15] Iwasaki, M.; Iino, S.; Nishihara, Y. Org. Lett. 2013, 20, 5326.[16] Pena, D.; Escudero, S.; Perez, D.; Guitian, E.; Castedo, L. Angew.Chem., Int. Ed. 1998, 37, 2659.[17] García-López, J. A, Greaney, M. F. Org. Lett. 2014, 9, 2338.[18] Le Berre, V.; Angely, L.; Simonet, J.; Mousset, G.; Bellec, M. J.Electroanal. Chem. Interf. Electrochem. 1987, 1, 173.[19] Freudemann, R.; Behnisch, B.; Hanack, M. J. Mater. Chem . 2001,11, 1618.[20] Nayak, M. K.; Wan, P. Photochem. Photobiol. Sci . 2008, 12, 1544. [21] Biegasiewicz, K. F.; Denis, J. D. S.; Carroll, V. M.; Priefer, R. Tet-rahedron Lett. 2010, 33, 4408.[22] Nairoukh, Z.; Fanun, M.; Schwarze, M.; Schomäcker, R.; Blum, J.J. Mol. Catal. A : Chem. 2014, 382, 93.(Lu, Y .)。
4_3H_喹唑啉酮类化合物的合成

参考文献 :
[1 ]Berman E M ,Werbel L M. The renewed potential for folate antagonists in contemporary cancer chemotherapy [ J ] . J . Med. Chem . ,1991 ,34 (2) :4792485.
合成方法反应条件温和 ,产率较高 ,但异氰酸酯毒 性大 。
M = O ,S ; Y= Ph ,42Cl —Ph ,42CH3 —Ph ,42NO2 —Ph
丁明武等 [ 8 ] 应用膦亚胺与芳基异氰酸酯的氮 杂 Wittig 反应 ,得到的碳二亚胺再与醇在醇钠催 化下反应 ,合成了 22烷氧基24 (3H) 2喹唑啉酮衍生 物 ,产率 58 %~84 %。该反应同样用到毒性大的 异氰酸酯 。合成路线如下 。
4( 3 H)2喹唑啉酮类化合物的合成
王先波1 ,郭燕文1 ,曹胜利 3 2
(1. 北京理工大学 理学院 ,北京 100081 ;2. 首都师范大学 化学系 ,北京 100037)
摘要 :综述了 4 (3H)2喹唑啉酮类化合物的几种主要合成方法 ,并进行简要的评述 。 关键词 :4 (3H)2喹唑啉酮 ;合成 ;综述 中图分类号 :O626 文献标识码 :A 文章编号 :025823283 (2006) 0220083203
化妆品安全技术规范

化妆品安全技术规范(报送稿)目录正文 (1)1 范围 (1)2术语和释义 (1)3 化妆品安全通用要求 (2)附录一、化妆品禁用组分 (4)表1 化妆品禁用组分(1)(2) (4)表2 化妆品禁用植(动)物组分(1)(2)(3) (92)附录二、化妆品限用组分 (98)表3 限用防腐剂(1) (98)表4 限用防晒剂(1) (105)表5 限用着色剂(1) (108)表6 限用染发剂(1)(3) (4) (129)表7 其他限用组分 (136)附录三、化妆品检测和评价方法 (148)一、理化检验方法 (148)(一)总则 (148)(二)禁用组分 (151)第1节4-氨基偶氮苯和联苯胺 (151)第2节4-氨基联苯及其盐 (155)第3节8-甲氧基补骨脂素等4种物质 (159)第4节α-氯甲苯 (163)第5节氨基己酸 (167)第6节斑蝥素 (170)第7节苯并[а]芘 (172)第8节丙烯酰胺 (175)第9节补骨脂素等4种物质 (179)第10节氮芥 (182)第11节二噁烷 (184)第12节镉 (187)第13节汞 (190)第14节环氧乙烷和甲基环氧乙烷 (195)第15节甲醇 (199)第16节马来酸二乙酯 (202)第17节米诺地尔 (206)第18节铅 (210)第19节氢醌、苯酚 (213)第20节砷 (219)第21节石棉 (225)第22节维甲酸和异维甲酸 (232)第23节维生素D2和维生素D3 (236)(三)限用组分 (239)第1节6-甲基香豆素 (239)第2节α-羟基酸 (246)第3节二硫化硒 (252)第4节过氧化氢 (255)第5节间苯二酚 (258)第6节可溶性锌盐 (260)第7节奎宁 (262)第8节硼酸和硼酸盐 (264)第9节羟基喹啉 (267)第10节巯基乙酸 (269)第11节水杨酸 (275)第12节酮麝香 (278)第13节游离氢氧化物 (280)第14节总硒 (282)(四)防腐剂 (285)第1节苯甲醇 (285)第2节苯甲酸及其钠盐 (292)第3节苯氧异丙醇 (299)第4节苯扎氯铵 (302)第5节苄索氯铵、劳拉氯铵和西他氯铵 (304)第6节甲醛 (306)第7节甲基氯异噻唑啉酮等12种物质 (312)第8节氯苯甘醚 (315)第9节三氯卡班 (317)第10节山梨酸和脱氢乙酸 (319)(五)防晒剂 (321)第1节苯基苯并咪唑磺酸等15种物质 (321)第2节二苯酮-2 (327)第3节二氧化钛 (330)第4节二乙氨羟苯甲酰基苯甲酸己酯 (332)第5节二乙基己基丁酰胺基三嗪酮 (334)第6节亚苄基樟脑磺酸 (336)第7节氧化锌 (339)(六)着色剂 (341)第1节酸性黄36等5种物质 (341)第2节酸性紫43等7种物质 (347)第3节着色剂CI 16185等10种物质 (350)(七)染发剂 (356)第1节对苯二胺等8种物质 (356)第2节对苯二胺等32种物质 (359)(八)去屑剂 (364)第1节水杨酸等5种物质 (364)(九)抗感染药物 (367)第1节氟康唑等9种物质 (367)第2节盐酸美满霉素等7种物质 (372)第3节依诺沙星等10种物质 (374)(十)激素 (378)第1节雌三醇等7种物质 (378)第2节氢化可的松等7种物质 (387)(十一)有机溶剂 (391)第1节二氯甲烷等15种物质 (391)(十二)其他 (396)第1节二甘醇 (396)第2节化妆品抗UV A能力仪器测定法 (400)第3节邻苯二甲酸二甲酯等10种物质 (402)第4节邻苯二甲酸二丁酯等8种物质 (407)第5节钕等15种元素 (412)第6节pH值 (415)第7节乙醇胺等5种物质 (417)二、微生物检验方法 (422)(一)总则 (422)(二)菌落总数 (424)(三)耐热大肠菌群 (427)(四)铜绿假单胞菌 (430)(五)金黄色葡萄球菌 (433)(六)霉菌和酵母菌 (436)三、毒理学试验方法 (438)(一)总则 (438)(二)急性经口毒性试验 (439)(三)急性经皮毒性试验 (441)(四)皮肤刺激性/腐蚀性试验 (443)(五)急性眼刺激性/腐蚀性试验 (446)(六)皮肤变态反应试验 (449)(七)皮肤光毒性试验 (453)(八)鼠伤寒沙门氏菌/回复突变试验 (456)(九)体外哺乳动物细胞染色体畸变试验 (463)(十)体外哺乳动物细胞基因突变试验 (466)(十一)哺乳动物骨髓细胞染色体畸变试验 (469)(十二)体内哺乳动物细胞微核试验 (472)(十三)睾丸生殖细胞染色体畸变试验 (475)(十四)亚慢性经口毒性试验 (478)(十五)亚慢性经皮毒性试验 (481)(十六)致畸试验 (485)(十七)慢性毒性/致癌性结合试验 (488)四、人体安全性检验方法 (493)(一)总则 (493)(二)人体皮肤斑贴试验 (494)(三)人体试用试验安全性评价 (497)五、人体功效评价检验方法 (499)(一)总则 (499)(二)防晒化妆品防晒指数(SPF值)测定方法 (500)(三)防晒化妆品防水性能测试方法 (506)(四)防晒化妆品长波紫外线防护指数(PFA值)测定方法 (508)正文1 范围本规范规定了化妆品的安全技术要求,包括通用要求、禁限用组分要求以及检验评价方法等。
一种唑啉草酯的制备方法[发明专利]
![一种唑啉草酯的制备方法[发明专利]](https://img.taocdn.com/s3/m/2e1f36e077eeaeaad1f34693daef5ef7bb0d1247.png)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 201810512382.4(22)申请日 2018.05.25(71)申请人 江苏中旗科技股份有限公司地址 210048 江苏省南京市化学工业园区长丰河路309号江苏中旗科技股份有限公司(72)发明人 卜龙 张璞 钱梓伟 侯远昌 王凤云 (74)专利代理机构 常州市权航专利代理有限公司 32280代理人 黄晶晶(51)Int.Cl.C07D 498/04(2006.01)(54)发明名称一种唑啉草酯的制备方法(57)摘要本发明涉及有机合成领域,尤其涉及一种唑啉草酯的合成方法,包括如下步骤:包括如下步骤:4-甲基-2,6-二乙基苯胺在氯化铜或氯化亚铜的催化下与1,1二氯乙烯、亚硝酸酯反应生成化合物1;化合物1与醇钠反应,反应产物经酸性水解得到化合物2;化合物2与碳酸二酯、强碱反应得到中间体3;二甘醇二甲磺酸酯与水合肼反应后,再与盐酸成盐得到中间体4;中间体3和4在碱的作用下成环得到化合物5;化合物5在碱或碱/DMAP的作用下与特戊酰氯得到唑啉草酯。
本发明提供的唑啉草酯的合成方法不使用昂贵或有毒的催化剂,不需要采用保护/脱保护的策略,具有低成本,高原子经济性的特点。
权利要求书2页 说明书7页CN 110526927 A 2019.12.03C N 110526927A1.一种唑啉草酯的制备方法,其特征在于包括如下步骤:(1)4-甲基-2,6-二乙基苯胺在氯化铜或氯化亚铜的催化下与1,1二氯乙烯、亚硝酸酯反应生成化合物1;(2)化合物1与醇钠反应,反应产物经酸性水解得到化合物2;(3)化合物2与碳酸二酯、强碱反应得到中间体3;所述强碱包括氨基钠、叔丁醇钾、叔丁醇钠或氢化钠。
(4)二甘醇二甲磺酸酯与水合肼反应后,再与盐酸成盐得到中间体4;(5)中间体3和4在碱的作用下成环得到化合物5;(6)化合物5在碱或碱/DMAP的作用下与特戊酰氯得到唑啉草酯;上述反应的反应式如下:其中,R1和R2各自独立的选自C1~5烷基。
磷氯化物_PCl_3_PCl_5_省略_化试剂在有机合成中应用的研究进展_唐除痴

RO O
O
(RO)3P =S +POCl3
P
+ ROPCl2 (R =C1 ~ 4烷基)
RS Cl 8
近来的研究表明[ 107 , 114 ~ 123] , 上述异构化氯化反应可以扩展到 O , O -二烷基硫代磷(膦)酸酯 9 , 成为合成各种各样 S -烷基不对称硫代磷(膦)酰氯10 的一种通用的 、便利的新方法 。 10 进一步 与各种亲核试剂反应可以便利地得到含烷硫基的不对称硫(二硫)代磷(膦)酸酯11 , 因此这一反应 在有机磷农药新药合成[ 124~ 128] 和老品种的新工艺(如甲胺磷[ 129] , 速丙磷[ 130] )方面均可得到应用 。
2 与羧酸的反应
2 .1 生成酰氯 羧酸与磷氯化物反应生成酰氯 , 这是制备酰氯的重要方法之一 。 对链烃脂肪酸来说 , 常用的氯
化剂为三氯化磷[ 36~ 42] 。 芳香羧酸可用三氯化磷 、五氯化磷(三氯化磷/ 氯气)[ 43~ 44] 或三氯氧磷[ 44] 为氯化剂 。 其它取代羧酸如杂环[ 45] 、芳烷基[ 46] 、胺基[ 47 ~ 49] 、环烷基[ 50, 51] 的羧酸以及草酸[ 52] 均能 与磷氯化物反应生成高产率的酰氯 。此外 , 磷氯化物还可以使聚合物中的羧基转化为酰氯[ 53, 54] 。 2 .2 生成三氯甲基衍生物
通常只有芳香羧酸或杂环羧酸才能被转化成三氯甲基衍生物 。 如烟酸高产率转化为 3 -三氯
本文 1997 -12 -29 收到 唐除痴 , 男 , 59 岁 , 教授 , 博士生导师 , 主要从事杂原子有机化学及农药化学的研究 。
·2·
第四章 酰化反应 答案
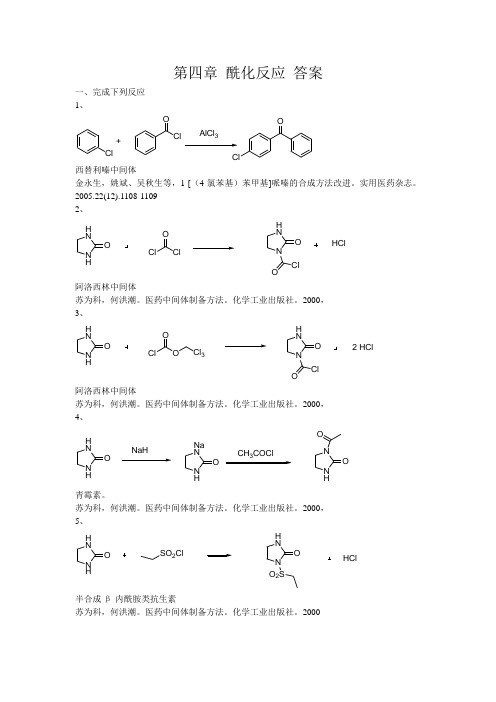
第四章 酰化反应 答案一、完成下列反应 1、ClClClOO+AlCl 3西替利嗪中间体金永生,姚斌、吴秋生等,1-[(4-氯苯基)苯甲基]哌嗪的合成方法改进。
实用医药杂志。
2005.22(12).1108-1109 2、 N HH NO ClO ClN H NO ClOHCl阿洛西林中间体苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 3、 N HH NO ClO ON H NO ClO2 HClCl 3阿洛西林中间体苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 4、 N HH NO NaHN HNa NO CH COClN HNO O青霉素。
苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 5、 N HH NO SO 2ClN H NO O 2SHCl半合成β-内酰胺类抗生素苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
20006、OOO3C OCH 2CH 2COOH芬不芬章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,1340 7N HS CH3C O O CCH O NS COCH 3乙酰丙嗪8NH 2COOHNHCOCH 3COOH安眠酮章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,13 9N N SH 2NSHCH3C O CCH 3O N N S HN SHCOCH 3乙酰唑胺章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,14 10 NH 2OHCH3C O O CCH O NHCOCH 3OH嘧啶苯芥章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,15 11 NH 23NHCOCH 3磺胺类药物章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,17 12NH2 F3CCl2NHCOClF3CClCH3CN卤卡班章思规。
实用精细化学品手册(有机卷)下。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2010年第30卷有机化学V ol. 30, 2010第8期, 1201~1206 Chinese Journal of Organic Chemistry No. 8, 1201~1206lujunrui@*E-mail:Received December 11, 2009; revised January 20, 2010; accepted March 31, 2010.国家自然科学基金(Nos. 20776114, 20976135)、天津市高校科技发展基金(No. 2006ZD33)资助项目.1202有 机 化 学 V ol. 30, 2010to 100% at 0.01% mass concentration, which displayed excellent antibacterial activities; and the inhibitory rates against Monilia albican and Staphlococcus aureus were over 70%, which exhibited a certain extent antibacterial activities. The inhibitory rates against Moniliaalbican and Escherichia coli of the compounds 4a ~4f reached to 100% at 0.01% mass concentration, which displayed excellent antibacterial activities. The inhibitory rates against Staphlococcus aureus were over 78%, which exhibited a certain extent antibacterial activities. Comparing with those of 3a ~3f , the inhibitory rates of the compounds 4a ~4f were enhanced. Keywords 2-phenylhydrazono-3-(o -hydroxybenzoylhydrazono)-ethyl butanoate; 1-(o-hydroxybenzoyl)-4- substituted phenylhydrazono-pyrazolone; synthesis; characterization; antibacterial-activity邻羟基二苯醚类化合物是目前广为流行的高效广谱杀菌剂. 生物信息学研究表明, 邻羟基二苯醚类化合物的杀菌作用是通过破坏和终断细菌的脂肪酸生物合成实现的[1]. 邻羟苯基对FabI 基因、NAD +辅酶等病原体靶标具有很好的亲合性, 在化合物抑杀病原体过程中起关键作用, 可作为设计抗菌、抗病毒药物分子的核心结构单元[2~4].吡唑啉类化合物具有很好的抗菌[5~8]、抗结核[9]等生物活性, 近年越来越多地用作高效低毒的广谱抗菌药物. 杀菌机制研究表明, 该类化合物对羊毛甾醇、14α-去甲基化酶等病原体靶标具有较强的亲合性和特异性, 其杀菌作用主要是通过唑环氮原子与病原菌体内麦角甾醇的酶系细胞色素P-450的铁结合, 干扰酶系活性, 阻断麦角甾醇前体羊毛甾醇14α-脱甲基化反应, 从而抑制麦角甾醇的合成而抑制病原菌生长或使其死亡[10~12].腙类化合物具有优良的生物活性[13,14]、强的配位能力、多样化的配位形式、很好的亲脂性, 能与生物体细胞中的金属离子形成稳定的配合物, 从而可以影响相关的酶促反应, 具有很好的研究前景.基于以上研究, 为了研制出抗菌活性更高、谱更广、低毒的化合物, 依据生物活性叠加原理, 将上述三类化合物的核心结构片断邻羟苯基、吡唑啉、苯腙进行合理组装和修饰, 构建了2-取代苯腙基-3-(2-羟基苯甲酰腙基)-丁酸乙酯(3a ~3f )和1-(2-羟基苯甲酰基)-3-甲基-4-取代苯腙基-吡唑啉酮(4a ~4f )两类化合物. 计算表明, 两类化合物中氢键接受体(HA)个数小于10, 氢键供给体(HD)个数小于5, 均符合Lipinski5规则[15]. 共合成了12种化合物, 其中8种化合物未见报道, 12种化合物的生物活性均未见报道. 化合物4a , 4c , 4e , 4f 的合成已见报道[16], 但未见4c , 4e , 4f 的表征数据, 本文采用新的合成方法高收率制备了上述化合物. 生物活性测试表明, 质量浓度为0.01%时, 化合物3a ~3f 对大肠杆菌的抑菌率高达100%, 具有强抑菌活性, 对白色念球菌的抑菌率均在80%以上, 对金黄色葡萄球菌的抑菌率均高于70%, 具有一定的抑菌活性. 化合物4a ~4f 对白色念球菌、大肠杆菌的抑菌率高达100%, 具有强抑菌活性, 对金黄色葡萄球菌的抑菌率均高于80%, 具有一定的抑菌活性, 与3a ~3f 相比, 形成吡唑啉酮环后化合物的抗菌活性更高. 合成路线如Scheme 1所示.R =H (a ), 4-Br (b ), 4-Cl (c ), 3-Cl (d ), 4-NO 2 (e ), 2-OCH 3 (f )Scheme 1No. 8 邹敏等:1-(2-羟基苯甲酰基)-3-甲基-4-取代苯腙基-吡唑啉酮及其中间体的合成、表征及抑菌活性12031 实验部分1.1 试剂与仪器美国尼高立仪器公司的Avatar370型红外光谱仪(KBr压片); 美国Bruker公司的300, 400 MHz型核磁共振仪(TMS为内标, CDCl3或DMSO-d6为溶剂); 日本Yanaco公司的Yanaco CHN CORDER MF-3型元素分析仪; 上海亚荣生化仪器厂RE-52AA型旋转蒸发仪; 天津市仪器分析厂RY-1型熔点测定仪, 温度计未校正.芳香胺、水杨酸甲酯、乙酰乙酸乙酯、N,N-二甲基甲酰胺及溶剂等为分析纯, 亚硝酸钠、碳酸钠等为化学纯, TLC选用青岛海洋化工厂硅胶GF2, 于紫外灯下观察或碘蒸气显色.1.2 实验过程1.2.1 重氮盐溶液的制备在装有电磁搅拌、温度计和冷凝器的100 mL三颈瓶中, 加入2.81 g (30 mmol)苯胺, 室温加入8 mL浓盐酸及6 mL水, 搅拌20 min, 形成苯胺盐酸盐溶液, 冰浴降至0 ℃, 液面下将2.2 g (30.30 mmol)亚硝酸钠的水溶液一次快速加入, 始终保持淀粉碘化钾试纸呈微蓝色,搅拌0.5 h, 停止反应, 得到淡黄色透明重氮液.1.2.2 2-取代苯腙基-3-羰基-丁酸乙酯的合成在装有电磁搅拌、温度计和冷凝器的100 mL三颈瓶中, 加入3.90 g (30 mmol)乙酰乙酸乙酯、50 mL乙醇, 7.30 g (90 mmol)乙酸钠水溶液, 将上述重氮液缓慢加入此混合液中, 温度控制10 ℃以下, 搅拌反应5 h, TLC跟踪[展开剂: V(石油醚)∶V(乙酸乙酯)=5∶1], 停止反应,室温静置, 抽滤, 水洗, 乙醇重结晶, 得橙黄色2-苯腙基-3-羰基-丁酸乙酯固体6.07 g, 产率87.2%, m.p. 70~71 ℃; 1H NMR (300 MHz, DMSO) δ: 14.25 (s, 1H, NH), 7.53 (d,J=8.4 Hz, 2H, ArH), 7.43 (t, J=7.8 Hz, 2H, ArH), 7.19 (t, J=7.5 Hz, 1H, ArH), 4.25 (q, J=7.2 Hz,2H, CH2), 3.37 (s, 3H, OCH3) 1.31 (t, J=6.9 Hz, 3H, CH3); IR (KBr) ν: 2830 (CO—H), 1718 (C=O), 1737 (C=O), 1590、1506 (C=C) cm-1.参照上述方法制得: 2-(4-溴苯腙基)-3-羰基-丁酸乙酯, 黄色固体, 产率87.0%, m.p. 87~89 ℃; 2-(4-氯苯腙基)-3-羰基-丁酸乙酯, 黄色固体, 产率84.5%, m.p. 79~80 ℃; 2-(3-氯苯腙基)-3-羰基-丁酸乙酯, 黄色固体, 产率81.7%, m.p. 65~67 ℃; 2-(4-硝基苯腙基)-3-羰基-丁酸乙酯, 黄色固体, 产率80.5%, m.p. 118~120 ℃; 2-(2-甲氧基苯腙基)-3-羰基-丁酸乙酯, 黄色固体, 产率81.9%, m.p. 105~107 ℃. 1.2.3 2-取代苯腙基-3-(2-羟基苯甲酰腙基)-丁酸乙酯的合成在装有电磁搅拌、温度计和冷凝器的100 mL三颈瓶中, 加入2.34 g (10 mmol) 2-苯腙基-3-羰基-丁酸乙酯和 1.55 g (10.05 mmol)水杨酰肼, 加入适量乙醇溶解, 搅拌, 并缓慢加热至回流, 反应过程中不断有黄色固体生成, 回流温度下反应8 h, TLC跟踪[展开剂: V(石油醚)∶V(乙酸乙酯)=3∶1], 待2-苯腙基-3-羰基-丁酸乙酯反应完全后, 停止反应, 静置, 抽滤, 滤饼用无水乙醇重结晶, 得目标化合物 3.02 g. 参照上述方法制得同系列目标化合物, 化合物3a~3f的物理性质, IR 和1H NMR数据如下.2-苯腙基-3-(2-羟基苯甲酰腙基)-丁酸乙酯(3a): 黄色晶体, 收率82.1%. m.p. 150~151 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 14.78 (s, 1H, OH), 11.80 (s, 1H, NH), 11.61 (s, 1H, NH), 8.04 (dd, J=7.8, 1.2 Hz, 1H, ArH), 7.38~7.51 (m, 5H, ArH), 7.07~7.09 (m, 3H, ArH), 4.26 (q, J=6.9 Hz, 2H, OCH2), 2.31 (s, 3H, CH3), 1.32 (t, J=7.1 Hz, 3H, CH3); IR (KBr) ν: 3386 (OH), 3285 (NH), 2873 (CH3), 2850 (CH2), 1630 (C=N), 1723 (C=O), 1594, 1501 (C=C) cm-1. Anal. calcd for C19H20N4O4: C 61.95, H 4.47, N 15.21; found C 61.91, H 4.50, N 15.25.2-(4-溴苯腙基)-3-(2-羟基苯甲酰腙基)-丁酸乙酯(3b): 黄色晶体, 收率81.5%. m.p. 228~230 ℃; 1H NMR (CDCl3, 300 MHz) δ: 14.61 (s, 1H, OH), 13.13 (s, 1H, NH), 9.70 (s, 1H, NH), 7.67 (d, J=7.8 Hz, 1H, ArH), 7.36~7.50 (m, 4H, ArH), 7.08 (d,J=8.0 Hz, 1H, ArH), 6.90~7.05 (m, 2H, ArH), 4.36 (q, J=6.8 Hz, 2H, OCH2), 2.41 (s, 3H, CH3), 1.26 (t, J=7.1 Hz, 3H, CH3); IR (KBr) ν: 3391 (OH), 3281 (NH), 2875 (CH3), 2855 (CH2), 1635 (C=N), 1725 (C=O), 1590, 1482 (C=C) cm-1. Anal. calcd for C19H19Br N4O4: C 51.02, H 4.28, N 12.53; found C 49.97, H 4.32, N 12.50.2-(4-氯苯腙基)-3-(2-羟基苯甲酰腙基)-丁酸乙酯(3c): 黄色晶体, 收率84.9%. m.p. 214~215 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 14.70 (s, 1H, OH), 13.19 (s, 1H, NH), 9.74 (s, 1H, NH), 7.64 (d, J=7.8 Hz, 1H, ArH), 7.28~7.46 (m, 4H, ArH), 7.08 (d,J=8.0 Hz, 1H, ArH), 6.87~7.03 (m, 2H, ArH), 4.34 (q, J=7.2 Hz, 2H, CH2), 2.41 (s, 3H, CH3), 1.26 (t, J=7.1 Hz, 3H, CH3); IR (KBr) ν: 3397 (OH), 3290 (NH), 2879 (CH3), 2858 (CH2), 1639 (C=N), 1720 (C=O), 1595, 1485 (C=C) cm-1. Anal. calcd for C19H19Cl N4O4: C 56.65, H 4.75, N 13.91; found C 56.62, H 4.73, N 13.95.1204有机化学V ol. 30, 20102-(3-氯苯腙基)-3-(2-羟基苯甲酰腙基)-丁酸乙酯(3d): 黄色晶体, 收率85.1%. m.p. 230~232 ℃; 1H NMR (CDCl3, 300 MHz) δ: 13.58 (s, 1H, OH), 10.63 (s, 1H, NH), 10.57 (s, 1H, NH), 7.75 (dd, J=8.0, 0.8 Hz, 1H, ArH), 7.51~7.55 (m, 2H, ArH), 7.37 (t, J=8.0 Hz, 1H, ArH), 7.23~7.28 (m, 2H, ArH), 7.06 (d, J=8.4 Hz, 1H, ArH), 6.98 (t,J=7.2 Hz, 1H, ArH), 4.35 (q, J=6.8 Hz, 2H, CH2), 2.41 (s, 3H, CH3), 1.26 (t, J=7.1 Hz, 3H, CH3); IR (KBr) ν: 3393 (OH), 3301 (NH), 1732 (C=O), 2860 (CH3), 1635 (C=N), 1722 (C=O), 1597, 1496 (C=C) cm-1. Anal. calcd for C19H19Cl N4O4: C 56.65, H 4.75, N 13.91; found C 56.70, H 4.72, N 13.94.2-(4-硝基苯腙基)-3-(2-羟基苯甲酰腙基)-丁酸乙酯(3e): 黄色粉末, 收率86.2%. m.p. 195~198 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 14.71 (s, 1H, OH), 12.99 (s, 1H, NH), 10.05 (s, 1H, NH), 8.31 (d, J=9.0 Hz, 1H, ArH), 8.20 (d,J=9.0 Hz, 1H, ArH), 8.01~8.04 (m, 1H, ArH), 7.42~7.51 (m, 3H, ArH), 7.02~7.091 (m, 2H, ArH), 4.30 (q, J=6.9 Hz, 2H, CH2), 2.10 (s, 3H, CH3), 1.33 (t, J=7.1 Hz, 3H, CH3); IR (KBr) ν: 3415 (OH), 3316 (NH), 2883 (CH3), 2861 (CH2), 1729 (C=O), 1639 (C=N), 1605 1495 (C=C) cm-1. Anal. calcd for C19H19N5O6: C 55.20, H 4.63, N 16.94; found C 55.16, H 4.61, N 16.98.2-(2-甲氧基苯腙基)-3-(2-羟基苯甲酰腙基)-丁酸乙酯(3f): 黄色粉末, 收率84.0%. m.p. 182~184 ℃; 1H NMR (CDCl3, 400 MHz) δ: 13.71 (s, 1H, OH), 10.82 (s, 1H, NH), 10.67 (s, 1H, NH), 8.11 (d, J=8.0 Hz, 1H, ArH), 7.78 (d,J=6.4 Hz, 1H, ArH), 7.23~7.50 (m, 2H, ArH), 7.04~7.07 (m, 2H, ArH), 6.95~6.98 (m, 2H, ArH), 4.28 (q, J=7.2 Hz, 2H, CH2), 3.90 (s, 3H, OCH3), 2.34 (s, 3H, CH3), 1.26 (t,J=7.1 Hz, 3H, CH3); IR (KBr) ν: 3390 (OH), 3289 (NH), 2876 (CH3), 2857 (CH2), 1721 (C=O), 1633 (C=N), 1599, 1489 (C=C) cm-1. Anal. calcd for C20H22N4O5: C 60.29, H 5.57, N 14.06; found C 60.33, H 5.54, N 14.03.1.2.4 1-(2-羟基苯甲酰基)-3-甲基-4-取代苯腙基-吡唑啉酮的合成在装有电磁搅拌、温度计和冷凝器的50 mL三颈瓶中, 加入2.11 g (6 mmol) 2-苯腙基-3-(2-羟基苯甲酰腙基)-丁酸乙酯, 加入适量冰醋酸, 搅拌, 并缓慢加热至回流, TLC跟踪[展开剂: V(石油醚)∶V(乙酸乙酯)=2∶1], 回流温度反应7 h, 停止反应, 静置, 抽滤, 滤饼用冰醋酸重结晶, 得目标化合物 1.65 g. 参照上述方法制得同系列目标化合物, 化合物4a~4f的物理性质、IR 和1H NMR数据如下.1-(2-羟基苯甲酰基)-3-甲基-4-苯腙基-吡唑啉酮(4a): 黄色晶体, 收率85.2%. m.p. 176~179 ℃; 1H NMR (CDCl3, 300 MHz) δ: 13.39 (s, 1H, OH), 10.70 (s, 1H, NH), 8.00 (dd, J=8.1, 1.5 Hz, 1H, ArH), 7.49~7.54 (m,1H, ArH), 7.44 (d, J=6.0 Hz, 4H, ArH), 7.27 (t, J=4.2 Hz, 1H, ArH), 7.04 (d, J=7.5 Hz, 1H, ArH), 6.94 (t, J=7.6 Hz, 1H), 2.40 (s, 3H, CH3); IR (KBr) ν: 3346 (OH), 3215 (NH), 1670 (pyrazole-C=O), 1539 (pyrazole-C=N), 1490 (C=C) cm-1. Anal. calcd for C17H14N4O3: C 63.35,H 4.38, N 17.38; found C 63.38, H 4.40, N 17.33.1-(2-羟基苯甲酰基)-3-甲基-4-(4-溴苯腙基)-吡唑啉酮(4b): 黄色晶体, 收率82.4%. m.p. 149~151 ℃; 1H NMR (CDCl3, 300 MHz) δ: 13.39 (s, 1H, OH), 10.66 (s,1H, NH), 7.99 (dd, J=8.1, 1.5 Hz, 1H, ArH), 7.54 (t, J=4.2 Hz, 1H, ArH), 7.45 (d, J=1.5 Hz, 4H, ArH), 7.24~7.27 (m, 1H, ArH), 6.95 (t, J=7.8 Hz, 1H, ArH), 2.39 (s,3H, CH3); IR (KBr) ν: 3342 (OH), 3301 (NH), 1671 (pyrazole-C=O), 1541 (pyrazole-C=N), 1485 (C=C) cm-1. Anal. calcd for C17H13BrN4O3: C 50.89, H 3.27, N 13.96; found C 50.90, H 3.25, N 14.00.1-(2-羟基苯甲酰基)-3-甲基-4-(4-氯苯腙基)-吡唑啉酮(4c): 黄色粉末, 收率84.1%. m.p. 223~224 ℃; 1H NMR (CDCl3, 300 MHz) δ: 13.29 (s, 1H, OH), 10.55 (s,1H, NH), 7.92 (dd, J=8.1, 1.2 Hz, 1H, ArH), 7.45 (t, J=7.8 Hz, 1H, ArH), 7.33 (d, J=1.5 Hz, 4H, ArH), 6.97 (d,J=8.4 Hz, 1H, ArH), 6.87 (t, J=7.8 Hz, 1H, ArH), 2.32 (s, 3H, CH3); IR (KBr) ν: 3349 (OH), 3315 (NH), 1677 (pyrazole-C=O), 1542 (pyrazole-C=N), 1481 (C=C) cm-1. Anal. calcd for C17H13ClN4O3: C 57.23, H 3.67, N 15.70; found C 57.24, H 3.65, N 15.73.1-(2-羟基苯甲酰基)-3-甲基-4-(3-氯苯腙基)-吡唑啉酮(4d): 黄色粉末, 收率86.5%. m.p. 145~147 ℃; 1H NMR (CDCl3, 300 MHz) δ: 13.31 (s, 1H, OH), 10.63 (s,1H, NH), 8.02 (d, J=8.0 Hz, 1H, ArH), 7.54 (t, J=4.4 Hz,2H, ArH), 7.38 (t, J=8.0 Hz, 1H, ArH), 7.23~7.28 (m,2H, ArH), 7.06 (d, J=8.4 Hz, 1H, ArH), 6.98 (t, J=4.2 Hz, 1H, ArH), 2.41 (s, 3H, CH3); IR (KBr) ν: 3352 (OH), 3320 (NH), 1670 (pyrazole-C=O), 1553 (pyrazole-C=N), 1458 (C=C) cm-1. Anal. calcd for C17H13ClN4O3: C 57.23, H 3.67, N 15.70; found C 57.19, H 3.70, N 15.74.1-(2-羟基苯甲酰基)-3-甲基-4-(4-硝基苯腙基)-吡唑啉酮(4e): 黄色粉末, 收率89.7%. m.p. 238~240 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 13.73 (s, 1H, OH), 11.05 (s, 1H, NH), 8.28 (d, J=9.2 Hz, 2H, ArH), 7.84 (d, J=9.2 Hz, 2H, ArH), 7.34 (d, J=7.6 Hz, 2H, ArH), 6.90 (d, J=No. 8邹敏等:1-(2-羟基苯甲酰基)-3-甲基-4-取代苯腙基-吡唑啉酮及其中间体的合成、表征及抑菌活性12057.6 Hz, 2H, ArH), 2.50 (s, 3H, CH 3); IR (KBr) ν: 3362 (OH), 3326 (NH), 1679 (pyrazole-C =O), 1555 (pyrazole- C =N), 1478 (C =C) cm -1. Anal. calcd for C 17H 13N 5O 5: C 55.59, H 3.57, N 19.07; found C 55.62, H 3.55, N 19.04.1-(2-羟基苯甲酰基)-3-甲基-4-(2-甲氧基苯腙基)-吡唑啉酮(4f ): 黄色粉末, 收率82.0%. m.p. 246~248 ℃;1H NMR (CDCl 3, 400 MHz) δ: 13.64 (s, 1H, OH), 10.82(s, 1H, NH), 8.10 (d, J =8.0 Hz, 1H, ArH), 7.78 (d, J =9.4 Hz, 1H, ArH), 7.52 (t, J =5.8 Hz, 1H, ArH), 7.20~7.23 (m, 1H, ArH), 7.00~7.07 (m, 2H, ArH), 6.96~6.98 (m, 2H, ArH), 3.96 (s, 3H, CH 3O), 2.40 (s, 3H, CH 3); IR (KBr) ν: 3342 (OH), 3203 (NH), 1673 (pyrazole-C =O), 1541 (pyrazole-C =N), 1488 (C =C) cm -1. Anal. calcd for C 18H 16N 4O 4: C 61.36, H 4.58, N 15.70; found C 61.32, H 4.60, N 15.66.1.3 目标化合物的抑菌活性测试按照国标GB15979-2002《一次性使用卫生标准》中溶出性抑菌产品抑菌性能实验方法进行, 所用菌株为大肠杆菌(Ec ) (8099)、金黄色葡萄球菌(Sa ) (ATCC 6538)、白色念珠菌(Ma ) (ATCC10231), 均由预防医学科学院消毒检测中心提供, 试样质量浓度均为0.01%, 结果见表1.表1 化合物3a ~3f 和4a ~4f 的抑菌活性数据aTable 1 Antibacterial activities of 3a ~3f and 4a ~4fCompd. Inhibitory ratio/%Ma Ec Sa 3a 89.6 90.3 74.2 3b 95.2 100 79.0 3c 96.0 10079.03d 93.6 90.1 70.1 3e 87.7 80.0 72.0 3f 82.7 84.2 78.7 4a 100 97.6 78.9 4b 100 100 89.8 4c 100 100 83.8 4d 99.3 10089.04e 100 98.0 83.2 4f97.7 90.1 81.9Fluconazole 99.2 95.5 80.1 aReaction time: 20 min.2 结果与讨论2.1 中间体及目标化合物的合成腙类化合物通常由重氮盐还原制得苯肼, 苯肼再与羰基化合物缩合制得, 我们采用重氮盐与具有活泼亚甲基的乙酰乙酸乙酯反应, 直接得到腙类化合物2a ~2f , 反应过程中需加入过量的乙酸钠, 重氮液与乙酸钠的物质的量比为1∶3时收率较佳, 过量的乙酸钠用于中和重氮液制备过程中过量的盐酸, 并为反应提供弱酸性环境.介质的酸碱性对3a ~3f 的制备有显著影响, 酸性介质(如醋酸)中, 反应难以停留在席夫碱3a ~3f 阶段, 而是快速闭环生成化合物4a ~4f , 这可能是文献[16]无法制得化合物3a ~3f 的重要原因. 与通常的席夫碱制备反应不同[4], 由于分子内闭环反应的存在, 酸性介质不利于席夫碱3a ~3f 的制备, 要制备高收率的席夫碱3a ~3f , 反应介质需要控制在中性或弱碱性进行.化合物4a ~4f 的合成经历了生成席夫碱3a ~3f 及其分子内闭环反应, 介质对化合物3a ~3f 的分子内闭环反应有很大影响, 如1-(2-羟基苯甲酰基)-3-甲基-4-(4-硝基苯腙基)-吡唑啉酮(4e )的制备, 单用甲苯作溶剂, 该反应需53 h, 产率73.1%; 用甲苯作溶剂、冰醋酸作催化剂, 该反应仅需14 h, 产率80.5%; 单用N ,N -二甲基甲酰胺作溶剂, 该反应需48 h, 产率79.1%; 用N ,N-二甲基甲酰胺作溶剂、冰醋酸作催化剂, 该反应仅需11 h, 产率84.3%; 用冰醋酸作溶剂, 反应仅需7 h, 产率高达89.7%, 推测其关环机理如Scheme 2所示。
