高中化学式大全2018
常见物质的化学式

常见物质的化学式1. 水:化学式为H2O,是由两个氢原子和一个氧原子形成的化合物。
2. 盐酸:化学式为HCl,是由氢原子和氯原子形成的一种无机强酸。
3. 乙醇:化学式为C2H5OH,是一种有机化合物,常见于酒精、燃料和医药制剂中。
4. 二氧化碳:化学式为CO2,是一种无色无味的气体,在饮料、汽车尾气等领域广泛应用。
5. 氨水:化学式为NH3·H2O,是由氨和水混合而成的溶液,常用于农业和制造化学品。
6. 甲烷:化学式为CH4,是一种无色无味的气体,是天然气的主要成分。
7. 葡萄糖:化学式为C6H12O6,是一种单糖,是生命活动所必需的能源物质。
8. 碳酸钙:化学式为CaCO3,是一种常见的无机盐,广泛应用于建筑材料和药品等领域。
9. 氯化钠:化学式为NaCl,是一种无机盐,也称为食盐,是人类日常生活中必不可少的调味品。
10. 铁:化学符号为Fe,是一种化学元素,常见于钢铁制造和医药制剂中。
11. 氧气:化学式为O2,是一种无色无味的气体,是生命活动所必需的气体之一。
12. 硝酸:化学式为HNO3,是一种无机强酸,是制造化学品和炸药的重要原料。
13. 硫酸:化学式为H2SO4,是一种无机强酸,广泛应用于制造化学品和肥料等领域。
14. 氢气:化学式为H2,是一种无色无味的气体,是太阳和其他恒星中最丰富的元素之一。
15. 氯气:化学式为Cl2,是一种黄绿色气体,广泛应用于消毒和水处理等领域。
16. 聚乙烯:化学式为(C2H4)n,是一种常见的合成聚合物,广泛应用于塑料制品和包装材料等领域。
17. 硝酸盐:化学式为NO3-,是一种无机离子,广泛应用于制造肥料和炸药等领域。
18. 酒石酸:化学式为C4H6O6,是一种有机酸,常用于制造食品添加剂和药品等领域。
19. 脲:化学式为CH4N2O,是一种有机化合物,广泛应用于制造化学品和农药等领域。
20. 氢氧化钠:化学式为NaOH,是一种无机强碱,广泛应用于制造肥料、纸浆和石硫合成等领域。
高一化学必背的化学方程式汇总
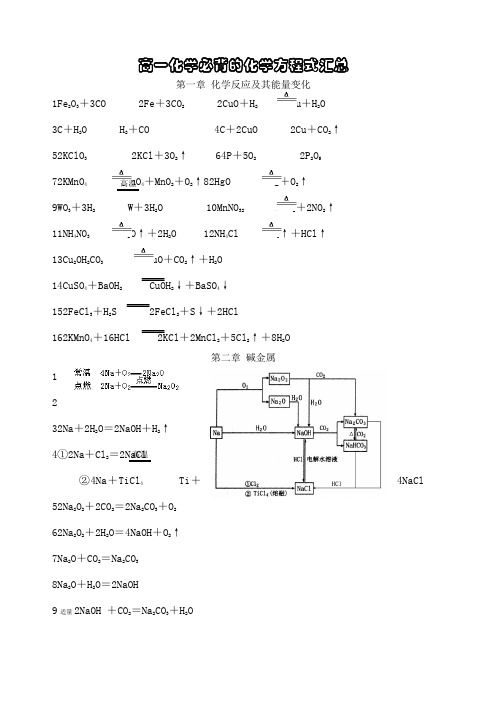
高一化学必背的化学方程式汇总第一章 化学反应及其能量变化1Fe 2O 3+3CO 2Fe +3CO 2 2CuO +H 2 Cu +H 2O 3C +H 2O H 2+CO 4C +2CuO 2Cu +CO 2↑ 52KClO 3 2KCl +3O 2↑ 64P +5O 2 2P 2O 5 72KMnO 4 K 2MnO 4+MnO 2+O 2↑82HgO 2Hg +O 2↑ 9WO 3+3H 2 W +3H 2O 10MnNO 32 MnO 2+2NO 2↑ 11NH 4NO 3 N 2O ↑+2H 2O 12NH 4Cl NH 3↑+HCl ↑ 13Cu 2OH 2CO 3 2CuO +CO 2↑+H 2O 14CuSO 4+BaOH 2 CuOH 2↓+BaSO 4↓ 152FeCl 3+H 2S 2FeCl 2+S ↓+2HCl162KMnO 4+16HCl 2KCl +2MnCl 2+5Cl 2↑+8H 2O第二章 碱金属1 232Na +2H 2O =2NaOH +H 2↑4①2Na +Cl 2=2NaCl②4Na +TiCl 4 Ti +4NaCl52Na 2O 2+2CO 2=2Na 2CO 3+O 2 62Na 2O 2+2H 2O =4NaOH +O 2↑ 7Na 2O +CO 2=Na 2CO 3 8Na 2O +H 2O =2NaOH9适量2NaOH +CO 2=Na 2CO 3+H 2O高温 高温10过量NaOH +CO 2=NaHCO 311NaOH +HCl =NaCl +H 2O 122NaCl +2H 2O 2NaOH +H 2↑+Cl 2↑ 13Na 2CO 3+CO 2+H 2O =2NaHCO 3142NaHCO 3 Na 2CO 3+CO 2↑+H 2O 15Na 2CO 3+2HCl =2NaCl +H 2O +CO 2↑反应相对NaHCO 3慢 16NaHCO 3+HCl =NaCl +H 2O +CO 2↑ 反应相对Na 2CO 3 快 17①CaOH 2适量 CaOH 2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2O②CaOH 2过量 CaOH 2+NaHCO 3=CaCO 3↓+NaOH +H 2O184Li +O 2 2Li 2O 192K +2H 2O =2KOH +H 2↑202Na +CuSO 4+2H 2O =CuOH 2↓+Na 2SO 4+H 2↑21NaH +H 2O =NaOH +H 2↑ 222Na +S Na 2S22NH 4HCO 3 NH 3↑+H 2O ↑+CO 2↑232NaCl 熔融 2Na +Cl 2↑242NH 4Cl + CaOH 2 △ CaCl 2 + 2H 2O + 2NH 3↑第三章 物质的量 第四章 卤 素1Cu +Cl 2 CuCl 2 22Fe +3Cl 2 2FeCl 3 32P +3Cl 2 2PCl 32P +5Cl 2 2PCl 542Na +Cl 2=2NaCl52NaCl +2H 2O 2NaOH+H 2↑+Cl 2↑ 6H 2+Cl 2 2HCl 7 8电解点燃点燃电解点燃 点燃 点燃 点燃 电解 点燃9Cl 2+2NaOH =NaCl +NaClO +H 2O 10Cl 2+H 2O =HCl +HClO 11Cl 2+2KI =I 2+2KCl 123Cl 2+2FeBr 2=2FeCl 3+2Br 2 13NaCls +H 2SO 4浓=NaHSO 4+HCl ↑2NaCls +H 2SO 4浓 Na 2SO 4+2HCl ↑14NaOH +HCl =NaCl +H 2O 15Fe +2HCl =FeCl 2+H 2↑ 16CuO +2HCl =CuCl 2+H 2O17CaCO 3+2HCl =CaCl 2+H 2O +CO 2↑ 183Cl 2+6KOH 浓 5KCl +KClO 3+3H 2O 195KCl +KClO 3+3H 2SO 4=3K 2SO 4+3Cl 2↑+3H 2O202KClO 3+I 2=2KIO3+Cl 2 21KClO 3+6HCl 浓=KCl +3H 2O +3Cl 2↑ 224HCl +O 2 2Cl 2↑+2H 2O23CaClO 2+CO 2+H 2O =CaCO 3↓+2HClO24H 2+F 2=2HF 25H 2+Br 2 2HBr26H 2+I 2 2HI 272HClO 2HCl +O 2↑282F 2+2H 2O =4HF +O 2 292NaBr +Cl 2=2NaCl +Br 230Br 2+2KI =I 2+2KBr31KBr +AgNO 3=AgBr↓+KNO 332KI +AgNO 3=AgI ↓+KNO 3 332AgBr 2 2Ag +Br 2 342NH 4Cl + CaOH 2 △ CaCl 2 + 2H 2O + 2NH 3↑ 35I 2+5Cl 2+6H 2O =2HIO 3+10HCl第五章 物质结构 元素周期律1Mg +2H 2O MgOH 2↓+H 2↑2Mg +2HCl =MgCl 2+H 2↑32Al +6HCl =2AlCl 3+3H 2↑ 42Al +2NaOH +2H 2O =2NaAlO 2+3H 2↑ 5Al 2O 3+6HCl =2AlCl 3+3H 2O 6Al 2O 3+2NaOH =2NaAlO 2+H 2O 7NaOH 适量 AlCl 3+3NaOH =AlOH 3↓+3NaClC 450 ︒C 500 ︒光照 光照NaOH过量 AlCl3+4NaOH=NaAlO2+3NaCl+2H2O8AlOH3+3HCl=AlCl3+3H2O9AlOH3+NaOH=NaAlO2+2H2O第六章硫和硫的化合物环境保护1S+H2 H2S 22Na+S Na2S 3Fe+S FeS42Cu+S Cu2S 5Hg+S HgS 6S+O2SO272H2S+O22S↓+2H2OO2不足2H2S+3O22SO2+2H2OO2足量8SO2+2H2S=3S↓+2H2O 9H2S+X2=2HX+S↓X=Cl、Br、I10FeS+2HCl=FeCl2+H2S↑ 11Na2S+FeCl2=FeS↓+2NaCl12Na2S+2HCl=2NaCl+H2S↑13H2S+2NaOH=Na2S+2H2O14H2S+HgNO32=HgS↓+2HNO315Na2S+PbSO4=Na2SO4+PbS↓16Na2S+CuCl2=2NaCl+CuS↓ 17Na2S+2AgNO3=2NaNO3+Ag2S↓18H2S+PbSO4=H2SO4+PbS↓19H2S+CuCl2=2HCl+CuS↓20H2S+2AgNO3=2HNO3+Ag2S↓ 21SO2+H2O H2SO322SO2适量SO2+2NaOH=Na2SO3+H2O,SO2过量SO2+NaOH=NaHSO323SO2+Na2SO3+H2O=2NaHSO324Na2SO3+2HCl=2NaCl+H2O+SO2↑252Na2SO3+O2=2Na2SO4262SO2+O22SO327SO3+H2O=H2SO428SO2+X2+2H2O=H2SO4+2HXX=Cl、Br、I295SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO430Na2SO3+X2+H2O=Na2SO4+2HXX=Cl、Br、I31Na2SO3+H2SO4浓 Na2SO4+H2O+SO2↑32Cu+2H2SO4浓 CuSO4+SO2↑+2H2O33C+2H2SO4浓 CO2↑+2SO2↑+2H2O34S+2H2SO4浓 3SO2↑+2H2O△点燃点燃点燃△△△△△352HX+H2SO4浓 SO2↑+X2↑+2H2OX=Br、I364FeS2+11O22Fe2O3+8SO2372NaHSO3Na2SO3+SO2↑+H2O38H2S+H2SO4浓=S↓+SO2↑+2H2O3H2S+H2SO4浓=4S↓+4H2OH2S过量H2S+3H2SO4浓 4SO2↑+4H2O浓H2SO4过量39H2SO4+2NaOH=Na2SO4+2H2O40H2SO4+BaOH2=BaSO4↓+2H2O41H2SO4+CuOH2=CuSO4+2H2O42CuSO4+BaOH2=CuOH2↓+BaSO4↓433O2 2O3442H2O22H2O+O2↑453S+6KOH浓 2K2S+K2SO3+3H2O462K2S+K2SO3+3H2SO4=3S↓+3K2SO4+3H2O47H2S+Na2S=2NaHS 48NaHS+HCl=NaCl+H2S↑49NaHS+NaOH=Na2S+H2O50SO3+CaO=CaSO451S+2KNO3+3C K2S+N2↑+3CO2↑52NH42SO4 + 2NaOH△ 2NH3↑ + Na2SO4 + 2H2O第七章硅和硅酸盐工业1C+O2 CO22CO2+2Mg C+2MgO32NaOH+CO2=Na2CO3+H2O 4Na2CO3+2HCl=2NaCl+H2O+CO2↑5Na2CO3+CO2+H2O=2NaHCO362C+O22CO72NaHCO3 Na2CO3+CO2↑+H2O,NaHCO3+NaOH=Na2CO3+H2O8Na2CO3+CaOH2=CaCO3↓+2NaOH 9CO2+C 2CO102CO+O2 2CO211CaCO3+2HCl=CaCl2+CO2↑+H2O12CO2+CaOH2=CaCO3↓+H2OCO2适量2CO2+CaOH2=CaHCO32CO2过量高温△△放电2MnO△点燃△高温点燃点燃13CO 2+CaCO 3+H 2O =CaHCO 3214Na 2CO 3+BaOH 2=BaCO 3↓+2NaOH 15CaHCO 32+2NaOH =CaCO 3↓+Na 2CO 3+2H 2O16C +Si SiC 17Si +2F 2=SiF 4 18Si +O 2 SiO 219Si +2Cl 2 SiCl 4 20Si +4HF =SiF 4↑+2H 2↑21Si +2NaOH +H 2O =Na 2SiO 3+2H 2↑22SiO 2+2C Si+2CO ↑ 23SiO 2+3C SiC +2CO ↑ 24SiO 2+CaO CaSiO 3 25SiO 2+2NaOH =Na 2SiO 3+H 2O 26SiO 2+4HF =SiF 4↑+2H 2O 27Na 2SiO 3+2HCl +H 2O =2NaCl +H 4SiO 4↓ 28Na 2SiO 3+CO 2+2H 2O =Na 2CO 3+H 4SiO 4↓H 2O 过量 29Na 2SiO 3+CO 2+H 2O =Na 2CO 3+H 2SiO 3↓30Na 2SiO 3+2CO2+2H 2O =2NaHCO 3+H 2SiO 3↓CO 2过量 31H 2SiO 4 2H 2O +SiO 2 32H 2SiO 3 H 2O +SiO 2 33H 2SiO 3+2NaOH =Na 2SiO 3+2H 2O 34H 4SiO 4+2NaOH =Na 2SiO 3+3H 2O高温△℃500400 高温 高温 高温 △。
高中化学公式大全 (完整版)

二. 金属单质(Na,Mg,Al,Fe,Cu) 的还原
性
2Na+H2==2NaH==4Na+O2==2Na2O==2Na2O
+O2==2Na2O2
2Na+O2==Na2O2==2Na+S==Na2S(爆炸)
2Na+2H2O==2NaOH+H2
↑
==2Na+2H2O=2Na++2OH―+H2↑
2Na+2NH3==2NaNH2+H2
样中 SiO2 的含量,玻璃雕刻)
4HF+Si==SiF4+2H2↑
2HF+CaCl2==CaF2+2HCl==H2S+Fe==FeS
↓+H2↑
H2S+CuCl2==CuS↓+2HCl==(弱酸制强酸
的典型反应)
H2S+Cu2+=CuS↓+2H+
H2S+2AgNO3==Ag2S↓+2HNO3
H2S+2Ag+=Ag2S↓+2H+
↑
==2Al+6H+=2Al3++3H2↑
2Al+6H2SO4( 浓 )==Al2(SO4)3+3SO2+6H2
O==(Al,Fe 在冷,浓的 H2SO4,HNO3 中钝
化)
Al+4HNO3( 稀 )==Al(NO3)3+NO ↑
+2H2O==Al+4H++NO3–=Al3++NO↑+2H2O
2Al+2NaOH+2H2O==2NaAlO2+3H2
高中常见化学式大全

编名称化学式式量描述号1 水H2O 18 H2O是常见的碱,具有碱的通性,是一种不含金属离子的碱2 铁锈Fe2O31603 铜绿Cu2(OH)2CO3221 也叫孔雀石;化学名:碱式碳酸铜;绿色固体4 酒精C2H5OH 465 甲醇CH3OH 32 木精(工业酒精)6 乙酸CH3COOH 60 CH3COO-:醋酸根离子。
乙酸也叫醋酸。
7 碳酸钠晶体Na2CO3·10H2O 2868 硫酸铜晶体CuSO4·5H2O 249.5 俗称:胆矾、蓝矾9 硫酸亚铁晶体FeSO4·7H2O 278 俗称:绿矾,皂矾,青矾10 氯化钙晶体CaCl2·6H2O 21911 硫酸钙晶体CaSO4·2H2O 172 俗称:生石膏12 硫化钠Na2S 7813 氧气O232 无色无味的气体14 氢气H2 2 爆鸣气的主要成分:H2和O2;无色无味的气体15 氮气N228 无色无味的气体16 氯气Cl27117 氨气NH317 NH3是碱性气体;无色,但有刺激性气味18 一氧化碳CO 28 无色无味的气体19 二氧化碳CO244 无色无味的气体20 二氧化硫SO264 无色,但有刺激性气味21 三氧化硫SO38022 二氧化氮NO24623 甲烷CH416 天然气(沼气)的主要成分24 乙炔C2H226 电石气:C2H2(通常含H2S、PH3等)25 氧化钙CaO 56 白色固体26 氧化镁MgO 40 白色固体27 氧化锌ZnO 8128 氧化铜CuO 79.5 黑色固体29 氧化汞HgO 217 红色固体30 二氧化锰MnO287 黑色固体31 三氧化二铝Al2O310232 三氧化二铁Fe2O3160 俗称:赤铁矿石;红色固体33 四氧化三铁Fe3O4232 俗称:磁铁矿石;黑色固体34 五氧化二磷P2O5142 白色固体35 三氧化钨WO34836 过氧化氢H2O23437 盐酸HCl 36.5 无色,但有刺激性气味;38 硝酸HNO363 具有刺激性气味的液体39 硫酸H2SO498 纯净的硫酸是没有颜色、粘稠、油状的液体,不容易挥发。
高中常见化学式大全

高中常见化学式大全集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)编号名称化学式式量描述1水H2O18H2O是常见的碱,具有碱的通性,是一种不含金属离子的碱2铁锈Fe2O31603铜绿Cu2(OH)2CO3221也叫孔雀石;化学名:碱式碳酸铜;绿色固体4酒精C2H5OH465甲醇CH3OH32木精(工业酒精)6乙酸CH3COOH60CH3COO-:醋酸根离子。
乙酸也叫醋酸。
7碳酸钠晶体Na2CO3·10H2O2868硫酸铜晶体CuSO4·5H2O249.5俗称:胆矾、蓝矾9硫酸亚铁晶体FeSO4·7H2O278俗称:绿矾,皂矾,青矾10氯化钙晶体CaCl2·6H2O21911硫酸钙晶体CaSO4·2H2O172俗称:生石膏12硫化钠Na2S7813氧气O232无色无味的气体14氢气H22爆鸣气的主要成分:H2和O2;无色无味的气体15氮气N228无色无味的气体16氯气Cl27117氨气NH317NH3是碱性气体;无色,但有刺激性气味18一氧化碳CO28无色无味的气体19二氧化碳CO244无色无味的气体20二氧化硫SO264无色,但有刺激性气味21三氧化硫SO38022二氧化氮NO24623甲烷CH416天然气(沼气)的主要成分24乙炔C2H226电石气:C2H2(通常含H2S、PH3等)25氧化钙CaO56白色固体26氧化镁MgO40白色固体27氧化锌ZnO8128氧化铜CuO79.5黑色固体29氧化汞HgO217红色固体30二氧化锰MnO287黑色固体31三氧化二铝Al2O310232三氧化二铁Fe2O3160俗称:赤铁矿石;红色固体33四氧化三铁Fe3O4232俗称:磁铁矿石;黑色固体34五氧化二磷P2O5142白色固体35三氧化钨WO34836过氧化氢H2O23437盐酸HCl36.5无色,但有刺激性气味;38硝酸HNO363具有刺激性气味的液体39硫酸H2SO498纯净的硫酸是没有颜色、粘稠、油状的液体,不容易挥发。
高一常见化学式

⾼⼀常见化学式 ⽤化学式(有机化学中有机物⼀般⽤结构简式)来表⽰物质化学反应的式⼦,叫做化学⽅程式。
下⾯是店铺为您带来的⾼⼀常见化学式,希望对⼤家有所帮助。
⾼⼀常见化学式(⼀) 1、OH- + HSO3- === H2O + SO32- 2、Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 3、C + 2浓H2SO4 CO2↑+ 2SO2↑+ 2H2O 4. N2 + 3H2 2NH3 (⼯业合成氨) 5. N2 + O2 === 2NO 2NO + O2 === 2NO2 6. 3NO2 + H2O = 2HNO3 + NO △V=2 7. N2 + 3Mg Mg3N2 Mg3N2 + 6H2O ==3 Mg(OH)2 ↓ + 2NH3↑ 8. NH3 + HCl(⽓体)==NH4Cl (固体) (现象:⽩烟) 9. 4NH3 + 5O2 4NO + 6H2O (氨的催化氧化) 10. 4NH3 + 3O2(纯氧) 2N2 + 6H2O 11. NH4Cl NH3↑+ HCl↑ 12. NH4HCO3 NH3↑ + H2O + CO2↑ 13. (NH4)2CO3 2NH3↑ +H2O↑+CO2↑ 14. 2NH4Cl + Ca(OH)2 2H2O + 2NH3↑+ CaCl2 15. 3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O(只有2份HNO3被还原) 16. Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O(只有2份HNO3被还原) 17. 4HNO3====4NO2↑+O2↑+2H2O (所以硝酸常显黄⾊) 18. 4NO + 3O2 + 2H2O == 4HNO3 19、钠与氧⽓(常温):4Na + O2 = 2Na2O (加热)2Na + O2 △ Na2O2 钠与⽔反应:2Na + 2H2O = 2NaOH + H2↑ 20、铁与⽔蒸⽓反应:3Fe + 4H2O(g) △ Fe3O4 + 4H2 21、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ 22、过氧化钠与⽔反应:2Na2O2 + 2H2O = 4NaOH + O2↑ 过氧化钠与⼆氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2 23、Na2CO3溶液加⼊过量盐酸:Na2CO3+2HCl=2NaCl+CO2↑+H2O NaHCO3和盐酸反应:NaHCO3+HCl=NaCl+CO2↑+H2O NaHCO3和NaOH反应:NaHCO3+ NaOH = Na2CO3+H2O NaOH溶液中通⼊少量CO2:2NaOH + CO2 = Na2CO3 + H2O 继续通⼊过量CO2:Na2CO3+CO2+H2O =2NaHCO3 总: NaOH + CO2 = NaHCO3 NaHCO3固体受热分解:2NaHCO3 Na2CO3+CO2↑+H2O 24、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O 氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O 25、Al(OH)3的制备:Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH4)2SO4 氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O 氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O 氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2O 26、氧化亚铁与盐酸反应:FeO + 2HCl = FeCl2 + H2O 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 27、Fe(OH)3的制备:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl Fe(OH)2的制备:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 Fe(OH)2被空⽓中的氧⽓氧化成Fe(OH)3: 4Fe(OH)2 + O2+ 2H2O = 4Fe(OH)3 (现象: ) 氢氧化铁加热分解:2Fe(OH)3 △ Fe2O3 + 3H2O 28、Fe3+向Fe2+转化(加铁粉):2FeCl3 + Fe = 3FeCl2 Fe2+向Fe3+转化(加氯⽔):2FeCl2 + Cl2 = 2FeCl3 29、⼆氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4↑+ 2H2O ⼆氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O ⼆氧化硅与氧化钙⾼温反应:SiO2 + CaO ⾼温 CaSiO3 ⼯业制玻璃原理:SiO2 + Na2CO3 ⾼温 Na2SiO3 + CO2↑ SiO2 + CaCO3 ⾼温 CaSiO3 + CO2↑ 30、硅酸钠溶液中通⼊⼆氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓ 硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ 硅酸受热分解:H2SiO3 △ SiO2 + H2O ⾼⼀常见化学式(⼆) 1、粗硅的制取:SiO2 + 2C ⾼温 Si + 2CO↑ 2、硅单质与F2、HF、NaOH溶液:Si + 2F2 = SiF4 Si + 4HF = SiF4 + 2H2↑ Si + 2NaOH + H2O = NaSiO3↓ +2H2↑ 3、氯⽓与⾦属反应:2Na + Cl2 点燃 2NaCl 2Fe + 3Cl2 点燃 2FeCl3 Cu + Cl2 点燃 CuCl2 氯⽓与⾮⾦属H2反应:H2 + Cl2点燃 2HCl 氯⽓与⽔反应:Cl2 + H2O = HCl + HClO HClO光照下分解:2HClO 光照 2HCl + O2↑ 制漂⽩液(或氯⽓尾⽓处理):Cl2 + 2NaOH = NaCl + NaClO + H2O 制漂⽩粉(或漂粉精):2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O 漂⽩粉长期置露在空⽓中失效:Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO ,2HClO 光 2HCl + O2↑ 4、硫与⾮⾦属:S + O2 点燃 SO2 H2+ S △ H2S 硫与⾦属: Fe + S △ FeS 2Cu + S △ Cu2S 5、⼆氧化硫与⽔反应:SO2 + H2O H2SO3 ⼆氧化硫与碱性氧化物反应:SO2 + CaO = CaSO3 ⼆氧化硫与碱反应:SO2 + 2NaOH = Na2SO3 + H2O ⼆氧化硫与硫化氢⽓体反应:2H2S +SO2 = 3S↓ + 2H2O ⼆氧化硫通⼊氯⽔中:SO2 + Cl2 + 2H2O = 2HCl + H2SO4 (Cl2可换作Br2、I2) ⼆氧化硫被O2氧化:2SO2 + O2 2SO3 6、三氧化硫:SO3 + H2O = H2SO4 SO3 + Ca(OH)2 = CaSO4↓ + H2O 7、氮⽓与氧⽓在放电下反应:N2 + O2 放电或⾼温 2NO ⼀氧化氮与氧⽓反应:2NO + O2 = 2NO2 ⼆氧化氮与⽔反应:3NO2 + H2O = 2HNO3 + NO 有关NO、NO2、O2混合⽓体溶于⽔的计算:4NO2 + O2 +2H2O = 4HNO3 4NO + 3O2 +2H2O = 4HNO3 8、NH3在⽔中的反应:NH3 + H2O NH3•H2O NH4++ OH— NH3•H2O受热分解:NH3•H2O △ NH3↑ + H2O 氨⽓与氯化氢反应:NH3 + HCl = NH4Cl 9、氯化铵受热分解:NH4Cl △ NH3↑ + HCl↑ 碳酸氢氨受热分解:NH4HCO3 △ NH3↑ + H2O↑ + CO2↑ 硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NaNO3 +NH3↑ + H2O (检验NH4+的⽅法: 10、实验室制取氨⽓:2NH4Cl + Ca(OH)2 △ CaCl2 + 2NH3↑+ 2H2O ⼯业合成氨:N2 + 3H2 2NH3 11、浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + SO2↑+ 2H2O 浓硫酸与⽊炭反应:C + 2H2SO4(浓) △ CO2 ↑+ 2SO2↑+ 2H2O 12、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O 稀硝酸与铜反应:3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O 浓硝酸与⽊炭反应:C + 4HNO3(浓) = CO2↑+ 4NO2↑+ 2H2O 13.加成反应 (C17H33COO)3C3H5+3H2 (C17H35COO)3C3H5 14.氧化反应 2C2H2+5O2 4CO2+2H2O 2CH3CH2OH+O2 2CH3CHO+2H2O 2CH3CHO+O2 CH3CHO+2Ag(NH3)2OH +2Ag↓+3NH3+H2O 15.消去反应 C2H5OH CH2═CH2↑+H2O CH3-CH2-CH2Br+KOH CH3-CH═CH2+KBr+H2O 16.酯化反应 17.⽔解反应 C2H5Cl+H2O C2H5OH+HCl CH3COOC2H5+H2O CH3COOH+C2H5OH (C6H10O5)n+nH¬2O nC6H12O6 18. 氯⽓与氢氧化钠的反应:Cl2+2NaOH=NaCl+NaClO+H2O 19. 铁丝在氯⽓中燃烧:2Fe+3Cl2点燃===2FeCl3 20. 制取漂⽩粉(氯⽓能通⼊⽯灰浆)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 21. 氯⽓与⽔的反应:Cl2+H2O=HClO+HCl 22. 次氯酸钠在空⽓中变质:NaClO+CO2+H2O=NaHCO3+HClO 23. 次氯酸钙在空⽓中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 24. 硅与氢氧化钠反应:Si+2NaOH+H2O=Na2SiO3+2H2↑ 25. 硅与氢氟酸反应:Si+4HF=SiF4+H2↑ 26. ⼆氧化硅与氢氧化钠反应:SiO2+2NaOH=Na2SiO3+H2O 27. ⼆氧化硅与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O 28. 制造玻璃主要反应:SiO2+CaCO3⾼温===CaSiO3+CO2↑SiO2+Na2CO3⾼温===Na2SiO3+CO2↑ 29. 过氧化钠与⽔反应:2Na2O2+2H2O=4NaOH+O2↑ 30. 过氧化钠与⼆氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2 ⾼⼀常见化学式(三) 1. 实验室制取氯⽓的⽅程式:MnO2+4HCl(浓) △==== MnCl2+Cl2↑+2H2O ;氯⽓在⽔中的溶解度(常温常压)是1:2;氯⽓溶于⽔后⼤部分仍以氯分⼦的形式存在,⼩部分与⽔反应:Cl2+H2O=HCl+HClO;⽣成的次氯酸不稳定,见光或受热分解:2HClO见光==== 2HCl+O2↑;所以,久置的氯⽔其实就是稀盐酸。
2018高中化学方程式及现象

高一化学 化学方程式及现象序号 反应化学方程式 现象1 钠与氧气接触 4Na+O 2=2Na 2O 有白色物质生成2 钠在氧气中燃烧 2Na+O 2Na 2O 2 淡黄色固体生成3 钠在氯气中燃烧 2Na+Cl 22NaCl燃烧放热,产生大量白烟4 钠与硫研磨2Na+S Na 2S研磨后有爆炸现象 5 钠与水的反应 2Na+2H 2O=2NaOH+H 2↑ 浮、游、球、嘶、红 6 钠与盐酸反应2Na+2HCl===2NaCl+H 2↑反应剧烈,有气体放出 7 钠与硫酸铜溶液反应 2Na+2H 2O+CuSO 4==Cu(OH)2↓+Na 2SO 4+H 2↑ 反应剧烈,有气体放出并有蓝色沉淀生成 8 过氧化钠与水反应2Na 2O 2+2H 2O=4NaOH+O 2↑ 反应后有气泡产生 9 过氧化钠与二氧化碳反应 2Na 2O 2+2CO 2=2Na 2CO 3+O 210 过氧化钠与盐酸反应2Na 2O 2+4HCl=4NaCl++2H 2O +O 2↑ 11 碳酸钠溶液与二氧化碳反应Na 2CO 3+ H 2O+CO 2===2NaHCO 3 12 碳酸钠与盐酸反应 Na 2CO 3+2HCl===2NaCl+H 2O+CO 2↑ 13 碳酸氢钠与盐酸反应 NaHCO 3+HCl===NaCl+H 2O+CO 2↑14 碳酸氢钠溶液与氢氧化钠溶液反应NaHCO 3+NaOH= Na 2CO 3+H 2O15 碳酸氢钠固体受热分解 2NaHCO 3 Na 2CO 3+ H 2O+CO 2↑ 产生使澄清石灰水变浑浊的气体16 氯气与铜反应 Cu+Cl 2CuCl 2 燃烧放热,火星四溅,并有黄棕色的烟产生 17 氯气与铁反应 2Fe+3Cl 22FeCl 3燃烧放热,火星四溅,并有黄褐色的烟产生 18 氯气与磷反应 2P +3Cl 22PCl 3(液体) PCl 3+Cl 2====PCl 5 燃烧放热,并有白色的烟雾产生19 氯气与氢气反应 H 2+Cl 22HCl H 2+Cl 2 ======2HCl 点燃:显苍白色火焰 光照:爆炸 20 氯气与水反应 Cl 2+H 2O=====HCl+HClO21 次氯酸见光分解2HClO=====HCl+O 2↑光照后有气泡产生 22 氯气与氢氧化钠反应 Cl 2+2NaOH====NaCl +NaClO +H 2O23 氯气与氢氧化钙反应(制漂白粉)2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O24实验室制氯气(二氧化锰与浓盐酸反应) MnO 2+4HCl(浓)MnCl 2+Cl 2↑+2H 2O反应后产生一种有刺激性气味的黄绿色气体 25 氟气与水反应 2F 2+4H 2O===4HF+O 226 溴与水反应 Br 2+H 2O=====HBr +HBrO 序号 反应化学方程式现象 27 碘与水反应 I 2+H 2O=====HI +HIO 28 溴与氢气反应 Br 2+H 2 2HBr 29 碘与氢气反应I 2+H 22 HI30 氯水(氯气)与溴化钠反应 Cl 2+2NaBr===2NaCl +Br 2 反应后溶液变为橙红色31氯水(氯气)与碘化钾反应 Cl +2KI===2KCl +I反应后溶液变为紫色光照光照 高温32 溴水(溴单质)与碘化钾反应Br 2+2KI===2KBr +I 2反应后溶液变为紫色 33 硝酸银与盐酸反应 AgNO 3+ HCl==== AgCl ↓+ HNO 3 有白色沉淀产生34 硝酸银与溴化钠反应 AgNO 3+ NaBr=== AgBr ↓+ NaNO 3 有淡黄色沉淀产生 35 硝酸银与碘化钾反应 AgNO 3+ KI === AgI ↓+ KNO 3 有黄色沉淀产生 36 溴化银见光分解2AgBr=====2Ag+ Br 237 碘化银见光分解2AgI=====2Ag+ I 238 硫与氢气反应 H 2+S H 2S 有臭鸡蛋气味的气体产生 39 硒与氢气反应 H 2+Se H 2Se 40 硫化氢受热分解 H 2S H 2↑+S41 硫与铁粉共热 Fe +S FeS 有黑色固体产生 42 硫与铜共热Cu +S Cu 2S 有黑色固体产生43 硫在氧气中燃烧S+O 2SO 2有刺激性气味的气体产生 44 过氧化氢溶液和二氧化锰制氧气45 硫化氢完全燃烧 2H 2S+3O 2=2H 2O +2SO 246 硫化氢不完全燃烧 2H 2S+O 2=2H 2O +2S ↓ 有水珠和黄色固体产生47 硫化亚铁与稀盐酸反应制硫化氢FeS +2HCl=FeCl 2+H 2S ↑ 有气泡产生,生成臭鸡蛋气味的气体48 硫化亚铁与稀硫酸反应制硫化氢FeS +H 2SO 4=FeSO 4+H 2S ↑ 有气泡产生,生成臭鸡蛋气味的气体 49 二氧化硫与水反应 SO 2+H 2O H 2SO 3 50 二氧化硫与氧气反应2SO 2+ O 22SO 351 二氧化硫与硫化氢反应 SO 2+2H 2S===3S+2H 2O有水珠和黄色固体产生 52 三氧化硫与水反应 SO 3+H 2O===H 2SO 453 二氧化硫与溴水反应 SO 2+Br 2+ 2H 2O===2HBr +H 2SO 4 溶液由橙红色变为无色54二氧化硫与碘水反应SO 2+I 2+ 2H 2O===2HI +H 2SO 4 溶液由棕褐色变为无色 序号 反应 化学方程式现象55 铜和浓硫酸反应Cu +2H 2SO 4(浓)CuSO 4+SO 2↑+2H 2O溶液由无色变为蓝色,在铜片上有气泡产生,生成有刺激性气味的气体56 碳和浓硫酸反应 C +2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O有气泡产生,生成有刺激性气味的气体57 硫化氢与浓硫酸反应 H 2S +2H 2SO 4(浓)====S ↓+SO 2↑+2H 2O 有黄色固体和刺激性气味的气体产生 58 氢溴酸与浓硫酸反应 2HBr +H 2SO 4(浓)====Br 2+SO 2↑+2H 2O 59 硅与氧气加热反应 Si+O 2SiO 2 60 硅与氟气反应 Si+2F 2==== SiF 461 硅与氢氟酸反应Si+4HF==== SiF 4↑+2H 2↑62 硅与氢氧化钠溶液反应 Si+2NaOH+H 2O====Na 2SiO 3+2H 2↑ 63二氧化硅与氢氟酸反应SiO +4HF===SiF ↑+2H O光照 光照64 二氧化硅与碳共热 SiO 2+2C Si+2CO ↑ 65 高温下二氧化硅与氧化钙反应SiO 2+CaOCaSiO 366 二氧化硅与氢氧化钠反应 SiO 2+2NaOH=== Na 2SiO 3+H 2O 67 碳酸钠与二氧化硅高温下反应Na 2CO 3+ SiO 2 Na 2SiO 3+ CO 2↑ 68碳酸钙与二氧化硅高温下反应CaCO 3+ SiO 2CaSiO 3+ CO 2↑高二化学(上) 化学方程式及现象序号 反应 化学方程式现象及说明1 氮气与氢气反应 ())(322g H g N +()g NH 32 氮气与氧气反应 N 2+O 2 ==== 2NO3 一氧化氮与氧气反应 2NO +O 2 ==== 2NO 2 气体由无色变为红棕色4二氧化氮与水反应3 NO 2 +H 2O====2HNO 3+NO试管内红棕色的气体消失,液面上升,并有无色气体产生 5 氨气与氧气反应(氨的催化氧化)4NH 3+5O 2======4NO+6H 2O6 氨气和氯化氢气体反应 NH 3+HCl=== NH 4Cl有白烟产生 7氯化铵受热分解NH 4Cl NH 3↑+HCl ↑ 白色固体消失 序号 反应 化学方程式 现象及说明 8 碳酸氢铵受热分解NH 4HCO 3NH 3↑+H 2O+CO 2↑试管内有水珠,并有刺激性气味的气体,和使澄清石灰变浑浊的气体产生9实验室用氯化铵和氢氧化钙制氨气2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+2H 2O试管内有水珠,并有刺激性气味使湿润的红色石蕊试纸变蓝的气体产生10 HNO 3见光或受热分解4HNO 3====== 4NO 2↑+O 2↑+2H 2O 产生有红棕色的气体,该气体溶于浓硝酸,使浓硝酸呈黄色 11 铜与浓硝酸反应Cu+4HNO 3(浓)===Cu(NO 3)2+NO 2↑+2H 2O铜片上有气泡,溶液由无色变蓝色,并有红棕色气体产生,铜片最后消失12 铜与稀硝酸反应 3Cu+8HNO 3(稀)===3Cu(NO 3)2+2NO ↑+4H 2O铜片上有气泡,溶液由无色变蓝色,并有无色气体产生,在试管口气体变为红棕色,铜片最后消失13碳与浓硝酸反应 C+4HNO 3(浓)===CO 2↑+4NO 2↑+2H 2O 有红棕色气体产生 14 铝在氧气中点燃 4Al+3O 22Al 2O 3反应放热,并有耀眼白光产生 15 铝在氯气中点燃 2Al+3Cl 22AlCl 316 铝粉与硫粉混合加热 2Al+3S Al 2S 317 铝条下稀盐酸反应2Al+6HCl====2AlCl 3+3H 2↑铝条上有气泡产生 光照或△ 放电△催化剂19 铝粉与氧化铁高温下反应2Al+Fe2O3Al2O3+2Fe20 铝粉与三氧化二铬高温下反应2Al+Cr2O3Al2O3+2Cr21 铝粉与二氧化锰高温下反应4Al+3MnO22Al2O3+3Mn22 氧化铝与稀盐酸反应Al2O3+6HCl====2AlCl3+3 H2O23 氧化铝与氢氧化钠溶液反应Al2O3+2NaOH====2NaAlO2+ H2O24 氯化铝与氨水反应[Al(OH)3的实验室制法]AlCl3+3NH3·H2O====Al(OH)3↓+3NH4Cl 产生白色胶状物质25 氢氧化铝受热分解Al(OH)3Al2O3 +3H2O26 氢氧化铝与盐酸反应Al(OH)3+3 HCl ====AlCl3+3 H2O 白色胶状物质溶解27 氢氧化铝与氢氧化钠溶液反应Al(OH)3+ NaOH ====NaAlO2+ 2H2O 白色胶状物质溶解序号反应化学方程式现象及说明28 氯化铝与过量的氢氧化钠溶液反应AlCl3+4 NaOH ====NaAlO2+3NaCl+ 2H2O 先有白色胶状物质产生,最后白色胶状物质溶解29 氢氧化铝的电离H2O+H++AlO2-Al(OH)3Al3++3OH-30 铁在氧气中点燃3Fe+2O2Fe3O4反应放热,火星四溅31 铁在氯气中点燃2Fe+3Cl22FeCl3;反应放热,火星四溅,产生大量棕褐色的烟32 铁粉与硫粉混合加热Fe+S FeS 反应剧烈,产生黑色固体33 铁与水蒸汽在高温下反应3Fe+4H2O(气)Fe3O4+4H234 铁与稀盐酸反应Fe+ 2HCl====FeCl2+ H2 ↑铁片上有气泡产生35 铁与稀硝酸反应Fe+4HNO3(稀)=== Fe(NO3)3+NO↑+2H2O 铁片上有气泡产生,溶液由无色变黄色,并有无色气体产生,在试管口气体变为红棕色,铜片最后消失36 甲烷在空气中点燃CH4+O2CO2+2H2O 发出淡蓝色火焰,有使澄清石灰变浑浊的气体产生37 乙烯在空气中点燃C2H4+O22CO2+2H2O 火焰明亮并伴有黑烟,有使澄清石灰变浑浊的气体产生38 乙炔在空气中点燃C2H2+O22CO2+H2O 火焰明亮并伴有浓烈的黑烟,有使澄清石灰变浑浊的气体产生39 苯在空气中点燃2C6H6+15O212CO2+12H2O 火焰明亮并伴有浓烈的黑烟,有使澄清石灰变浑浊的气体产生40 甲烷的高温分解CH4C+2H241 甲烷与氯气在光照下反应CH4+Cl2CH3Cl+HClCH3Cl+Cl2CH2Cl2+HClCH2Cl+Cl2CHCl3+HCl42 乙烯与溴水反应CH 2=CH 2+Br 2CH 2Br —CH 2Br 溴水由橙红色褪为无色 43乙烯与氢气在催化剂存在下反应CH 2=CH 2+H 2CH 3—CH 344 乙烯与水在催化剂存在下反应CH 2=CH 2+H 2O CH 3—CH 2OH 45 乙烯与氯化氢在催化剂存在下反应 CH 2=CH 2+HCl CH 3—CH 2Cl46 乙烯的聚合反应 n CH 2=CH 2 [CH 2—CH 2] n47乙炔与溴水反应(加成)CH ≡CH+Br 2CHBr =CHBr CHBr =CHBrCHBr 2—CHBr 2溴水由橙红色褪为无色 48 乙炔与氯化氢反应(加成) CH ≡CH+ HCl CH 2=CHCl 49 氯乙烯制聚氯乙烯(加聚) CH 2=CHCl[CH 2—CH] nCl50苯与溴在催化剂下反应(取代)有比水重的无色液体生成51 苯的硝化反应(取代) +HO —NO 2∆浓硫酸—NO 2+H 2O 有苦杏仁味无色油状液体(比水重)生成 52 苯的磺化反应(取代) +HO —SO 3H∆浓硫酸—SO 3H +H 2O53苯与氢气的加成反应C H 2CH 2C H 2CH 2CH 2C H 2+3H 2催化剂54乙醇和浓硫酸反应(乙烯的实验室制法)O H CH CH OH CH CH SO H 2222342+↑=−−−→−浓 溶液变黑并有难溶于水,稍有气味的无色气体产生55电石与水反应(乙炔的实验室制法) 22222)(2OH Ca H C O H CaC +↑→+无色无味的气体产生高二化学(下) 化学方程式及现象序号 反应化学方程式 现象1 乙醇和金属钠反应 2C 2H 5OH+2Na 2C 2H 5ONa+H 2↑反应剧烈(比水弱),有气泡产生 2 乙醇在催化剂存在下与氧气反应 2CH 3CH 2OH+ O 22CH 3CHO+2H 2O有刺激性气味的气体产生 3苯酚与氢氧化钠溶液反应ONa OH +H 2O+NaOH170ºC4苯酚钠溶液中通入二氧化碳气体 OH ONa +CO 2+H 2O +NaHCO 3溶液变浑浊5苯酚中加入溴水OHBrBrBrOHBr 2++3HBr有白色沉淀产生6 乙醛与氢气在催化剂存在下加热反应 2CH 3CHO+H 22C 2H 5OH7 乙醛与氧气在催化剂存在下加热反应 2CH 3CHO+O 22CH 3COOH8 乙醛与银氨溶液反应2Ag(NH 3)2OH +CH 3CHO → CH 3COONH 4 +2Ag ↓+3NH 3 +H 2O有银镜现象 9 乙醛与新制氢氧化铜反应CH 3CHO CH 3COOH Cu 2O+2Cu(OH)2++2H 2O有红色沉淀产生 10 乙酸与碳酸钠溶液反应2CH 3COOH+ Na 2CO 32CH 3COONa+H 2O+CO 211乙酸与乙醇反应CH 3COOH+C 2H 5OHCH 3COOC 2H 5+ H 2O有果香味,不溶于水的油状液体产生 12酯在酸性条件下水解RCOOR'+H 2ORCOOH+HOR'酯化水解13 酯与氢氧化钠溶液反应 RCOOR'+NaOHRCOONa+R'OH14 蔗糖水解 C 12H 22O 11 + H 2O C 6H 12O 6+ C 6H 12O 6(葡萄糖、果糖) 15 麦芽糖水解 C 12H 22O 11 + H 2O2C 6H 12O 6(葡萄糖)16 淀粉、纤维素水解 (C 6H 10O 5)n + n H 2On C 6H 12O 617油酸甘油酯的氢化反应C 17H 33COO C 17H 33COO C 17H 33COOCH 2CH 2CH CH 2CH 2CH C 17H 35COO C 17H 35COO C 17H 35COO+3H 2Ni18硬酯酸甘油酯在酸性条件下水解CH 2CH 2CH C 17H 35COO C 17H 35COO C 17H 35COOC 17H 35COOH CH 2CH 2CHOH OH OH+3H 2O3+H 2SO 419硬酯酸甘油酯的皂化反应CH 2CH 2CH C 17H 35COO C 17H 35COO C 17H 35COOC 17H 35COONaCH 2CH 2CH OH OH OH+3+3NaOH20 有机物燃烧C x H y O z +2z)-y (2x O 2x CO 2+2yH 2O。
高中化学式全

1.硫酸根离子的检验:BaCl2+Na2SO4=BaSO4↓+2NaCl2.碳酸根离子的检验:CaCl2+Na2CO3=CaCO3↓+2NaCl3.碳酸钠与盐酸的反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑4.木炭还原氧化铜:2CuO+C高温2Cu+CO2↑5.铁片与硫酸铜溶液反应:Fe+CuSO4=FeSO4+Cu6.氯化钙与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl7.钠在空气中燃烧:2Na+O2△Na2O2钠在氧气中燃烧:2Na+O2=2Na2O8.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑9.过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O210.钠与水反应:2Na+2H2O=2NaOH+H2↑11.铁与水蒸气反应:3Fe+4H2O(g)=Fe3O4+4H2↑12.铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑13.氧化钙与水反应:CaO+H2O=Ca(OH)214.氧化铁与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O15.氧化铝与盐酸反应:Al2O3+6HCl=2AlCl3+3H2O16.氧化铝与氢氧化钠溶液反应: Al2O3+2NaOH=2NaAlO2+H2O17.氯化铁与氢氧化钠溶液反应: FeCl3+3NaOH=Fe(OH)3↓+3NaCl18.硫酸亚铁与氢氧化钠溶液反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO419.氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+CO2=4Fe(OH)320.氢氧化铁加热分解:2Fe(OH)3△Fe2O3+3H2O↑21.实验室制取氢氧化铝: Al2(SO4)3+6NH3▪H2O=2Al(OH)3↓+3(NH3)2SO422.氢氧化铝与盐酸反应Al(OH)3+3HCl=AlCl3+3H2O23.氢氧化铝与氢氧化钠溶液反应: Al(OH)3+NaOH=NaAlO2+2H2O24.氢氧化铝加热分解: 2Al(OH)3△Al2O3+3H2O25.三氯化铁溶液与铁粉反应: 2FeCl3+Fe=3FeCl226.氯化亚铁中通入氯气: 2FeCl2+Cl2=2FeCl327.二氧化硅与氢氟酸反应: SiO2+4HF=SiF4+2H2O↑硅单质与氢氟酸反应:Si+4HF=SiF4+2H2↑28.二氧化硅氧化钙高温反应:SiO2+CaO高温CaSiO329.二氧化硅与氢氧化钠溶液反应: SiO2+2NaOH=Na2SiO3+H2O30.往硅酸钠溶液中通入二氧化碳:Na2SiO3+CO2+H2O=Na2CO3+H2SiO331.硅酸钠与盐酸反应: Na2SiO3+2HCl=2NaCl+H2SiO3↓32.氯气与金属铁反应: 2Fe+3Cl2点燃2FeCl333.氯气与金属铜反应: Cu+Cl2点燃CuCl234.氯气与金属钠反应: 2Na+Cl2点燃2NaCl35.氯气与水反应: Cl2+H2O=HCl+HClO36.次氯酸光照分解: 2HClO光照2HCl+O2↑37.氯气与氢氧化钠溶液反应Cl2+2NaOH=NaCl+NaClO+H2O38.氯气与消石灰反应: 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O39.盐酸与硝酸银溶液反应: HCl+AgNO3=AgCl↓+HNO340.漂白粉长期置露在空气中: Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO41.二氧化硫与水反应: SO2+H2O=H2SO342.氮气与氧气在放电下反应: N2+O2放电2NO443.一氧化氮与氧气反应: 2NO+O2=2NO244.一氧化氮与水反应: 3NO2+H2O=2HNO3+NO45.二氧化硫与氧气在催化剂的作用下反应: 2SO2+O2催化剂2SO346.三氧化硫与水反应: SO3+H2O=H2SO447.浓硫酸与铜反应: Cu+2H2SO4(浓)△CuSO4+2H2O+SO2↑48.浓硫酸与木炭反应: C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O49.浓硫酸与铜反应: Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑50.稀硝酸与铜反应: 3Cu+8HNO3(稀) )△3Cu(NO3)2+4H2O+2NO↑51.氨水受热分解: NH3▪H2O△NH3↑+H2O52.氨气与氯化氢反应: NH3+HCl=NH4Cl53.氯化铵受热分解: NH4Cl△NH3↑+HCl↑54.碳酸氢铵受热分解: NH4HCO3△NH3↑+H2O↑+CO2↑55.硝酸铵与氢氧化钠反应NH4NO3+NaOH△NH3↑+NaNO3+H2O56.氨气的实验室制取: 2NH4Cl+Ca(OH)2△CaCl2+2H2O+2NH3↑57.氯气与氢气反应: Cl2+H2点燃2HCl58.硫酸铵与氢氧化钠反应: (NH4)2SO4+2NaOH△2NH3↑Na2SO4+2H2O59.SO2+CaO=CaSO360.SO2+2NaOH=Na2SO3+H2O61.SO2+Ca(OH)2=CaSO3↓H2O62.SO2+Cl2+2H2O=2HCl+H2SO463.SO2+2H2S=3S+2H2O64.NO,NO2的回收:NO2+NO+2NaOH=2NaNO2+H2O65.Si+2F2=SiF466.Si+2NaOH+H2O=NaSiO3+2H2↑67.硅单质的实验室制法:粗硅的制取:SiO2+2C高温电炉Si+2CO(石英沙)(焦碳)(粗硅)粗硅转变为纯硅Si(粗)+2Cl2△SiCl4SiCl4+2H2高温Si(纯)+4HCl1.镁在空气中燃烧:2Mg+O2点燃2MgO2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O43.铝在空气中燃烧:4Al+3O2点燃2Al2O34.氢气在空气中燃烧:2H2+O2点燃2H2O5.红磷在空气中燃烧:4P+5O2点燃2P2O56.硫粉在空气中燃烧:S+O2点燃SO27.碳在氧气中充分燃烧:C+O2点燃CO28.碳在氧气中不充分燃烧:2C+O2点燃2CO9.二氧化碳通过灼热碳层:C+CO2高温2CO10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO211.二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312.生石灰溶于水:CaO+H2O=Ca(OH)213.无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4▪H2O14.钠在氯气中燃烧:2Na+Cl2点燃2NaCl分解反应15.实验室用双氧水制氧气:2H2O2 MnO22H2O+O2↑16.加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17.水在直流电的作用下分解:2H2O通电2H2↑+O2↑18.碳酸不稳定而分解:H2CO3=H2O+CO2↑19.高温煅烧石灰石:CaCO3高温CaO+CO2↑20.铁和硫酸铜溶液反应:Fe+CuSO4=FeSO4+Cu21.锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑22.镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑23.氢气还原氧化铜:H2+CuO△Cu+H2O24.木炭还原氧化铜:C+2CuO高温2Cu+CO2↑25.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O26.水蒸气通过灼热碳层:H2O+C高温H2+CO27.焦炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑其他:28.氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4=Cu(OH)2↑+Na2SO429.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O30.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O31.一氧化碳还原氧化铜:CO+CuO△Cu+CO232.一氧化碳还原氧化铁:3CO+Fe2O3高温2Fe+3CO233.二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2=CaCO3↓+H2O34.氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2=Na2CO3+H2O35.石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl=CaCl2+H2O+CO2↑36.碳酸钠与浓盐酸反应(泡沫灭火器的原理):Na2CO3+2HCl=2NaCl+H2O+CO2↑物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2Mg+O2点燃2MgO2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O43.铜在空气中受热:2Cu+ O2△2CuO4.铝在空气中燃烧:4Al+3O2点燃2Al2O35.氢气在空气中燃烧:2H2+O2点燃2H2O6.红磷在空气中燃烧:4P+5O2点燃2P2O57.硫粉在空气中燃烧:S+O2点燃SO28.碳在氧气中充分燃烧:C+O2点燃CO29.碳在氧气中不充分燃烧:2C+O2点燃2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO211.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O12.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O二、几个分解反应:13.水在直流电的作用下分解:2H2O通电2H2↑+O2↑14.加热碱式碳酸铜:Cu2(OH)2CO3△2CuO+H2O+CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3 MnO22KCl+3O2↑16.加热高锰酸钾:2KMNO4△K2MNO4+MNO2+O2↑17.碳酸不稳定而分解:H2CO3=H2O+CO2↑18.高温煅烧石灰石:CaCO3高温CaO+CO2↑三、几个氧化还原反应:19.氢气还原氧化铜:H2+CuO△Cu+H2O20.木炭还原氧化铜:C+2CuO高温2Cu+CO2↑21.焦炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑22.焦炭还原四氧化三铁:2C+Fe3O4高温3Fe+2CO2↑23.一氧化碳还原氧化铜:CO+CuO△Cu+CO224.一氧化碳还原氧化铁:3CO+Fe2O3高温2Fe+3CO225.一氧化碳还原四氧化三铁:4CO+Fe3O4高温3Fe+4CO2四、单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸——盐+氢气(置换反应)26.锌和稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑27.铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑28.镁和稀硫酸反应:Mg+ H2SO4=MgSO4+H2↑29.铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑30.锌和稀盐酸反应:Zn+2HCl=ZnCl2+H2↑31.铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑32.镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑33.铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑(2)金属单质+盐(溶液)——另一种金属+另一种盐34.铁和硫酸铜溶液反应:Fe+CuSO4=FeSO4+Cu35.锌和硫酸铜溶液反应:Zn+CuSO4= ZnSO4+Cu36.铜和硝酸汞溶液反应:Cu+Hg(NO3)2=Cu(NO3)2+Hg(3)金属单质+盐(溶液)——另一种金属+另一种盐37.氧化铁和稀盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O38.氧化铁和稀硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O39.氧化铜和稀盐酸反应:CuO+2HCl=CuCl2+H2O40.氧化铜和稀硫酸反应:CuO+H2SO4=CuSO4+H2O41.氧化镁和稀硫酸反应:MgO+H2SO4=MgSO4+H2O42.氧化钙和稀盐酸反应:CaO+2HCl=CaCl2+H2O(4)酸性氧化物+碱——盐+水43.苛性钠暴露在空气中变质:2NaOH+CO2=Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH+SO2=Na2SO3+H2O45.苛性钠吸收三氧化硫气体:2NaOH+SO3=Na2SO4+H2O46.消石灰放在空气中变质:Ca(OH)2+CO2=CaCO3↓+H2O47.消石灰吸收二氧化硫:Ca(OH)2+SO2=CaCO3↓+H2O (5)、酸+碱——盐+水48.盐酸和烧碱起反应:HCl+NaOH=NaCl+H2O49.盐酸和氢氧化钾反应:HCl+KOH=KCl+H2O50.盐酸和氢氧化铜反应:2HCl+Cu(OH)2=CuCl2+2H2O51.盐酸和氢氧化钙反应:2HCl+Ca(OH)2=CaCl2+2H2O52.盐酸和氢氧化铁反应:3HCl+Fe(OH)3=FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3=AlCl3+3H2O54.硫酸和烧碱反应:H2SO4+2NaOH=Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4+2KOH=K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2=CuSO4+2H2O57.硫酸和氢氧化铁反应:3 H2SO4+2Fe(OH)3=Fe2(SO4)3+6H2O58.硝酸和烧碱反应:HNO3+NaOH=NaNO3+H2O(6).酸+盐——另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑61.碳酸镁与稀盐酸反应:MgCO3+2HCl=MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3=AgCl↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反应:H2SO4+BaCl2=BaSO4↓+2HCl (7).碱+盐——另一种碱+另一种盐65.氢氧化钠与硫酸铜反应:2NaOH+CuSO4=Cu(OH)2↓+Na2SO466.氢氧化钠与氯化铁反应:3NaOH+FeCl3=Fe(OH)3↓+3NaCl67.氢氧化钠与氯化镁反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl68.氢氧化钠与氯化铜反应:2NaOH+CuCl2=Cu(OH)2↓+2NaCl69.氢氧化钙与碳酸钠反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH (8).盐+盐——两种新盐70.氯化钠溶液和硝酸银溶液反应:NaCl+AgNO3=AgCl↓+NaNO371.硫酸钠和氯化钡:Na2SO4+BaCl2=BaSO4↓+2NaCl五、其它反应:72.二氧化碳溶解于水:CO2+H2O=H2CO373.生石灰溶于水:CaO+H2O=Ca(OH)274.氧化钠溶于水:Na2O+H2O=2NaOH75.三氧化硫溶于水:SO3+H2O=H2SO476.硫酸铜晶体受热分解:CuSO4▪5H2O△CuSO4+5H2O无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4▪5H2O化学方程式反应现象应用77.剧烈燃烧,耀眼白光,生成白色固体,放热,产生大量白烟【白色信号弹】2Mg+O2△或点燃2MgO78.银白液体,生成红色固体【拉瓦锡实验】2Hg+O2△或点燃2HgO79.红色金属变为黑色固体2Cu+O2△或点燃2CuO80.银白金属变为白色固体4Al+3O2△或点燃2Al2O381.剧烈燃烧,火星四射,生成黑色固体,放热3Fe+2O2点燃Fe3O44Fe+3O2高温2Fe2O382.剧烈燃烧,白光,放热,使石灰水变浑浊C+O2点燃CO283.剧烈燃烧,放热,刺激味气体,【空气中淡蓝色火焰,氧气中蓝紫色火焰】S+O2点燃SO284.淡蓝火焰,放热,生成使无水CuSO4变蓝的液体(水)【高能燃料】2H2+O2点燃2H2O85.剧烈燃烧,大量白烟,放热,生成白色固体【证明空气中氧气含量】4P+5O2点燃2P2O586.蓝色火焰,放热,生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)【甲烷和天然气的燃烧】CH4+2O2点燃2H2O+CO287.蓝色火焰,放热,黑烟,生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)【氧炔焰,焊接切割金属】2C2H2+5O2点燃2H2O+4CO288.生成使带火星的木条复燃的气体【实验室制备氧气】2KClO32MnO2KCl+3O2↑89.紫色变为黑色,生成使带火星木条复燃的气体【实验室制备氧气】2KMnO4△K2MnO4+MnO2+O2↑90.红色变为银白,生成使带火星木条复燃的气体【拉瓦锡实验】2HgO△2Hg+O2↑91.水通电分解为氢气和氧气【电解水】2H2O通电2H2↑+O2↑92.绿色变为黑色,试管壁有液体,使石灰水变浑浊气体【铜绿加热】Cu2(OH)2CO3△2CuO+H2O+CO2↑93.白色固体消失,管壁有液体,使石灰水变浑浊气体碳酸氢铵长期暴露在空气中会消失NH4HCO3△NH3↑+H2O+CO2↑94.有大量气泡产生,锌粒逐渐溶解【实验室制备氢气】Zn+H2SO4=ZnSO4+H2↑95.有大量气泡产生,金属颗粒逐渐溶解Fe+H2SO4=FeSO4+H2↑96.有大量气泡产生,金属颗粒逐渐溶解Mg+H2SO4=MgSO4+H2↑97.有大量气泡产生,金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑98.红色逐渐变为银白色,试管壁有液体【冶炼金属、利用氢气的还原性】Fe2O3+3H2△2Fe+3H2O99.黑色逐渐变为银白色,试管壁有液体【冶炼金属、利用氢气的还原性】Fe3O4+4H2△3Fe+4H2O100.【冶炼金属钨、利用氢气的还原性】WO3+3H2△W+3H2O101.【冶炼金属钼、利用氢气的还原性】MoO3+3H2△MO+3H2O102.剧烈燃烧,黄色火焰【离子化合物的形成】2Na+Cl2△或点燃2NaCl103.点燃苍白色火焰,瓶口有白雾【共价化合物的形成、制备盐酸】H2+Cl2光照或点燃2HCl104.蓝色沉淀生成,上部为澄清溶液【质量守恒定律实验】CuSO4+2NaOH=Cu(OH)2↓+Na2SO4105.煤炉中常见反应,空气污染物之一【煤气中毒原因】2C+O2点燃2CO106.蓝色火焰【煤气燃烧】107.黑色逐渐变为红色,产生使澄清石灰水变浑浊的气体【冶炼金属】C+CuO高温2Cu+CO2↑108.【冶炼金属】2Fe2O3+3C高温4Fe+3CO2↑109.【冶炼金属】Fe3O4+ 2C高温3Fe+2CO2↑110.碳酸使石蕊变红【证明碳酸的酸性】C+CO2高温2CO111.石蕊红色褪去CO2+H2O=H2CO3112.澄清石灰水变浑浊【应用CO2检验和石灰浆粉刷墙壁】Ca(OH)2+CO2=CaCO3↓+H2O113.白色沉淀逐渐溶解【溶洞的形成,石头的风化】CaCO3+H2O+CO2=Ca(HCO3)2114.白色沉淀,产生使澄清石灰水变浑浊的气体【水垢的形成钟乳石的形成】Ca(HCO3)2△CaCO3↓+H2O+CO2↑115.产生使澄清石灰水变浑浊的气体【小苏打蒸馒头】2NaHCO3△Na2CO3+H2O+CO2↑116.【工业制备二氧化碳和生石灰】CaCO3高温CaO+ CO2↑117.固体逐渐溶解,有使澄清石灰水变浑浊的气体【实验室制备二氧化碳,除水垢】CaCO3+2HCl=CaCl2+H2O+CO2↑118.固体逐渐溶解,有使澄清石灰水变浑浊的气体【泡沫灭火器原理】Na CO+H SO=Na SO+H O+CO↑119.固体逐渐溶解,有使澄清石灰水变浑浊的气体【泡沫灭火器原理】Na2CO3+2HCl=2NaCl+H2O+CO2↑120.固体逐渐溶解,有使澄清石灰水变浑浊的气体MgCO3+2HCl=MgCl2+H2O+CO2↑121.黑色逐渐变为红色,产生使澄清石灰水变浑浊的气体【冶炼金属】CuO+CO△Cu+CO2↑122.【冶炼金属原理】Fe2O3+ 3CO高温2Fe+3CO2123.【冶炼金属原理】Fe3O4+ 4CO高温3Fe+4CO2124.【冶炼金属原理】WO3+3CO高温W+3CO2125.蓝色火焰,产生使石灰水变浑浊的气体,放热【酒精的燃烧】CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O126.银白色金属表面覆盖一层红色物质【湿法炼铜,镀铜】Fe+CuSO4=Cu+FeSO4127.溶液由浅绿色变为无色Mg+FeSO4=Fe+MgSO4128.红色金属表面覆盖一层银白色物质【镀银】Cu+Hg(NO3)2=Hg+Cu(NO3)2Cu+2AgNO3=2Ag+Cu(NO3)2129.青白色金属表面覆盖一层红色物质【镀铜】Zn+CuSO4=Cu+ZnSO4130.铁锈溶解,溶液呈黄色【铁器除锈】Al2O3+6HCl=2AlCl3+3H2O132.白色固体溶解Na2O+2HCl=2NaCl+H2O133.黑色固体溶解,溶液呈蓝色CuO+2HCl=CuCl2+H2O134.白色固体溶解ZnO+2HCl=ZnCl2+H2O135.白色固体溶解MgO+2HCl=MgCl2+H2O136.白色固体溶解CaO+2HCl=CaCl2+H2O137.白色固体溶解NaOH+HCl+NaCl+H2O138.蓝色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O139.白色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O140.白色固体溶解【胃舒平治疗胃酸过多】Al(OH)3+3HCl=AlCl3+3H2O141.红褐色沉淀溶解,溶液呈黄色Fe(OH)3+3HCl=FeCl3+3H2O142.生成白色沉淀,不溶解于稀硝酸【检验Cl—的原理】Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3=AgCl↓+HNO3143.铁锈溶解,溶液呈黄色【铁器除锈】Fe2O3+3H2SO4=Fe2(SO4)3+3H2O144.白色固体溶解Al2O3+3H2SO4=Al2(SO4)3+3H2O145.黑色固体溶解,溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O147.白色固体溶解MgO+H2SO4=MgSO4+H2O2NaOH+H2SO4=Na2SO4+2H2O148.蓝色固体溶解Cu(OH)2+H2SO4=CuSO4+2H2O149.白色固体溶解Mg(OH)2+H2SO4=MgSO4+2H2O150.白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O151.红褐色沉淀溶解,溶液呈黄色2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O152.生成白色沉淀,不溶解于稀硝酸【检验SO42—的原理】Ba(OH)2+H2SO4=BaSO4↓+2H2O153.生成白色沉淀,不溶解于稀硝酸【检验SO42—的原理】BaCl2+H2SO4=BaSO4↓+2HCl154.生成白色沉淀,不溶解于稀硝酸【检验SO42—的原理】Ba(NO3)2+H2SO4=BaSO4↓+2HNO3155.白色固体溶解Na2O+2HNO3=2NaNO3+H2O156.黑色固体溶解,溶液呈蓝色CuO+2HNO3=Cu(NO3)2+H2O157.白色固体溶解ZnO+2HNO3=Zn(NO3)2+H2O158.白色固体溶解MgO+2HNO3=Mg(NO3)2+H2O159.白色固体溶解CaO+2HNO3=Ca(NO3)2+H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O161.白色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O162.白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+2H2OCa(OH)2+2HNO3=Ca(NO3)2+2H2O163.红褐色沉淀溶解,溶液呈黄色Fe(OH)3+3HNO3=Fe(NO3)3+2H2O164.【吸收CO、O2、H2中的CO2】3NaOH+H3PO4=3H2O+Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+H2O165.【处理硫酸工厂的尾气(SO2)】2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2O166.溶液黄色褪去,有红褐色沉淀生成FeCl3+3NaOH=Fe(OH)3↓+3NaCl167.有白色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl168.溶液蓝色褪去,有蓝色沉淀生成MgCl2+2NaOH=Mg(OH)2↓+2NaCl169.白色块状固体变为粉末【生石灰制备石灰浆】CuCl2+2NaOH=Cu(OH)2↓+2NaCl170.有白色沉淀生成CaO+H2O=Ca(OH)2171.有白色沉淀生成【工业制烧碱,实验室制少量烧碱】Ca(OH)2+SO2=CaSO3↓+H2O172.有白色沉淀生成Ca(OH)2+Na2CO3=CaSO3↓+2NaOH173.有白色沉淀生成Ba(OH)2+Na2CO3=BaSO3↓+2NaOH174.蓝色晶体变为白色粉末Ca(OH)2+K2CO3=CaCO3↓+2KOH175.白色粉末变为蓝色【检验物质中是否含有水】CuSO4+5H2O=CuSO4▪H2O176.白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)【应用于检验溶液中的氯离子】CuSO4▪H2O△CuSO4+5H2O177.白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)【应用与检验硫酸根离子】BaCl2+Na2SO4=BaSO4↓+2NaCl178.有白色沉淀生成CaCl2+Na2CO3=CaCO3↓+2NaCl179.有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓CaCO3+2HCl=CaCl2+H2O+CO2↑MgCO3+2HCl=MgCl2+H2O+CO2↑180.生成使湿润石蕊试纸变蓝色的气体【应用于检验溶液中的铵根离子】NH4NO3+NaOH=NaNO3+NH3↑+H2O181.生成使湿润石蕊试纸变蓝色的气体NH4Cl+KOH=KCl+NH3↑+H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
编
名称化学式式量描述
号
1 水H2O 18 H2O是常见的碱,具有碱的通性,是一种不含金属离子的碱
2 铁锈Fe2O3160
3 铜绿Cu2(OH)2CO3221 也叫孔雀石;化学名:碱式碳酸铜;绿色固体
4 酒精C2H5OH 46
5 甲醇CH3OH 32 木精(工业酒精)
6 乙酸CH3COOH 60 CH3COO-:醋酸根离子。
乙酸也叫醋酸。
7 碳酸钠晶体Na2CO3·10H2O 286
8 硫酸铜晶体CuSO4·5H2O 249.5 俗称:胆矾、蓝矾
9 硫酸亚铁晶体FeSO4·7H2O 278 俗称:绿矾,皂矾,青矾
10 氯化钙晶体CaCl2·6H2O 219
11 硫酸钙晶体CaSO4·2H2O 172 俗称:生石膏
12 硫化钠Na2S 78
13 氧气O232 无色无味的气体
14 氢气H2 2 爆鸣气的主要成分:H2和O2;无色无味的气体
15 氮气N228 无色无味的气体
16 氯气Cl271
17 氨气NH317 NH3是碱性气体;无色,但有刺激性气味
18 一氧化碳CO 28 无色无味的气体
19 二氧化碳CO244 无色无味的气体
20 二氧化硫SO264 无色,但有刺激性气味
21 三氧化硫SO380
22 二氧化氮NO246
23 甲烷CH416 天然气(沼气)的主要成分
24 乙炔C2H226 电石气:C2H2(通常含H2S、PH3等)
25 氧化钙CaO 56 白色固体
26 氧化镁MgO 40 白色固体
27 氧化锌ZnO 81
28 氧化铜CuO 79.5 黑色固体
29 氧化汞HgO 217 红色固体
30 二氧化锰MnO287 黑色固体
31 三氧化二铝Al2O3102
32 三氧化二铁Fe2O3160 俗称:赤铁矿石;红色固体
33 四氧化三铁Fe3O4232 俗称:磁铁矿石;黑色固体
34 五氧化二磷P2O5142 白色固体
35 三氧化钨WO348
36 过氧化氢H2O234
37 盐酸HCl 36.5 无色,但有刺激性气味;
38 硝酸HNO363 具有刺激性气味的液体
39 硫酸H2SO498 纯净的硫酸是没有颜色、粘稠、油状的液体,不容易挥发。
40 磷酸H3PO498
41 碳酸H2CO362
42 氢硫酸H2S 34
43 火碱NaOH 40 也叫:苛性钠、火碱、烧碱;白色固体
44 氢氧化钾KOH 56
45 氢氧化钙Ca(OH)274 石灰乳;白色固体
46 氢氧化镁Mg(OH)258
47 氢氧化铝Al(OH)378
48 氢氧化铁Fe(OH)3107
49 氢氧化亚铁Fe(OH)290
50 氢氧化铜Cu(OH)297.5
编号名称化学式式量描述
51 氢氧化钡Ba(OH)2171
52 硫酸钾K2SO4174
53 硫酸氢钾KHSO4136
54 硫酸钠Na2SO4142
55 亚硫酸钠Na2SO3126
56 硫酸氢钠NaHSO4120
57 硫酸镁MgSO4120
58 硫酸铝Al2(SO4)3342
59 硫酸铁Fe2(SO4)3400
60 硫酸亚铁FeSO4152
61 硫酸锌ZnSO4161
62 硫酸铜CuSO4159.5
63 硫酸钡BaSO4233 俗称:钡餐,重晶石
64 碳酸钙CaCO3100 大理石(方解石、石灰石)的主要成分;俗称:白垩
65 碳酸钠Na2CO3106 俗称:纯碱(碱面)、苏打;白色固体
66 碳酸氢钠NaHCO384 小苏打
67 氯化钾KCl 74.5 白色固体
68 氯化钠NaCl 58.5 白色固体;食盐的主要成分
69 氯化锌ZnCl2136
70 氯化铁FeCl3162.5
71 氯化亚铁FeCl2127
72 氯化铜CuCl2134.5
73 氯化亚铜CuCl 99
74 氯化银AgCl 143.5
75 氯化钡BaCl2208
76 硝酸钾KNO3101
77 硝酸钠NaNO385 俗称:智利硝石
78 硝酸锌Zn(NO3)2189
79 硝酸镁Mg(NO3)2148
80 硝酸铁Fe(NO3)3242
81 硝酸铜Cu(NO3)2187.5
82 硝酸汞Hg(NO3)2325
83 硝酸银AgNO3170
84 硝酸钙Ca(NO3)2164
85 高锰酸钾KMnO4158 紫黑色
86 氯酸钾KClO3122.5 白色固体
87 锰酸钾K2MnO4197
88 磷酸二氢钠
89 磷酸二氢钙 Ca(H2PO4)2234
90 硫酸氨(NH4)2SO4132
91 硝酸氨NH4NO380
92 碳酸氢氨NH4HCO379
93 氯化氨NH4Cl 53.5
94 氨水NH3·H2O 35
95 尿素CO(NH2)260
96 磷矿粉Ca3(PO4)2310
97 硫酸钙CaSO4136
98 磷酸二氢氨 NH4H2PO4115
99 磷酸氢二氨 (NH4)2HPO4132
100 磷酸二氢钾 KH2PO4136
101 皓矾ZnSO4·7H2O 287
102 硫酸钠晶体 Na2SO4·10H2O 322 俗称:芒硝,朴硝,皮硝
103 明矾KAl(SO4)2·12H2O 474
104 莹石CaF278
105 黄铜矿CuFeS2183.5
106 矾土Al2O3·H2O 120 矾土:Al2O3*H2O、Al2O3*3H2O和少量Fe2O3 、SiO2 107 碳酸铁Fe2CO3172 俗称:菱铁矿石
一、无机
纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3
大苏打:Na2S2O3
石膏(生石膏):CaSO4.2H2O
熟石膏:2CaSO4·.H2O
莹石:CaF2
重晶石:BaSO4(无毒)
碳铵:NH4HCO3
石灰石、大理石:CaCO3
生石灰:CaO
食盐:NaCl
熟石灰、消石灰:Ca(OH)2
芒硝:Na2SO4·7H2O (缓泻剂)
烧碱、火碱、苛性钠:NaOH
绿矾:FaSO4·7H2O
干冰:CO2
尿素:CO(NH2) 2 明矾:KAl (SO4)2·12H2O
漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O
胆矾、蓝矾:CuSO4·5H2O
双氧水:H2O2
皓矾:ZnSO4·7H2O
硅石、石英:SiO2
刚玉:Al2O3
水玻璃、泡花碱、矿物胶:Na2SiO3
铁红、铁矿:Fe2O3
磁铁矿:Fe3O4
黄铁矿、硫铁矿:FeS2
铜绿、孔雀石:Cu2 (OH)2CO3
菱铁矿:FeCO3
赤铜矿:Cu2O
波尔多液:Ca (OH)2和CuSO4
石硫合剂:Ca (OH)2和S
玻璃的主要成分:Na2SiO3、CaSiO3、SiO2
过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4
重过磷酸钙(主要成分):Ca (H2PO4)2
天然气、沼气、坑气(主要成分):CH4
水煤气:CO和H2
硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色
光化学烟雾:NO2在光照下产生的一种有毒气体
王水:浓HNO3与浓HCl按体积比1:3混合而成。
铝热剂:Al + Fe2O3或其它氧化物。
——————————————————————————————————————————————————————二、有机
氯仿:CHCl3
电石:CaC2
电石气:C2H2 (乙炔)
TNT:三硝基甲苯
酒精、乙醇:C2H5OH
醋酸:冰醋酸、食醋CH3COOH 甘油、丙三醇:C3H8O3
石炭酸:苯酚
果糖:C6H12O6葡萄糖:C6H12O6
蔗糖:C12H22O11
麦芽糖:C12H22O11
淀粉:(C6H10O5)n
硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH 蚁醛:甲醛 HCHO
蚁酸:甲酸 HCOOH
福尔马林:35%—40%的甲醛水溶液
草酸:乙二酸 HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。
氟氯烃:是良好的制冷剂,有毒,但破坏O3层
裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。
焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。
