质量守恒和化学方程式练习
专题08 质量守恒定律和化学方程式-2021年中考化学真题分类训练(第01期)(教师版含解析)
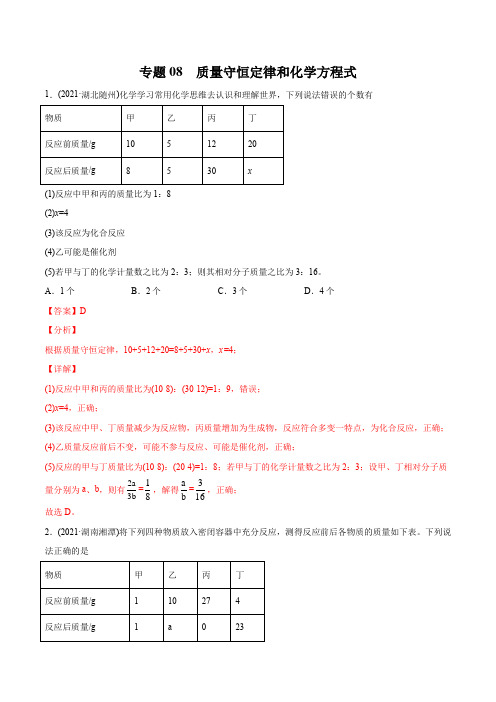
专题08 质量守恒定律和化学方程式1.(2021·湖北随州)化学学习常用化学思维去认识和理解世界,下列说法错误的个数有(1)反应中甲和丙的质量比为1:8(2)x=4(3)该反应为化合反应(4)乙可能是催化剂(5)若甲与丁的化学计量数之比为2:3;则其相对分子质量之比为3:16。
A.1个B.2个C.3个D.4个【答案】D【分析】根据质量守恒定律,10+5+12+20=8+5+30+x,x=4;【详解】(1)反应中甲和丙的质量比为(10-8):(30-12)=1:9,错误;(2)x=4,正确;(3)该反应中甲、丁质量减少为反应物,丙质量增加为生成物,反应符合多变一特点,为化合反应,正确;(4)乙质量反应前后不变,可能不参与反应、可能是催化剂,正确;(5)反应的甲与丁质量比为(10-8):(20-4)=1:8;若甲与丁的化学计量数之比为2:3;设甲、丁相对分子质量分别为a、b,则有2a3b=18,解得ab=316,正确;故选D。
2.(2021·湖南湘潭)将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表。
下列说法正确的是A .a 的值是8B .甲物质一定是该反应的催化剂C .该反应属于分解反应D .反应过程中乙、丁的质量比是5:2 【答案】C 【分析】 本题考查计算。
【详解】根据表格信息可知,丙从27g 变成0g ,是反应物,丁从4g 增加到23g ,是生成物,由于反应前后物质的质量是守恒的,所以推算出乙的质量应该是27g -19g=8g ,写出该反应的方程式为:+ 丙丁乙。
A 、因为生成乙的质量为8g ,所以a 应该是8+10=18,故A 不符合题意;B 、甲反应前后质量不变,可能是催化剂,也可能是不参与反应的杂质,故B 不符合题意;C 、该反应由一种物质生成两种物质,是分解反应,故C 符合题意;D 、反应中乙生成了8g ,丁生成了19g ,所以质量比为8:19,故D 不符合题意; 故选C 。
专题 质量守恒定律化学方程式

化学方程式配平最小公倍数法:KMnO4── K2MnO4+MnO2+O2奇数配偶法:H2O2── H2O+O2观察法:Fe+O2 ── Fe3O4定一法:CH3OH+O2──H2O+CO2例题1.在反应X+2Y====R+2M中,当1.6 g X与Y完全反应后,生成4.4 g R,且反应生成的R和M的质量之比为11∶9,则在此反应中Y和M的质量之比为( )A.23∶9B.16∶9C.32∶9D.46∶9例题2.已知A物质发生分解反应生成B物质和C物质,当一定量的A反应片刻后,生成56克B和44克C;则实际发生分解的A物质的质量为( )A.12克B.44克C.56克D.100克例题3.在X+2O2CO2+2H2O中,根据质量守恒定律,X的化学式为( )A.CH4 B.C2H5OH C.CH3OH D.CH3COOH例题4.已知反应3A+2B→2C+D,A、B两物质完全反应时的质量比为3∶4,若生成C和D 共140g,则反应消耗B的质量是A. 60gB. 80gC. 90gD. 120g例题5.下列关于化学反应“X2+3Y2===2Z”的叙述错误的是A. Z的化学式为XY3B.若mg X2和ngY2恰好完全反应,则生成(m+n)g ZC.若X2和Y2的相对分子质量分别为M和N,则Z的相对分子质量为(M+N)D.若ag X2完全反应生成bg Z,则同时消耗(a-b)g Y2例题6.下列化学方程式书写错误的是A. B. Zn+H2SO4=ZnSO4+H2↑C. CH4+O2=CO2+H2O D. HCl+NaOH=NaCl+H2O例题7.过氧化氢(H2O2)的水溶液俗称双氧水。
实验室用双氧水制取氧气的反应如下:2H2O2MnO2===2H2O+O2↑ 现有1000克双氧水,H2O2的质量分数为3.4%。
请计算:⑴1000克双氧水中含H2O2的质量是多少克?⑵用这些双氧水制氧气,可制得氧气多少克?(相对原子质量:H—1,O—16)练习题一、选择题1.“神舟五号”载人飞船的成功发射与回收,表明我国的载人航天技术已经达到了国际领先水平。
质量守恒定律和化学方程式-2022年中考化学真题分项汇编(全国通用)(第01期)(原卷版)

专题08 质量守恒定律和化学方程式1.(2022年湖南省怀化市中考)下列化学方程式正确的是( ) A .232Fe O +3CO2Fe+3CO 高温B .24242NaOH+H SO =a SO +N H OC .22Cu+2HCl=CuCl +HD .2222H O =O H O ↑+2.(2022年四川省自贡市中考)下列化学方程式正确的是( ) A .点燃天然气:CH 4+2O 2点燃2H 2O+CO 2↑B .铁粉溶于稀盐酸:2Fe+6HCl═2FeCl 3+3H 2↑C .硫在空气中燃烧:S+O 2点燃SO 2D .高炉炼铁:Fe 2O 3+CO高温2Fe+CO 23.(2022年江苏省扬州市中考)北京冬奥会火种灯使用化合物X 作燃料,其燃烧反应方程式为2X+5O 点燃223CO +4H O 。
推断X的化学式是( ) A .C 3H 8B .C 3H 6C .C 2H 6O 2D .C 3H 8O 34.(2022年江苏省扬州市中考)将一定量的N 2、H 2和物质M 置于密闭容器中,在特定条件下发生化学反应,反应前后各物质的质量分数如图所示。
下列说法不正确的是( )A .反应前后原子的数目不变B.参加反应的N2和H2分子个数比为1:3C.M可能是该反应的催化剂D.反应后H2和NH3质量分数之比为1:15.(2022年湖南省衡阳市中考)某化学反应的微观示意图如图所示,有关该化学反应的说法错误的是()A.化学反应前后元素的种类不变B.丙是形成酸雨的气体之一C.该反应生成的丙、丁分了个数比为1:1D.该反应是置换反应6.(2022年重庆市中考)工业炼铁原理为3CO+Fe2O3高温2Fe+3CO2,其中CO体现还原性。
下列化学反应中有物质体现还原性的是()A.SO3+H2O=H2SO4B.H2+CuO ΔCu+H2OC.CuSO4+BaCl2=BaSO4↓+CuCl2D.H2SO4+2NaOH=Na2SO4+2H2O7.(2022年安徽省中考)我国科研人员将二氧化碳高效合成为可供微生物直接利用的物质X,合成过程中主要物质向转化的微现示意图如下、下列说法错误的是()A.催化剂提高了合成效率B.X的化学式为CH2OC.CO2合成的过程中伴随能量变化D.一定有含氢元素的物质参与合成反应8.(2022年湖南省衡阳市中考)下列实验方案,不能达到相应实验目的的是()A.证明烧碱有吸水性B.比较Zn和Fe的金属活动性强弱C.测定空气中氧气的含量D.验证蜡烛燃烧的产物中有水9.(2022年湖南省衡阳市中考)甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。
专题08 质量守恒定律和化学方程式(2)

A.生成物一定是混合物
B.分子在化学变化中不可分
C.化学反应前后原子的种类不变
D.该反应既不是化合反应也不是分解反应
【答案】C
【解析】A、由生成物的微观构成可知,生成物是由同种分子构成,属于纯净物,选项A不正确;B、由微粒的变化可知,分子在化学变化中发生了变化,分子可再分,选项B不正确;C、由微粒的变化可知,化学反应前后原子的种类不变,选项C正确;D、由反应的图示可知,该反应的反应物是两种,生成物是一种,该反应是化合反应,选项D不正确。故选C。
【解析】
(1)氧化汞受热分解成汞和氧气,汞由汞原子直接构成,氧气由氧分子构成,根据质量守恒定律,反应前后原子数目和种类不变,每2个氧化汞分子分解成2个汞原子和一个氧分子,所以在C图中补充的是一个氧分子的模型图: 图片为 ;(2)化学反应的实质是分子破裂,原子重新组合的过程,在图示A中存在氧化汞分子,图示B中存在单个的汞原子和氧原子,而图示C中则存在氧分子和聚集的汞原子,所以该过程是在加热条件下,氧化汞分子分解成氧原子和汞原子,每两个氧原子结合成一个氧分子,许多氧分子聚集成氧气,许多汞原子聚集成金属汞的过程;(3)氧的质子数是8,所以核外电子分两层排布,第一层为两个电子,第二层为6个电子,所以结构示意图可以表示为: 。
(2)聚丙烯中碳、氢元素的质量比为(12×3):(1×6)=6:1,故填:6:1。(3)根据质量守恒,反应前后原子的种类数目不变, ,反应前4C、8H、6O反应后4C、8H、4O,故x中含有两个氧原子,为氧气,酒精化学式C2H5OH和酒精反应生成二氧化碳和水,化学方程式为C2H5OH+3O2 2CO2+3H2O,故填:O2;C2H5OH+3O2 2CO2+3H2O。(4)米饭富含糖类,红烧肉富含油脂,鸡蛋汤、牛奶,富含蛋白质,还缺少维生素,还应补充的食物是蔬菜,故填:蔬菜。
质量守恒定律经典练习题40道

质量守恒定律经典练习题40道1、哪个图像能够反映加热高锰酸钾时剩余固体质量与反应时间的关系。
2、碱式碳酸铜受热分解成CuO、CO2和H2O三种物质,它的组成是什么。
3、在方程式CxHyOz + 5O2 = 4CO2 + 4H2O中,x、y、z的值是什么。
4、mg的硫在ng的氧气中燃烧,生成的二氧化硫的质量最合理的答案是什么。
5、镁在空气中燃烧时,生成氧化镁和氮化镁(Mg3N2)。
12g的镁在空气中燃烧后,产生的产物质量是多少。
6、在化学反应aA + bB = cC + dD中,哪个说法是正确的。
7、关于质量守恒定律,哪个叙述是正确的。
8、根据反应3NO2 + H2O = 2HNO3 + X,推断X的化学式是什么。
9、黑火药爆炸的反应主要是2KNO3 + 3C + S = K2S +3CO2↑ + X↑,则X的化学式是什么。
10、哪个现象不能用质量守恒定律解释?11、瑞奥汀河是一条酸河,其中含有硫酸和硫酸亚铁。
研究表明,酸河的形成是由于上游河床含有某种物质R,在水中氧气的作用下发生反应所致。
反应方程式为2R+2H2O+7O2→2FeSO4+2H2SO4.因此,R的化学式为FeS。
12、在实验中,某纯净物X在密闭中稍加加热就分解为NH3、H2O和CO2.根据这一实验事实,无法得出X由四种元素组成、X是化合物、X中有水或X不稳定这些结论。
13、根据化学方程式CxHyOz+5O2→4CO2+4H2O,可以得出x、y、z的值分别为4、8、2.14、在反应2H2O2→2H2O+O2中,肯定发生变化的是各种原子的数目。
15、能够用质量守恒定律解释的说法是:B。
62g磷和80g氧反应生成142g五氧化二磷。
16、某物质在纯氧中燃烧生成氮气和水蒸气,因此该物质一定含有氮元素和氧元素。
17、根据质量守恒定律,铁丝在氧气中完全燃烧后,生成物的质量一定等于铁丝的质量。
18、化学反应前后没有发生改变的是:①原子的数目③元素的种类④物质的总质量⑥原子的种类。
化学方程式与质量守恒定律 选择题精选(原卷版)

化学方程式与质量守恒定律选择题精选一、选择题1.全球能源生产正向“氢能经济”转型,以可再生生物资源(如纤维素)等为原料生产氢气已成为能源研究的重点。
如图是某新型能源转换与利用模式示意图。
某有机物水相重整制取氢气分两步进行反应,其中第一步反应可表示为:C x H y O z→CO+H2(未配平),则x:z的值为( )A.1:2B.1:1C.2:1D.任意比2.下列关于化学反应“X2+3Y2═2Z”的叙述中错误的是( )①Z的化学式为XY3②若mgX2和ngY2恰好完全反应,则生成(m+n)gZ③若X2和Y2的相对分子质量分别为M和N,则Z的相对分子质量为(M+N)④若agX2完全反应生成bgZ,则同时消耗(a﹣b)gY2。
A.①②B.①③C.②④D.③④3..小宇探究某种有机化合物的组成,他取该物质3.2g在足量的氧气里充分燃烧,生成8.8g二氧化碳和7.2g水.则该有机物中( )A.一定含有碳、氢两种元素,可能含有氧元素B.一定含碳、氢、氧三种元素C.一定只含有碳、氢两种元素,不含氧元素D.无法确定4.铜锈主要成分是Cu2(OH)2CO3。
加热分解的化学方程式为:Cu2(OH)2CO3=2X+H2O+CO2↑,其中X的化学式是( )A.CuB.CuOC.Cu(OH)2D.CuCO35.关于化学方程式CH4+2O2CO2+2H2O的描述正确的是( )A.甲烷加氧气在点燃条件下,反应生成二氧化碳和水B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水C.1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子D.1gCH4和2gO2在点燃条件下,生成1gCO2和2gH2O6.一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为( )A.5.6gB.8.8gC.4.4gD.4.8g7.下列四个反应的生成物都是C,如果C的化学式为A2B5,则该反应的化学方程式为( )A.2AB2+B2═2CB.3AB2+B2═2CC.4AB2+B2═2CD.AB2+4B2═2C8.mgKClO3与zgMnO2混合共热,完全反应后留下残留物ng,则生成气体的质量为( )A.(m﹣n)gB.(m﹣z﹣n)gC.(m+z﹣n)gD.(n﹣z)g9.根据化学方程式不能获得的信息是( )A.化学反应的快慢B.该反应中的反应物和生成物量)( )14.根据质量守恒定律,6克镁和6克氧气反应生成氧化镁的质量为( )依次为28、32、44、18,则它们之间所发生反应的化学方程式为( ) A.A+B C+DB.A+2B2C+DC.A+3B C+2DD.A+3B 2C+2D19.催化剂在化学反应前后:①质量变少;②质量不变;③化学性质改变;④化学性质不变;⑤能加快反应速度;⑥若用双氧水制氧气时忘了添加二氧化锰,则会使氧气的产量减少;⑦二氧化锰可以作为各种化学反应的催化剂。
质量守恒和化学方程式及计算专题(含答案)

质量守恒和化学方程式及计算专题姓名_______【知识点1】质量守恒定律1、涵义:参加的各物质质量总和等于反应后生成的各物质质量的总和,这个规律叫做质量守恒定律。
2、适用范围:化学变化(物理变化与质量守恒定律无关)。
3、守恒实质:化学反应前后,各种、、都不改变.4、化学反应过程中的变与不变——五不变,二改变,一可能变①不改变:从宏观来看反应物和生成物的质量总和不变以及元素种类不变。
从微观来看有三不变,即原子种类不变、原子数目不变、原子质量不变。
②改变:从宏观来看物质种类一定改变从微观来看分子种类一定改变③可能改变:分子总数可能改变5、应用:①利用质量守恒定律推断物质的组成②利用质量守恒定律推断反应物或生成物的化学式③利用质量守恒定律进行有关计算④质量守恒定律中的守恒对象是物质质量6、注意:①质量守恒,不是体积守恒。
②参加反应的各物质的质量总和并不是反应物的任意质量之和,未参加反应的物质质量不能计算在内。
质量守恒定律应用的试题归类1.解释化学反应前后质量变化原因【例】纸在空气中燃烧后化为灰烬,为什么灰烬的质量比纸的质量小?2.推断物质的组成【例】某化合物完全燃烧,需要4.8 g氧气,同时只生成4.4 g二氧化碳和2.7 g 水,则该化合物中()A.只含有碳、氢两种元素B.只含有碳、氧两种元素C.含有碳、氢、氧三种元素D.无法确定【例2】4。
6克某有机物在氧气中充分燃烧可生成二氧化碳8.8克、水5.4克,则该有机物含有元素,它们的质量比是。
3.确定物质的化学式【例】某发电厂烟气处理的新工艺:CH4十2NO2= N2+X+2H2O,则X的化学式为()A. CO B.CO2C. O2 D. C4。
配平化学方程式【例】2008年奥运会“祥云”火炬中燃料燃烧后不会对环境造成污染,体现了“绿色奥运”的理念.反应的化学方程式为C3H8+5O2xCO2+4H2O,则x的数值是( ) A. 1 B.2 C. 3 D .45。
专题02 质量守恒定律 化学方程式(练习)(原卷版)

专题02 质量守恒定律化学方程式目录考点过关练2考点01 质量守恒定律2考点02 化学方程式3考点03 根据化学方程式的计算4真题实战练5重难创新练9考点01 质量守恒定律1. 超氧化钾(KO2)常备于急救器和消防队员背包中,能迅速与水反应放出氧气:2KO2+2H2O===2KOH+X+O2↑,关于此反应的说法不正确...的是()A. X的化学式为H2O2B.反应前后元素种类发生变化C.反应前后氧元素化合价发生变化D.反应前后物质状态发生变化2. 科学家研制出一种新型催化剂,可用于去除装修残留的甲醛(化学式为CH2O),该反应过程的微观示意图如下。
下列说法正确的是()A.物质甲为甲醛,其分子由碳原子和水分子构成B.物质乙中氧元素的化合价为-2 价C.该反应前后原子种类和数目均发生改变D.该反应消耗物质甲和生成物质丁的质量比为5﹕33. 甲、乙、丙、丁四种物质在一定的条件下反应,测得反应前后各物质的质量分数如图所示,则有关说法中正确的是()A.该反应为分解反应B.甲可能是单质C.丙、丁两物质变化的质量比为9:10D.乙一定是这个反应的催化剂4. 在一个密闭容器中放入X、Y、Z、M四种物质,使之在一定条件下发生化学反应。
一段时间后,测得有关数据如下表:物质X Y Z M反应前的质量/g 20 5 3 28反应后的质量/g 待测值30 3 8关于此反应的认识不正确的是()A.物质Z可能是该反应的催化剂B.该反应一定是化合反应C.参加反应的Y、M的质量比为5∶4 D.待测值为135. 在“宏观一徽观”之间建立联系是化学学科特有的思维方式。
下图为二氧化碳用于生产甲醇(CH3OH)的微观示意图,有关说法正确的是()A.该反应中,四种物质均为化合物B.反应前后氢元素的化合价不变C.参加反应的甲、乙分子个数之比为1:3D.反应前后氢原子个数之比为1:3考点02 化学方程式6. 下列化学方程式书写正确的是()A.Mg+O2点燃=======MgO B.4Fe+3O2点燃=======2Fe2O3C.2KClO3=2KCl+3O2↑D.S+O2点燃=======SO27. 关于化学方程式的意义的说法不正确的是()A.表示各物质之间的质量比B.表明了反应的条件C.表明了反应的速率D.表明化学反应的反应物、生成物8. 化学方程式2Mg+O2点燃=========2MgO可读作()A.镁加氧气等于氧化镁B.2个镁加1个氧气等于2个氯化镁C.镁和氧气在点燃条件下生成氧化镁D.镁加氧气点燃等于氧化镁9. 下列有关叙述对应的化学方程式都正确的是()A.镁在空气中燃烧:Mg+O2点燃=======MgO2B.过氧化氢分解:H2O2═H2↑+O2↑C.铁在氧气中燃烧:Fe+O2═Fe2O3D.铝具有很好的抗腐蚀性:4Al+3O2═2Al2O310. 下列说法正确的是()A.符号↑:表示在生成物中有气体产生 B.配平时可以改动化学式右下角表示的小数字C.符号△:表示点燃D.化学方程式中的等号表示反应物与生成物的分子数相等11. 配平下列反应的化学方程式:(1) NH3+ Cl2= N2+ HCl(2) C2H2+ O2= CO2+ H2O(3) Fe2O3+ CO= Fe+ CO2(4) C2H6O+ O2= CO2+ H2O考点03 根据化学方程式的计算12.我国核工业技术世界领先,现已出口到西方发达国家。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
儒洋教育学科教师辅导讲义
A B C D
、为研究化学反应前后反应物和生成物之间的质量关系,三个同学分别作了如下三个实验:
实验一:称量镁条,点燃,待反应结束后,再称量。
实验二:将盛有稀盐酸的小试管放入城有锌粒的烧杯中,称量,然后将盐酸和锌粒接触,充分反应后再称量。
2
2
“
.反应前后,原子的种类、数目不变
某化合物在氧气中燃烧,只生成了二氧化硫和水,则该化合物中
.一定含有硫、氢元素,可能含有氧元素
中,各化学式前的计量数之间的关系正确的是
2
,试分析辰砂组成中一定含有的元素是
2
,其中
13. 在探究质量守恒定律时,王冠同学将种物质放在某密闭容器中,反应一段时间后,测得反应前后
如右图是测定白磷燃烧前后质量的变化情况,用来验证质量守恒定律的实验。
试回答下列问题:
被冲开,导致实验失败。
瓶塞未塞紧,结果天平的指针
2
3
O D.2HgO 22
2 2A+B。
