伊维菌素质量标准
伊维菌素注射液含量的测定法

伊维菌素注射液含量的测定法作者:孙永泰来源:《江西饲料》 2014年第4期孙永泰(辽宁省辽中县北一路75号辽中 110200 )摘要:用紫外分光光度法测定伊维菌注射液中伊维菌素B1的含量。
伊维菌素注射液溶于甲醇,于200~400nm间扫描,在238nm、245nm波长处有最大吸收峰,245nm波长处测定吸伊维菌素作对照品测得伊维菌素注射液的平均回收率为100.06%,RSD为0.24%(n=5),与《中国兽药典》规定方法比较,结果基本一致,且具有快速、准确、易操作等优点。
关键词:紫外分光光度法;伊维菌素注射液;伊维菌素B1中图分类号:S859.79文献标识码:A文章编号:1008-6137(2014)04-0027-020 引言伊维菌素为抗生素类药,含有两种有效成分,即含有多于80%的22-23-双氢埃维菌素B1a和少于20%的22-23-双氢埃维菌素B1b[1]。
伊维菌素注射液对线虫、昆虫和螨均具有驱杀作用,其含量测定《中国兽药典》(2000年版一部)[2]采用高效液相色谱法,该方法测定结果准确,但对实验设备要求高,一般兽药厂难以达到。
经采用紫外分光光度法测定伊维菌素注射液中伊维菌素B1含量,操作简便、快速,结果满意。
该方法对市场快速检测,生产厂家质量监控具有实用价值。
1 食品与试剂美国UnicamUV-300型紫外分光光度计;伊维菌素原料、伊维菌素注射液由武汉光牧生化科技有限公司提供;伊维菌素对照品来源于中国兽药监察所,批号KY31297;甲醇为分析纯。
2 方法与试验结果2.1 伊维菌素备用溶液的制备取伊维菌素约40mg,精密称定,置100mL容量瓶中,加甲醇稀释至刻度,摇匀即得。
2.2 伊维菌素紫外吸收曲线吸取上述备用液3mL,置100mL容量瓶中,加甲醇稀释至刻度,摇匀,于200~400nm绘制紫外吸收图谱,在238nm、245nm有最大吸收,其中245nm处吸收度最大,2.3 伊维菌素紫外吸收标准曲线的制定取伊维菌素备用液,分别用甲醇稀释成4.0、8.0、12.0、16.0、20.0、24.0、28.0μg/mL溶液,用甲醇作空白,于1cm石英比色池中,在245nm处测定其吸收度,得标准曲线:C=26.5404A-0.5323 r=0.9999结果表明:伊维菌素B1浓度在4.0~28.0μg/mL范围内时与吸收度呈良好线性关系,符合朗伯-比尔定律。
伊维菌素杂质整理总结文档
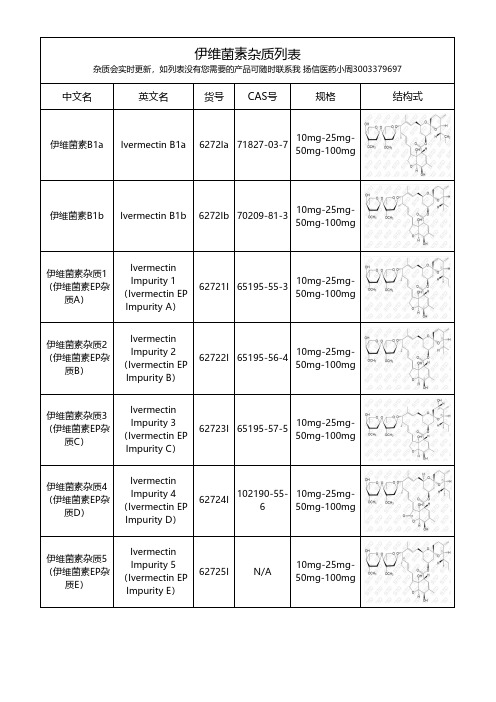
伊维菌素杂质列表杂质会实时更新,如列表没有您需要的产品可随时联系我 扬信医药小周3003379697中文名英文名货号CAS号规格结构式伊维菌素B1a Ivermectin B1a 6272Ia 71827-03-710mg-25mg-50mg-100mg伊维菌素B1b Ivermectin B1b 6272Ib 70209-81-310mg-25mg-50mg-100mg伊维菌素杂质1(伊维菌素EP杂质A)Ivermectin Impurity 1(Ivermectin EP Impurity A)62721I 65195-55-310mg-25mg-50mg-100mg 伊维菌素杂质2(伊维菌素EP杂质B)Ivermectin Impurity 2(Ivermectin EP Impurity B)62722I 65195-56-410mg-25mg-50mg-100mg 伊维菌素杂质3(伊维菌素EP杂质C)Ivermectin Impurity 3(Ivermectin EP Impurity C)62723I 65195-57-510mg-25mg-50mg-100mg 伊维菌素杂质4(伊维菌素EP杂质D)Ivermectin Impurity 4(Ivermectin EP Impurity D)62724I 102190-55-610mg-25mg-50mg-100mg 伊维菌素杂质5(伊维菌素EP杂质E)Ivermectin Impurity 5(Ivermectin EP Impurity E)62725I N/A 10mg-25mg-50mg-100mg伊维菌素杂质6(伊维菌素EP杂质F)IvermectinImpurity 6(Ivermectin EPImpurity F)62726I N/A 10mg-25mg-50mg-100mg伊维菌素杂质7(伊维菌素EP杂质G)Ivermectin Impurity 7(Ivermectin EP Impurity G)62727I 73162-95-510mg-25mg-50mg-100mg 伊维菌素杂质8(伊维菌素EP杂质H)Ivermectin Impurity 8(Ivermectin EP Impurity H)62728I 71837-27-910mg-25mg-50mg-100mg 伊维菌素杂质9(伊维菌素EP杂质I)Ivermectin Impurity 9(Ivermectin EP Impurity I)62729I 1135339-49-910mg-25mg-50mg-100mg 伊维菌素杂质10(伊维菌素EP杂质J)Ivermectin Impurity 10(Ivermectin EP Impurity J)627210I N/A 10mg-25mg-50mg-100mg伊维菌素杂质11(伊维菌素EP杂质K)Ivermectin Impurity 11(Ivermectin EP Impurity K)627211I 74567-01-410mg-25mg-50mg-100mg。
1%伊维菌素

伊维菌素注射液50ml:0.5g制造商:出口商:1.产品制造商姓名和地址:2. 申请人状态进口商3. 产品名称:伊维菌素注射液(50ml:0.5g)4. 适应症抗寄生虫药。
主治畜禽各类体内外寄生虫病。
1、体内寄生虫:猪蛔虫、肺丝虫、食道口线虫、消化道线虫、胃线虫等。
牛、马、羊血矛虫、圆线虫、夏伯特线虫、网尾线虫、胃线虫等。
2、体外寄生虫:猪疥螨、蛔虫、肺丝虫、心丝虫、绦虫、血吸虫、钩虫、脑包虫、肾虫、螨虫、微丝蚴、蝇蛆、鼠等。
3、牛、羊各种线虫,绦虫、肝片吸虫、姜片吸虫、血吸虫、血矛线虫、奥斯林线虫、古柏线虫、食道口线虫、网尾线虫、圆形线虫、仰口线虫、矛形双腔吸虫、胰阔形吸虫、莫尼茨虫、贝尼莫茨虫、牛细颈囊尾蚴。
4、此外,对寄生虫引起的家畜食欲不振、倦怠、精神不振、发热等症状有显著治疗作用。
5. 说明和包装包装规格:50ml*100瓶/箱包装材料:该产品药液由玻瓶加胶塞与复合铝盖封装。
6. 每种成分的名称和数量:每100ml内含:成分单位用量内含物说明参照标准伊维菌素1g 活性成分CVP2010 二甲基甲酰胺10ml 非活性成分丙二醇90ml 非活性成分7. 每种成分的化学名称和结构式:7.1伊维菌素(1)结构式和对映体(2)分子式C48H74O14(3)分子量875.09(4) CAS号:70288-86-77.2二甲基甲酰胺(1)结构式和对映体(2)分子式C3H7NO(3)分子量73.09(4) CAS号:68-12-28. 生产方法:a)构成伊维菌素注射液内含氧化镁铬合剂、乙醇胺酸碱调节剂和注射用水溶剂。
b)生产配方药物产品批量100L,配方如下所示:成分单位用量伊维菌素1kg二甲基甲酰胺10L丙二醇90Lc)生产过程描述根据批量和配制要求,把伊维菌素加入二甲基甲酰胺中,搅拌完全溶解;加入丙二醇中搅拌均匀;通过过滤器进行过滤,然后进行灌装、压盖、灭菌、灯检、包装。
灌装药液所使用的瓶子必须经过洗瓶并进行烘干灭菌的预处理后才能投入使用。
阿苯达唑伊维菌素粉质量标准、说明书

阿苯达唑伊维菌素粉本品含阿苯达唑(C12H15N3O2S)与伊维菌素(H2B1a+H2B1b)均应为标示量的90.0%---110.0%。
【性状】本品为白色或类白色粉末。
【鉴别】(1)取阿苯达唑含量测定项下溶液,照紫外-可见分光光度法测定,在295nm的波长处有最大吸收,在277nm波长处有最小吸收。
(2)在伊维菌素含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】干燥失重取本品,在105℃干燥至恒重,减失重量不得过10.0%。
其他应符合粉剂项下有关的各项规定。
【含量测定】阿苯达唑取本品适量(约相当于阿苯达唑20mg),精密称定,置100ml量瓶中,加冰醋酸10ml,振摇使阿苯达唑溶解,用乙醇稀释至刻度,摇匀,滤过,精密量取滤液5ml,置另一100ml量瓶中用乙醇稀释至刻度,摇匀,照紫外-分光光度法(附录23页),在295nm波长处测定吸光度,按C12H15N3O2S的吸收系数(E1%1cm)为444计算,即得。
伊维菌素照高效液相色谱法(附录32页)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;乙腈—甲醇—水(56:28:16)为流动相;检测波长为245nm.理论板数按伊维菌素H2B1a峰计算不低于2000,伊维菌素H2B1a与H2B1a分离度应符合要求。
测定法取本品适量(约相当于伊维菌素20mg),精密称定,置100ml量瓶中,加适量甲醇振荡使伊维菌素溶解,用甲醇稀释至刻度,摇匀,过滤,精密量取续滤液10ul,注入液相色谱仪,记录色谱图;另取伊维菌素对照品,按外标法,以峰面积计算,即得。
【作用与用途】驱虫药。
用于去除或杀灭猪线虫、吸虫、螨等体内外寄生虫。
【用法与用量】以本品计。
内服:一次量,每10kg体重,猪0.7~1g.【不良反应】按推存剂量使用,未见不良反应。
【注意事项】本品中伊维菌素对鱼、虾有剧毒,残存物,包装品及动物排泄物切勿污染水源。
伊维菌素注射液内控质量标准
GMP管理文件
一.目的:制定伊维菌素注射液内控质量标准,规范公司伊维菌素注射液的采购。
二.适用范围:适用于伊维菌素注射液的采购和质检。
三.责任者:生产部经理、质管部经理、检验员
四.正文:
伊维菌素注射液
本品为伊维菌素与适宜溶剂配制而成的无菌溶液。
含伊维菌素(H2B1a+H2B1b)应为标示量的91.0%~108.0%。
【性状】本品为无色澄明液体,略黏稠。
【鉴别】在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】颜色本品应无色;如显色,与黄色或黄绿色2号标准比色液比较,不得更深。
水分取本品,照水分测定法测定,含水分不得过0.8%。
无菌取本品,依法检查,应符合规定。
伊维菌素组分照含量测定项下的方法测定,伊维菌素H2B1a的峰面
积不得少于伊维菌素项下的方法测定,即得。
其他应符合注射剂项下有关的各项规定。
【含量测定】精密量取本品适量,用甲醇稀释成每1ml中约含0.2mg 和溶液,照伊维菌素项下的方法测定,即得。
【类别】同伊维菌素。
【规格】按伊维菌素(H2B1a+H2B1b)计算(1)1ml:0.01g (2)2ml:0.02 g (3)5 ml:0.05 g (4)50ml:0.5 g (5)100 ml:1 g。
伊维菌素微乳的安全性评价及质量标准研究

伊维菌素微乳的安全性评价及质量标准研究伊维菌素微乳的安全性评价及质量标准研究引言:伊维菌素微乳作为一种新型的药物制剂,具有较高的溶解度、生物利用度以及细胞内渗透能力,被广泛应用于医学领域。
然而,伊维菌素微乳的安全性以及合格的质量标准对于其有效且安全的使用至关重要。
本文旨在通过安全性评价以及质量标准研究,探究伊维菌素微乳的药理学特性、毒理学属性以及优化的质量控制标准。
一、伊维菌素微乳的药理学特性伊维菌素微乳作为一种药物制剂,是通过将伊维菌素以微乳的形式进行载体化而制备的。
微乳中的伊维菌素具有较高的生物利用度,可加速其溶解度以及吸收速度。
同时,伊维菌素微乳的微乳胶束结构可提供细胞内渗透的路径,使药物能更好地进入细胞内部,提高药效。
二、伊维菌素微乳的安全性评价1. 急性毒性试验通过动物急性毒性试验,可以评估伊维菌素微乳对于动物体内的短期急性毒性。
实验结果表明,在合适的剂量下,伊维菌素微乳具有低毒性或无毒性效果。
2. 亚慢性毒性试验亚慢性毒性试验旨在评估伊维菌素微乳对于动物体内长期应用所产生的毒性效应。
实验结果显示,长期应用合适剂量的伊维菌素微乳并不会对动物体内造成明显的毒性反应。
3. 生殖和发育毒性试验生殖和发育毒性试验可评估伊维菌素微乳对动物繁殖和发育的影响。
实验结果表明,伊维菌素微乳对动物繁殖和发育并无明显不良影响。
4. 过敏反应评价过敏反应评价可评估伊维菌素微乳是否具有过敏原性。
实验结果表明,伊维菌素微乳并不具有过敏原性,较安全地应用于动物体内。
三、伊维菌素微乳的质量标准研究1. 外观质量标准伊维菌素微乳的外观质量标准应包括颜色、透明度、凝胶形状等因素。
2. 理化性质标准理化性质标准包括伊维菌素微乳的粒径分布、粘度、pH值等指标,这些指标直接影响到其药效和稳定性,必须符合一定的范围。
3. 药效性标准药效性标准包括伊维菌素微乳的溶解度、生物利用度、抗菌效果等指标,这些指标可反映伊维菌素微乳的药效。
Q_LHHQG 052-2019伊维菌素企业标准
Q/LHHQG 武陟兰海生物科技有限公司企业标准LHHQG052-2019伊维菌素2019-12-26发布2019-12-27实施武陟兰海生物科技有限公司发布前言本标准按照GB/T1.1《标准化工作导则第一部分:标准的结构和编写》给出的规则起草。
本标准为首次发布。
本标准由武陟兰海生物科技有限公司提出。
本标准起草单位:武陟兰海生物科技有限公司。
本标准主要起草人:张火星伊维菌素1范围本标准规定了伊维菌素的技术要求、检验方法、检验规则及标志、标签、包装、运输和贮存。
本标准适用于伊维菌素及由伊维菌素和其他适宜溶剂复配制造的系列产品。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T191包装储运图示标志GB/T8170数值修约规则与极限数值的表示和判定GB/T6678化工产品采样总则GB/T611化学试剂密度测定通用方法国家质量监督检验检疫总局第75号令《定量包装商品计量监督管理办法》3技术要求3.1外观要求本品应为淡黄色的澄清液体。
3.2技术指标应符合表1规定。
表1项目指标伊维菌素含量,%≥ 1.04试验方法4.1外观目测检验4.2鉴别试验在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
4.3伊维菌素含量测定4.3.1试剂与溶液4.3.1.1甲醇:色谱纯;4.3.1.2伊维菌素B1对照品;4.3.1.3甲醇-水(85:15)。
4.3.2仪器与设备4.3.2.1电子天平;4.3.2.2高效液相色谱仪4.3.3色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以甲醇-水(85:15)为流动相;检测波长245nm。
伊维菌素B1b和B1a峰的分离度应符合规定。
4.3.4测定步骤取本品适量,精密称定,用甲醇制成每1ml中含200µg的溶液,精密量取10µl,注入液相色谱仪,记录色谱图。
伊维菌素的含量测定
伊维菌素的含量测定一、实验说明本品为伊维菌素H2B1a与H2B1b的混合物,药典中伊维菌素的含量测定采用高效液相色谱法,要求满足的色谱条件为:用十八烷基硅烷键合硅胶为填充剂;乙腈-甲醇-水(53∶35∶12)为流动相;检测波长为254 nm,理论板数按H2B1a峰计算应不低于2 000,伊维菌素H2B1a与H2B1b峰的分离度应不小于3.0。
伊维菌素H2B1b峰约为H2B1a峰相对保留时间的0.8。
规定按无水、无乙醇、无甲酰胺物计算,含伊维菌素(H2B1a+H2B1b)应为95.0%~102.0%。
通过本实验的训练,进一步熟悉高效液相色谱仪的使用技能,理解外标法定量的原理。
二、仪器与试剂(1)仪器电子天平,高效液相色谱仪,十八烷基硅烷键合硅胶,超声波清洗器,容量瓶,抽滤器。
(2)试剂伊维菌素原料药,伊维菌素对照品,乙腈(色谱纯),甲醇(色谱纯),纯化水。
三、测定过程(1)配制溶液配制流动相按乙腈-甲醇-水(53∶35∶12)配制适量的流动相,并对流动相进行过滤和脱气处理。
配制供试液取伊维菌素供试品适量,精密称定,加甲醇制成每1 mL中约含0.8 mg的供试液。
配制对照液取伊维菌素对照品适量,精密称定,加甲醇制成每1 mL中约含0.8 mg的对照液。
(2)系统适用性试验取对照液20 μL,注入液相色谱仪,记录色谱图。
计算H2B1a峰的理论板数、伊维菌素H2B1a与H2B1b峰的分离度。
(3)含量测定分别取供试液和对照液20 μL,注入液相色谱仪,分别记录色谱图。
按外标法计算含量。
四、数据记录与报告五、注意事项(1)严防气泡进入系统,吸液软管必须充满流动相,吸液管的烧结不锈钢过滤器必须始终浸在溶剂内,如更换溶剂瓶,必须先停泵,再将过滤器移到新的溶剂瓶内,然后才能开泵使用。
(2)流动相必须进行脱气处理。
(3)流动相及供试品溶液须澄清,用滤器过滤后使用或进样。
(4)工作完毕,需用适当的有机溶剂清洗,尤其是使用酸性或含盐溶剂后,以防系统零件被损坏。
伊维菌素双羟萘酸噻嘧啶咀嚼片质量标准
伊维菌素双羟萘酸噻嘧啶咀嚼片质量标准
很抱歉,我无法为您提供关于伊维菌素双羟萘酸噻嘧啶咀嚼片的质量标准具体信息。
不过,我可以告诉您一些关于这种药物的一般信息。
伊维菌素双羟萘酸噻嘧啶咀嚼片是一种兽用处方药,主要用于治疗犬的蛔虫病、钩虫病等。
这种药物含有两种主要成分:伊维菌素和双羟萘酸噻嘧啶。
伊维菌素是一种抗蠕虫药,对寄生在动物体表的节肢动物和体内的线虫具有良好的驱杀作用。
它可以通过促进寄生虫的突触前神经元释放γ-氨基丁酸(GABA),使GABA介导的氯离子通道开放,从而干扰神经肌肉间的信号传递,使虫体松弛麻痹,导致虫体死亡或被排出体外。
双羟萘酸噻嘧啶也是一种抗蠕虫药,其作用机理是对敏感虫体产生一种去极化型的神经肌肉阻断作用,使虫体麻痹,通过胃肠道蠕动将虫体排出体外。
这种药物的溶解度很低,极少从肠道吸收,使其能到达肠道的后段,发挥驱虫活性。
如果您需要了解更多关于这种药物的质量标准具体信息,建议您查阅相关的兽药典或咨询兽医专业人士。
伊维菌素检验记录
不得过0.1%。
检验结果:
重金属
含重金属不得过百万分之二十。
检验结果:
乙醇和甲酰胺
含乙醇不得过5.0%。
检验结果:甲酰胺不得过3.0%。
检验结果:
复核人:检验人:
有限公司
原辅料检验记录附页
文件编号: 00 第 2 页 共 3页
含量测定:伊维菌素室温26℃湿度51%
主要
分析
仪器
名 称
型 号
精度
A-B
相对偏差 ×100%
A+B
标准规定:按无水物计,含伊维菌素应为95.0%-102.0%
项目结论:
检验结论:本品按《伊维菌素内控质量标准》检验,结果规定.
检验人:复核人:
有限公司
原辅料检验记录报告单
文件编号:21-00 第 3 页 共 3页
原辅料名称
检验单号
批 号
供货单位
供货数量
请验单位
取样数量
4、炽灼残渣 不得过0.1%——规定
5、重金属 不得过百万分之二十——规定
6、乙醇和甲酰胺 乙醇不得过5.0%——规定
甲酰胺不得过3.0%——规定
(4)含量测定:
按干燥品计,含伊维
菌素应为95.0%-102.0%。规定
检验结论: 本品按<<伊维菌素内控质量标准>>检验,结果规定。
备注:
负责人:肖法君复核人:肖法君检验人:苏景豹、梁勿云斯其格
检验结果:
2本品的红外线吸收图谱应与对照品的图谱一致。
检验结果:
伊维菌素组分
照含量测定项下的方法测定,伊维菌素H2B1a的峰面积不得少于伊维菌素H2B1a与伊维菌素H2B1b峰面积之和的90.0%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
伊维菌素
质量标准
制定人: 日期: 审核人: 日期: 批准人: 批准日期:
生效日期:
伊维菌素Yiweijunsu Ivermectin
伊维菌素 H
2B
1a
:R=CH
2
CH
3
C
48
H7
4
O
14
875.10
伊维菌素 H
2B
1b
:R=CH
3
C
47
H
71
O
14
861.07
本品为伊维菌素H
2B
1a
和伊维菌素H
2
B
1b
的混合物。
按无水、无乙醇、无甲酰
胺物计算,含伊维菌素(H
2B
1a
+ H
2
B
1b
)应为95.0%~102.0%。
[性状]本品为白色结晶性粉末;微有引湿性。
本品在甲醇、乙酸乙酯、三氯甲烷中易溶,在乙醇、丙酮中溶解,在水中几乎不溶。
比旋度取本品,精密称定,加甲醇溶解并定量稀释制成每1ml中约含25mg的溶液,依法测定(附录47页),按无水、无乙醇、无甲酰胺物计算,比旋度为-17。
至-20。
[鉴别](1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外吸收图谱应与对照品的图谱一致。
[检查] 伊维菌素组分照含量测定项下的方法测定,伊维菌素H
2B
1a
的封
峰面积不得少于伊维菌素H
2B
1b
峰面积之和的90.0%。
有关物质取含量项下的对照品溶液,精密量取1ml,置100ml量瓶,加甲醇稀释至刻度,作为对照品溶液(1);精密量取对照品溶液(1)5ml,置100ml 量瓶中,用甲醇稀释至刻度,作为对照品溶液(2)。
照含量测定项下的色谱条件,取对照品溶液(2)20µl,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的10%。
立即精密量取含量项下的供试品溶液和对照品溶液(1)各20µl,注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
供试品溶液的色谱图中,伊维菌素H
2B
1a
峰的相对保留时间1.3~1.5之间的各
杂质峰面积之和不得大于对照品溶液(1)主峰,面积的2.5倍(2.5%);其他单个杂质的峰面积不得大于对照品溶液(1)主峰面积(1.0%);各杂质峰面积
的和不得大于对照品溶液(1)主峰面积的5倍(5.0%)。
〔供试品溶液色谱图中任何小于对照品溶液(2)主峰面积(0.05%)的峰可忽略不计〕
水分取本品,照水分测定法(附录69页,第一法A)测定,含水分不得过1.0%。
炽灼残渣不得过0.1%(附录71页)。
重金属取炽灼残渣项下遗留的残渣,依法检查(附录66页,第二法
含重金属不得过百万分之二十。
乙醇和甲酰胺取本品约0.2g,精密称定,置离心管中,加间二甲苯2ml 使溶解(必要时,在40~50℃水浴加热),精密加水2ml,混匀,离心,取上层液在精密加水2ml萃取一次,合并两次萃取的水层液,精密加内标液(0. 5%异丙醇水溶液)1ml,摇匀,作为供试品溶液;取无水乙醇0.15g和甲酰胺0.09g,精密称定,置同一50ml量瓶中,用水稀释至刻度,摇匀,精密量取2ml 置离心管中,加间二甲苯2ml,照上述方法,自“混匀,离心”起,同法操作,作为对照品溶液。
照残留溶剂测定法(附录71页,第三法)测定,以(6%)氰丙基苯基-(94%)二甲基聚硅氧烷为固定液(或极性相似的固定液)的毛细管为色谱柱,程序升温,初始温度40℃维持5分钟,以每分钟20℃的升温速率升至180℃,维持2分钟;检测器为氢火焰离子化检测器(FID),检测器温度为250℃;进样口温度为140℃;载气为氮气或氦气,流速为每分钟5.0ml。
理论板数以甲酰胺峰计算不低于1500,各峰分离度应符合规定。
量取供试品溶液与对照品溶液各1µl,分别注入气相色谱仪,记录色谱图。
按内标法以峰面积计算,含乙醇不得过5.0%,甲酰胺不得过3.0%。
[含量测定] 照高效液相色谱法(附录32页)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;乙腈-
甲醇-水(53:35:12)为流动相;检测波长254nm。
理论板数按H
2B
1a
峰计算
应不低于2000,伊维菌素H
2B
1a
和H
2
B
1b
峰的分离度应不小于3.0。
伊维菌素H
2
B
1b
峰约为伊维菌素H
2B
1a
峰相对保留时间的0.8。
测定法取本品适量,精密称定,加甲醇制成每1ml中约含0.8mg的溶液,精密量取20µl,注入液相色谱仪,记录色谱图;另取伊维菌素对照品适量,同法测定。
按外标法以峰面积计算,即得。
[作用与用途]抗寄生虫类药。
[贮藏]遮光,密闭,在干燥处保存。
[制剂]伊维菌素注射液
[标准来源]《中国兽药典》二00五版一部
.。
