Ksp的应用和计算word版本
(完整word版)《水分析化学》课后习题答案

水分析化学平时作业整理第一章1.简述水分析化学课程的性质及任务。
性质:水分析化学是研究水及其杂质、污染物的组成、性质、含量和它们的分析方法的一门学科。
任务:通过水分析化学学习,掌握水分析化学的四大滴定方法(酸碱滴定法、络和滴定法、沉淀滴定法和氧化还原滴定法)和主要仪器分析法(如吸收光谱法、色谱法和原子光谱法等)的基本原理、基本理论、基本知识、基本概念和基本技能,掌握水质分析的基本操作,注重培养学生严谨的科学态度,培养独立分析问题和解决实际问题的能力。
2.介绍水质指标分几类,具体包括哪些指标?(1) 物理指标1) 水温2) 臭味和臭阈值3) 颜色和色度4)浊度5)残渣6)电导率7)紫外吸光度值8)氧化还原电位(2)微生物指标1) 细菌总数2) 总大肠菌群3) 游离性余氯4) 二氧化氯(3) 化学指标1) pH值2) 酸度和碱度3) 硬度4) 总含盐量5) 有机污染物综合指标6) 放射性指标第二章1.简述水样分析前保存的要点是什么?水样保存希望做到:减慢化学反应速度,防止组分的分解和沉淀产生;减慢化合物或络合物的水解和氧化还原作用;减少组分的挥发溶解和物理吸附;减慢生物化学作用。
水样的保存方法主要有加入保存试剂,抑制氧化还原反应和生化作用;控制pH值和冷藏冷冻等方法,降低化学反应速度和细菌活性。
2.测定某废水中的COD,十次测定结果分别为50.0,49.2,51.2,48.9,50.5,49.7,51.2,48.8,49.7和49.5 mgO2/L,问测量结果的相对平均偏差和相对标准偏差(以CV表示)各多少?第三章1.已知下列各物质的Ka 或Kb ,比较它们的相对强弱,计算它们的Kb 或Ka ,并写出它们的共轭酸(或碱)的化学式。
(1) HCN NH 4+ H 2C 2O 44.93×10-10(Ka ) 5.6×10-10(Ka ) 5.9×10-2(Ka 1)6.4×10-5(Ka 2)(2) NH 2OH CH 3NH 2 AC -9.1×10-9(Kb )4.2×10-4(Kb )5.90×10-10(Kb )解:(1)酸性强弱:H 2C 2O 4> NH 4+ > HCN(2)碱性强度:CH3NH2 > NH2OH >AC-2.简述酸碱滴定中指示剂的选用原则。
高三计算专题四“Ksp的计算”

第 1 页计算专题四、——“K sp 的计算”K sp 的五大应用1.判断能否沉淀[示例1] 等体积混合0.2 mol·L -1的AgNO 3和NaAc 溶液是否会生成AgAc 沉淀?(已知AgAc 的K sp 为2.3×10-3)2.判断能否沉淀完全[示例2] 取5 mL 0.002 mol·L -1BaCl 2与等体积的0.02 mol·L -1Na 2SO 4的混合,是否有沉淀产生?若有,计算Ba 2+是否沉淀完全。
(该温度下BaSO 4的K sp =1.1×10-10)3.计算某一离子浓度[示例3] 已知在室温时,Mg(OH)2的溶度积K sp =4×10-12,求室温下Mg(OH)2饱和溶液中Mg 2+和OH -的物质的量浓度。
4.沉淀生成和沉淀完全时pH 的计算[示例4] 已知:Cu(OH)2(s)Cu 2+(aq)+2OH -(aq),K sp =c (Cu 2+)·c 2(OH -)=2×10-20。
当溶液中各种离子的浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO 4溶液里c (Cu 2+)=0.02 mol·L -1,如果生成Cu(OH)2沉淀,应调整溶液的pH ,使之大于________。
(2)要使0.2 mol·L -1CuSO 4溶液中Cu 2+沉淀较为完全(使Cu 2+浓度降至原来的千分之一),则应向溶液里加入NaOH 溶液,使溶液的pH 为________。
5.溶度积与溶解度的相互计算 (1)已知K sp ,计算溶解度(S )[示例5] 已知常温下,CaCO 3的K sp =2.9×10-9,则该温度下,CaCO 3的溶解度S =________。
(2)已知溶解度,计算K sp[示例6] 已知某温度下,Ag 2CrO 4(相对分子质量332)的溶解度S =4.349 2×10-3g ,计算Ag 2CrO 4的K sp =______。
2020高考化学冲刺核心素养微专题: 6 四大平衡常数(Ka、Kh、Kw、Ksp)的综合应用
温馨提示:此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。
关闭Word文档返回原板块。
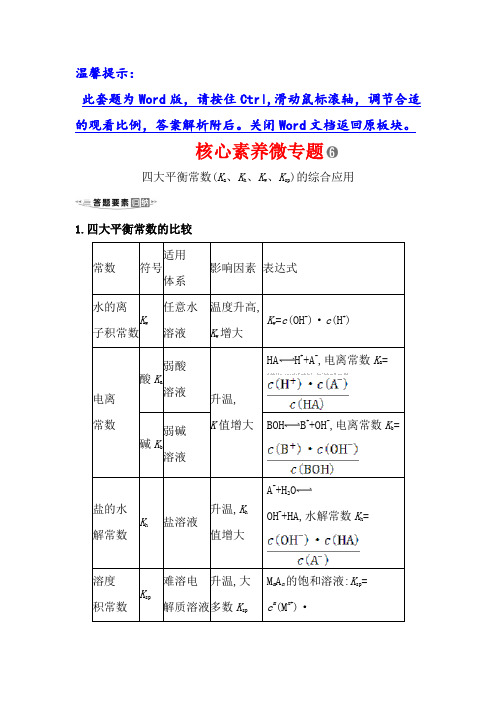
核心素养微专题四大平衡常数(K a、K h、K w、K sp)的综合应用1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K w任意水溶液温度升高,K w增大K w=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a=碱K b弱碱溶液BOH B++OH-,电离常数K b=盐的水解常数K h盐溶液升温,K h值增大A-+H2OOH-+HA,水解常数K h=溶度积常数K sp难溶电解质溶液升温,大多数K spM m A n的饱和溶液:K sp=c m(M n+)·值增大c n(A m-)2.四大平衡常数的应用(1)判断平衡移动的方向Q c与K的关系平衡移动方向溶解平衡Q c>K逆向沉淀生成Q c=K不移动饱和溶液Q c<K正向不饱和溶液(2)常数间的关系。
①K h=②K h=(3)判断离子浓度比值的大小变化。
如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为,此值不变,故的值增大。
(4)利用四大平衡常数进行有关计算。
【典例】(2019·武汉模拟)(1)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1________V2(填“>”“=”或“<”)。
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。
(用含a的代数式表示)。
ksp方案

KSP方案1. 简介KSP(Kerbal Space Program)是一款模拟宇航员在太空中进行航天任务的游戏。
玩家可以构建自己的火箭、太空飞船,并进行各种宇航任务,如卫星发射、星际探索等。
本文档将介绍KSP游戏的基本玩法和常用操作技巧。
2. 游戏基本操作2.1 主界面KSP的主界面包括以下几个重要组件:•航天公司大厅:玩家可以在这里接收任务、购买零部件以及获取任务奖励。
•航天中心:玩家可以在这里进行研发新技术、管理船坞和发射台。
•太空中心:玩家可以在这里安排任务、查看星图以及进行航天飞行训练。
•航天器编辑器:玩家可以在这里构建并修改火箭、太空飞船。
•场景管理器:玩家可以在这里保存、加载不同的游戏场景。
2.2 火箭和太空飞船构建2.2.1 火箭构建在航天器编辑器中,玩家可以通过拖拽和放置零部件的方式构建火箭。
每个零部件都有不同的功能和属性,玩家需要根据任务需求和重量限制来选择合适的零部件。
火箭构建完成后,可以保存并命名,以备后续使用。
2.2.2 太空飞船构建太空飞船的构建与火箭类似,但需要考虑更多的因素,如燃料管理、姿态控制和太空环境适应等。
玩家可以选择不同的舱内设备和科学仪器来满足任务需求。
2.3 任务接收与执行航天公司大厅提供了各种任务供玩家接收。
玩家可以浏览任务列表,选择符合自己能力和兴趣的任务,并接收任务。
任务执行时需要注意以下几点:•燃料管理:确保火箭或太空飞船的燃料充足,并合理调配燃料消耗。
•姿态控制:通过合理调整引擎推力和方向,控制姿态以实现轨道变换、对接等操作。
•天文导航:使用星图和导航仪器来导航和定位,确保按照任务要求前往目的地。
2.4 研发新技术和零部件在航天中心,玩家可以使用科技研发点数进行新技术的研发,并可以购买新零部件。
研发新技术和购买新零部件可以提升火箭和太空飞船的性能和功能,使任务执行更加顺利。
3. 高级操作技巧3.1 燃料优化为了提高火箭和太空飞船的燃料效率,玩家可以尝试以下几种方法:•多级分离:将火箭分成多个级别,每个级别完成任务后分离,减少无用载荷的消耗。
Ksp的计算及图像

变式训练1
2.(1)(2017·全国卷Ⅰ,27)若“滤液②”(含有 Fe2+和 Mg2+)中 c(Mg2+)=0.02 mol·L
-1,加入双氧水和磷酸(设溶液体积增加 1 倍),使 Fe3+恰好沉淀完全即溶液中 c(Fe3+)
3. (2017·广东广州 3 月综合测试)已知浸出液中 Mn2+、Zn2+的浓度约为 0.1 mol·
L-1,为了除去浸出液中的 Fe2+,方法是:加入 H2O2 溶液将 Fe2+氧化为 Fe3+,再调 节 pH 使 Fe3+完全沉淀。根据下列数据计算,调节 pH 的合理范围是____3____至
变式2:某浓缩液中含有I-、Cl-等离子,取 一定量的浓缩液,向其中滴加AgNO3溶液, 当AgCl开始沉淀时,溶液中 c(Cl-)/c(I -) 为 4_.7_×__1_0_-_7_。[已知:Ksp(AgCl)=1.8×10-10, Ksp(AgI)=8.5×10-17]
[提示] 当 AgCl 开始沉淀时,说明溶液中的 c(I-)和 c(Cl-)均已达到饱和状态, 因此可以根据溶度积表达式进行计算,溶液中ccCI-l-=KKspspAAggCIl=81..58××1100--1170= 4.7×10-7。
=1.0×10-5 mol·L-1,此时是否有 Mg3(PO4)2 沉淀生成?________(列式计算)。FePO4、
Mg3(PO4)2 的 Ksp 分别为 1.3×10-22、1.0×10-24。 ____F_e_3_+_恰__好__沉__淀__完__全__时__,__c(_P_O__34_-_)=__1_1._.30_××__11_00_--_252__m__o_l·_L_-_1_=__1_.3_×__1_0_-_1_7_m__o_l·_L__ -_1,__c3_(_M__g_2+_)_·c_2_(_P_O_34_-_)_值__为__0_._0_1_3×__(_1_._3_×__1_0_-_17_)2_=__1_._7_×__1_0_-_40_<__K_s_p[_M__g_3_(P_O__4)_2_],__ 因__此__不__会__生__成__M__g_3_(_P_O_4_)_2 _沉__淀__________________________________________。
标准溶度积ksp的计算公式

标准溶度积ksp的计算公式
标准溶度积ksp是一种计算溶解度的方法,它用来衡量一种物质在某种温度和压力下,在特定溶剂中可以溶解的最大量。
它的计算公式是Ksp = [A]^a[B]^b[C]^c...,其中A、B、C...是溶解在溶剂中的物质,a、b、c...是物质的溶解度系数。
使用标准溶度积ksp可以计算出溶解度,从而确定物质溶解的最大量。
比如,假设在某种温度和压力下,物质A、B、C的溶解度系数分别为2、3、4,那么溶解度ksp就可以通过Ksp = [A]^2[B]^3[C]^4来计算。
标准溶度积ksp计算出来的,可以用来判断溶解物在某种温度和压力下,是否容易溶解以及溶解的最大量。
它可以帮助我们了解溶解物的溶解性,从而提高溶解过程的效率,并有效控制溶解度。
此外,标准溶度积ksp还可以用来识别溶质之间的反应性,并根据反应性来调整溶解度。
例如,某种溶质在某种温度和压力下的溶解度系数可能会发生变化,如果使用标准溶度积ksp,就可以根据变化的溶解度系数来调整溶解度,从而提高溶解效率。
总之,标准溶度积ksp是一种有用的计算溶解度的工具,它可以帮助我们了解物质溶解的最大量,并根据反应性来调整溶解度,从而提高溶解效率。
(完整word版)沉淀溶解平衡讲义

难溶电解质的溶解平衡考点一溶解平衡和溶度积常数1.沉淀溶解平衡的概念在一定温度下,当难溶强电解质溶于水形成____________时,________速率和____________速率相等的状态。
2.溶解平衡的建立固体溶质错误!溶液中的溶质(1)v溶解____v沉淀,固体溶解(2)v溶解____v沉淀,溶解平衡(3)v溶解____v沉淀,析出晶体3.溶解平衡的特点4.电解质在水中的溶解度20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:5.溶度积和离子积以A m B n(s) m A n+(aq)+n B m-(aq)为例:溶度积离子积概念________的平衡常数溶液中有关离子____幂的乘积符号K sp Q c表达式K sp(A m B n)=______________,式中的浓度都是平衡浓度Q c(A m B n)=______________,式中的浓度是任意浓度应用判断在一定条件下沉淀能否生成或溶解①Q c____K sp:溶液过饱和,有沉淀析出②Q c____K sp:溶液饱和,处于平衡状态③Q c____K sp:溶液未饱和,无沉淀析出6.K sp的影响因素(1)内因:难溶物质本身的性质,这是主要决定因素.(2)外因①浓度:加水稀释,平衡向________方向移动,但K sp________________。
②温度:绝大多数难溶盐的溶解是________过程,升高温度,平衡向________方向移动,K sp________。
③其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但K sp不变。
1.难溶的氯化银在水中也存在着溶解平衡AgCl(s) Ag+(aq)+Cl-(aq),怎样用实验证明溶液中可以同时存在着少量的Ag+和Cl-?2.(1)0。
1 mol·L-1的盐酸与0.1 mol·L-1的AgNO3溶液等体积混合完全反应后溶液中含有的微粒有________________________。
有关Ksp的应用小结

常见考查Ksp的类型四川省巴中中学彭中华沉淀溶解平衡中Ksp的计算是高中新课程新增内容,也是与高校化学知识比较紧密的接近的部分,也是今年考纲要求新增的内容(要求学生理解Ksp的含义,能进行相关的计算)。
部分学生对有关Ksp的计算,图像问题存在困惑,往往无从下手。
为了让学生能有效应对高考中有关Ksp的计算,图像问题,现将有关Ksp的考查小结如下:一、明确Ksp的含义:Ksp指的是沉淀溶解平衡常数,对于溶解平衡A m A n(s)⇌mM n+(aq)+nA m−(aq)Ksp=[((M n+)]m·[((A m−)]n二、常元的考查类型:(一)影响Ksp的因素:例1:向AgCl饱和溶液中加水,下列叙述正确的是()A、AgCl的溶解度,增大B、AgCl的溶解度,Ksp均不变C、AgCl的Ksp增大D、AgCl的溶解度,Ksp均增大解析:在一定温度和指定的溶剂条件下,难溶盐的溶解度和溶度积均为常数,故选B(二)、有关Ksp的计算1、判断是否有沉淀生成:在一定温度下,Ksp是一个常数,通过比较Ksp与溶液中有关离子浓度幂的乘积——离子积Qc的相对大小,可以判断难溶电解质在给定条件下能否有沉淀生成。
若Qc>Ksp则有沉淀生成,Qc≤Ksp则没有沉淀生成。
例2:取10ml 0.002mol/L的BaCl2溶液与等体积的0.02mol/L Na2SO4溶液混合,是否有沉淀产生?(该温度下BaSO4的Ksp=1.1×10-10)解析:混合后溶液中(Ba2+)=1×10-3 mol/LC(SO42-)=1×10-2mol/LQc=C(Ba2+).C(SO42-)=1×10-5>Ksp故有沉淀生成。
2、判断能否沉淀完全。
主要是计算沉淀后溶液中相关离子的实际浓度,并与10-5mol/L相比较。
若实际浓度大于1×10-5mol/L 则沉淀不完全,否则沉淀完全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ksp的应用和计算
1.难溶电解质在水中存在沉淀溶解平衡,其平衡常数称为_______ __,简称_______ __。
请写出PbI2Cu(OH)2 BaSO4 CaCO3 Al(OH)3 CuS的沉淀溶解平衡与溶度积K SP表达式
3.用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。
其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
经检测发现滤液中仍含有一定量的SO42-,其原因是___________【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】
4. 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所
示。
已知: pM=-lg c(M),pc(CO32-)= -lg cc(CO32-)。
下列说法正确的是
A.MgCO3、CaCO3、MnCO3的K sp依次增大
B.a 点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-)
C.b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D.c 点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-)
5.实验室常用MnO2与浓盐酸反应制备Cl2,制备反应会因盐酸浓度下降而停止。
为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
判断此方案的实验结果(填“偏大”、“偏小”或“准确”)。
(已知:Ksp(CaCO3 ) = 2.8×10-9、Ksp(MnCO3 ) = 2.3×10-11)
6.已知在室温时,Cu(OH)2的溶度积Ksp=2.2×10-20 mol3·L-3,求室温下Cu(OH)2饱和溶液中Cu2+和OH-的物质的量浓度。
7.已知298K时,Ksp(CaCO3)=2.80×10—9,Ksp(CaSO4)=4.90×10—5 ,求此温度下该反应
的平衡常数K(计算结果保留三位有效数字):
8. KI溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的K sp=7.0×10-9。
将等体积的KI溶液与Pb(NO3)2溶液混合,若KI的浓度为1×10-2 mol·L-1,则生成沉淀所需Pb(NO3)2溶液的最小浓度为______________。
9.在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=____mol·L-1(K sp[Cu(OH)2]=2.2×10-20)。
若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是________mol·L-1。
10.已知:①难溶电解质的溶度积常数:K sp(CaF2)=1.5×10-10 ②25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),
得到c(HF)、c(F-)与溶液pH的变化关系,如
下图所示:请根据以下信息回答下列问题:(1)25℃时,HF电离平衡常数的数值K a≈。
(2)4.0×10-3,mol·L-1HF溶液与4.0×10-4,mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
