电化学第一节电解原理ppt课件
合集下载
12第1课时电解的原理55页[可修改版ppt]
![12第1课时电解的原理55页[可修改版ppt]](https://img.taocdn.com/s3/m/1baaa2f43968011ca2009167.png)
(1)例题中若铁片做阳极时,阳极的电极反应式如何书写? (2)若两电极连接电源的方向互换,是否还能“黑笔写红字”? 答案:(1)Fe-2e-===Fe2+。 (2)不能。
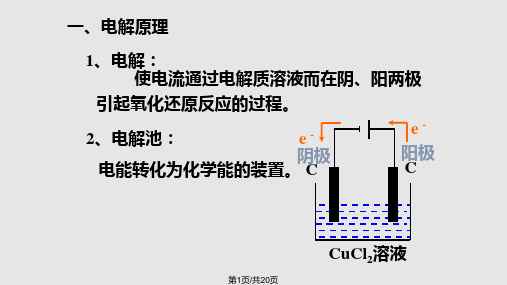
3.电解原理
阴极:与电源的□15 ________相连,溶液中的□16 ________在电极 上发生□17 ________反应。 阳极:与电源的□18 ________相连,活泼电极或溶液中的 □19 ________在电极上发生□20 ________反应。
电解过程是在直流电作用下发生的非自发的氧化还原反应,在 电解过程中电能转化为化学能,从而使许多情况下不能发生的 反应得以进行。
(2)阴极:根据阳离子放电顺序进行判断,阳离子的放电顺序为 Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+ >H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
(1)离子在电极表面失去或得到电子的过程也叫做 “放电”。 (2)在水溶液中活泼金属离子不放电,即 K+、Ca2+、Na+、Mg2+、 Al3+等不会在阴极上放电,这些活泼金属的阳离子只在熔融状态 下放电。
(1)实验现象:通电后,石墨片周围有□1 ________产生,铁片上 生成银白色金属。
(2)实验分析 ①熔融 NaCl 中存在微粒 Na+、Cl-。 ②通电后离子运动方向:Na+移向□2 ________电极;Cl-移向 □3 ________电极。 ③电极上发生的反应:铁电极:□4 ________; 石墨电极:□5 ________________。 (3)实验结论:熔融的 NaCl 在□6 ________作用下发生了□7 _____, 分解生成了□8 ________。
1.判断正误 (1)任何化学反应都可以设计成电解池反应。( ) (2)电解质溶液导电的过程发生化学变化。( ) (3)某些不能自发进行的氧化还原反应,通过电解可以实现。 () (4)电解饱和 NaCl 溶液可以得到金属钠。( ) 答案:(1)× (2)√ (3)√ (4)×
电化学原理(课件PPT)

原电池的负极→ 失去电子→电子流出→ 发生氧化反应 →氧化还原反应中的还原剂 原电池的正极→ 得到电子→电子流入→ 发生还原反应 →氧化还原反应中的氧化剂
电解池的阳极→ 失去电子→电子流出→ 发生氧化反应 电解池的阴极→ 得到电子→电子流入→ 发生还原反应
把a、b、c、d四块金属片浸泡在稀硫酸中, 用导线两两连接,可以组成各种原电池,若a、 b相连时,a为负极;若c、d相连时,d极表面 有气泡冒出;另将a投入c的盐溶液中,a的 表面有c析出;若将b投入d的盐溶液中, 无明显现象。则四种金属的活动性由强到弱 为( )
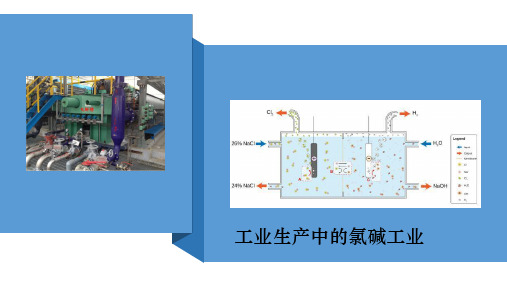
考点八:氯碱工业
在U型管里装人饱和食盐水,用一根碳棒作阳极, 一根铁棒作阴极。接通直流电源。
1.电解饱和食盐水反应原理
阳极反应:2Cl——2e— = Cl2↑
阴极反应:2H+ + 2e— = H2↑
a
b
总反应:2NaCl + 2H2O
2NaOH + Cl2↑+ H2↑
2.离子交换膜法制烧碱
1、电解槽组成: 阳极室:阳极材料为金属钛网,有钛、钌的氧化物涂层,
依反应式找出相关物质的关系式 依电子守恒进行计算。
1、在Cu-Zn原电池中,100mLH2SO4 溶液的浓度为 1mol/L , 若工作一段时间后,从装置中共收集到 1.12L 升气体,则流过导线的电子为———— mol,反应后溶液 的pH值为_________?(溶液体积变化忽略不计)
类题:资料244页举一反三第4题
书写注意事项:
①阴、阳极类似于原电池正、负极,电极反应式通常写离 子方程式,满足电子守恒
②总方程式通常写化学方程式,标条件:电解,若电解 的H+或OH-来自水,则反应物应写成水的形式,若来自 弱电解质,则应写弱电解质的分子形式。
电解原理PPT教学课件

• 干扰素是由效应T细胞产生的糖蛋白,可阻 断细胞分裂间期,抑制DNA复制,从而可用 于治疗疾病。但干扰素在体外很难保存。
• 玉米中赖氨酸的含量比较低
• 在已研究过的几千种酶中,只有极少数可以应用 于工业生产,绝大多数酶都不能应用于工业生产, 这些酶虽然在自然状态下有活性,但在工业生产 中没有活性或活性很低。这是因为工业生产中每 一步的反应体系中常常会有酸、碱或有机溶剂存 在,反应温度较高,在这种条件下,大多数酶会 很快变性失活。提高蛋白质的稳定性是工业生产 中一个非常重要的课题。一般来说,提高蛋白质 的稳定性包括:延长酶的半衰期,提高酶的热稳 定性,延长药用蛋白的保存期,抵御由于重要氨 基酸氧化引起的活性丧失等。
应
用
电解质和溶剂均不变:电解精炼铜、电镀
熔融电解:NaCl、MgCl2 、Al2O3
淡盐水
阳极 金属钛网
Cl2 +
Cl2
Cl—
H2 -
H+ Na+
NaOH溶液
阴极 碳钢网
OH—
精制饱和 NaCl溶液
离子交换膜
H2O(含少量NaOH)
-e- +
阴极 Fe C 阳极
oooooooooooo ooooooooooo
离子
放
金属越不活泼的对应阳离子越容易得电子;
电 ①阴极: H+(水)
顺
序 ②阳极: 金属(除Pt、Au外)>S2->I->Br->Cl-
>
OH-(水)>NO3->SO42->F-
电
电解质变化,溶剂不变:CuCl2、HCl
解 原
电解溶质和水:NaCl、CuSO4、AgNO3
理
电解原理PPT课件
阳极: 2Cl -- 2e-=Cl2↑
阴极: 2H+ +2e-= 总反应:2HCl=电=解
H2 ↑ Cl2↑
+
H2↑
第7页/共20页
7、电解规律(用惰性电极电解时) ⑶、电解不活泼金属的含氧酸盐时,电解质和水都 有一部分被电解,如电解CuSO4溶液、AgNO3溶液 等。 电解CuSO4溶液
阳极 : 4OH--4e-=2H2O +O2↑ 阴极: 2Cu2+ +4e-=2Cu 总反应: 2CuSO4 +2H2O电=解 2Cu+O2↑ +2H2SO4
阴极区
PH值变化 电极反应式
有H+生成, PH值减小
①
有OH-减少, PH减小
②
有H+生成, PH值减小
②
/
②
有H+生成, PH值减小
Cu2++2e=Cu
PH值变化
有H+减少, PH值增大 有OH-生成, PH值增大 有OH-生成, PH值增大 有OH-生成, PH值增大
/
第11页/共20页
电解过程中会出现两极区的PH值差异,某些原电 池工作时也会出现两极PH值的不平衡性,当然这 与H2与O2参加电极反应有关:
阴极上的电极反应式是 Cu2+ +2e-=Cu
。
第19页/共20页
感谢观看!
第20页/共20页
第9页/共20页
8.电解后溶液PH值的变化
H+只可能在阴极放电,OH-只可能在阳极放电,对于非酸、 非碱溶液来说,放电的H+来自于阴极区的水的电离,放电 的OH-来自于阳极区水的电离。所以有:
⑴H+总是在阴极放电,OH-总是在阴极上生成 ① 2 H++2e-=H2↑ ② 2H2O+2e-= H2↑+2 OH- 电解过程中,阴极区PH值会因H+减少或OH-生成而增大; ⑵OH-总是在阳极上放电,H+总是在阳极上生成 ③ 4 OH--4e-=2H2O+O2↑ ④ 2H2O-4e-=4H++O2↑ 电解过程中,阳极区的PH值会因OH-减少或H+的生成而减小。
电解原理实用ppt人教版
电解原理实用ppt人教版(优秀课件)
电解原理实用ppt人教版(优秀课件)
5.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、
无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用
铅笔在滤纸上写字会出现红色字迹。则下列叙述正确的是( D )
A.铅笔端作阳极,发生还原反应 B.铂片端作阴极,发生氧化反应 C.铅笔端有少量的氯气产生 D.a点是负极,b点是正极
(1)通入氢气的电极为__负__极____(填“正极”或“负极”),负极的电极 反应式为: H2-2e-+2OH-===2H2O 。 (2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜 溶液浓度将___减__小___(填“增大”“减小”或“不变”)。
电解原理实用ppt人教版(优秀课件)
电解原理实用ppt人教版(优秀课件)
课堂巩固
4.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质, 可用电解法制备高纯度的镍,下列叙述正确的是( D )
(已知氧化性:Fe2+<Ni2+<Cu2+) A.阳极发生还原反应,其电极反应式: Ni2+ + 2e— = Ni B.电解过程中,阳极质量的减少与阴极质量的增加相等 C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ D.电解后,电解槽底部的阳极泥中只有Cu和Pt
Ag、Au
电解原理实用ppt人教版(优秀课件)
电解原理实用ppt人教版(优秀课件)
3.电解精炼铜
电解原理实用ppt人教版(优秀课件)
镍铁精炼炉
铜精炼阳极炉车间
电解原理实用ppt人教版(优秀课件)
4.电冶金
(1)金属冶炼的本质: 使矿石中的金属离子获得电子,从它们 的化合物中还原出来,电解法用于冶炼 活泼金属冶炼钠、钙、镁、铝这些金属
第1课时电解原理

CuCl2 = Cu2++ 2Cl通电前: H2O H+ + OH-
碳
阴极
碳
阳极
2.通电后,这些离子在溶液中的运 动是否会发生变化?如何变化?
通电后: Cu2+ 、H+移向阴极, Cl- 、OH-移向阳极 3.通电后,移向各区域的离子可能发生什么反应?
阴极:Cu2+ + 2e- = Cu 阳极:2Cl--2e- = Cl2↑
放电:阴离子失去电子,阳离子得到电子的过程。 若阳极区域收集到11.2L气体(标况下),则电解过程中理 论上有 m1ol电子转移,阴极增重 g 32
3、电子、离子移向:
电子: 电源负极→电解池阴极 电解池阳极→电源正极
阴离子移向阳极,阳离子移向阴极
【过渡】电解CuCl2 水溶液时为何阳极是Cl–放 电而不是OH-放电,阴极放电的是Cu2+ 而不是H+?
阴极
阳极c: 2Cl– – 2e– = Cl2↑ 阴极d: Cu2+ + 2e– = Cu
3.下图是以石墨为电极,电解NaCl溶液的装置图。 (1)请在图上标出:①电源各电极的名称;②电解池各电 极的名称;③电子流向;
(2)写出各电极反应式及总反应式
C (放电顺序H+>Na+,Cl- > OH- )
4、离子放电顺序 (1)阴极反应(还原反应):
与电极材料无关
阳离子放电(得电子,氧化性强的离子先得电子)
Ag+>Hg2+> Fe3+ >Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+> Zn2+> H+(水)>Al3+、Mg2+、Na+、Ca2+、K+ …
高一化学电解原理(共10张PPT)

高铁电池是一种新型可充电电池,与普通高能电池相比,
该电池长时间保持稳定的放电电压。高铁电池的总反应
为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+
2Fe(OH)3+4KOH,下列叙述不正确的是 C
A. 放电时负极反应为:Zn-2e+2OH =Zn(OH)2
B 充电时阳极反应为FeOH3-3e+5OH =FeO42-+ 4H2O
电能
电能
化学能
B 电池的总反应是:2C4H10+13O2 8CO2+10H2O
(1)接通直流电源后,阳极和阴极附近有何现象?
负极:电子流出 正 K+ Ca2+ Na+ Mg2+ Al3+(H+水中)Zn2+ Fe2+ Pb2+ H+(酸中)Cu2+Hg2+Ag+
电极名称 极:电子流进 阳极:得电子 还原反应
举例 物质类别
实例
水
含氧酸
H2SO4
电
强碱
NaOH
解 活泼金属的 Na2SO4
含氧酸盐
溶
无氧酸
HCl
质
电 不活泼金属 CuCl2 解 的无氧酸盐
溶质和 活泼金属的 水同时 无氧酸盐 电解 不活泼金属
的含氧酸盐
NaCl CuSO4
电极反应
阳极:4OH—-4e—=O2↑+2H2O 阴极:4H++4e—=2H2↑
高一化学电解原理
负极判断方法: 1、较活泼的金属
2、电子流出 3、发生氧化反应
阳极判断方法:
1、连电源正极
2、发生氧化反应 3、阴离子移向
实质
装置名称 2H+ +2e- = H2
电解原理精选教学PPT课件

想一想、做1、溶做液中看哪些微粒?
[例]以石墨碳棒为电极,请2、写阳阴出极极分区区别有又电哪有些哪解离些下子离列?子溶?液时, 在阴、阳两极上发生的电极反3、应哪式个及离总子的先化放电学?方程式。 (1)NaCl溶液: 阳极:2Cl--2e-=Cl2↑
阴极:2H++2e-=H2↑电(解2H2O 2H++2OH-)
阴离子:Cl- OH-
思考2:在通电时这些微粒各向什么区移动?
Cu2+ H+向阴极区移动; Cl- OH-向阳极区移动
思考3:猜想在通电时在阳极和阴极各会发生
什么样的电极反应?产物可能是哪些?
阴极区: Cu2+→Cu H+→H2↑
阳极区: Cl-→Cl2↑ OH-→O2↑
实践探究
1、向氯化铜溶液中通入直流电
假如人生不曾相遇,我不知道自己有那样一个习惯,收集你的欢笑,收集你的感情,收集你的一切一切。 假如人生不曾相遇,我不能深刻的体会孤独和忧伤,有着莫名的感动,激荡着热泪盈眶的心情入眠。
假如人生不曾相遇,我不会保持着一个人的想象,即使这想象难免寂寞无奈,但我仍然坚持着这样的梦想。 假如人生不曾相遇,我怎会理解一个人的孤独是那样铭心,但却可以释放自我的彷徨与无助。含泪的沧桑,无限的困惑,因为遇见了你,才会有更深的意义。可为什么在爱的时候,总伴着淡淡的心伤?
阳极:4OH--4e-=2H2O+O2↑(4H2O=4H++4OH-) 阴极:4H++4e-=2H2 ↑
通电
总反应式:2H2O=O2 ↑+2H2 ↑
课堂小结:我应该学会什么!
一、知识目标
知道什么是电解池吗? 知道什么是电解池的阳极与阴极吗? 会分析电解质溶液中存在的阴阳离子吗? 知道电解池中阴阳离子的运动吗? 知道阳极一般是何种微粒发生反应?发生什么反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cu2+-2e-=Cu
Cu2+-2e-=Cu
习题
写出用惰性电极电解下列物质的电极反应式
电解水 及总反应式. 电解本身 H SO ①Na2SO4 NaOH H2O 2 4 电解阳离子 ②CuCl2 HCl 电解阴离 ③CuSO4 AgNO3 子 ④NaCl KCl
电解CuCl2 阴极材料 阴极反应 反应式 碳棒
Cu的精练 纯铜片
电镀铜 待镀件 铜沉积在镀件 上 Cu2++2e-=Cu
生成的铜沉积 铜沉积在纯铜 在碳棒上 片上 Cu2++2e-=Cu Cu2++2e-=Cu
阳极材料
阳极反应
碳棒
生成氢气
粗铜
铜氧化成Cu2+
铜
铜氧化成Cu2+
反应式
2Cl--2e-=Cl2
原电池和电解池的比较
原电池 电解池
负极
正极
阳极
阴极
氧化反应
还原反应
氧化反应
还原反应
二、铜的电解精炼
阳极材料
粗铜棒 Cu
– 2e- =Cu2+
阴极材料 电解质溶液 铜棒 硫酸铜 Cu2++ 2e- = Cu
三、电镀铜
阳极材料
铜棒 Cu
– 2e- =Cu2铜 Cu2++ 2e- = Cu
定向移动
Cu2+ CI— H+ OH--
2. 通电后这些离子的运动情况?
离子的放电顺序
K+Ca2+Na+Mg2+Al3+Zn2+Fe2+Sn2+Pb2+H+Cu2+Fe3+Hg+Ag+
M0 S2- I- Br- Cl- OH-
电解池
概念
借助电流引起氧化还原反应的装置,也 就是把电能转化成化学能的装置,就叫 做电解池或电解槽
第一节
电解原理
高二化学
教学目的:
理解电解原理 2. 了解铜的电解精练 3. 了解电镀铜
1.
一. 电解原理
下面以电解氯化铜为例来分析电解原理
概念: 使电流通过电解质溶液而在阴阳两极引
起氧化还原反应的过程叫做 电解
讨论
自由移动 1. 通电前氯化铜溶液里主要存在那些离子?这 些离子的运动情况?
