过渡金属的习题
大学无机化学第20章 过渡金属元素习题答案 20120319

第20章d区过渡金属元素习题解答1.为什么过渡元素中,同族元素从上到下高氧化态物质的稳定性升高,而过渡后的p区元素同族自上而下低氧化态的物质趋于稳定?2.自ⅣB族到ⅦB族元素的最高氧化态在溶液中为什么不存在简单的离子M4+、M5+、M6+?3.为什么d区金属的密度、硬度、熔点、沸点一般较高?4.过渡元素的氧化态分布有何特点?5.由MnO2制备锰酸盐应在酸性介质还是碱性介质中进行?欲把Mn2+ 离子氧化为MnO4–离子应选用何种氧化剂?6.Cr3+与Al3+在生成化合物方面有何异同?7.根据下列实验现象,写出相应的化学反应方程式:(1)在酸性K2Cr2O7溶液中加入Na2SO3溶液,颜色由橙红变蓝绿色,此时加入乙醚,并用HNO3酸化,溶液变为深蓝色。
(2)黄色的BaCrO4溶在浓盐酸中,得到的是绿色溶液,写出化学方程式,说明颜色变化。
(3)Fe2(SO4)3溶液与Na2CO3溶液作用,得不到Fe2(CO3)3。
(4)在水溶液中用Fe3+与KI作用,不能制得FeI3。
(5)向Fe3+溶液中加入KSCN后出现红色,若再向溶液中加入Fe粉或NH4F晶体,红色又消失;(6)向CoCl2溶液中加入NaOH溶液,先析出粉红色沉淀,沉淀很快又转为灰绿色至褐色。
8.写出下列反应的化学方程式:(1)TiO2(s) + BaCO3(s) → ;(2)V2O5(s) + HCl(aq) → ;(3)Cr2O72–(aq) + Ag+(aq) + H2O(l) → ;(4)[Cr(OH)4]–(aq) + H2O2(l) + OH–(aq) → ;(5)MnO4–(aq) + Fe2+(aq) + H+(aq) → ;(6)MnO2(s) + HCl(aq,浓) → ;(7)Cr3+(aq) + MnO4–(aq) + H2O(l) → ;(8)Co2O3(s)+ HCl (aq,浓) → ;(9)K3[Fe(CN)6] (aq) + Fe2+(aq) → ;(10)PO43–(aq) + (NH4)2MoO4(aq) + H+(aq) → ;(11)PdCl2(aq) + CO(g) + H2O(l) → ;(12)Pt(s) + HNO3(aq) + HCl(aq) → 。
高考复习(化学)专项练习:非选择题专项练【含答案及解析】(一)

非选择题专项练(一)1.过渡金属及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价层电子轨道表示式为;与钛同周期的过渡元素中,基态原子的成对电子数与钛相同的有种;金属钛是一种新兴的结构材料,其硬度比金属镁和铝大的原因是。
(2)在浓的TiCl3的盐酸中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为2∶4,则由该配合离子组成的晶体化学式还可以写为。
(3)航母螺旋桨主要用铜合金制造。
含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
①M所含元素的第一电离能最大的是(用元素符号表示)。
②X化合物中中心原子铜的配位数是,上述反应中断裂和形成的化学键有。
(4)金红石(TiO2)是含钛的主要矿物之一,其晶胞结构(晶胞中相同位置的原子相同)如图所示。
①A、B、C、D 4种粒子,其中钛原子是(填字母)。
②若A、B、C的原子坐标参数分别为A(0,0,0)、B(0.69,0.69,1)、C(1,1,1),则D的原子坐标参数为D(0.19,,);该化合物的密度为 g·cm-3(用含a、c、N A的代数式表示)。
2.钛铁矿(FeTiO3)中往往含有Fe2O3、MgO、CaO、Al2O3、SiO2等杂质。
一种硫酸法制取白色颜料钛白粉(TiO2)的生产工艺如图所示:已知:Ⅰ.酸浸后,钛主要以TiOSO4形式存在。
Ⅱ.强电解质TiOSO4在溶液中仅能电离出S O42-和一种阳离子。
Ⅲ.H2TiO3不溶于水和稀酸。
(1)为提高酸浸速率,一般采取的措施是。
(写两条)(2)滤渣①的主要成分是。
(3)酸浸过程中,写出含钛化合物发生反应的化学方程式:。
(4)加入铁粉的目的是还原体系中的Fe3+。
为探究最佳反应条件,某实验室做如下尝试。
图1图2①在其他条件不变的情况下,体系中Fe(Ⅲ)含量随pH的变化如图1所示,试分析在pH介于4~6之间时,Fe(Ⅲ)含量基本保持不变的原因:。
过渡金属的习题

交作业时间说明:第13周周五20160520:过渡的第一、二部分和稀有气体;第15周周五20160603:过渡的第三部分过渡的第四部分(不交)过渡金属的习题第一部分:元素通性1. 第一过渡周期的二价金属离子的半径如下,写出他们在正八面体弱场中的d电子排布并2. 试从结构的观点予以解释:(1)第一过渡系金属水合离子颜色及含氧酸根颜色产生的原因;(2)同族的过渡金属元素的金属性、氧化还原稳定性变化规律,与碱金属、碱土金属的区别;(ⅢB-ⅤB)第二部分:IIIB-VIIB族为主1.根据以下连续性实验事实说明发生了什么反应,试用反应方程式解释。
(1)打开装有TiCl4的瓶塞,立即冒白雾;(2)向TiCl4溶液中加入浓盐酸和Zn,溶液显紫色;(3)缓慢加入NaOH使溶液呈碱性,析出紫色沉淀;(4)沉淀经过滤分离后,用硝酸溶解,再用稀碱溶液处理,得白色沉淀;(5)将白色沉淀过滤并灼烧后,与等物质的量的MgO共熔。
2.回答下列问题:(1)为什么TiO2+(aq)无色,而TiI4为暗棕色晶体。
(2)如何鉴别TiO2+离子和Ti3+离子?(3)从热力学角度看,[Ti(H2O)6]2+、[Ti(H2O)6]3+、[Ti(H2O)6]4+离子中,哪个或哪几个不能稳定存在?为什么?3. Sc2O3在哪些性质上与Al2O3相似,为什么?最近有一篇很火的Science的论文,主要是Al 电池的研究,预测一下是否可以进行Sc电池的研究?4.微观角度解释现象:(1)向V2+(aq)中逐滴加入KMnO4溶液,观察颜色变化。
(2)浓氨水逐滴加入含NH4Cl的CrCl3溶液中,颜色变化:紫红→浅红→橙红→橙黄→黄色的变化。
(3)Mn2+的半径为80pm,Mg2+为66pm,但MnCO3的分解温度低于MgCO3。
(4)溶液中含有NH4+时,更利于Mn和水的反应。
5. 结合反应式解释现象:(1)酸性钒酸盐溶液中通入SO2时生成一深蓝色溶液。
金属有机化学习题
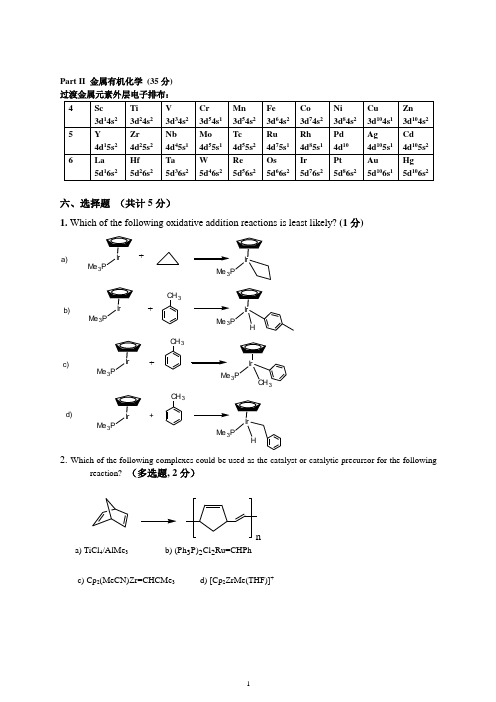
Part II 金属有机化学 (35分) 过渡金属元素外层电子排布:六、选择题 (共计5分)1. Which of the following oxidative addition reactions is least likely? (1分)Me 3PMe 3PMe 3PHMe 3PCH 3Me 3PMe 3PMe 3PIr Me 3PH+a)b)c)d)+++CH 3CH 3CH 32. Which of the following complexes could be used as the catalyst or catalytic precursor for the followingreaction? (多选题, 2分)na) TiCl 4/AlMe 3b) (Ph 3P)2Cl 2Ru=CHPhc) Cp 2(MeCN)Zr=CHCMe 3d) [Cp 2ZrMe(THF)]+3. Which of the following species could be used as the catalyst or catalytic precursor for the following reaction? (多选题, 2分)+H2a) IrCl(PPh3)3b) IrH3(PPh3)3c) RuHCl(PPh3)3d) NaH七、推导计算题(共计10分)1. On the basis of the 18 electron rule, identify the first-row transition metal for each ofthe following: (6 points)a) [M(CO)7]+; b) H3CM(CO)5; c) M(CO)2(CS)(PPh3)Br; d) [(η3-C3H5)(η3-C5H5)M(CO)]-; e) (OC)5M=C(OCH3)(C6H5); f) [(η4-C4H4)(η5-C5H5)M]+; g) [M(CO)4I(dppe)]-例e) 18 – 5x2 – 4 = 4, M(II), d4, Cr;2. On the basis of the 18 electron rule, determine the expected charge on the following: (4 points)a) [Co(CO)3]z; b) [Ni(CO)3(NO)]z (contains linear NO); c) [Ru(CO)4(CMe3)]z; d) (η3-C3H5)V(CNCH3)5]z; e) [(η5-Cp)Fe(CO)3]z例b) 18 – 3x2 – 2 = 10, Ni(0), d10, z = 0八、Provide a mechanism for the following transformation. (每题4分,共计16分)a) When A is treated with a Pd(0) catalyst and methyl acrylate, B is formed. When C is treated with a Pd(0) catalyst and methyl acrylate, D is formed. Please provide a mechanism for each reaction and explain the difference in the reaction pathways.b)ICOOH OO+34o 52%23.3c)R+PhArI+ArRPh34NaHCO3d)e)f) The Pd-catalyzed reaction of aryl halides with alcohols under an atmosphere of CO affords esters:Sketch a catalytic cycle for this reaction. You may assume the formation of small but usefulequilibrium concentrations of Et 3NHOMe.九、Predict the metal-containing products of the following reactions. (每题1分,共计4分)例,Ph 3P PtPh 3P+?IPh 3PPt PPh 3Ia)PCy 3RuPCy 3Cl OCH+Ph( )b)Mo NO CO++MeLi( )c)+IrPh 3PPPh 3PhBr( )d)NPPh 2PPh 2Pt +PhNH 22+BF 4-( )。
化学自主招生专题习题8 铜锌 铁系 过渡金属元素

宁乡一中自主招生培训专题训练8铜锌铁系过渡金属元素一:简答题1:(09北大)Ag为什么能置换出HI(aq)和H2S(aq)中的氢?2:用反应方程式说明下列现象:(1)铜器在潮湿空气中会慢慢生成一层铜绿;(2)金溶于王水中;(3)在CuCl2(4)当SO2通入CuSO4与NaCl的浓溶液时析出白色沉淀;(5)往AgNO3溶液滴加KCN溶液时,先生成白色沉淀而后溶解,再加入但加入少许Na2S溶液时却析出黑色Ag2S沉淀。
3:1:焊接铁皮时,常先用浓ZnCl2溶液处理铁皮表面;2:HgS不溶于HCl,HNO3和(NH4)2S中而能溶于王水或Na2S中,4:解释下列问题:(1)在Fe3+离子的溶液中加入KSCN(2)为什么Fe3+盐是稳定的?而Ni3+盐尚未制得?(3)为什么不能在水溶液中由Fe3+盐和KI制得FeI3?(4)变色硅胶含有什么成分?为什么在干燥的时候呈蓝色,吸水后变成粉红色?5:自来水厂用绿矾和氯气一起净水,写出有关反应的离子方程式:6:根据《本草纲目》有关记载:“水银乃至阴之毒物,因火煅丹砂而出,加以盐、以硫磺升而为银朱”。
写出主要化学反应方程式。
4)2CO3CaCO3和CaSO3都是难溶的电解质,试说明原因。
五、将锌粒投入CuSO4溶液后,常常可以观察到这样的现象.锌粒表面有黑色粉物生成,并出现少量气泡。
静止2~3小时,黑色粉状物大量增加。
经过滤后得到的部分黑色粉状物用蒸馏水洗涤5~6次,至少量洗液中滴入过量氨水无颜色变化止。
凉干黑色粉状物后进一步实验;取少量黑色粉状物于试管中,滴加适量的稀盐酸即出现紫红色粉状物,并伴有极少量的气泡,溶液显淡黄绿色。
吸取淡黄绿色溶液少许至另一洁净试管中,加入过量氨水,生成蓝色溶液。
1.黑色粉状物的组成是什么?2.生成黑色粉状物的原因是什么?3.如欲在锌拉与CuSO4溶液的反应中观察到表面析出的紫红色铜,应采取什么措施?六:高铁(Ⅵ)酸盐是新一代水处理剂,其制备方法有:①次氯酸盐氧化法(湿法);②高温过氧化物法(干法);等。
第二十三章_过渡金属(一)课后习题参考答案

第二十三章过渡金属(一)课后习题参考答案4解:(1) 因TiCl4吸水后强烈水解产生HCl,导致冒白烟. TiCl4 + H2O == H4TiO4↓+ 4HCl ↑(2) 因Ti(Ⅳ)被Zn还原成Ti3+而显紫色. 2TiCl4 + Zn == 2TiCl3 + ZnCl2(3) 因Ti3+与OH-形成紫色沉淀Ti(OH)3. TiCl3 + 3NaOH == Ti(OH)3↓+ 3NaCl(4) Ti(OH)3溶于硝酸后被氧化为Ti(Ⅳ),遇碱生成TiO2·xH2O的白色胶状沉淀.3Ti(OH)3 + 7HNO3 == 3TiO(NO3)2 + NO↑+8H2O TiO2+ + 2OH- + H2O == H4TiO4↓5解:(1) Ti + 6HF == H2TiF6 + 2H2↑ (2) TiCl62- + NH4+ == (NH4)2TiCl6↓(黄色)(3) TiO2 + BaCO3BaTiO3 + CO2(4) V2O5 + 2NaCl + 1/2O22NaVO3 + Cl2 2NaVO3 + 2H+ == 2Na+ + V2O5 + H2O(5) V2O5 + 6HCl == 2VOCl2 + Cl2 + 3H2O V2O5 + 6NaOH == 2Na3VO4 + 3H2O(6) 2NH4VO3 V2O5 + 2NH3 + H2O7解:2VO2+ + SO2 == 2VO2+ + SO42- 2VO2+ + 3Zn + 8H+ == 2V2+ + 3Zn2+ + 4H2O VO2+ + V2+ + 2H+ == 2V3+ + H2O9解:(1) (NH4)2Cr2O7Cr2O3+N2+4H2O(2) Cr2(SO4)3 + 6NaOH == 2Cr(OH)3↓+ 3Na2SO4 Cr(OH)3 + OH- == CrO2- + 2H2O2CrO2- + 3Br2 + 8OH- == 2CrO42- + 6Br- + 4H2O(3) Cr2O72- +3Zn + 14H+ == 2Cr3+ + 3Zn2+ + 7H2O 2Cr3+ + Zn ==2Cr2+ + Zn2+4Cr2+ + O2 + 4H+ == 4Cr3+ + 2H2O(4)Cr2O72- + 8H+ + 3H2S == 2Cr3+ + 3S + 7H2O(5)Cr2O72-+2Ba2+ + H2O == 2BaCrO4 + 2H+(6)2BaCrO4 + 16HCl(浓) == 2BaCl2 + 2CrCl3 + 8H2O + 3Cl2(7)K2Cr2O7 + S K2SO4 + Cr2O310解:A:K2Cr2O7 B:Cl2 C:Cr3+ 溶液D:Cr(OH)3 E:CrO2- F:CrO42-Cr2O72- + 8H+ + 6HCl==2Cr3+ + 3Cl2 + 7H2O Cr3+ + 3OH-==Cr(OH)3Cr(OH)3 + OH-==CrO2- + 2H2O 2CrO2- + 3H2O2 + 2OH-==2CrO42- + 4H2O2CrO42- + 2H+ ==Cr2O72- + H2O11解:已知Ag2CrO4的Ksp=×10-12,AgCl的Ksp=×10-10.Ag2CrO4刚沉淀时[Ag+]=(Ksp/[CrO42-])=×10-12/×10-3)=×10-5AgCl刚沉淀时[Ag+]=Ksp/[Cl-]=×10-10/×10-3=×10-7.∵×10-7<×10-5, 说明AgCl先沉淀析出,而Ag2CrO4后析出.当Ag2CrO4刚析出时,溶液中[Ag+]=×10-5, 这时[Cl-]= Ksp/[Ag+]=×10-10/×10-5=×10-6 <10-5, 说明此时AgCl已经沉淀完全,即两者是可以分离的.12解:(1) 对于平衡: 2CrO42- + 2H+ == Cr2O72- + H2O平衡浓度: 1×90% x 1/2×代入平衡常数表达式: ×(1×2×x2=×1014∴ x=×10-8(mol/L) pH=当Cr2O72-占90%时: 1××y2=×1014∴ y=×10-7(mol/L) pH=18解:A:MnO2; B:Mn2+(溶液); C:O2; D:Mn(OH)2; E:MnO(OH)2; F:K2MnO4; G:MnO4-MnO2+2H2SO4(浓)==2MnSO4+2H2O+O2 MnSO4+2OH-==Mn(OH)2↓(白)+SO42-2Mn(OH)2+O2==2MnO(OH)2(棕色) 3MnO2+6KOH+KClO3==3K2MnO4+KCl+3H2O3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO319解:该溶液中含有Cl-,MnO4-和Cr2O72-(或者CrO42-)Ag+ + Cl- == AgCl↓ Cr2O72- + 4Ag+ + H2O == 2Ag2CrO4(砖红)↓ + 2H+2Ag+ + CrO42- == Ag2CrO4 2Ag2CrO4 + 2H+ == Cr2O72- + 4Ag+ + H2O2MnO4- + 5SO32- + 6H+ == 2Mn2+ + 5SO42- + 3H2O20解:(1) 已知电势图: MnO4- MnO42- MnO2∵ψθ(右)>ψθ(左) ∴反应: 3MnO42- + 4H+ == 2MnO4- + MnO2 + 2H2O 可自发向右进行,即MnO42-在标态下是不能稳定存在的.要使其稳定,则上述反应的△E<0,即△Eθ[MnO4-]2/[MnO42-]3[H+]4<0 令 [MnO4-]=[MnO42-]=Lψθ(MnO42-/ MnO2)-ψθ(MnO4-/ MnO42-)[H+]-4<0[H+]<×10-15 pH> [OH-]>(mol/L)(2) a. 从生成焓的数据来看: △f Hθ(Mn2+,aq)= mol; △f Hθ(Fe3+,aq)= mol;生成Mn2+(aq)时放出的热量远大于Fe3+(aq),说明Mn2+比Fe3+更稳定.b. 从电极电势数据看: ψθ(Mn2+/ Mn)= ; ψθ(MnO2/ Mn2+)=; ψθ(Fe3+/ Fe2+)=; ψθ(Fe2+/电极电势值△rGθψθ(Mn2+/ Mn)= Mn2+的△rGθ= kJ/molψθ(MnO2/ Mn)=MnO2的△rGθ= + kJ/molψθ(Fe2+/ Fe)= Fe2+的△rGθ= kJ/molψθ(Fe3+/ Fe)= Fe3+的△rGθ= kJ/mol由△rG= -nFE= nFψ得△rG,见上表.以△rGθ对氧化态作图得到如图所示结果.由此图可看出,Mn2+的稳定性高于Fe3+(和Fe2+).c. 从电离能数据看:Mn元素: I1=717kJ/mol; I2=1509kJ/mol;I3=3248kJ/mol;Fe元素: I1=759kJ/mol; I2=1561kJ/mol;I3=2957kJ/mol;Mn失去两个电子形成Mn2+后,再失去第三个电子是较困难的(因I3远大于I2),而Fe的I3和I2相差不如Mn的大,即Fe2+容易再失去1个电子变为Fe3+,Fe3+也较易得到1个电子变为Fe2+,所以Fe3+不如Mn2+稳当.(3) 首先NaBiO3把Mn2+氧化到MnO4-,则溶液显紫色.而紫色消失是由于产物MnO4-与反应物Mn2+继续反应生成MnO2沉淀.2Mn2++5BiO3-+14H+==2MnO4-+5Bi3++7H2O 2MnO4-+3Mn2++2H2O==5MnO2+4H+(4) 因MnO4-不稳定,在水溶液中会发生分解而析出MnO2沉淀4MnO4- + 2H2O == 4MnO2 + 4OH- + 3O221解:(1) Fe2+ + 2OH- == Fe(OH)2↓(白) 4Fe(OH)2 + O2 +2H2O == 4Fe(OH)3↓(棕)(2) Fe(OH)3 + 3HCl == FeCl3 + 3H2O(3)Fe3+ + nSCN- == [Fe(SCN)n]3-n(血红色)(4)2[Fe(SCN)n]3-n + SO2 + 2H2O == 2Fe2+ + 2nSCN- + SO42- + 4H+(5)5Fe2+ + MnO4- + 8H+ == 5Fe3+ + Mn2+ + 4H2O(6)4Fe3+ + 3Fe(CN)64- == Fe4[Fe(CN)6]322解:(1) 对于水合离子[Co(H2O)6]2+和[Co(H2O)6]3+,在八面体弱场中,两者均存在3个成单电子,但由于稳定化能的绝对值[Co(H2O)6]2+的大于[Co(H2O)6]3+的,所以[Co(H2O)6]3+不能稳定存在,而[Co(H2O)6]2+可以。
过渡元素(课后基础习题)

过渡元素1、钛的主要矿物是什么?简述从钛铁矿制取钛白得反应原理。
2、完成并配平下列反应方程式。
(1)Ti + HF →(2)TiO2 + H2SO4→(3)TiCl4 + H2O →(4)FeTiO3 + H2SO4→(5)TiO2 + BaCO3→(6)TiO2 + C + Cl2→3、完成下列反应(1)TiI4在真空中强热;(2)FeTiO3和碳得混合物在氯气中加热;得水溶液加入过量得氨;(3)向含有TiCl-26(4)向VCl3的水溶液加入过量的氨;(5)将VCl2的固体加到HgCl2水溶液中。
4、根据下列实验写出有关的反应方程式:将一瓶TiCl4打开瓶塞时立即冒白烟。
向瓶中加入浓HCl溶液和金属锌时生成紫色溶液,缓慢地加入NaOH溶液直至溶液呈碱性,于是出现紫色沉淀。
沉淀过滤后,先用HNO3处理,然后用稀碱溶液处理,生成白色沉淀。
5、完成并配平下列反应方程式−(1)V2O5 + NaOH−→−(2)V2O5 + HCl−→−(3)VO43- + H+(过量) −→−(4)VO2+ + Fe2+ + H+−→−(5)VO2+ + H2C2O4 + H+−→6、新生成的氢氧化物沉淀为什么会发生下列变化(1)Mn(OH)2几乎是白色的,在空气中变为暗褐色?(2)白色的Hg(OH)2立即变为黄色?(3)蓝色的Cu(OH)2,加热时为什么变黑?7、根据下述各实验现象,写出相应的化学反应方程式(1)往Cr2(SO4)3溶液中滴加NaOH溶液,先析出葱绿色絮状沉淀,后又溶解,此时加入溴水,溶液就由绿色变为黄色。
用H2O2代替溴水,也得到同样结果。
(2)当黄色BaCrO4沉淀溶解在浓HCl溶液中时得到一种绿色溶液。
(3)在酸性介质中,用锌还原Cr2O-2时,溶液颜色由橙色经绿色而变成蓝色。
放置时又变回绿色。
7(4)把H2S通入已用H2SO4酸化的K2Cr2O7溶液中时,溶液颜色由橙变绿,同时析出乳白色沉淀。
第19章-过渡元素(一)习题

第19章 过渡元素(一)习题1.选择题19-1下列配离子属于反磁性的是……………………………………………( )(A) [Mn(CN)6]4-(B) [Cu(en)2]2+ (C) [Fe(CN)6]3- (D) [Co(CN)6]3-19-2下列氧化物与浓H 2SO 4共热,没有O 2生成的是……………………( ) (A) CrO 3 (B) MnO 2 (C) PbO 2(D) V 2O 5 19-3下列离子中磁性最大的是………………………………………………( )(A) V 2+ (B) Cr 3+ (C) Mn 2+ (D) Fe 2+19-4 在某种酸化的黄色溶液中,加入锌粒,溶液颜色从黄经过蓝、绿直到变为紫色,该溶液中含有……………………………………………………………( )(A) Fe 3+ (B) +2VO (C)-24CrO (D) Fe (CN)-4619-5在碱性溶液中氧化能力最强的是………………………………………( )(A) -4MnO (B) NaBiO 3 (C) Co 2O 3 (D)-272O Cr19-6过渡金属和许多非金属的共同点是……………………………………( )(A) 有高的电负性 (B) 许多化合物有颜色(C) 有多种氧化态 (D) 许多化合物具有顺磁性 19-7 CrO 5中Cr 的氧化数为 …………………………………………………( )(A) 4 (B) 6 (C) 8 (D) 10 19-8在酸性介质中加入过氧化氢(H 2O 2)时不生成过氧化物的化合物是…( )(A) 钛酸盐 (B) 重铬酸盐 (C) 钒酸盐 (D) 高锰酸盐 19-9根据铬在酸性溶液中的元素电势图可知, ϕ(Cr 2+/Cr)为…………… ( )Cr 3+──── Cr 2+ ───── Cr(A) -0.58 V (B) -0.91 V(C) -1.32 V (D) -1.81 V19-10 已知V 3+ / V 2+ 的 ϕ= -0.26 V ,O 2/H 2O 的 ϕ= 1.23 V ,V 2+离子在下述溶液中能放出氢的是………………………………………………………………( )(A) pH = 0的水溶液 (B) 无氧的pH = 7的水溶液 -0.41 V -0.74 V(C) pH = 10的水溶液 (D) 无氧的pH = 0的水溶液19-11对第四周期的过渡元素,不具备的性质是…………………………( )(A) 形成多种氧化态 (B) 形成配位化合物(C) 配位数为4或6 (D) 形成的离子必具有4s 23d n 的电子排布19-12根据价层电子的排布,预料下列化合物中为无色的是………………( )(A) TiCl 3 (B) ScF 3 (C) MnF 3 (D) CrF 319-13由铬在酸性溶液中的元素电势图,可确定能自发进行的反应是……( ) Cr 3+ ───── Cr 2+ ───── Cr(A) 3Cr 2+ → 2Cr 3+ + Cr(B) Cr + Cr 2+ → 2Cr 3+(C) 2Cr → Cr 2+ + Cr 3+(D) 2Cr 3+ + Cr → 3Cr 2+19-14用 Nernst 方程式 ϕ =][][lg 0592.0还原剂氧化剂n + ϕ,计算MnO 4-/Mn 2+的电极电势 ϕ ,下列叙述不正确的是…………………………………………………( )(A) 温度应为298 K (B) Mn 2+ 浓度增大则ϕ 减小(C) H + 浓度的变化对ϕ 无影响 (D) MnO -4浓度增大,则ϕ 增大19-15下列各组自由离子的磁矩从小到大变化顺序,正确的是………( )(A) Cu 2+ < Ni 2+ < Co 2+ (B) Cr 2+ < Fe 2+ <Fe 3+(C) Cr 2+ < Mn 2+ < V 2+ (D) Ti 2+ < V 3+ < Cr 2+19-16在强碱性介质中,钒(Ⅴ)存在的形式是………………………………( )(A) VO (B) VO 3+(C) V 2O 5·n H 2O(D)-34VO 19-17已知某黄色固体是一种简单化合物,它不溶于热水而溶于热的稀盐酸,生成一种橙红色溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
交作业时间说明:
第13周周五20160520:过渡的第一、二部分和稀有气体;
第15周周五20160603:过渡的第三部分
过渡的第四部分(不交)
过渡金属的习题
第一部分:元素通性
1. 第一过渡周期的二价金属离子的半径如下,写出他们在正八面体弱场中的d电子排布并
2. 试从结构的观点予以解释:
(1)第一过渡系金属水合离子颜色及含氧酸根颜色产生的原因;
(2)同族的过渡金属元素的金属性、氧化还原稳定性变化规律,与碱金属、碱土金属的区别;(ⅢB-ⅤB)
第二部分:IIIB-VIIB族为主
1.根据以下连续性实验事实说明发生了什么反应,试用反应方程式解释。
(1)打开装有TiCl4的瓶塞,立即冒白雾;
(2)向TiCl4溶液中加入浓盐酸和Zn,溶液显紫色;
(3)缓慢加入NaOH使溶液呈碱性,析出紫色沉淀;
(4)沉淀经过滤分离后,用硝酸溶解,再用稀碱溶液处理,得白色沉淀;
(5)将白色沉淀过滤并灼烧后,与等物质的量的MgO共熔。
2.回答下列问题:
(1)为什么TiO2+(aq)无色,而TiI4为暗棕色晶体。
(2)如何鉴别TiO2+离子和Ti3+离子?
(3)从热力学角度看,[Ti(H2O)6]2+、[Ti(H2O)6]3+、[Ti(H2O)6]4+离子中,哪个或哪几个不能稳定存在?为什么?
3. Sc2O3在哪些性质上与Al2O3相似,为什么?最近有一篇很火的Science的论文,主要是Al 电池的研究,预测一下是否可以进行Sc电池的研究?
4.微观角度解释现象:
(1)向V2+(aq)中逐滴加入KMnO4溶液,观察颜色变化。
(2)浓氨水逐滴加入含NH4Cl的CrCl3溶液中,颜色变化:紫红→浅红→橙红→橙黄→黄色
的变化。
(3)Mn2+的半径为80pm,Mg2+为66pm,但MnCO3的分解温度低于MgCO3。
(4)溶液中含有NH4+时,更利于Mn和水的反应。
5. 结合反应式解释现象:
(1)酸性钒酸盐溶液中通入SO2时生成一深蓝色溶液。
相同量的钒酸盐溶液用锌汞齐还原时得到紫色溶液。
将此两溶液混合,得到绿色溶液。
(2)在酸性介质中,用锌还原Cr2O72-时,溶液的颜色变化是:橙色-绿色-蓝色,反应完成后又变为绿色。
(3)往硫酸铬溶液中,逐渐加入氢氧化钠溶液,开始生成灰蓝色沉淀,继续加碱,沉淀又溶解,再向所得溶液中滴加溴水,直到溶液的绿色转变为黄色。
6. 关于锰,讨论下列问题:
(1)根据锰的电势图和有关理论,讨论MnO42-离子稳定存在的pH最低应为多少?
(2)试从生成焓、电极电势、电离能数据,讨论锰(II)不如铁(II)稳定的原因。
7. 二氧化钛在现代社会里有广泛的用途,其产量是一个国家国民经济发展程度的标志,试画出硫酸法生产二氧化钛的简化流程框图并回答下列问题:
(1)指出流程框图中何处发生了化学反应,写出相应的反应方程式;
(2)氯化法生产二氧化钛是以金红石为原料,氯气可以回收、循环利用,试写出相关化学反应方程式;
(3)请对比硫酸法和氯化法的优缺点。
8. 在实验室中如何配制铬酸洗液?其去污原理是什么?
12.教材作业:p223-224页,1(1)-(7)、3、8、10、13、14
第三部分:第VIII族和贵金属为主
1.设计简单的实验方案,在不引入杂质的前提下,完成下列目标:
(1)除去FeCl2溶液中的FeCl3。
(2)除去FeCl3溶液中的FeCl2。
(3)除去Fe2(SO4)3溶液中的FeSO4。
2.试解释:
(1)为何[Co(CN)6]4-容易被氧化。
(2)在标准状态下,Fe3+可氧化I-而[Fe(CN)6]3-不能。
3.在用NH4SCN试剂鉴定CO2+时,为什么要用NH4SCN浓溶液或固体,并加丙酮萃取?溶液中存在何种常见离子时会干扰此鉴定?如何消除此种干扰?
5.化合物Li+[Co3(CO)10]-在2080-2000、1850、1600cm-1区出现3个不同类型的羰基带,
试对此阴离子提出一种合理的结构。
5. 蔡斯盐K[Pt(C2H4)Cl3]在金属有机化学发展史上占有重要的地位。
(1)写出制备蔡斯盐的化学反应方程式;
(2)讨论蔡斯盐的结构和化学键,它是否符合18电子规则?此盐阴离子的结构可用什么方法来确定?
(3)用乙醚萃取蔡斯盐的水溶液,可得化学式为Pt(C2H4)Cl2的中性化合物,试写出此化合物的可能的分子式和结构式。
6. 配合物Ni (CO)4和[Ni(CN)4] 2-具有不同的结构,但二者都是反磁性的,用价键理论予以解释。
7. 关于铂,回答下列问题:
(1)写出Pt溶于王水的反应方程式,并说明原因;
(2)将Pt粉与固体NaOH和Na2O2共熔后,再将熔体溶于浓盐酸。
在此溶液中铂形成了什么化合物?
(3)写出Pt(OH)4与KOH作用的反应方程式;
(4)写出氯铂酸钾与SO2作用的反应方程式;
(5)说明在实验室中使用铂丝、坩埚钳、铂蒸发皿等器皿时,必须严格遵守哪些规定?试联系铂的化学性质说明原因。
8. 有两种配合物,都具有Rh(NH3)4Br2Cl化学式,其中一种化合物为黄色,另一种化合物为橙色,它们都能与硝酸银溶液反应,1mol上述2种配合物都生成1molAgCl沉淀,但都不会有AgBr沉淀,问这2种配合物含什么配离子?结构式分别是怎样的?互为何种异构体?如何命名这2种配合物?哪一种结构是黄色的?为什么?
9. 从铂出发如何制备下述一系列的铂化合物?填写下面的反应条件、反应产物的颜色
10.教材作业:p224页,1(8)-(13)、5、17、19、33
第四部分:IB、IIB和镧系为主
1.比较Ti和Zn的活泼性。
结合反应式说明Ti,Zn与稀盐酸,稀硫酸,氢氟酸及NaOH的作用的异同。
2.已知氯化亚铜和氯化亚汞均为逆磁性物质。
请问应该用CuCl还是Cu2Cl2来表示氯化亚铜?应该用HgCl还是Hg2Cl2表示氯化亚汞?为什么?另外,作为跟Hg同族的Zn和Cd能形成这一类的化合物吗?他们在性质上有何差异?
3.区分并鉴定:
(1)CuCl,AgCl,Hg2Cl2三种难溶于水的白色固体。
(2)含有Ag+、Cu2+、Zn2+、Hg2+、Hg22+、Mg2+和Cd2+的混合溶液;
4.关于铜,试简要回答下列问题:
(1)用铜粉还原Cu2+盐溶液制备CuCl时,为什么要加入过量的浓盐酸?简述CuCl的性质。
(2)试说明在CuSO4⋅5H2O晶体中Cu2+为6配位。
(3)解释CuSO4⋅5H2O呈蓝色、[Cu(NH3)4]2+呈深蓝色、CuCl2的浓溶液呈绿色,很浓的溶液呈黄绿色,而稀的CuCl2则呈蓝色。
(4)铜的导电性仅次于银,但价格较低,为啥在航空仪表中不采用铜,而是用价格较昂贵的Au、Pt、Pd合金作为触点?
5. 结合反应式解释现象和回答问题:
(1)Cu2+与铜片在浓盐酸中煮沸,生成墨绿色溶液;
(2)将上述溶液加水稀释,生成白色沉淀;
(3)在第一步制备过程中需要加入一定量的NaCl溶液,其作用是什么?为啥不能一步制备出白色沉淀?
6. 含汞废水的处理是环保工作的重要任务之一,化学沉淀法是在含汞废水中先加入一定量的硫化钠,然后再加入FeSO4,试就以上过程进行说明。
7. 何谓稀土元素?许多稀土矿物通常都缺少铕,而在含钙的矿物中常常发现高浓度的铕化合物,试解释之。
8.结合实例说明从非镧系元素中分离镧系元素的方法和原理。
9.教材作业,p225页21、24、25、29;p237页2,4,7
稀有气体思考题
1.阅读书p67,4.3.2 分离方法,设计一个框图表示出稀有气体的分离过程和方法,写出反
应方程式,并用各种数据说明其道理。
2.稀有气体第一个化合物是氙的化合物,他的制得是化学原理的完美的应用,写出过程,
给了你什么启示。
3.教材作业,p78 第一题。
