“扬子石化杯”第届化学奥林匹克竞赛江苏赛区夏令营暨选拔赛试题含答案
“扬子石化杯”第届中国化学奥林匹克竞赛江苏赛区夏令营暨选拔赛试题含答案
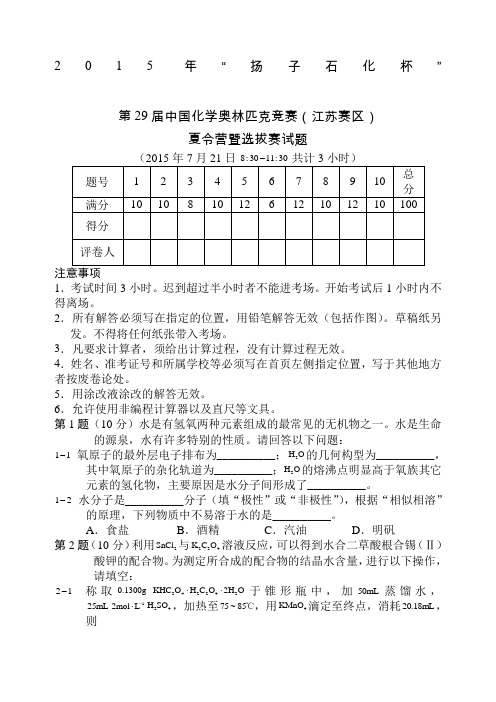
2015年“扬子石化杯”第29届中国化学奥林匹克竞赛(江苏赛区)夏令营暨选拔赛试题8:3011:30-1.考试时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
2.所有解答必须写在指定的位置,用铅笔解答无效(包括作图)。
草稿纸另发。
不得将任何纸张带入考场。
3.凡要求计算者,须给出计算过程,没有计算过程无效。
4.姓名、准考证号和所属学校等必须写在首页左侧指定位置,写于其他地方者按废卷论处。
5.用涂改液涂改的解答无效。
6.允许使用非编程计算器以及直尺等文具。
第1题(10分)水是有氢氧两种元素组成的最常见的无机物之一。
水是生命的源泉,水有许多特别的性质。
请回答以下问题:11- 氧原子的最外层电子排布为__________;2H O 的几何构型为__________,其中氧原子的杂化轨道为__________;2H O 的熔沸点明显高于氧族其它元素的氢化物,主要原因是水分子间形成了__________。
12- 水分子是__________分子(填“极性”或“非极性”),根据“相似相溶”的原理,下列物质中不易溶于水的是__________。
A .食盐B .酒精C .汽油D .明矾 第2题(10分)利用2SnCl 与224K C O 溶液反应,可以得到水合二草酸根合锡(Ⅱ)酸钾的配合物。
为测定所合成的配合物的结晶水含量,进行以下操作,请填空:21- 称取0.1300g 242242KHC O H C O 2H O ⋅⋅于锥形瓶中,加50mL 蒸馏水,25mL 12mol L -⋅24H SO ,加热至75~85℃,用4KMnO 滴定至终点,消耗20.18mL ,则()4KMnO c =____________1mol L -⋅。
22-称取0.1500g 配合物样品于锥形瓶中加50mL 蒸馏水,20mL 12mol L -⋅24H SO 。
加热至75~85℃,用上述4KMnO 溶液滴定至终点,用去20.79mL 。
第29届“扬子石化杯”中国化学奥林匹克竞赛(江苏赛区)初赛试卷及答案

“扬子石化杯”第29届中国化学奥林匹克竞赛(江苏赛区)初赛试卷可能用到的原子量:H:1C:12N:14O:16F:19Na:23Si:28P:31S:32Cl:35.5K:39Ca:40Mn:55Ni:59Zn:65I:127Pb:207Ba:2371.本试卷共22题,用2小时完成,共120 分;2.可使用计算器;3.用铅笔作答无效;4.不可使用涂改液或修正带。
一、选择题(本题包括15小题,每小题4 分,共计60 分。
每小题有1~2 个选项符合题意。
请将答案填在下方的表格内。
)1.化学与生活、生产、环境等密切相关。
下列说法错误的是A.煤的液化、石油的裂化和油脂的皂化都属于化学变化B.糖、油脂和蛋白质都是人体生命活动所需的基本营养物质C.静电除尘、燃煤固硫和汽车尾气催化净化都有利于改善空气质量D.将秸秆就地充分燃烧,可避免秸秆腐烂造成环境污染2.下列化学用语表示正确的是A .甲基的电子式:B.HClO的结构式:H一Cl一OC.Si 的原子结构示意图:D.原子核内有20个中子的氯原子:3.下列装置(固定装置略去)或操作正确且能达到实验目的的是A.图1:酸碱中和滴定B.图2:用CC14萃取KI溶液中的碘C.图3:配制银氨溶液D.图4:验证浓硫酸的脱水性和强氧化性4.常温下,下列各组离子在指定溶液中一定能大量共存的是A.0.lmol/LFeCl2溶液中:H+、Na+、Cl-、NO3-B.c(H+)=0.lmol·L-1的溶液中:K+、Na+、HCO3一、SO42-C.pH=13的溶液中:K+、Na+、ClO一、NO3-D.通入足量CO2后的溶液中:Na+、SiO32一、C6H5O一、HCO3-5.下列有关物质的性质与应用不相对应的是A.瓷坩埚能耐高温,可用于加热分解石灰石B.常温下,干燥的氯气与铁不反应,可用钢瓶贮运液氯C.浓硫酸具有脱水性,可用作干燥剂D.医用酒精能使蛋白质变性,可用来消毒杀菌6.用N A表示阿伏加德罗常数的值。
“扬子石化杯”第 届中国化学奥林匹克竞赛 江苏赛区 夏令营暨选拔赛试题答案及解析

。
【总结与点评】
本题总体是一道高考难度的题目,除了最后一空需要一些额外的知识外,其他均为课内知识。《全国
高中学生化学竞赛基本要求》(下称《基本要求》)中明确指出,现行中学化学教学大纲、普通高中化学课
程标准及高考说明规定的内容均属初赛要求。因此,课内知识的掌握,对于化学竞赛参赛者来说是十分重
要的。
【注】
碱,PH3 分子的碱性比 NH3
(填“强”或“弱”);N2H4 分子的碱性比 NH3
(填“强”或“弱”)。PH3 分子的配位能力比 NH3
(填“强”或“弱”)。
3-3 铋酸钠在酸性介质中是强氧化剂。请写出在酸性介质中铋酸钠氧化+2 价锰离子的离子反应方程式:
。
【参考答案】
3-1 NCl3 + 3H2O = NH3↑+ 3HClO (2 分) PCl3 + 3H2O = H3PO3 + 3HCl (2 分)
3-2 3-3
在元素周期表中,P 位于 N 下方,非金属性更弱,因而 PH3 的碱性弱于 NH3;而 N2H4 可以视为氨 基取代的 NH3,氨基上的 N 具有吸电子性,削弱了另一个 N 上的电子云密度,Lewis 碱性变弱; 而 PH3 中 P 原子还有空的 d 轨道,可以形成 d-p 反馈 π 键,配位能力更强。 铋酸钠氧化性很强,可以将 Mn2+氧化到 Mn(VII),铋酸钠自身被还原成 Bi3+。铋酸钠是难溶沉淀,
面 分 子 骨 架 , 在 垂 直 分 子 平 面 方 向 形 成 了 一 个 离 域 大 π 键 。 S2N2 中 N 原 子 的 杂 化 方 式
为
,离域大 π 键可表达为
。
【参考答案】
1-1 氧气 1-2 3s23p4 【试题解析】
2021年全国高中学生化学竞赛江苏省赛区夏令营选拔赛试题

第11题(8分) C60的发现开创了国际科学的一个新领域,除C60分子本身具有诱人的性质外,人们发现它的金属掺杂体系也往往呈现出多种优良性质,所以掺杂C60成为当今的研究热门领域之一。经测定C60晶体为面心立方结构,晶胞参数a=1420pm。在C60中掺杂碱金属钾能生
4-2绝大多数含有金属-金属键的配合物中,金属表现出为0或接近0的低氧状态,如
C3X2(CO)10。已知X2(CO)10中心原子的配位数为6,试画出其结构。
4-3某催化剂研究所催化剂生产装置在生产聚丙烯腈催化剂的同时产生了大量的催化剂粉尘
和工业废气,其废气主要成分为NOX(氮氧化物)。工业上一般采用碱液、氨水或碱性KXO4(含KOH)溶液吸收NOX。其中以碱性溶液的吸收效率最高。
(1)写出碱性KXO4溶液吸收NOX的化学反应方程式(反应中KXO4全转化为XO2)
(2)为了增强KXO4的氧化吸收能力,KOH的浓度应控制偏高还是偏低,为什么?
第5题(10分)化合物(4)一种新的向列型液晶材料组成成分,该化合物在环已基和芳环之间插入两个饱和碳原子,使其具有低粘度和低的介电各向异性的特性。它与低粘度和高的介电各向异性向列型液晶材料混合使用,能改善液晶材料的显示性能,提高清晰度,在液晶显示材料中具有良好的应用前景。该化合物可按下面的方法合成:
1-2放射性元素的发现19世纪末20世纪初物理学发生巨大变革的基础。最早发现的具有放
235射性的元素是铀,铀也是核电厂的燃料。*****U是自然界存在的易于发生裂变的唯一核素。92U142吸收一个中子发生核裂变可得到
Ba和91Kr,或135I和97Y等。请写出上述核反应方程式:
“扬子石化杯”第33届中国化学奥林匹克竞赛(江苏赛区)初赛试卷(含答案)
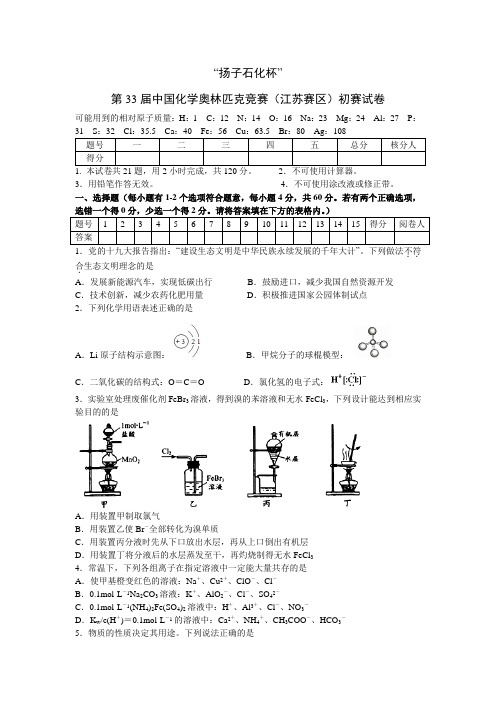
“扬子石化杯”第33届中国化学奥林匹克竞赛(江苏赛区)初赛试卷可能用到的相对原子质量:H:1C:12N:14O:16Na:23Mg:24Al:27P:1. 本试卷共21题,用2小时完成,共120分。
2.不可使用计算器。
3.用铅笔作答无效。
4.不可使用涂改液或修正带。
一、选择题(每小题有1-2个选项符合题意,每小题4分,共60分。
若有两个正确选项,..合.生态文明理念的是A.发展新能源汽车,实现低碳出行B.鼓励进口,减少我国自然资源开发C.技术创新,减少农药化肥用量D.积极推进国家公园体制试点2.下列化学用语表述正确的是A.Li原子结构示意图:B.甲烷分子的球棍模型:C.二氧化碳的结构式:O=C=O D.氯化氢的电子式:3.实验室处理废催化剂FeBr3溶液,得到溴的苯溶液和无水FeCl3,下列设计能达到相应实验目的的是A.用装置甲制取氯气B.用装置乙使Br-全部转化为溴单质C.用装置丙分液时先从下口放出水层,再从上口倒出有机层D.用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl34.常温下,下列各组离子在指定溶液中一定能大量共存的是A.使甲基橙变红色的溶液:Na+、Cu2+、ClO-、Cl-B.0.1mol·L-1Na2CO3溶液:K+、AlO2-、Cl-、SO42-C.0.1mol·L-1(NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO3-D.K w/c(H+)=0.1mol·L-1的溶液中:Ca2+、NH4+、CH3COO-、HCO3-5.物质的性质决定其用途。
下列说法正确的是A.石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体B.熟石灰有碱性,可用于改良酸性过强的土壤C.铜的金属活泼性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀D.浓硫酸具有吸水性,可用于干燥H2、SO2等7.A、B、C、D是原子序数依次增大的短周期主族元素,A的一种氢化物常用作制冷剂,B的原子的最外层电子数是电子层数的3倍,C离子在同周期简单离子中半径最小,D元素是最重要的“成盐元素”。
2006年“南京工业大学·扬子石...

2006年“南京工业大学·扬子石...第一篇:2006年“南京工业大学·扬子石化杯”杯第20届全国高中学生化学竞赛夏令营暨选拔赛试题参考答案及评分标准2006年“南京工业大学·扬子石化杯”杯第20届全国高中学生化学竞赛(江苏赛区)夏令营暨选拔赛试题参考答案及评分标准共4页1 2006年“南京工业大学·扬子石化”杯第20届全国高中学生化学竞赛(江苏省赛区)夏令营选拔赛试题参考答案及评分标准说明:化学方程式反应物或产物错不得分,配平错扣一半分。
第1题(9分)1-1 第三周期第IA族(1分)低固能易(每空0.5分,共2分)1-2 23592U+0n−−→114256Ba+36Kr+30n110~120℃91123592U+0n−−→113553I+39Y+40n(各1分,共2分)9711-3 ① SO2+I2+2H2O② 2H2SO4③ 2HI2HI+H2SO(1分)900℃ 2SO2+O2 +2H2O(1分)450℃H2I(1分)SO2、I2(1分,错任一个即0分)第2题(12分)-—2-1 Ca10(OH)2(PO4)6(s)+2F=Ca10F2(PO4)6(s)+2OH(1分)K=c2(OH-)/c2(F -)=Ksp[Ca10(OH)2(PO4)6]/Ksp[Ca10F2(PO4)6] =3.8×10-37/1.0×10-60=3.8×1023(2分)此反应的平衡常数很大,说明羟基磷灰石转化为氟磷灰石的倾向很大,即氟磷灰石更稳定(1分)2-2 不可以。
蛋白质口服下去后在胃、肠里经胃蛋白酶和胰蛋白酶水解生成了氨基酸,不可能完整地以蛋白质(酶)的形式去分解脂肪(答出蛋白质水解变成氨基酸即可)(2分)42-3(1)C1、C3N、C2、O(各1分,错1个扣0.5分,共3分)II36(各1分,共2分)(2)略(1分)第3题(9分)Br+NH3NH3 +NH3NH3NH3CrONONH3 3-1 6(1分)NH3NH3CrONOBr(2分)3-2 d2sp3(1分)3-3 3.9μ0(2分)3.9μ0(1分)3-4 不能晶体场分裂能△0=31850cm-1 所对应的光的波长为λ=(1/31850)cm=3140×10-8=314nm,即所吸收的光为紫外光或不吸收可见光。
“扬子石化杯”第 届中国化学奥林匹克竞赛 江苏赛区 夏令营暨选拔赛试题及参考答案
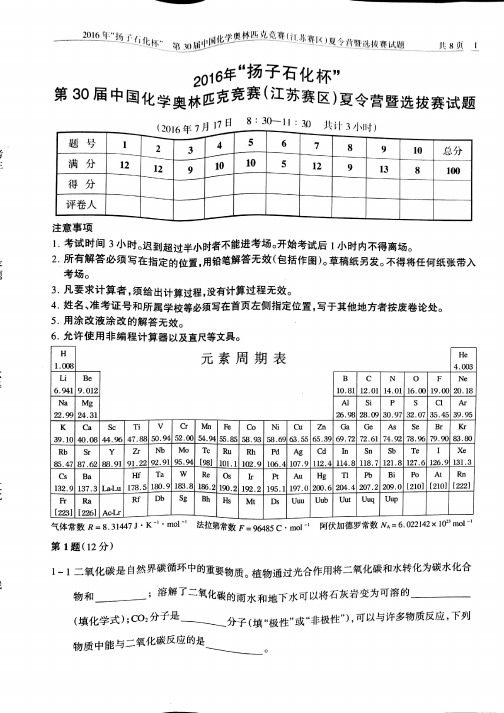
2016年“扬子石化杯”第30届中国化学奥林匹克竞赛(江苏赛区)夏令营暨选拔赛试题参考答案及评分标准说明化学方程式配平错误扣一半分第1题(12分)1-1 氧气Ca(HCO3)2 非极性(每空2分,共6分) A B (每个1分,共2分)1-2 3s23p4sp2(每空1分,共2分) 6(2分)4第2题(12分)2-1 Na2S + I2 === 2NaI + S (1分)2Na2S2O3 + I2 === 2NaI + Na2S4O6(1分)ZnCO3 + Na2S ===ZnS↓+ Na2CO3 (2分)71.48% 28.00% (每空2分,共4分)2-2 pH=p K a – lg([H2CO3])/([HCO3-]) 或pH = 6.35- lg([H2CO3])/([HCO3-]) (2分) 0.100 (2分)第3题(9分)3-1NCl3 + 3H2O === NH3 + 3HClO (2分)PCl3 + 3H2O === H3PO3+ HCl (2分)3-2 弱弱强(每空1分,共3分)3-3 2Mn2+ + 5NaBiO3 + 14H+ === 2MnO4- +5Na+ + 5Bi+ + 7H2O (2分)第4题(10分)4-1 白Fe(OH)2(每空2分,共4分)4-2 [Ni(en)2(NO2)2] 八面体型(每空2分,共4分) N、O (2分,写出一个得1分) 第5题(10分)5-1 1s22s22p63s23p63d104s24p64d105s25p3+5 +3 -3 (每空1分,共4分)5-2 2Sb2S3 + 9O2 === 2Sb2O3 + 6SO2(2分)5-3 [H3O2]+[SbF6]-(2分)2[H3O2]+[SbF6]- === 2[H3O]+[SbF6]- + O2 (2分)第6题(5分)6-1H2、Cu、Zn (2分)6-2Cu (1分)6-3 6.05×10-39mol·L-1(2分)第7题(12分)7-1(2分)面心正交晶胞1个I2分子(每空1分,共2分)注;晶胞中画出的I2分子必须同时具备以下两个条件才可得分A)处于面心位置B)与相互平行的晶面面心的I2分子平行。
江苏夏令营暨选拔赛试题

江苏化学夏令营暨选拔赛试题2014年“扬子石化杯”第28届中学化学奥林匹克竞赛(江苏赛区)夏令营暨选拔赛试题第1题硅元素在地壳中的含量仅次于氧而居于第二位。
硅是古老而又年轻的元素,它既是金砖汉瓦的组成元素,又在现代信息工业中有广泛的应用,请回答以下问题:1-1 硅原子的最外层电子排布为;SiF4的几何构型为,其中Si原子的杂化轨道为;SiO2是硅最重要的化合物,它熔点高、硬度大,是典型的晶体。
1-2 实验表明,若略去氢原子,N(SiH3)3分子为三角锥形结构,而N(CH3)3分子却为平面结构,其主要原因是N(SiH3)3中存在着N(CH3)3中没有的键,N(SiH3)3和N(CH3)3均为路易斯碱,其中碱性较强。
第2题(14分)铬元素个增加钢铁的抗腐蚀性,适量锰元素可增加钢铁的硬度,这两种元素的含量是不锈钢品种的重要指标。
可用以下方法来分析钢材中Cr和Mn的含量。
称取2.500g钢材样品,将其溶解并将其中的Cr和Mn氧化为Cr2O72-和MnO4-,再通过适当的操作配制成100.00mL溶液A,移取A溶液50.00mL,调节pH,加入过量的BaCl2溶液,期中的铬完全沉淀为2.910gBaCrO4。
再取A溶液25.00mL,在酸性条件下,用含0.4000mol/LFe2+的溶液滴定,达到滴定终点时,共用去43.50mL2-1 写出Fe2+溶液滴定Cr2O72-和MnO4-的离子方程式2-2 该钢材样品中Cr%为,Mn%为%。
2-3 含氟牙膏是目前最常见的药物牙膏,欧美国家有80%的牙膏加有氟化物。
其主要作用是利用刚牙膏中的活性氟促进牙釉质的再矿化,增强牙齿饿抗龋力。
制造含氟牙膏时,摩擦剂不能用碳酸钙或者磷酸钙,因为期中的钙离子容易及活性氟结合,形成非溶性氟化钙,大大降低牙膏的防龋作用。
已知CaF2的Ksp=3.4×10-11,HF的Ka=3.4×10-4。
25℃时将0.31mol/LHF溶液及0.002mol/LCaCl2溶液等体积混合,(填能或者不能)产生沉淀,氟化钙在纯水中(忽略水解)的溶解度为mol/L,而在0.01mol/LCaCl2溶液中的溶解度为mol/L。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2015年“扬子石化杯”第29届中国化学奥林匹克竞赛(江苏赛区)夏令营暨选拔赛试题8:3011:30-1.考试时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
2.所有解答必须写在指定的位置,用铅笔解答无效(包括作图)。
草稿纸另发。
不得将任何纸张带入考场。
3.凡要求计算者,须给出计算过程,没有计算过程无效。
4.姓名、准考证号和所属学校等必须写在首页左侧指定位置,写于其他地方者按废卷论处。
5.用涂改液涂改的解答无效。
6.允许使用非编程计算器以及直尺等文具。
第1题(10分)水是有氢氧两种元素组成的最常见的无机物之一。
水是生命的源泉,水有许多特别的性质。
请回答以下问题:11- 氧原子的最外层电子排布为__________;2H O 的几何构型为__________,其中氧原子的杂化轨道为__________;2H O 的熔沸点明显高于氧族其它元素的氢化物,主要原因是水分子间形成了__________。
12- 水分子是__________分子(填“极性”或“非极性”),根据“相似相溶”的原理,下列物质中不易溶于水的是__________。
A .食盐B .酒精C .汽油D .明矾 第2题(10分)利用2SnCl 与224K C O 溶液反应,可以得到水合二草酸根合锡(Ⅱ)酸钾的配合物。
为测定所合成的配合物的结晶水含量,进行以下操作,请填空:21- 称取0.1300g 242242KHC O H C O 2H O ⋅⋅于锥形瓶中,加50mL 蒸馏水,25mL 12mol L -⋅24H SO ,加热至75~85℃,用4KMnO 滴定至终点,消耗20.18mL ,则()4KMnO c =____________1mol L -⋅。
22-称取0.1500g 配合物样品于锥形瓶中加50mL 蒸馏水,20mL 12mol L -⋅24H SO 。
加热至75~85℃,用上述4KMnO 溶液滴定至终点,用去20.79mL 。
(1)写出上述滴定反应的化学方程式并配平:________________________________________________________ (2)由滴定得到的数据计算该配合物的摩尔质量为_____________1g mol -⋅。
(3)该配合物每个分子中含有_________个结晶水。
23- 溶解度和溶度积均可以表示物质溶解性的大小。
已知:()36sp K CuS 6.010-=⨯,2H S 的al pK 7.24=,a2pK 14.92=请计算CuS 在纯水中的溶解度。
(1)若不考虑2S -的水解,CuS 在纯水中的溶解度为________1mol L -⋅; (2)若考虑2S -的水解,CuS 在纯水中的溶解度应________(填“大于”或“小于”)(1)中的数值。
第3题(8分)1774年,瑞典化学家甘恩用软锰矿()2MnO 与木炭和油的混合物一起加热,首次分离出了金属锰,柏格曼将它命名为manganese (锰)。
它的拉丁名称manganum 和元素符号Mn 由此而来。
31- 在实验室用22H O 制备2O 时,常用2MnO 作__________剂,在用浓盐酸制备2Cl 时,用2MnO 作__________剂; 32- 锰元素电势图为(酸性溶液/V A E θ)据图可知,__________和__________两种离子在水溶液中不稳定,会发生__________反应;32- 锰酸锂()24LiMn O 是锂离子电池的重要材料,它作为电极材料具有价格低、电位高、环境友好、安全性能高等有点。
工业上利用23Li CO 和2MnO 来制备24LiMn O 。
(1)先将23Li CO 和2MnO 混合均匀后加热,升温到515℃时,开始有2CO 生成,同时生成固体A ,该温度比23Li CO 的分解温度723℃低很多,原因是________________________________ ______________________________________。
(2)升温到566℃时,开始有2O 生成,同时得到固体B ,升温到720℃时,A 和B 反应,得到高纯度锰酸锂,请写出A 和B 反应的化学反应方程是:___________________________________________________________________________。
第4题(10分)氮是空气中含量最多的元素,在自然界中存在十分广泛,在生物体内亦有极大作用,是组成氨基酸的几本元素之一。
氮的某氧化物A 低温下为蓝色固体,A 易分解为无色气体B 和红棕色气体C 。
B 在空气中极易被氧化而变为红棕色气体C 。
气体B 、C 均有很高的毒性。
除去B 的简便方法是用硫酸亚铁溶液吸收,这是因为能生成配合物D 的缘故。
C 可被3NH 在一定温度下经催化还原为无毒的气体E 。
41- 写出下列物质的化学式:A______________ B______________ C______________ D______________ E______________42- 气体B 的磁性强烈收温度的影响,表现出高温顺磁,低温逆磁。
那么气体C 磁性将如何随温度变化?试解释你的结论。
______________________________________________________________________________________________________________________________________________________________________43- 在三甲胺()3N CH 和三甲硅胺()33N SiH 中,三角锥形的分子是__________,含有πd p —键的分子是__________。
第5题(12分)某常见金属M 的硫酸盐A 的水溶液为蓝色,加入氨水生成深蓝色配离子B ,B 在隔绝空气条件下雨金属M 反应,可生成无色配离子C 。
在A 的溶液中加入KI 可得沉淀D 。
D 可用于检查室内汞含量是否超标:用涂有D 的试纸悬挂于室内,室温下若三个小时试纸变色,则表明室内汞超标。
51- 请写出以下各物质的化学式:A______________ B______________ C______________ D______________52- 从原子结构的角度分析,C 为无色的原因是____________________________________________,请估计沉淀D 的颜色为____________;53- 用D 试纸检测汞蒸气时,其反应方程式为:_________________________________________________________________________________第6题(6分)设计合成特殊结构的纳米材料是一个极其活跃的研究领域。
下图给出的是蛋黄-蛋壳型碳包硅()Si@C yolk shell -合成示意图:其中,步骤1的产物为硅球外包裹一层厚度可调控的多孔2SiO 层,可以通过正硅酸四乙酯()TEOS 的水解获得;步骤2和步骤3的产物最外层为厚度较薄的多孔碳层,可以通过蔗糖等有机物的高温碳化获得。
步骤3通过除去2SiO 得到蛋黄-蛋壳型碳包硅。
请回答下列问题:61- 上述过程中,正硅酸四乙酯()TEOS 的水解产物是__________; 62- 步骤3中除去2SiO 可以选用的试剂为__________;63- 采用高温下的镁热还原法可以将步骤2产物中的2SiO 也转变为Si ,反应的化学方程式为______________________________________________________。
第7题(12分)超导是20世纪最伟大的科学发现之一,超导材料在信息通讯、生物医学、航空航天等领域的应用前景越来越广阔。
近年来,中国科学家在铁基超导研究方面取得了一系列重大突破,2014年1月,以赵忠贤等为代表的研究团队获得2013年度国家自然科学一等奖。
《科学》杂志对比评论称:“中国如洪流般不断涌现的研究结果标志着在凝聚态物理领域已经成为一个强国。
”请解答如下有关铁基超导材料的问题:71- LiZnAs 是研制铁基超导材料的重要前体,LiZnAs 是面心立方晶胞,Zn 做A1型堆积,实验测得Zn 与Li 形成NaCl 型结构,那么,As 的位置应位于__________;Zn 与As 形成__________型结构。
72- LiZnAs 的晶胞参数 5.94AA a =,则计算可得出晶胞中的As As -之间的距离为__________A ;73- 画出(1)中Zn 与As 形成的正当晶胞沿着a 轴方向的投影(请标出原子的表示方式);74- 下图是铁基超导材料中Fe 与As 形成的结构单元(“○”小球代表Fe ,“●”小球代表As ),在新型铁基超导材料中,Fe 与As 形成的结构单元的对称性对于材料性质有着重要影响。
(1)图1是111型铁基超导材料中的Fe As -结构单元,试指出其对称操作及其个数:______________________________;(2)图2是122型铁基超导材料中的Fe As -结构单元,其对称性与图1所示的结构有区别吗?______________________________;(3)如果将图2中的1号原子去掉,可得一种结构单元,含有这种结构单元的铁基超导材料尚未见报道,试结合(1)、(2)对Fe As -结构单元对称性特点的分析,给出合理的解释。
______________________________________________________________________________________________________________________________________________________________第8题(10分)81- 下列反应中,产物C 分子中的不同化学环境氢的个数比是6:6:1,画出合理的、带电荷中间体A 和B 以及产物C 的结构简式。
A__________________ B__________________ C__________________ 82- 写出以下过程中D 、E 、F 、G 和H 的结构简式D________________________ E________________________ F________________________G________________________ H________________________ 83- 写出以下过程中I 、J 的结构简式I________________________ J________________________第9题(12分)化合物()G 是生物合成核酸的必需前体物质,是蛋白质合成与分解的调节物,是氨基酸从外围组织转动至内脏的携带者,肾脏排泄的重要基质,对机体免疫功能和修复具有重要作用。
