化工热力学课件第1章流体pvt关系
高等热力学课件第1章流体pVT关系

3
等温与绝热
可用于描述理想气体的扩张和压缩过程,探索其热力学性质。
流体的比热容和焓
比热容
衡量流体在吸收或释放热量时的 温度变化。
焓
描述了系统的内能和对外界做功 的总和性 质和能量转化。
麦克斯韦方程和吉布斯-杜亨方程
1 麦克斯韦方程
热力学函数之间的偏导数关系,揭示了系统 的性质。
理想气体与实际气体
1 理想气体
遵循理想气体定律,分子之间无相互作用。
2 实际气体
分子之间有相互作用,需要使用状态方程来描述。
3 真实气体状态方程
包括艾伦-富根方程和范德华方程。
等温过程和绝热过程
1
等温过程
温度保持不变,内能转化为热量与环境交换。
2
绝热过程
热量不从或不向环境交换,内能转化为功或由功转化为内能。
2 吉布斯-杜亨方程
描述了多组分体系的平衡条件。
相图和临界点
相图
展示了物质在不同温度和压 力条件下的各种相态。
临界点
温度和压力达到临界值时, 物质不再存在液态和气态之 分。
临界温度和临界压力
定义了物质转变为超临界流 体的条件。
流体在工程中的应用
1 流体动力学
用于设计飞行器、汽车和船只的空气动力学 和水动力学。
2 能源转换
涉及流体的燃烧、蒸汽发电和涡轮机等领域。
3 化工过程
4 环境工程
流体在化学工程中的传热、传质和反应过程。
涉及水力学、水污染和废水处理等流体问题。
高等热力学课件第1章流 体pVT关系
流体力学的核心概念之一是流体的pVT关系。通过深入研究这些关系,我们可 以更好地理解流体的特性和行为。
流体的性质
第1章_流体的p-V-T关系

化工热力学标准化作业一流体的压力p、温度T、体积V和数量(质量或摩尔量)是可以通过实验测量的,利用这些可测得的量和流体的热容数据,可计算其它不能直接从实验测得的热力学性质,如焓H、熵、热力学能(内能)U、Gibbs自由焓G等。
流体pVT关系可采用两种方式来描述:一是图形法;二是解析法,如状态方程法与对应状态原理法等。
1 本章学习要求本章的核心内容是流体的pVT关系。
要求学生掌握纯物质的p-V-T立体相图中,点、线、面所代表的物理意义及在pT面和pV面上投影所形成的p-T相图和p-V相图。
认识物质的气、液、固三类常见状态和气-液、气-固、液-固相平衡等在相图中的表征方法;掌握临界点的物理意义及其数学特征。
要求掌握理想气体的基本概念及其基本的数学表达方法;明确在真实条件下,物质都是以非理想状态存在的,掌握采用立方型状态方程和多项级数展开式,如Virial方程进行非理想气体pVT计算的方法。
2 重点与难点(1) p-V-T相图(2) 状态方程(Equations of State,EOS)(3) 对应状态原理(Corresponding State Principle)(4) 混合物pVTx关系一、是否题(正确划√号,错误划×号,并写清正确与错误的原因)1、纯物质由蒸汽变成液体,必须经过冷凝的相变化过程。
答:2、当压力大于临界压力时,纯物质就以液态存在。
答:3、由于分子间相互作用力的存在,实际气体的摩尔体积一定小于同温同压下的理想气体的摩尔体积,所以,理想气体的压缩因子Z=1,实际气体的压缩因子Z<1。
答:4、纯物质的三相点随着所处的压力或温度不同而改变。
答:5、在同一温度下,纯物质的饱和液体与饱和蒸汽的吉氏函数相等。
答:6、纯物质的平衡气化过程,摩尔体积、焓、热力学能、吉氏函数的变化值均大于零,答:7、气体混合物的virial系数,如B、C…,是温度的函数。
答:8*、virial方程和RK方程既可以应用于汽相,又可以用于液相。
《流体的PVT关系 》课件

流量计
用于测量流体的流 量。
搅拌器
用于混合流体。
实验步骤与操作方法
准备实验设备与器材,确保其完好无损。
01
按照实验要求,向储液罐中加入适量的流 体,并搅拌均匀。
03
02
将压力表、温度计、流量计等测量仪器连接 到实验设备上。
04
启动实验设备,观察并记录压力、温度和 流量等参数的变化。
在实验过程中,保持环境温度和压力恒定 ,以减小误差。
03
pvt关系的表现形式
压力与体积的关系
压力与体积的负相关关系
在恒温条件下,流体的压力增大,体积将减小;压力减小,体积将增大。这是因 为压力的增加会导致流体分子间的平均距离减小,从而体积减小。
等温压缩系数
描述压力变化时体积变化的程度。等温压缩系数越大,表示压力变化引起的体积 变02
气体定律
气体在一定条件下遵循pvt关系,如理想气体定律和范德华方程等。这 些定律可以帮助我们预测和解释气体在不同压力、温度和体积下的行为 。
流体的压缩性
流体的压缩性是指流体在压力变化下体积的变化程度。通过pvt关系, 我们可以了解流体的压缩性,进而研究流体在管道中的流动特性。
压力对pvt关系的影响
总结词
压力是影响流体pvt关系的另一个重要因素 。
详细描述
在高压下,流体的分子间的距离变小,相互 作用力增强,导致流体的密度和粘度增加。 同时,压力的变化也可能影响流体的蒸气压
和溶解度等物性参数。
物质种类对pvt关系的影响
要点一
总结词
要点二
详细描述
不同物质具有不同的分子结构和相互作用力,因此其pvt关 系也不同。
不同物质的pvt关系曲线存在差异,这是因为不同物质的分 子间相互作用力和分子结构不同。此外,同一种物质在不 同温度和压力下的pvt关系也可能存在差异。
第1章流体pVT关系

RT a p 2 V b V
对van der Walls方程作了很多改进,其中比较成功地改进 包括Redlich和Kwong改进的RK方程、Soave的进一步改进 (Soave方程,1972年),Peng和Robinson(1976年) 这些立方型状态方程中的参数基本上可用临界性质表示, 但也包括对温度和其他性质如压缩因子Z或偏心因子的修 正,这些方程的改进大都是经验的或者任意的。 近来一些统计力学理论已用于改进立方型状态方程。流体的p –V -T关系
主要内容
流体pVT关系发展概况 维里方程 立方型状态方程 流体的非理想性 混合物的pVT行为 总结
流体的p –V –T关系的发展概况
一、理想气体
1662年 Boyle定律
1834年 理想气体状态方程 二、维里方程
B C Z 1 Bp C p 1 2 V V
b 0.07780 RTc / pc
(T ) 1 k(1 T )
0.5 r
2
k 0.3746 1.54226 0.26992
a( T )=f (Tc,pc,T, ω)
2
方程使用情况:
(1)RK方程和RKS方程在计算临界压缩因子Zc和
液体密度时都会出现较大的偏差,PR方程弥补这一
a T RT p V b V V b
方程参数:
a T a T 0.4278 R 2Tc2 / pc T
b 0.08664 RTc / pc
(T ) 1 m(1 T )
0.5 r
2
m 0.480 1.574 0.176 2 式中,ω为偏心因子
2
化工热力学第三版第1章绪论与第2章流体的pVT关系

2.4.3 混合物的状态方程
(3)Martin-Hou方程 温度函数混合规则的通式为
若L代表方程常数b,则n=1
2.4.3 混合物的状态方程
2.4.4 状态方程混合规则的发展
(1)单流体混合规则的改进
2.4.4 状态方程混合规则的发展
1.3.1 体系与环境
1. 孤立体系:体系与环境之间既无物质的交换又无能量 的交换
2. 封闭体系:体系与环境之间只有能量的交换而无物质 的交换
3. 敞开体系:体系与环境之间可以有能量与物质的交换。
1.3.2 平衡状态与状态函数
状态是指体系在某一瞬间所呈现的宏观物理状况。热 力学中,一般说体系处于某个状态, 即指平衡状态。
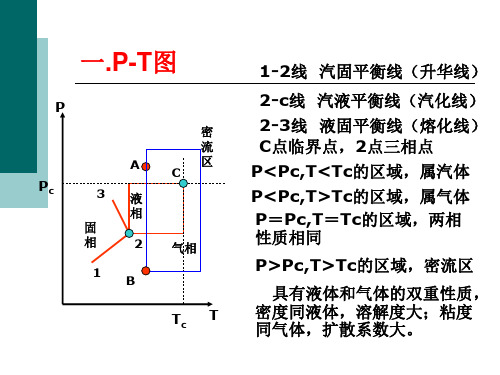
2.1 纯物质的p-V-T关系
2.1 纯物质的p-V-T关系
2.1 纯物质的p-V-T关系
等温线在两相区中的水平线段随着温度升高而缩短,最 后在临界温度时缩成一点犆。从图2-3上看出,临界等温 线在临界点上的斜率和曲率都等于零。数学上表示为
2.1 纯物质的p-V-T关系
2.2 气体的状态方程
对比态原理认为,在相同的对比状态下,所有的物质表 现出相同的性质。 令 将这些关系代入van der Waalls方程,得
这种关系在数学上可表示为
因为
2.3.2 以偏心因子为第三参数 的对比态原理
物质的对比蒸气压的对数与绝对温度有近似线性关系, 即
对比蒸气压方程可以表示为
2.3.2 以偏心因子为第三参数 的对比态原理
2.2.1 理想气体方程
理想气体方程是最简单的状态方程,即
2.2.2 立方型状态方程
所谓立方型状态方程是因为方程可展开为体积 ( 或密 度)的三次多项式。Vander Waals方程 (1873年)是第 一个适用真实气体的立方型方程,是对理想气体方程 (2-4)的校正。
化工热力学-流体的 p-V-T 关系

Z
Z
Z
1
q
Z
或
Z
0.026196
Z
Z
0.026196
1.026196 Z 6.6060 0.026196
将 Z= 代入上式右边,迭代计算后得到收敛值Z=0.04331。
V l ZRT 0.043318.314350 133.3 cm3mol1
p
0.9457
为了比较计算结果,在例2/5-1的情况下,运用四种立方型状态 方程所计算得到的V v及V l 值列表如下:
第二章 流体的 p-V-T 关系
(一)纯流体的三维相图
自由度与相律
(二)纯流体的二维相图
异戊烷的p-V图
p-T相图
T-V图
(三)纯流体 pVT 行为的模型化
→ 什么是状态方程?
f p,V,T 0
dV
V T
p
dT
V p
T
dp
V=V(T,p)
p=p(T,V )
(四)理想气体
只有在Zc相等的条件下,对比态原理才能成立
以ω为第三参数的对应状态原理
Z f pr ,Tr ,
偏心因子
Pitzer: 物质对比饱和蒸汽压的对数,与对比温度的倒数呈 下列线性关系
log
prS
a 1
1 Tr
prS
pS pc
球形分子虽然临界参数相差很大,但在Tr=0.7时,对比蒸气压 logprS = -1 。
ZC 3/8 1/3 1/3 0.30740
临界压缩因子Zc
VDW: 3/8 RK/SRK: 1/3 PR: 0.3047
立方型状态方程的数值求解
p
RT
V b
V
化工热力学 流体的P-V-T关系

Tc T
超临界流体既不同于液体,又不同于气体,密度可以接近液体,但又具有气体的
体积可变性和传递性质,可以作为特殊的萃取溶剂和反应介质。开发超临界流体 区的分离技术和反应技术已成为目前研究的热点。
二.P-V图
T2 T1 T3 Tc
气
T4 C P T5
D、D’——……
注意:B≠B’ C ≠C’ D ≠D’
B' B RT
C'
C B2
RT 2
(近似式)
D 3BC 2B3
D' RT3
2.两项维里方程
维里方程式中,保留前两项,忽略掉第三项之 后的所有项,得到:
Z=PV/RT=1+B’P
Z=PV/RT=1+B/V
把这个式子代入用压力表示的两项维里方程中, 就得到常用的两项维里方程。
1.试差法解题
8.314106 273.15 v - 26.8026
101.33106
1.55881012 (273.15)0.5 v(v 26.8026)
2270.9691 101.33 1.5588106
v - 26.8026
16.5277v(v 26.8026)
试差法: 假定v值
方程左边
2.通过作图得出结果
若令 y1=方程左边=f1(v) y2=方程右边=f2(v) Y
V求
V
2.迭代法 :
A a 4.934 4.934 4.934 1.549
B
bRT1.5
(T/Tc )1.5
273.15 1.5
2.1641.5
126.2
B 0.08664Pr Tr
流体的PVT关系PPT课件
3. 81型
在55型方程的基础上增加了常数B4,这样就得到了我 们讲义P12式(2-33),此式称为81型M-H方程。
优点: a:计算精度高,误差:气相1%,液相<5% b:常数易确定,只需两点实测数据(临界点,常压下数 据)
c:可用于极性气体PTV性质计算 d:可用于VLE和液相性质的计算
问题:对液相极性物质计算误差大,最大误差达16% 参考文献:化工学报, (1). 1981
实际气体的等温线
将范德华方程整理后得到: P(V-b)V2=RTV2-a(V-b) PV3-(bP+RT)V2+aV+ab=0
由这个方程可以看出,当温度不变时,是一个关于V的 三次方程,其解有三种情况:
P
• 三个不等的实根。 • 三个相等的实根 • 一个实根,两个虚根
L
DH
V
• R-K Equation (1949年,Redlich and Kwong)
b 0.08664RTc Pc
a(T) a(Tc)(T) 0.42748R2Tc2 (T)
Pc
(T) 0.5 1 m'(1 Tr0.5)
m' 0.481.574 - 0.1752
R-K Eq经过修改后,应用范围扩宽。 SRK Eq:可用于两相PVT性质的计算,对烃类计算,其 精确度很高。
关于两常数(立方型)状态方程,除了我们介绍的 范德华、R-K、SRK Eq以外,还有许多方程,包括我们 讲义上的P-R Eq和P-T Eq
Tr1 =T1/TcH2
Pr1=P1/PcH2
对于N2
状态点记为2,P2 V2 T2
Tr2 =T2/TcN2
Pr2=P2/PcN2
当Tr1=Tr2 ,Pr1=Pr2 时,此时就称这两种流体处
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C V2
Onnes:1901年以一种经验的关系式开发出了维 里方程;
Ursell:1927年 维里方程的进一步理论发展;
Mayer:1937年 维里方程的进一步理论发展
三、立方型状态方程
1873年van der Waals(范德华) 首次提出了能表达从气 态到液态连续性的状态方程 :
RT a pV bV2
再如:研究四氯化碳CCl4~丙酮及氯仿CHCl3~丙 酮之间的作用力非常不同。
2
1
混合焓,
KJ/mol0
-1
-2
CCl4~丙酮 丙酮摩尔分数
-20
冰点
-100 -60
-100
丙酮摩尔分数
1. 丙酮和四氯化碳的混合热是正的(吸热),而丙酮和氯仿 的混合热是负的,数值上也差别很大。
四氯化碳混合热的数据表明,物理的分子力的影响只造成少量 的吸热。但在氯仿混合物中,化学效应之大不仅抵消了物理作 用对混合热应有的贡献,而且造成放热。因为破坏氢键需要能 量,所以形成氢键时,自然需要放出能量。
➢氯仿和二异丁基甲酮也形成氢键,但由于存在空间障碍, 络合的趋势小得多。
Cl Cl C H
Cl
CH3C
O CH3CO源自CC C C CC C C
比较同分异构体C2H6O的某些热力学性质,便可 以很好地说明氢键对于物化性质的强烈影响。
乙醇 CH3CH2OH;二甲醚 CH3OCH3
乙醇
二甲醚
正常沸点,℃
Jones 12-6位能函数。
ur
4
12
6
r r
分子的缔合和氢键
极性物质的分子趋向于形成基团,因为它们的氢 原子表现出好像有剩余价,这种作用称为氢键。 其趋势是随着组成原子的电负性减小而减小。
例如(HF)6;而乙酸、甲酸的气体在略高于沸点时 是双分子;醇类、酯类、醛类和其他物质,在正 常压力和温度下,也表现出明显的缔合。这种缔 合的程度随压力和浓度减小而降低,缺随着温度 的升高而降低。
流体的p –V -T关系
主要内容
流体pVT关系发展概况 流体的非理想性 混合物的pVT行为 维里方程 立方型状态方程 总结
流体的p –V –T关系的发展概况
一、理想气体
1662年 Boyle定律
pV 常数
1834年 理想气体状态方程
pV RT
二、维里方程
Z
1
Bp
C p 2
1
B V
78
-25
沸点下蒸发焓
42.6
18.6
8 ℃、1bar下在
无穷
7.12
水中的溶解度
g/100g
当形成氢键的物质溶于相对惰性的非极性溶剂中, 然后研究溶液的热力学性质,往往可以发现同种分 子的氢键。
如:乙醇溶于过量的非极性溶剂(如己烷或环己烷) 时,其混合体积有明显膨胀(超额体积大于0)。这 是由于氢键不断地断裂,直至无限稀释时,二聚体、 三聚体、高聚体等都消失,所有的分子都以单体存 在。
2. 氯仿和四氯化碳有两个低共熔点,之间有一段上凸的曲线, 极值点在50%处,这表明在固态中存在络合物,不过液态时解 离了。
存在络合物充分证明了两种不同分子间的强烈作用。极值点出 现在组成轴的中点。因此我们推知络合物化学计量比为1:1
缔合存在时的pVT行为
其转换分数为
nA An
Z
平初衡始时的的分分子子数数=表观压缩因子=1-+
对van der Walls方程作了很多改进,其中比较成功地改进 包括Redlich和Kwong改进的RK方程、Soave的进一步改进 (Soave方程,1972年),Peng和Robinson(1976年)
这些立方型状态方程中的参数基本上可用临界性质表示, 但也包括对温度和其他性质如压缩因子Z或偏心因子的修 正,这些方程的改进大都是经验的或者任意的。
此外,实际气体与理想气体之间的另一个重要差别是 它们的热行为。如
C
ig p
f T
Cp f T, p
二、分子间作用力
分子的大小、形状和结构确定了它们之间的力和最终的 pVT行为。引力使分子结合在一起,斥力使分子分开。前者 在分子距离大时起作用,后者在近距离范围内有影响。 根据分子的电性质,分子可以分为三种: (1)电中性和对称性,通常维非极性分子 (2)电中性而非对称性,即具有偶极距,称为极性分子; (3)有剩余价,可产生缔合和氢键。 在所有分子中都存在斥力和引力,但在缔合和极性分子中, 它们以不寻常的形式出现。 目前pVT关系和方程最成功地描述非极性物质的行为,包括 重要的烃类。
氢键
➢例如氟化氢 H FH FH- F
➢两个电负性足够大的原X和Y,在适当的条件下可以按的 形式和氢连接。 H XY 因而,分子如果含有和电负性 原子连接的氢(如在醇、酸、胺中),它就显示出互相缔 合以及和其他具有可接近的电负性原子的分子生成溶剂化 物的强烈趋势。
➢再如:醋酸主要以二聚体组成,这是存在氢键的作用。 ➢氯仿CHCl3和丙酮CH3COCH3有溶剂化的趋势,这是因 为氯仿中的伯氢原子和丙酮中的羰基氧之间形成氢键,这 种溶剂化作用对于氯仿-丙酮溶液的性质有显著影响。
近来一些统计力学理论已用于改进立方型状态方程。
四、液体
对于液体,虽然在理论上和关联方面已做了很多工作,但 了解仍然比气体少得多。
有一些经验关联式专门用于液体密度的计算,如 Hankinson 和Thomson提出的饱和液体密度计算关联式是 典型代表;
一些复杂的方程,如PR方程、BWR方程、Harmens- Knapp方程,可作为较好的液体密度表达式。
特别值得推荐的是ASOG和UNIFAC方法,通过流体的分
子结构去预测液体的混合物行为。
基团贡献法
流体的非理想性
一、与理想性的偏差
理想气体
分子的大小如同几何点 分子间不存在相互作用力
极低的压力下真实气体非常接近理想气体
许多实际物质的性质可以通过与理想气体的偏差,这 也是热力学研究的一个重要方法。如压缩因子Z,剩余 性质MR
分子极性
极性:当一个键的电中心与其质量中心不重合时,就产生 偶极距。极性是以偶极距的大小来定义的。偶极距的单位 为Debye。
极性分子特点:极性分子与非极性分子相比,具有较大的 黏度和较高的沸点和熔点;极性分子还更能溶解于水。特 别重要的是极性分子表现出更大的超额热力学性质。
分子之间的作用力可以使用位能函数来描述。例如Lennard-
