高中化学元素及其化合物知识点总结大全非常实用
高二化学《元素及其化合物基础知识和应用》知识点总结

高二化学《元素及其化合物基础知识和应用》知识点总结 1.金属及其化合物 (1)钠及其化合物之间的相互转化①2Na 2O 2+2H 2O===4Na ++4OH -+O 2↑①2Na 2O 2+2CO 2===2Na 2CO 3+O 2①Na 2CO 3+Ca(OH)2===CaCO 3↓+2NaOH①OH -+CO 2===HCO -3①CO 2-3+CO 2+H 2O===2HCO -3(2)铁及其化合物之间的相互转化①Fe +2H +===Fe 2++H 2↑或Fe +Cu 2+===Fe 2++Cu 等 ①2Fe +3Cl 2=====点燃2FeCl 3①2Fe 3++Fe===3Fe 2+或2Fe 3++Cu===2Fe 2++Cu 2+等①4Fe(OH)2+O 2+2H 2O===4Fe(OH)3(3)铝及其化合物之间的相互转化①Al 2O 3+6H +===2Al 3++3H 2O①Al 2O 3+2OH -===2AlO -2+H 2O①Al(OH)3+3H +===Al 3++3H 2O①Al(OH)3+OH -===AlO -2+2H 2O(4)铜及其化合物之间的相互转化①3Cu +8H ++2NO -3===3Cu 2++2NO↑+4H 2O或Cu +4H ++2NO -3===Cu 2++2NO 2↑+2H 2O ①Cu +2H 2SO 4(浓)=====①CuSO 4+SO 2↑+2H 2O①Cu 2++2OH -===Cu(OH)2↓2.非金属及其化合物 (1)卤素单质及其化合物之间的相互转化 ①Cl 2+H 2O H ++Cl -+HClO ①Cl 2+2Br -===2Cl -+Br 2①Br 2+2I -===I 2+2Br -①Cl 2+2OH -===Cl -+ClO -+H 2O(2)硫及其化合物之间的相互转化①2H 2S +SO 2===3S +2H 2O①SO 2+Cl 2+2H 2O===H 2SO 4+2HCl ①2H 2SO 4(浓)+Cu=====①CuSO 4+SO 2↑+2H 2O(3)氮及其化合物之间的相互转化①4NH 3+5O 2=====催化剂①4NO +6H 2O①3NO 2+H 2O===2HNO 3+NO ①3Cu +8HNO 3(稀)===3Cu(NO 3)2+2NO↑+4H 2O(合理即可)(4)碳、硅及其化合物之间的相互转化 ①SiO 2+2C=====高温Si +2CO↑①HCO -3+OH -===CO 2-3+H 2O①SiO 2-3+2H +===H 2SiO 3↓(合理即可)。
完整版)高中化学知识点总结:金属元素及其化合物

完整版)高中化学知识点总结:金属元素及其化合物高中化学知识点总结:金属元素及其化合物一、金属元素概述1.金属元素在周期表中的位置及原子结构特征金属元素分布在周期表的左下方,目前已知的112种元素中有90种金属元素。
金属元素最外层电子数一般小于4个,仅有Ge、Sn、Pb有4个,Sb、Bi有5个,Po有6个。
金属原子半径较同周期非金属原子半径大。
金属元素形成的金属单质固态时全是金属晶体。
2.金属的分类1)按冶金工业上的颜色分:黑色金属有Fe、Cr、Mn (其主要氧化物呈黑色),有色金属则是除Cr、Mn以外的所有金属。
2)按密度分:轻金属密度小于4.5g/cm³,如Na、Mg、Al;重金属密度大于4.5g/cm³,如Fe、Cu、W。
3)按存在丰度分:常见金属如Fe(4.75%)、Al(7.73%)、Ca(3.45%)等;稀有金属如锆、铪、铌等。
3.金属的物理性质1)状态:除汞外,其他金属通常为固态。
2)金属光泽:多数金属具有金属光泽。
3)易导电和导热:由于金属晶体中自由电子的运动,使金属易导电、导热。
4)延展性:金属可以压成薄片,也可以抽成细丝。
5)熔点及硬度:金属晶体中金属离子和自由电子的作用强弱决定其熔点和硬度,最高的是钨(3413℃),最低的是汞(-39℃)。
4.金属的化学性质1)与非金属单质作用。
2)与H2O作用。
3)与酸作用。
4)与碱作用,只有Al、Zn可以。
5)与盐的作用。
6)与某些氧化物的作用。
5.金属的冶炼1)热分解法(适用于不活泼金属):2HgO=2Hg+O²,2Ag2O=4Ag+O²。
2)热还原法(常用还原剂CO、H2、C活泼金属等):Fe2O3+3CO=2Fe+3CO2,Cr2O3+2Al=2Cr+Al2O3.3)电解法(适用于非常活泼的金属):2Al2O3=4Al+3O2,2NaCl=2Na+Cl2.二、碱金属元素1.钠及其化合物1)钠的物理性质:钠是一种柔软、银白色,有金属光泽的金属,具有良好的导电、导热性,密度比水小,比煤油大,熔点较低。
高中化学元素及其化合物知识点总结大全非常实用

高中化学元素及其化合物知识点总结大全非常实用一、元素的化学性质1.元素的原子结构:包括元素的原子序数、原子核的构成等;2.元素的化学活性:元素的化合价、化合能力等;3.元素的氧化还原性:元素在化合物中的氧化态和还原态、氧化还原反应的定义和原理等;4.元素的电性和金属性:元素的电负性、电离能、原子半径等;5.元素的地壳丰度和存在形式:元素在地壳中的含量、存在的化合物等。
二、常见化学元素及其性质1.金属元素:铁、铜、锌、锡、铝等金属元素的物理性质、化学性质、应用等;2.非金属元素:氢、氧、氮、碳、硫、磷等非金属元素的物理性质、化学性质、应用等;3.元素周期表:元素的周期规律、周期表的各种分类和用途等;4.难溶于水的元素:炭、硫、硅、铝等元素的溶解性和存在形式等;5.稀有元素:稀有气体、稀土元素、过渡金属等的特性、应用等。
三、化合物的性质与应用1.无机化合物:氧化物、酸、碱、盐等无机化合物的命名规则、性质和应用等;2.配合物:配合物的结构、性质和应用等;3.有机化合物:碳氢化合物、醇、醚、酮、酸、酯等有机化合物的命名规则、性质和应用等;4.聚合物:聚合物的结构、性质和应用等。
四、化学反应1.化学反应类型:化合反应、分解反应、置换反应、还原反应等反应类型的定义及示例;2.化学反应的平衡:化学反应速度、化学平衡常数、平衡常数的计算等;3.化学反应的能量变化:焓变、放热反应、吸热反应等。
五、化学方程式的平衡与计算1.化学方程式的平衡法则:平衡方程式的给定条件、平衡常数的计算、平衡位置的调节等;2.化学方程式的配平方法:试错法、代数法等;3.化学方程式的计算:质量计算、体积计算、摩尔计算等。
六、化学分析方法1.酸碱中和滴定:滴定的概念、滴定反应方程式、滴定的终点判定等;2.氧化还原滴定:氧化还原滴定的概念、滴定反应方程式、滴定的终点判定等;3.光度法:光度法的原理、操作和应用等;4.色谱法:气相色谱法、液相色谱法等的原理和应用等。
高中化学元素知识点
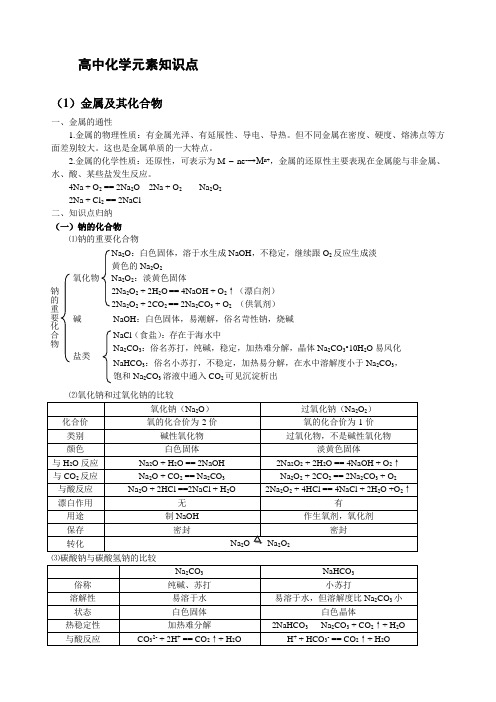
高中化学元素知识点(1)金属及其化合物一、金属的通性1.金属的物理性质:有金属光泽、有延展性、导电、导热。
但不同金属在密度、硬度、熔沸点等方面差别较大。
这也是金属单质的一大特点。
2.金属的化学性质:还原性,可表示为M – ne -→M n+,金属的还原性主要表现在金属能与非金属、水、酸、某些盐发生反应。
4Na + O 2 == 2Na 2O 2Na + O 2 Na 2O 2 2Na + Cl 2 == 2NaCl 二、知识点归纳 (一)钠的化合物 ⑴钠的重要化合物氧化钠(Na 2O ) 过氧化钠(Na 2O 2) 化合价 氧的化合价为-2价氧的化合价为-1价 类别 碱性氧化物 过氧化物,不是碱性氧化物颜色 白色固体 淡黄色固体与H 2O 反应 Na 2O + H 2O == 2NaOH 2Na 2O 2 + 2H 2O == 4NaOH + O 2↑ 与CO 2反应 Na 2O + CO 2 == Na 2CO 3 Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 与酸反应 Na 2O + 2HCl ==2NaCl + H 2O2Na 2O 2 + 4HCl == 4NaCl + 2H 2O +O 2↑漂白作用 无 有用途 制NaOH 作生氧剂,氧化剂保存 密封密封转化Na 2O → Na 2O 2Na 2CO 3 NaHCO 3 俗称 纯碱、苏打 小苏打溶解性 易溶于水 易溶于水,但溶解度比Na 2CO 3小状态 白色固体 白色晶体热稳定性 加热难分解2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O与酸反应CO 32- + 2H + == CO 2↑+ H 2OH + + HCO 3- == CO 2↑+ H 2O钠的重要化合物氧化物 Na 2O :白色固体,溶于水生成NaOH ,不稳定,继续跟O 2反应生成淡黄色的Na 2O 2Na 2O 2:淡黄色固体 2Na 2O 2 + 2H 2O == 4NaOH + O 2↑(漂白剂) 2Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 (供氧剂) 碱NaOH :白色固体,易潮解,俗名苛性钠,烧碱 盐类 NaCl (食盐):存在于海水中 Na 2CO 3:俗名苏打,纯碱,稳定,加热难分解,晶体Na 2CO 3•10H 2O 易风化NaHCO 3:俗名小苏打,不稳定,加热易分解,在水中溶解度小于Na 2CO 3,饱和Na 2CO 3溶液中通入CO 2可见沉淀析出与CaCl 2反应 Ca 2+ + CO 32- == CaCO 3↓不反应与NaOH 反应 不反应HCO 3- + OH - == CO 32- + H 2O 与Ca(OH)2反应Ca2++ CO 32- == CaCO 3↓2HCO 3-(过量)+ 2OH - + Ca 2+ == CO 32- +2H 2O + CaCO 3↓相互转化CO 32- + CO 2 + H 2O == 2HCO 3- NaHCO 3 + NaOH == Na 2CO 3 + H 2O 2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O(二) 铝及其重要化合物的性质⑴ 位置和原子结构示意图: 第3周期 第ⅢA 族。
高中化学必背知识点归纳与总结5篇

高中化学必背知识点归纳与总结5篇第1篇示例:高中化学必背知识点归纳与总结1. 元素和化合物(1)元素:元素是由具有相同原子核电荷数目的原子组成的,是化学中最基本的物质,例如氧、氢、铜等。
元素的周期表是化学中最基本的分类方法,根据元素的性质和原子结构进行分类。
(2)化合物:化合物是由两种或两种以上不同元素按照固定的比例结合而成的物质,如水(H2O)、氨(NH3)、二氧化碳(CO2)等。
化合物的命名和化学式是化学学习的基础,需要掌握常见的离子和分子式。
2. 化学反应(1)化学反应类型:化学反应包括合成反应、分解反应、单质燃烧反应、置换反应等。
对于不同类型的反应,需要了解其特点和示例,并能够进行化学方程式的平衡。
(2)化学方程式:化学方程式是描述化学反应过程的符号表示,包括反应物、生成物和反应条件等内容。
掌握化学方程式的书写、平衡和解读是化学学习的基础。
3. 化学键和分子结构(1)化学键:化学键是原子之间通过电子互相吸引而形成的强力联系,分为共价键、离子键和金属键等。
化学键的形成和特点对物质的性质和化学反应有重要影响。
(2)分子结构:分子是由不同原子通过共价键结合而成的物质单位。
分子的结构决定其性质和化学反应方式,需要掌握分子的几何构型和键角度等内容。
(1)化学反应速率:化学反应速率是反应物消耗或生成物产生的速度,受多种因素影响,如浓度、温度、催化剂等。
了解化学反应速率的计算方法和影响因素对实验和应用具有重要意义。
(2)化学平衡:化学平衡是指在一定条件下,反应物与生成物的浓度达到稳定状态,反应速率相等。
化学平衡常用平衡常数和Le Chatelier原理来解释和预测反应的变化。
5. 酸碱理论和溶液平衡(1)酸碱理论:酸碱理论包括布朗斯特德酸碱理论、阿伦尼乌斯酸碱理论等,用于描述和解释酸碱反应的性质和规律。
了解酸碱指示剂、pH值等相关知识对于理解溶液平衡具有重要意义。
(2)溶液平衡:溶液平衡是指在溶液中溶质和溶剂之间的平衡状态,包括饱和溶解度、离子平衡等内容。
高中元素化合物知识梳理

镁、铝、铜及其化合物 (一)镁与铝化学性质的比较1.与O 2的反应:Mg 、Al 均能与空气中的O 2反应,生成一层坚固而致密的氧化物保护膜.所以,金属镁和铝都有抗腐蚀性能。
它们都可燃烧:2Mg +O 2=====点燃2MgO,4Al +3O 2=====高温2Al 2O 32.与S 、X 2等非金属的反应:Mg +S=====△MgS ,Mg +Cl 2=====点燃MgCl 2 2Al +3S=====△Al 2S 3,2Al +3Cl 2=====点燃2AlCl 3 3.与酸的反应:非氧化性酸:Mg +2H +===Mg 2++H 2↑,2Al +6H +===2Al 3++3H 2↑氧化性酸:镁可溶于氧化性酸;常温下铝在冷的浓HNO 3、浓H 2SO 4中因发生钝化而难溶,但加热时也可溶解。
4.与碱的反应:镁不反应, 2Al +6H 2O +2NaOH===2Na[Al(OH)4]+3H 2↑5.与氧化物的反应:2Mg +CO 2=====点燃2MgO +C(金属镁能在CO 2气体中燃烧),2Al +Fe 2O 3=====高温2Fe +Al 2O 3[铝热反应,铝与比铝不活泼的金属氧化物(如CuO 、MnO 2、Fe 2O 3等)都可以发生铝热反应](二)氧化铝和氢氧化铝1.氧化铝:两性氧化物,既能与酸反应生成铝盐,又能与强碱反应生成四羟基合铝酸盐 :Al 2O 3+6H+===2Al 3++3H 2O , Al 2O 3+2OH -+3H 2O===2[Al(OH)4]-2.氢氧化铝:①既能溶于强酸,又能溶于强碱中:Al(OH)3+3H +===Al 3++3H 2O ,Al(OH)3+OH-===[Al(OH)4]-②受热分解:2Al(OH)3=====△Al 2O 3+3H 2O3.氢氧化铝的制法:可溶性铝盐与氨水反应:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4 或四羟基合铝酸钠 溶液通入CO 2:CO 2过量:[Al(OH)4]-+CO 2===Al(OH)3↓+HCO -3; CO 2少量: 2[Al(OH)4]-+CO 2===2Al(OH)3↓+H 2O +CO 2-3。
高中化学知识点总结完整版
高中化学知识点总结完整版一、化学基本概念1.物质的概念化学是研究物质的变化和构成的科学,物质是构成世界一切事物的基本要素,是具有质量和占据空间的对象。
化学中的物质分为元素和化合物两大类。
2.元素元素是由同一种原子组成的纯净物质,在化学元素周期表中有118种已发现的元素,包括金属元素、非金属元素和过渡金属元素等,例如氢、氧、铁、铜、铝等。
3.化合物化合物是由两种或两种以上不同元素通过化学变化结合而成的物质,具有独特的化学性质和物理性质。
如水(H2O)、盐酸(HCl)等。
二、原子结构1.原子的组成原子是构成物质的基本单位,由原子核和电子云组成。
原子核由质子和中子组成,质子的质量大约是中子的1.6726倍,正电荷为电子的负电荷,中子的质量大约是质子的1.0087倍,质子和中子都是由夸克构成的。
2.元素周期表元素周期表是以元素的原子序数(也称为阶数)有序排列的一张表,它是依据元素原子的基本性质(如原子半径、电负性、电离能等)而设计的。
在元素周期表中,元素按周期和族分布,元素的周期数代表着元素外层电子的主能级。
元素周期表中的元素具有一定的规律性。
3.元素的分类元素按金属、非金属和过渡金属的特性可以分成不同类别,金属元素的性质是对各种金属共有的一些基本性质的总称,是化学元素分类中的一个重要的分类方式。
非金属元素的特点是非金属元素呈多种化合价,不同的化合价所对应的性质也不尽相同。
过渡金属元素具有一些特殊的物理化学性质。
三、化学反应1.化学方程式化学方程式是描写化学反应的符号表示法,由化合物的化学式和化学反应中所需要或生成物质的符号组件而成。
由于化学方程式犹如语言文字一样具有一定的表现力,所以人们通常用化学方程式来表示化学反应过程。
化学反应方程式包括主体化学反应方程式、离子反应方程式、氧化还原反应方程式和离子平衡等。
2.化学反应的类型化学反应可分为合成反应、分解反应、置换反应、双替代反应、氧化还原反应等多种类型,不同类型的化学反应有着不同的特点和规律性。
超全高中化学知识点总结
超全高中化学知识点总结一、物质的组成和结构1.原子与分子-原子的结构:原子核(质子、中子)和电子壳层-元素与同位素-分子的概念和组成-化学式和化合价的表示方法2.物质的稳定性和反应性-元素的稳定性与反应性-化合物的稳定性与反应性-物质的能量状况与稳定性3.原子间的键和离子间的力-金属键、共价键、离子键的形成与性质- 分子间的力(Van der Waals力、氢键等)4.物质的排列与结构-晶体和非晶体-晶体的种类及晶体结构二、化学反应1.化学反应的基本概念-反应物和生成物-反应物质量关系-化学方程式的平衡2.化学反应速率和平衡-反应速率的影响因素-反应速率与反应能垒-化学平衡-平衡常数和平衡常数表达式3.化学平衡的移动-影响化学平衡的影响因素- Le Chatelier原理4.氧化还原反应-氧化还原反应的基本概念-氧化还原反应的电子转移与价电子情况-氧化剂和还原剂的特征与性质三、化学物质的变化1.化学物质变化的能量变化-热能与热化学反应-反应焓变与热动力学2.化学物质变化的速度变化-反应速率与反应速率常数的概念-反应机理与速率方程-影响反应速率的因素3.化学反应的平衡变化-化学平衡的实质-平衡均相反应和异相反应的平衡条件-平衡常数与反应方向的判定四、化学元素和化合物1.主要元素和元素周期表-元素周期表的构成和使用-主要元素的分类和特点2.主要化合物及其性质-酸、碱、盐的特性及性质-衍生化合物的命名和性质3.有机化合物-有机化合物的特征和命名规则-烃类、醇类、醛酮类、羧酸类的反应与性质五、化学变化的实验方法1.化学实验中常用的实验方法和仪器-常用的实验室仪器及其使用方法-化学实验中的安全注意事项2.化学实验中的常见技术和探究方法-分离、纯化和鉴别化学物质的方法-学习化学现象和规律的探究方法以上是高中化学的主要知识点总结,每个知识点都可以拓展更深入的内容,为了更好地理解和掌握化学知识,建议多做化学实验和练习题,结合实际应用和实验操作,加深对化学知识的理论和实践的理解。
高中化学基础知识点总结
高中化学基础知识点总结化学作为一门自然科学,是研究物质的组成、结构、性质、变化规律以及能量变化的学科。
在高中化学学习过程中,有许多基础知识点是非常重要且必须掌握的。
下面将对高中化学基础知识点进行总结。
一、元素与化合物1. 元素的概念:元素是由同种原子组成的物质,是化学元素周期表中的基本单位,可通过化学反应进行转化。
2. 化合物的概念:化合物是由不同元素按照一定的化学组合方式形成的物质,具有独特的化学性质。
3. 元素符号与元素周期表:元素以符号表示,如氧元素为O,碳元素为C。
元素周期表是元素按照一定规律排列的表格,能够反映元素的特征与变化规律。
二、化学键与分子结构1. 化学键的类型:化学键是原子间的连接力,主要包括离子键、共价键和金属键。
离子键形成于金属和非金属元素之间,共价键形成于两个非金属元素之间,金属键形成于金属元素之间。
2. 分子结构:分子由两种或更多原子通过化学键结合而成,如H2O (水分子)、CO2(二氧化碳分子)等。
3. 构成分子的最基本理论:分子的构成遵循伽利略-阿伏伽德罗定律,即描述了等量不同物质在化学反应中发生的数量关系。
三、化学方程式与化学反应1. 化学方程式:化学方程式是描述化学反应过程的方式,由反应物、生成物以及反应中的能量变化等组成。
2. 化学反应类型:包括合成反应、分解反应、置换反应、氧化还原反应等不同类型,每种类型具有特定的特征和要求。
3. 反应的平衡:化学反应在特定条件下达到平衡状态,平衡常数描述了反应物质浓度在平衡时的关系。
四、酸碱中和与溶液浓度1. 酸碱中和反应:酸和碱在适当条件下进行中和反应,生成盐和水的反应,是一种重要的化学变化。
2. 溶液的浓度:溶液中溶质的质量与溶剂的质量之比称为溶液的浓度,可通过浓度计算公式进行计算。
3. 弱酸弱碱的性质:弱酸、弱碱是指在水中只部分离解产生H+、OH-离子的化合物,具有一定的酸碱性。
五、化学反应与能量变化1. 化学反应的放热与吸热:放热反应是释放能量的反应,吸热反应是吸收能量的反应,反应热描述了反应中的能量变化。
高中化学元素及其化合物知识点总结大全非常实用
1.单质硫的颜色_______,______溶于水,______ 于酒精,易溶于_______________。
2.SO2漂白的原理为________________________________________________________ 。
3.CO2(SO2)除杂试剂为_____________________________________________________4.实验室制SO2的化学方程式__________________________________________________。
5.设计实验证明SO2气体中含有CO2:___________________________________________。
6.写出一个体现SO2具有氧化性的化学方程式_____________________________________。
7.写出两个体现CO2具有氧化性的方程式____________________________________________________________________________________。
8. SO2通入FeCl3溶液的现象为_____________________________,写出反应的离子方程式__________________________________________。
9. SO2能使酸性高锰酸钾溶液褪色,写出反应的离子方程式______________________________________________________________________。
10. SO2催化氧化的化学方程式___________________________________________________。
11. Cu与S加热条件下反应方程式:_____________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.单质硫的颜色_______,______溶于水,______ 于酒精,易溶于_______________。
2.SO2漂白的原理为________________________________________________________ 。
3.CO2(SO2)除杂试剂为_____________________________________________________4.实验室制SO2的化学方程式__________________________________________________。
5.设计实验证明SO2气体中含有CO2:___________________________________________。
6.写出一个体现SO2具有氧化性的化学方程式_____________________________________。
7.写出两个体现CO2具有氧化性的方程式____________________________________________________________________________________。
8. SO2通入FeCl3溶液的现象为_____________________________,写出反应的离子方程式__________________________________________。
9. SO2能使酸性高锰酸钾溶液褪色,写出反应的离子方程式______________________________________________________________________。
10. SO2催化氧化的化学方程式___________________________________________________。
11. Cu与S加热条件下反应方程式:_____________________________________________。
12. 写出两种鉴别CO2与SO2的方法_______________________、____________________。
13. 检验SO2的试剂为_________________________________________;检验水的试剂为______________________;检验CO2的试剂为_____________________。
14. 检验Clˉ的试剂是_________________________;检验SO42-的试剂是____________________________________;检验Cl2的试剂是_____________________________________。
15. SO2通入BaCl2溶液中的现象为_______________,SO2通入Ba(NO3)2溶液中的现象为__________________,SO2通入FeCl3和BaCl2溶液中的现象为_______________________。
16. SO2和Cl21:1混合通入品红溶液中,现象为_____________,反应的离子方程式为__________________________________________________。
17. SO2通入紫色石蕊试液中的现象是_______________,体现了SO2的________性。
18. Cl2通入紫色石蕊试液中的现象是______________________________________________。
19. SO2使溴水褪色的化学方程式为_______________________________________________。
20. Na2SO3既有氧化性又有还原性,证明Na2SO3具有氧化性的试剂是____________和____________,反应方程式是_________________________________________证明Na2SO3具有还原性的试剂是_________,反应的离子方程式为_____________________________。
21. 常见离子的还原性由大到小的顺序为_________________________________(写六个)。
22. SO2使碘水褪色,说明SO2具有__________________性。
23. 氢气在氯气__________燃烧,发出_________色火焰,集气瓶口有__________产生。
24. 铜丝在氯气中燃烧的现象为__________________________________________。
25. 氯气的水溶液叫_______________,Cl2___________溶于水,溶于水的Cl2约有________与水反应,化学方程式为___________________________________________。
26. 新制氯水的成分有_____________________________,颜色为___________________,溶质为_____________,久置氯水的成分为_______________________。
27. 家用消毒液的制备原理:___________________________________________,其有效成分为__________________。
28. 工业漂白粉的制备原理_____________________________________________,其主要成分为______________________,有效成分为________________________。
29. 漂白粉久置在空气中失效的原理为____________________________________________。
30. 增强漂白粉和家用消毒液的漂白消毒作用的方法是______________________________。
31. Cl2的尾气处理原理:_______________________________________________________。
32. 除去Cl2中的HCl的试剂是________________,验满Cl2的方法为__________________。
33. Cl2的实验室制法的化学方程式为_____________________________________________,在该反应中盐酸的作用是_________和_________,理论上要得到1mol氯气,实验中需要盐酸的物质的量为_______________mol。
34. KmnO4氧化浓盐酸制氯气____________________________________________________。
35. 加热条件下,KclO3氧化浓盐酸制氯气_________________________________________。
36. 工业制氯气的原理:_________________________________________________________。
37. 向溴水中滴加CCl4溶液,充分振荡现象为______________,说明Br2易溶于___________。
38. ________遇淀粉显____________色。
39. CO2(HCl)除杂试剂为_________________________________________________________。
40. 氯水滴入到含酚酞的NaOH溶液中,溶液红色消失,设计实验证明褪色的原因,其实验方案为____________________________________________________________________。
41. 向氯水中通入SO2的现象是_________________,反应的离子方程式为____________________________________________________________________。
42. SiO2的基本结构是以__________原子为中心,______原子在4个顶角上的【SiO4】四面体,而这些四面体又通过O原子相连,其Si与O原子个数之比为1:2的立体网状的巨型结构。
SiO2是_____________式。
43. 实验室盛装NaOH溶液的试剂瓶不用磨口玻璃塞的原理:_________________________。
44. 氢氟酸腐蚀玻璃的原理:____________________________________________________45. ________用来制造硅太阳能电池,___________用来制造光导纤维。
46. 工业制粗硅的反应方程式:__________________________________________________。
47. 写出一个证明硅酸的酸性弱于碳酸的反应方程式:_______________________________。
48. 硅酸是一种______________________________________________________________酸。
49. 写出由SiO2制硅酸的反应方程式:__________________________________________________________________________________________________________50. 硅酸胶体的制备方程式:______________________________________________________51. 硅胶的用途是______________________________________________________________。
52. ______________________俗称水玻璃,是制备硅胶和木材防火剂的原料。
53. 晶体硅是____________色的晶体,是良好的_______________________________。
54. 铁的氧化物中,Fe2O3_________色,用途是__________________________ Fe3O4_____色。
55. Fe(OH)2在空气中变质的化学方程式____________________________________________。
反应的现象为_______________________________________________________________。
