2017会考复习-金属及其化合物 铁
铁及其化合物(知识点归纳总结+典例导析)

铁及其化合物【学习目标】1、铁的性质:2、铁的重要化合物及其相互转化。
【要点梳理】要点一、铁“铁的原子结构示意图如下:1.物理性质⑴常温下,纯铁是银白色具有金属光泽的金属(纯铁的抗蚀力相当强),易导电.导热,有延展性。
⑵铁的熔沸点都很髙:熔点是1535°C,沸点是2750°C。
⑶铁能被磁体吸引,在磁场的作用下,自身也能产生磁性。
2.化学性质当跟弱氧化剂反应时:Fe-2e =Fe2+:当跟强氧化剂反应时:Fc・3c =F0°⑴铁与非金屈的反应:点燃3FC+2O? = FC3O4点燃2Fe+3Cl2^=2FeClv 2Fe+3Br2=2FeBnAFe+l2=FeI2i Fe+S ■ FeS⑵铁和某些盐(如CuSO4)溶液的反应:Fe+Cu2+=Fe2++Cu⑶铁与酸的反应:与非氧化性酸:Fc+2H+=Fe2++H2TA⑷铁与水蒸汽的反应:3Fe+4H2O(g) = Fe3O4+4H2(注意产物是Fe3O4)注意:①该实验所用铁粉为还原铁粉(即刚用还原的方法得到的铁粉九②实验中收集气体,并通过爆鸣实验来验证氢气的产生。
要点二、铁的化合物1.铁的氧化物(1) FeO不稳定,在空气里受热,就迅速被氧化成F CS O A(2) FcO常用作红色油漆和涂料,赤铁矿(主要成分是FezOj)是炼铁的原料。
(3) Fc的常见化合价只有+2价和+3价,FC3O4可以看成由FcO和FC2O3按物质的量之比1 : 1组合而成的复杂氧化物,通常也可写成FeO Fe2O3的形式。
FeO. FC2O3属于碱性氧化物,FC3O4不属于碱性氧化物。
2.铁的氢氧化物1 名称氢氧化亚铁氢氧化铁1 化学式Fe(OH)2Fe(OH)s1 分类碱碱色态白色固体红褐色固体水溶性不溶于水不溶于水与酸反应Fe(OH)2+2H+= Fe2* + 2H2O F C(OH)3+3H4=FE+3H2O还原性稳泄性4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)32Fe(OH)3------- FC2O3+3H2O (受热分解)制法1原理FE+2OH = Fe(OH)21Fe3+ +3OH = Fe(0H)3|现象白色絮状沉淀红褐色沉淀要点诠释:F C(0H)2的制备要点:①硫酸亚铁要现配(配制时,蒸餾水要煮沸,以减少蒸憎水中溶解的氧,防止亚铁离子被氧化)。
铁及其重要化合物考点及知识点总结归纳课件

(2)还原性气体保护法。用H2将装置内的空气排尽后,再关闭弹簧夹a使亚铁盐 与NaOH溶液混合,这样可长时间观察到白色沉淀,如图2所示。
(3)电解法。用铁作阳极,电解NaCl(或NaOH)溶液,并在液面上覆盖一层苯或 煤油,如图3所示。
有关金属铁及其氧化物、氢氧化物的计算★★★
6.纳米级四氧化三铁是应用最为广泛的软磁性材料之一。共沉淀法是目前制备 纳米四氧化三铁的重要方法,其流程如图所示:
第三章
金属及其化合物
第三节 铁及其重要化合物
考纲解读
考纲要求
Hale Waihona Puke 备考指南真题追踪命题趋势
1.了解铁及其重要化合物 的制备方法。 2.掌握铁及其重要化合 物的主要性质及其应 用。
2018·全国卷Ⅰ7、
10A、13,全国卷 Ⅱ11B、13B、28; 2017·全国卷Ⅲ26、27; 2016·全国卷Ⅰ8,全国
方程式为___4_F_e_(O__H__)2_+__O__2+__2_H__2O__=_=_=_4_F__e_(O__H_)_3______
【思维深化】
1.判断正误(正确的画“√”,错误的画“×”)。 (1)铁具有导电性、导热性、延展性及被磁体吸引的特性( ) (2)Fe分别与氯气和盐酸反应所得氯化物相同( ) (3)常温下用铁制容器可以运输浓硝酸和浓硫酸( ) (4)氧化铁能与酸反应,所以可用于制作红色染料( ) (5)Fe2O3不可与水反应得到Fe(OH)3,所以不能通过化合反应制取Fe(OH)3( ) (6)一定条件下可完成转化:FeCl2溶液―→FeCl3溶液―→Fe(OH)3胶体( ) (7)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2( ) (8)根据Cl2、S与铁的反应可以判断氯元素和硫元素的非金属性强弱( ) 【答案】(1)√ (2)× (3)√ (4)× (5)× (6)√ (7)× (8)√
高中化学考点过关(中)考点10金属铁及其化合物(必修1)

考点过关(中)考点10 金属铁及其化合物铁是日常生活和生产中应用最广、用量最大的金属材料,在国民经济中占有极其重要的地位。
铁是中学化学教材中唯一系统介绍的一种过渡金属,是中学化学中的重要变价元素。
作为过渡元素的代表,铁及其化合物知识是高中学习的重点,铁元素一般可以呈现+2和+3价,这两个价态的化合物从特征到性质都有很大的不同,铁及其化合物主要包含单质铁的存在形式、铁的氧化物、铁的氢氧化物以及铁盐和亚铁盐的相关性质等内容。
铁及其化合物的性质考查常常以实验探究、化工流程题、有关化学反应的计算等重要题型的形式出现,具有“分散融合、交叉渗透”的特点,考查内容注重理论联系实际、综合分析、知识迁移能力和计算能力,综合性强,具有一定灵活性和较好的区分度。
由于含铁物质与对应知识较多,在学习时只有熟练掌握有关物质的性质,才能形成对物质的组成、性质与转化及其相互关系的认识思维模型。
铁元素在地壳中的含量仅次于氧、硅和铝,它在自然界中以单质形态(陨铁)和化合形态(铁矿石)存在,铁是人类认识和使用较早的金属元素,它与生产和人类的生活密切相关,人类使用铁已有好几千年的历史了,目前已发现的金属虽然已有90多种,但其中应用最广泛、用量最多的仍然是铁。
小到铁钉,达到桥梁、铁道、车辆和各种机械等,都需要大量的钢铁来制造。
就连动植物体内也含有铁,人体内缺铁会导致缺铁性贫血,体内过多的铁又能使肝、脾等硬化。
铁元素有0价、+2价、+3价和+6价,其中+2价和+3价较常见,+6价少见。
纯铁是白色或者银白色的,有金属光泽,有良好的延展性、导电、导热性能,有很强的铁磁性,属于磁性材料,熔点1538℃、沸点2750℃。
铁是比较活泼的金属,在金属活动顺序表里排在氢的前面,化学性质比较活泼,是一种良好的还原剂。
常温时,铁在干燥的空气里不易与氧、硫、氯等非金属单质起反应,若有杂质在潮湿的空气中易锈蚀,在有酸、碱或盐的溶液存在的湿空气中生锈更快。
在高温时,则剧烈反应,如铁在氧气中燃烧生成Fe3O4,反应的化学方程式是3Fe + 2O2点燃Fe3O4,赤热的铁和水蒸气起反应也生成Fe3O4,反应的化学方程式是3Fe +4H2O (g)Fe3O4 +4H2,加热时能同卤素、硫、硅、碳、磷等化合。
(完整版)铁及其化合物知识点+习题(带答案),推荐文档

铁及其化合物知识点1.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。
密度7.86 g/cm3,熔沸点较高。
能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
二.化学性质:1.与非金属反应1)Fe+S (I 2) FeS (FeI 2) 2)3Fe+2O 2 Fe 3O 4 3)2Fe+3Cl 2 2FeCl 3Fe 2+Fe 3+2.与水反应 3Fe + 4H 2O(g) Fe 3O 4 + 4 H 2 ↑(置换)3 与酸反应1)与非氧化性酸(盐酸、稀硫酸)反应 Fe +2H +== Fe 2+ + H 2↑2)与氧化性酸反应 :Fe+4HNO 3(稀)=Fe(NO 3)3+NO↑+2H 2O常温下,铁和冷浓硝酸、冷浓H 2SO 4发生钝化,但在加热条件下,钝化作用立即遭到破坏: Fe+6HNO 3(浓)Fe(NO 3)3+3NO 2↑+3H 2O Fe+6H 2SO 4(浓)Fe 2(SO 4)3+3SO 2↑+3H 2O4.与盐溶液反应:2Fe 3++ Cu = 2Fe 2++ Cu 2+ Fe + 2Fe 3+ = 3 Fe 2+ Fe + Cu 2+ = Fe 2+ + Cu三、铁的化合物1、铁的氧化物铁的氧化物的比较铁的氧化物FeO Fe 2O 3Fe 3O 4俗称铁红磁性氧化铁色、态黑色粉末红棕色粉末黑色晶体铁的价态+2+3+2、+3水溶性难溶于水稳定性不稳定性 6FeO+O 2=2Fe 3O 4稳定稳定与酸的反应FeO+2H +=Fe 2++H 2O Fe 2O 3+6H +=2Fe 3++3H 2O Fe 3O 4+8H +=2Fe 3++ Fe 2++4H 2O与CO 的反应Fe x O y +yCO=xFe+yCO 2制取高温熔融,过量的铁与氧气反应2Fe+O 2=2FeO Fe(OH)3的分解2Fe(OH)3=Fe 2O 3+3H 2O 铁在氧气中燃烧3Fe+2O 2=Fe 3O 42、铁的氢氧化物(1)Fe(OH)2的制备Fe(OH)2易被氧化,在制备时应注意(1)配制后的FeSO 4溶液中要加入少量铁粉;(2)配制溶液的蒸馏水以及所用NaOH 溶液均须煮沸以除去其中溶解的氧气;(3)Fe 2+容易被氧化,所以FeSO 4溶液要新配制. (4)为了防止滴加NaOH 时带入空气,可将吸收NaOH 的长滴管伸入FeSO 4溶液液面下,再挤出NaOH 溶液.(5)为了防止Fe 2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气.实验:FeSO 4溶液中加NaOH. 现象: 生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色化学方程式: FeSO 4 + 2NaOH = Fe(OH)2↓+Na 2SO 4 Fe 2++ 2OH -= Fe(OH)2↓(白色)4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3(红褐色) (白色→灰绿色→红褐色)(2)Fe(OH)3的制备实验:FeCl 3溶液中加NaOH 溶液. ①现象:生成红褐色沉淀②化学方程式:FeCl 3+3NaOH= Fe(OH)3↓+3NaCl Fe 3++ 3OH -= Fe(OH)3↓(红褐色)③热稳性:Fe(OH)3对热不稳定,受热能失去水生成红棕色的Fe 2O 3粉末.化学方程式: 2Fe(OH)3 Fe 2O 3 +3H 2O[小结]难溶性或微溶性的碱受热不稳定,容易分解。
[知识点]《铁及其化合物》知识点总结归纳
![[知识点]《铁及其化合物》知识点总结归纳](https://img.taocdn.com/s3/m/37f56804482fb4daa58d4bd2.png)
《铁及其化合物》知识点总结归纳【复习指导】
本部分内容为教材的第二自然节。
其主要考点是:
①铁的原子结构、位置和性质;
②铁的氧化物、氢氧化物的制备;
③Fe3+与Fe2+的相互转化及应用;
④Fe2+、Fe3+的检验;
⑤铜及其化合物的重要性质。
复习本部分内容时,在引导学生阅读理解“知识网络”的基础上,重点讲清:
1.根据铁在元素周期表中的位置和原子结构,指出铁是一种较活泼的过渡金属,有可变的化合价,指出铁三角关系,Fe、Fe3+、Fe2+三者之间相互转化规律,铁与哪些物质反应能生成+2价化合物?跟哪些物质反应能生成+3价铁的化合物?Fe2+和Fe3+通过哪些物质可以相互转化?并能让学生会写相关的化学方程式或离子方程式。
2.根据铁在金属活动顺序表中的位置,指出铁是一种活泼金属,由此属类理解铁能与非金属、水蒸气、酸、盐溶液的反应,写出有关的化学方程式或离子方程式。
分析判断铁的氧化物、氢氧化物的属类,推测应具有的性质写出有关的化学方程式或离子方程式。
从Fe2+的还原性、Fe2+和Fe3+易水解等知识角度理解亚铁盐和铁盐溶液的配制及保存方法。
结合离子的鉴别方法。
3.铜元素的有关知识在近几年来的高考
Fe2+和Fe3+的特性让学生掌握两种试题中经常涉及到,特别是各类高考试题中,多次出现与铜有关的试题,而这部分内容却分散在初中高中四本教材中,复习时按照元素化合物知识规律,将铜及其化合物知识进行归纳总结,使之系统化。
【本节知识框架】。
高中化学知识点:铁及其化合物

高中化学知识点:铁及其化合物
铁的性质
- 铁是一种金属元素,符号为Fe,原子序数为26。
- 铁是一种有色金属,具有良好的导电性和导热性。
- 铁在常温下是固态,可以延展和变形。
铁的化合物
氧化铁
- 氧化铁是铁常见的氧化物,由铁和氧组成。
- 三种常见的氧化铁是氧化亚铁(FeO)、氧化铁(Fe2O3)和氧化铁(Fe3O4)。
- 氧化亚铁是黑色的,氧化铁是红色的,氧化铁是黑色的。
铁的酸性氧化物
- 铁还可以形成酸性氧化物,可以和酸反应生成盐和水。
- 铁的酸性氧化物有氧化铁(Fe2O3)和氧化铁(Fe3O4)。
金属铁
- 金属铁是纯铁,具有较高的熔点和延展性。
- 金属铁通常用于制造各种工具和建筑材料。
铁的应用
- 铁是常见的金属材料,在工业和日常生活中有广泛的应用。
- 铁通常用于制造建筑材料、机械、电器、车辆等。
- 铁的化合物也有一些应用,例如氧化铁可以用于制作颜料。
总结
铁是一种有色金属,具有良好的导电性和导热性。
铁的主要化合物是氧化铁。
铁及其化合物在工业和日常生活中有广泛的应用。
铁及其化合物(复习)
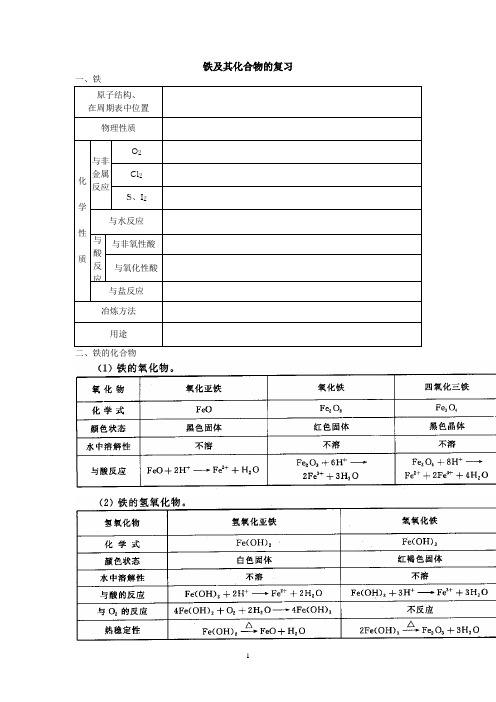
铁及其化合物的复习二、铁的化合物小结:1. 铁与氧化剂反应生成Fe3+,如等物质。
铁与氧化剂反应生成Fe2+,如等物质。
铁与冷的、浓硫酸和浓硝酸发生钝化反应,在加热条件下反应生成_______,若铁过量时,则生成___________。
小结:2. Fe、Cu 、Fe3+、Cu 2+、Fe之间的相互反应方程式:小结:3. 不能与Fe2+ 、Fe3+共存的离子不能与Fe3+共存的离子因水解不能共存的离子因发生氧化还原反应不能共存的离子不能与Fe2+共存的离子因水解不能共存的离子因发生氧化还原反应不能共存的离子小结:4. Fe2+ 、Fe3+的鉴别方法小结:5.Fe2+溶液的保存方法是;Fe3+溶液的配制方法是。
例1.一定量Fe、Cu 加入到一定量三氯化铁溶液中,若反应后溶液中有Fe3+,则溶液中还有的离子是,固体。
若反应后溶液中尚有固体,则溶液中一定有离子,一定没有离子。
例2.把铜粉和过量的铁粉加入到热的浓硝酸中,充分反应后,溶液中大量存在的金属阳离子是A.只有Fe2+B.只有Fe3+C.有Fe2+和Cu2+D.有Fe3+和Cu2+例3.向含有0.8mol 的稀硝酸溶液中慢慢加入22.4g 的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO 3→Fe(NO 3)3+NO ↑+H 2O(1)写出这两个阶段反应的离子方程式(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式例4.要证明某溶液中不含+3Fe 而可能含+2Fe ,进行如下实验操作时的最佳顺序为 ①加入足量氯水,②加入足量碘水,③加入少量KSCN 溶液 A .①③B .③②C .③①D .①②③【基础练习】1.写出下列物质的颜色物质(化学式) 颜色 物质(化学式) 颜色 氧化亚铁( )氧化铁( )四氧化三铁( ) 氢氧化亚铁( ) 氢氧化铁( ) 氯化铁溶液( ) 绿矾( )氯化亚铁溶液( )2.铁矿石的种类很多,常见的有以下几种(填写其主要成分的化学式)(1)菱铁矿 ____________________(2)磁铁矿_____________________ (3) 黄铁矿___________________ (4)褐铁矿 _____________________ 3.下列各物质中,不能由组成它的两种元素的单质直接化合而得到的是( )A 、FeSB 、Fe 3O 4C 、FeCl 3D 、FeCl 24.(1)将铁丝放入稀硫酸中,观察到的现象是________________,离子方程式为______________________。
高中会考复习提纲 七、铁、铜和合金材料

高中化学会考复习七、铁、铜和合金材料的知识点总结一、重要知识点回顾1、铜物理性质:有金属光泽的紫红色金属密度8.92 g/cm3质软,具有良好的导电导热性延展性2、化学性质1、与氧气反应2Cu+O2===2CuO CuO+2HCl==H2O+CuCl22、Cu与强氧化性的酸反应Cu+2H2SO4===CuSO4+SO2↑+H2O 3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O3Cu+2HNO3浓==Cu(NO3)2+2NO2↑+4H2O3、与盐反应Cu+2FeCl3==CuCl2+2FeCl2 (很重要)(1)铁的物理性质有金属光泽的银白色金属,质软\有良好的导电导热性延展性能被磁铁吸引(2)化学性质①与氧气反应(注意不同的价态)3Fe+2O2==Fe3O4 (要点燃,现象是:细铁丝在氧气中燃烧,火星四射,发出耀眼的白光,生成熔融黑色的固体附着在瓶子内壁)②与非金属反应2Fe+3Cl2==2FeCl3 (1,剧烈燃烧2,放出大量的热3,放出棕红或棕黄色烟雾(实际上是氯化铁的小微粒)4,加水后溶液呈棕黄色)③Fe+S==FeS③与酸反应Fe+H2SO4== FeSO4+ H2↑④与盐反应Fe+CuSO4==FeSO4+Cu Fe+2HCl== FeCl2+ H2↑Fe2O3与酸反应Fe2O3+6HCl==2FeCl3+3H2OFe3+的检验:滴入可溶性KSCN(硫氰化钾)溶液,溶液立即变成血红色。
Fe3++SCN-=Fe (SCN)3+Fe3+(黄色)和Fe2+(浅绿色)之间的相互转化(重点看,包括方程式)Fe2+ Fe3+ Fe3+ Fe2+氧化剂还原剂2FeCl2+Cl2==2FeCl3(浅绿色溶液变成黄色)2FeCl3 +Fe==3FeCl2 C u+2FeCl3==CuCl2+2FeCl2 2Fe2++Cl2==2Fe3++2Cl-2Fe3+ +Fe = 3Fe2+2Fe3+ +Cu = 2Fe2+ + Cu2+氢氧化铁制备: FeCl3 +3NaOH==Fe(OH)3+3NaCl 受热分解2Fe(OH)3== Fe2O3+3H2O 怎么除去氯化铁溶液中的氯化亚铁?方法:滴加氯水;2FeCl2+Cl2==2FeCl3怎么除去氯化铁中的氯化亚铁?加少量铁粉; 2FeCl3+Fe=3FeCl2如何防止FeCl2溶液的Fe2+被氧化成Fe3+?在盛有FeCl3溶液的试管中,加入1小匙铁粉,振荡试管。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章金属及其化合物铁
一.铁
铁在氧气中燃烧
铁与水蒸气反应______________________________________________________
铁与盐酸的反应_______________________________;离子反应_______________________
金属单质在反应中,化合价都__________,表现出_________性,作___________剂。
大部分金属较活泼,故在自然界中以________态形式存在,只有极少数如金、铂等是以________存在。
二.铁的氧化物
氧化亚铁:化学式_______,____色粉末,不稳定,在空气中容易被氧化成_____.铁元素价态
四氧化三铁:化学式___________,_______色晶体,俗称________________.铁元素价态
氧化铁:化学式____________,________色粉末,俗称____________,常用作红色油漆和涂料,赤铁矿的主要成分就是氧化铁,是炼铁原料.铁元素价态
铁的氧化物都不溶于水,也不与水反应.都能与酸反应.
FeO与盐酸反应___________________________________;离子反应_____________________________ Fe2O3 与盐酸反应___________________________________;离子反应____________________________ Fe3O4与盐酸反应;离子反应____________________________ 三.铁的氢氧化物:均于水(填“溶”或“不溶”),能与酸反应。
Fe(OH)3为_______溶于水的_________固体,由可溶性铁盐溶液与碱溶液反应制得.
氯化铁与氢氧化钠反应______________________________;离子反应________________________
Fe(OH)3加热可分解__________________________________;
Fe(OH)3可与盐酸反应_________________________________;离子反应_______________________
Fe(OH)2是_______溶于水的________色固体,由可溶性亚铁盐溶液与碱溶液起反应制得.
硫酸亚铁与氢氧化钠反应________________________________;离子反应_______________________ Fe(OH)2在空气中被氧气氧化生成Fe(OH)3,现象为:_________色沉淀迅速变为________色,最后变成_________色。
方程式:___________________________________
Fe(OH)2与盐酸反应;离子反应_______________________ 四.铁盐(色)与亚铁盐(色):
铁离子(Fe3+)的检验:加入_________溶液变____________.离子反应
铁盐与亚铁盐相互转化:
Fe3+Fe2+
氯化铁与铁粉反应_________________________________;离子反应_______________________
氯化铁与铜粉反应__________________________________;离子反应_______________________
氯化亚铁与氯气反应____________________________________________
明矾(KAl(SO4)2•12H2O)和硫酸铁(化学式:)都可作净水剂。
