专题二 水溶液中的平衡
高中化学水溶液平衡教案

高中化学水溶液平衡教案
教学目标:
1. 了解水溶液的基本概念和特点。
2. 理解水溶液中的平衡现象及相关的化学方程式。
3. 掌握水溶液平衡的影响因素和调节方法。
教学内容:
1. 水溶液的定义和性质。
2. 溶解度和溶解平衡。
3. 酸碱平衡和盐水平衡。
教学步骤:
第一步:导入(5分钟)
教师引导学生回顾有关水溶液的知识,提出学习的主题是水溶液平衡。
同时,引入水溶液
的平衡概念。
第二步:讲解水溶液的定义和性质(15分钟)
教师通过讲解,图像展示和示例演示等方式介绍水溶液的定义和性质,包括溶解度、溶解
平衡等内容。
并通过实验让学生亲自观察水溶液的形成。
第三步:探讨溶解度和溶解平衡(20分钟)
教师引导学生讨论溶解度和溶解平衡的概念,以及影响溶解度的因素。
通过实验和计算演
示不同物质的溶解度及平衡的动态过程。
第四步:学习酸碱平衡和盐水平衡(20分钟)
教师讲解酸碱平衡和盐水平衡的定义、反应特点及相关的化学方程式。
并通过实例讲解如
何调节水溶液的酸碱程度和盐水浓度。
第五步:课堂练习(10分钟)
教师布置针对水溶液平衡的练习题,让学生在课堂上进行解答并相互讨论,巩固所学知识。
第六步:总结与评价(5分钟)
教师对学生的学习情况进行总结和评价,强调水溶液平衡的重要性,并为下节课的学习内容做铺垫。
教学反思:
在教学过程中,应注重让学生通过实验和讨论来掌握水溶液平衡的相关知识,激发他们的学习兴趣和主动性。
同时,也要关注学生的实际学习情况,根据学生的反馈进行及时调整和指导。
第一阶段 专题二 第4讲 水溶液中的离子平衡

返回
[思考· 回顾]
1.溶度积 BaSO4、Fe(OH)3的溶度积常数表达式为: 2 c(Ba2+)· c(SO4-); Ksp(BaSO4)=
c(Fe3+)·3(OH-) 。 c Ksp[Fe(OH)3]=
2.沉淀的转化和溶解 (1)转化: 向AgCl悬浊液中加入足量KI溶液,有黄色沉淀产生,平衡 后再加入足量的Na2S溶液,又有黑色沉淀产生,这说明溶解 度: AgCl > AgI > Ag2S ,过程中发生反应的离子方程式为:
液中c(OH-)=10-12 mol· -1,水电离出的c(H+)=溶液中的 L c(OH-)=10-12 mol· -1。 L
(3)溶质为碱的溶液:
OH-来源于碱电离和水电离,而H+只来源于水电离。 如pH=12的NaOH溶液中c(H+)=10-12 mol/L,即水电离产 生的c(OH-)=c(H+)=10-12 mol/L。 返回
解析:因忽视温度对水电离平衡的影响而造成失误;升
高温度促进水的电离,其中的c(H+)增大,pH减小。
返回
[思考· 回顾]
1.盐类水解的基本规律
有下列八种物质的溶液:①NH3· 2O ②NaCl H
③NH4Cl ⑦NaHCO3 ④Na2CO3 ⑤CH3COOH ⑥H2SO4 ⑧CH3COONa
(1)溶液呈酸性的是 ③⑤⑥ 。 (2)溶液呈碱性的是 ①④⑦⑧ 。
盐酸:不变醋酸溶液:盐酸:不变醋酸溶液: 变大 变大 返回
2.由水电离出的c(H+)或c(OH-)的计算(25℃时)
(1)中性溶液:c(H+)=c(OH-)=1.0×10-7 mol· -1。 L
(2)溶质为酸的溶液: H+来源于酸电离和水电离,而OH-只来源于水电离。
高考化学真题专题解析—水溶液中的离子平衡

高考化学真题专题解析—水溶液中的离子平衡【母题来源】2022年全国乙卷【母题题文】常温下,一元酸HA 的3a K (HA)=1.010-⨯。
在某体系中,+H 与-A 离子不能穿过隔膜,未电离的HA 可自由穿过该膜(如图所示)。
设溶液中()c (HA)c(HA)c A -=+总,当达到平衡时,下列叙述正确的是A .溶液Ⅰ中()()()c Hc OH c A +--=+B .溶液Ⅱ中的HA 的电离度()-c A c (HA)⎛⎫ ⎪ ⎪⎝⎭总为1101C .溶液Ⅰ和Ⅱ中的(HA)c 不相等D .溶液Ⅰ和Ⅱ中的c (HA)总之比为410- 【答案】B 【试题解析】A .常温下溶液I 的pH=7.0,则溶液I 中c (H +)=c (OH -)=1×10-7mol/L ,c (H +)<c (OH -)+c (A -),A 错误;B .常温下溶液II 的pH=1.0,溶液中c (H +)=0.1mol/L ,K a =+-(H )(A )(HA)c c c ⋅=1.0×10-3,c 总(HA)=c (HA)+c (A -),则--0.1(A )(HA)-(A )c c c 总=1.0×10-3,解得-(A )(HA)c c 总=1101,B 正确; C .根据题意,未电离的HA 可自由穿过隔膜,故溶液I 和II 中的c (HA)相等,C 错误;D .常温下溶液I 的pH=7.0,溶液I 中c (H +)=1×10-7mol/L ,K a =+-(H )(A )(HA)c c c ⋅=1.0×10-3,c 总(HA)=c (HA)+c (A -),-710[(HA)(HA)](HA)c c c -总=1.0×10-3,溶液I 中c 总(HA)=(104+1)c (HA),溶液II 的pH=1.0,溶液II 中c (H +)=0.1mol/L ,K a =+-(H )(A )(HA)c c c ⋅=1.0×10-3,c 总(HA)=c (HA)+c (A -),0.1[(HA)(HA)](HA)c c c -总=1.0×10-3,溶液II 中c 总(HA)=1.01c (HA),未电离的HA 可自由穿过隔膜,故溶液I 和II 中的c (HA)相等,溶液I 和II 中c 总(HA)之比为[(104+1)c (HA)]∶[1.01c (HA)]=(104+1)∶1.01≈104,D 错误; 答案选B 。
2014届高考化学二轮复习简易通(广东专用)配套课件:上篇 专题二 第7讲 水溶液中的离子平衡

0.1 mol,酸过量,反应后的溶液中c(H+)=(0.12 mol-
0.1 mol)/(1+1)L=0.01 mol· L-1,故pH=2.0。 3.NaHCO3溶液中存在哪些平衡?该溶液中离子浓度的大 小关系如何?
答案 NaHCO3 溶液中存在三种平衡: HCO3 +H2O
―
H2CO3 + OH ― (HCO3 ― 水 解 平 衡 ) , HCO3 ― H + + CO32 ― (HCO3―电离平衡)和水的电离平衡 H2O H++OH-。离子浓 + ― ― ― + 度的大小关系为 c(Na )>c(HCO3 )>c(OH )>c(CO32 )>c(H )。
第7讲 水溶液中的离子平衡
知识体系建构
高考命题视角
考场失分防范
学科素养提升
【考纲点击】
1.了解电解质的概念。了解强电解质和弱电解质的概念。
2.了解电解质在水溶液中的电离,以及电解质溶液的导电
性。 3.了解弱电解质在水溶液中的电离平衡。 4.了解水的电离,离子积常数。 5.了解溶液pH的定义。了解测定溶液pH的方法,能进行
高考命题视角
考场失分防范
学科素养提升
角度2
弱电解质的判断(2013· 天津理综,1D)
知识链接
弱电解质的判断方法:(1)同温度同浓度下,与同类型的强 电解质溶液做导电性对比试验或比较反应速率快慢。(2)测
定一定物质的量浓度溶液的pH。如0.01 mol· L-1 HA的pH
>2,则HA为弱酸。(3)测定对应的盐溶液的酸碱性,如 NaA溶液pH>7,则HA为弱酸。(4)稀释前后pH与稀释倍 数的变化关系。如pH=2的酸溶液稀释103倍,pH<5,则 该酸为弱酸。(5)利用较强酸(碱)制取较弱的酸(碱)判断电
高中化学水溶液中平衡教案

高中化学水溶液中平衡教案
一、知识目标
1. 了解水溶液中的平衡反应及其特点。
2. 掌握水溶液中平衡反应的计算方法。
3. 能够解释水溶液中平衡反应的影响因素。
二、能力目标
1. 能够应用 Le Chatelier 原理解释水溶液中平衡反应的移动方向。
2. 能够设计实验验证水溶液中平衡反应的影响因素。
三、教学过程
1. 导入
通过一个问题引出水溶液中的平衡反应:“为什么在水溶液中某些化学反应会达到动态平衡?”引导学生思考。
2. 学习活动
a. 学习水溶液中平衡反应的特点和表达方式。
b. 学习水溶液中平衡反应的计算方法。
c. 学习水溶液中平衡反应的影响因素及其解释。
3. 回答问题
通过提问巩固学生对知识点的理解,如:“增加温度对水溶液中平衡反应会有什么影响?”
4. 实验设计
学生根据所学知识设计一个实验,以验证水溶液中平衡反应的影响因素。
可以是改变浓度、温度等条件,观察反应移动的方向。
5. 教学反思
老师根据学生的表现和实验结果,对教学过程进行总结和反思,进一步加深学生对水溶液
中平衡反应的理解。
四、作业
1. 阅读相关文献,了解更多关于水溶液中平衡反应的内容。
2. 完成相关习题,巩固所学知识。
五、课后反馈
老师可以通过学生的作业及实验报告等方式进行课后反馈,了解学生的学习效果和问题,及时进行指导。
注:本教案仅供参考,具体教学内容和活动可以根据实际情况进行调整和补充。
2023届高考化学第二轮专题复习真题模拟——水溶液中的离子反应与平衡1(含解析)
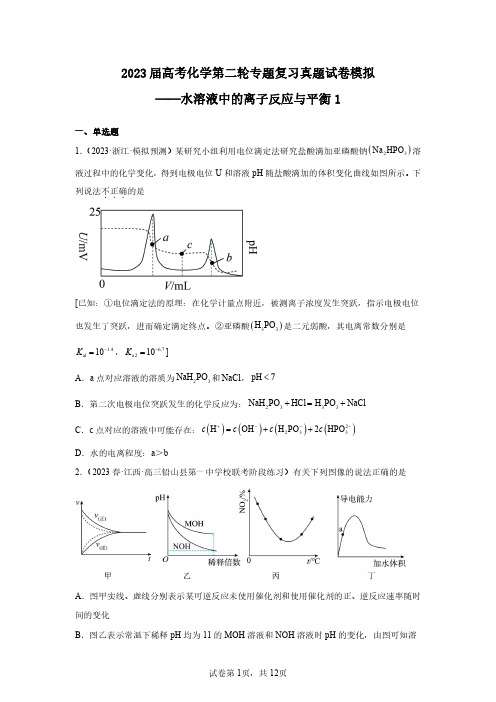
2023届高考化学第二轮专题复习真题试卷模拟——水溶液中的离子反应与平衡1一、单选题[已知:①电位滴定法的原理:在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。
②亚磷酸(H 1.4al 10K -=, 6.7a 210K -=]A .a 点对应溶液的溶质为32NaH PO 和NaCl ,pHB .第二次电极电位突跃发生的化学反应为:NaHC .c 点对应的溶液中可能存在:()()H OH c c +-=D .水的电离程度:a >b2.(2023春·江西·高三铅山县第一中学校联考阶段练习)有关下列图像的说法正确的是A .图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化B .图乙表示常温下稀释pH 均为11的MOH 溶液和NOH 溶液时pH 的变化,由图可知溶A .()-2.3b K ROH =10B .P 、Q 点对应溶液中()()++c R c H 的值:P Q>C .若将溶液无限稀释,溶液中()(+2-4c R 2c SO ≈D .相同条件下,若改为()124c R SO =0.2mol L -⋅4.(2023秋·浙江宁波·高三统考期末)下列溶液因盐的水解而呈酸性的是A .K SO 溶液B .NaHCO 溶液CA .完全沉淀废液中的2Pb +,I -的效果不如B .z 点,()()(2-2+3sp Q=c CO c Pb <K PbCO ⋅C .()sp 2K PbI 的数量级为1410-A .A -是HA 的共轭碱C .增大pH 过程中,()()A HA c c -的值减小()()HA A 1.0δδ-+=9.(2023·辽宁·模拟预测)难溶物2SrF 可溶于盐酸。
常温下,用A .1L 代表()2+-lgc Sr 与()()+c HF lg c H ⎡⎤⎢⎥⎢⎥⎣⎦的变化曲线B .a 、c 两点的溶液中均存在(2c Sr C .()a K HF 的数量级为710-D .c 点的溶液中存在()(2+-c Sr>c Cl 10.(2023·全国·模拟预测)某元素M(OH)3(s)M 3+(aq)+3OH -(aq)、A .曲线①代表lgc(M 3+)与pH 的关系B .M(OH)3的K sp 为1×10-33.5C .4.5≤pH≤9.3时,体系中元素M 主要以D .M(OH)4-与M 3+在溶液中可以大量共存11.(2023·山东·模拟预测)室温下,向柠檬酸A .C 6H 8O 7的K a1为10−3.13B .曲线b 表示δ(677C H O -)随pH 的变化C .在C 6H 6Na 2O 7溶液中,(677C H O -)>(66C H OD .pH 大于6时,发生的反应主要为2667C H O -12.(2023·辽宁·模拟预测)25℃时,用同一NaOH 溶液,pM[p 表示负对数,M 表示()()-c A c HA 、(c CuA .HA 为一元弱酸,25℃时7.4a K =10-B .线①代表滴定4CuSO 溶液时pM 与溶液C .滴定HA 溶液至x 点时,溶液中()()()()()-++-c HA >c A >c Na >c H >c OH D .滴定4CuSO 溶液至x 点时,改为滴加HA 溶液,沉淀逐渐完全溶解二、多选题A .25℃时,BOH 的电离平衡常数的数量级为10-4B .t=0.5,2c(H +)+c(B +)=2c(OH -)+c(BOH)C .P 1所示溶液:c(Cl -)>0.05mol·L -1D .P 2所示溶液:c(B +)>100c(BOH)14.(2023春·山东滨州·高三统考开学考试)25℃时,用HCl 气体调节0.1mol 体系中微粒浓度的对数值(lgc)与pH 的关系如图1所示(a 、b 、c 、d 线分别对应体系中除下列说法错误的是A .4NH Cl 水解平衡常数的数量级为1010-B .3P 对应溶液;()-1c Cl 0.05mol L-<⋅C .水的电离程度:123P P P <<D .4P 对应溶液:()()()-+4323c Cl =2c NH +2c NH H O⋅三、工业流程题常温下,有关金属离子开始沉淀和沉淀完全的pH 见下表:金属离子3Fe +3Al +2Mg +2Ca +(1)萃取塔中经过______(填写操作名称)可将含酚有机层分离出来。
高考化学二轮复习专题考点剖析—水溶液中的离子平衡

高考化学二轮复习专题考点剖析—水溶液中的离子平衡必备知识解读一、弱电解质的电离(弱电解质:包括弱酸、弱碱、极少数盐(如醋酸铅)、两性氢氧化物、水等。
)1.电离度(1)概念在一定条件下的弱电解质达到电离平衡时,已经电离的电解质分子数占原电解质总分子数的分数。
(2)表示方法α=已电离的弱电解质分子数溶液中原有弱电解质的总分子数×100%也可表示为α=弱电解质的离子浓度弱电解质的浓度×100%(3)影响因素温度的影响升高温度,电离平衡向右移动,电离度增大;降低温度,电离平衡向左移动,电离度减小浓度的影响当弱电解质溶液浓度增大时,电离度减小;当弱电解质溶液浓度减小时,电离度增大2.电离常数(1)概念:电离平衡的常数叫做电离常数。
(2)表达式①对于一元弱酸HA :HAH ++A -,电离常数K a =c(H +)·c (A -)c(HA)。
②对于一元弱碱BOH :BOH B ++OH -,电离常数K b =c(B +)·c(OH -)c(BOH -)。
(3)特点多元弱酸各级电离常数的大小关系是K 1≫K 2≫K 3,故其酸性取决于第一步电离。
(4)影响因素内因:弱电解质本身的性质外因:电离常数只与温度有关,升高温度,K值增大。
(5)意义K越大―→越易电离―→酸碱性越强如相同条件下常见弱酸的酸性强弱:H2C2O4>H2SO3>H3PO4>HF>HCOOH>CH3COOH>H2CO3>H2S>HClO。
3.电离常数的四大应用①判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
②判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,酸性(或碱性)越弱。
③判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
④计算弱酸、弱碱溶液中的c(H+)、c(OH-)。
有关电离平衡常数的计算(以弱酸HX为例)已知c(HX)和电离平衡常数,求c(H+)。
HX H++X-起始:c(HX)00平衡:c(HX)-c(H+)c(H+)c(X-)则:K=c(H+)·c(X-)c(HX)-c(H+)=c2(H+)c(HX)-c(H+)由于c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX),则c(H+)=K·c(HX),代入数值求解即可。
新教材高中化学第三章水溶液中的离子反应与平衡本章复习提纲新人教版选择性必修

第三章水溶液中的离子反应与平衡本章复习提纲专题一溶液中离子浓度的大小和粒子的守恒关系1.明确两个“微弱”(1)弱电解质的电离是微弱的,电离产生的离子的浓度小于弱电解质分子的浓度。
如弱酸HA溶液中c(HA)>c(H+)>c(A-)>c(OH-)。
(2)单一的弱酸根阴离子和弱碱阳离子的水解是微弱的,水解生成的粒子的浓度小于盐电离产生的离子的浓度。
ⅰ.单一溶液中不同离子浓度的大小比较①正盐溶液基本遵循c(不水解离子)>c(水解离子)>c(显性离子),当离子外有角标时,顺序提前,如醋酸钠溶液中有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
在浓度为c mol·L-1(NH4)2SO4溶液中,c(NH+4)>c(SO2-4)>c(H+)>c(OH-)。
②酸式盐溶液a.以电离为主的酸式盐,遵循c(自身)>c(电离产物)>c(水解产物)。
如NaHSO3溶液中,c(Na+)>c(HSO-3)>c(H+)>c(SO2-3)>c(OH-)。
b.以水解为主的酸式盐,遵循c(自身)>c(水解产物)>c(电离产物)。
如NaHCO3溶液中,c(Na+)>c(HCO-3)>c(OH-)>c(H+)>c(CO2-3)。
ⅱ.混合溶液中各离子浓度的比较要综合分析水解因素、电离因素。
①如相同浓度的NH4Cl和氨水混合液中,NH3·H2O的电离程度大于NH+4的水解程度。
则c(NH+4)>c(Cl-)>c(OH-)>c(H+)。
②又如相同浓度的CH3COOH和CH3COONa溶液中,因CH3COOH的电离程度大于CH3COONa的水解程度,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
[特别提示]多元弱酸要考虑分步电离(K a1≫K a2≫K a3),多元弱酸的正盐要依据分步水解分析离子浓度,如Na2CO3溶液中,c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题 2 水溶液中的离子平衡2/27/2015一、弱电解质的电离平衡和溶液的酸碱性(一)强弱电解质及其电离1.电解质、非电解质的概念 注意:①单质和混合物②CO 2、NH 3等③难溶的盐(BaSO 4等)2.电解质的电离(1)强电解质是 电离的,在溶液中 电解质分子,(2)弱电解质在水溶液中 发生电离的。
如25℃时0.1mol/L 的CH 3COOH 溶液中,CH 3COOH 的电离度只有1.32%。
(3)多元弱酸如H 2CO 3还要考虑分步电离: 3.弱电解质的电离平衡(1)特征:①动 ;②定: ;③变: 。
(2)影响因素(以CH 3COOH CH 3COO -+ H +为例)①浓度:加水稀释 电离,溶液中n(H +) ,c (H +) ②温度:升温 电离③相关离子:例如加入无水CH 3COONa 能 电离,加入盐酸也 电离,加入碱能 电离。
4.电离平衡常数(K )弱电解质电离程度相对大小一种参数 (1)表示方法:对于一元弱酸 HA H ++A -,平衡时,K (2)含义:K 值越大,电离程度 ,相应酸(或碱)的酸性(或碱性)越 。
(3)影响因素:K 值只随 变化。
(二)水的电离和溶液的pH 1.水的离子积(1)定义H 2O H ++OH - ;△H >0,K W =(2)性质 ①在稀溶液中,K w 只受 影响,而与溶液的酸碱性和浓度大小 关。
②在其它条件一定的情况下,温度升高,K W ,反之则 。
③溶液中H 2O 电离产生的c (H +) c (OH -)④在溶液中,K w 中的c (OH -)、c (H +)指溶液中总的离子浓度。
2.溶液的pH (1)定义pH= ,广泛pH 的范围 。
(2)pH 、c (H +)与溶液酸碱性的关系 (3)有关pH 的计算①酸溶液、碱溶液 ②强酸、强碱溶液稀释③强酸、强碱溶液混合后溶液的pH 计算,酸过量→c (H +)→pH 恰好完全反应,pH=7;碱过量→c (OH -)→c (H +)→pH (1)(2013·天津高考)在蒸馏水中滴加浓H 2SO 4,K W 不变( ) (2)(2012·福建高考)25℃与60℃时,水的pH 相等( ) (3)(2013·重庆高考)25℃时,用醋酸溶液滴定等浓度NaOH 溶液至pH =7,V (醋酸)<V (NaOH)(4)(2013·江苏高考)CH 3COOH 溶液加水稀释后,溶液中c (CH 3COOH )c (CH 3COO -)的值减小( )(5)(2013·天津高考)NaCl 溶液和CH 3COONH 4溶液均显中性,两溶液中水的电离程度相同( ) [典例] 醋酸是电解质,下列事实能说明醋酸是弱电解质的组合是( )①醋酸与水能以任意比互溶 ②醋酸溶液能导电③醋酸溶液中存在醋酸分子 ④0.1 mol/L 醋酸溶液的pH 比0.1 mol/L 盐酸的pH 大 ⑤醋酸能和碳酸钙反应放出CO 2 ⑥0.1 mol/L 醋酸钠溶液pH =8.9 ⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H 2速率慢A .②⑥⑦B .③④⑤⑥C .③④⑥⑦D .①② [演练1] (2013·新课标卷Ⅰ)短周期元素W 、X 、Y 、Z 的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )A .W 2-、X +B .X +、Y 3+C .Y 3+、 Z 2-D .X +、Z 2-[演练2] (2013·上海)H 2S 水溶液中存在电离平衡H 2S H ++HS -和HS -H ++S 2-。
若向H 2S 溶液中( )A .加水,平衡向右移动,溶液中氢离子浓度增大B .通入过量SO 2气体,平衡向左移动,溶液pH 值增大C .滴加新制氯水,平衡向左移动,溶液pH 值减小D .加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 二、盐类的水解平衡1.盐类水解的含义 2.影响盐类水解的因素(1)内因:有弱就水解,无弱不水解,谁弱谁水解,越弱越水解;(2)外因:3、水解的应用 (1)(2011·江苏)水解反应 NH +4+H 2O NH 3·H 2O +H +达到平衡后,升高温度平衡逆向移动。
(2)(2013·江苏)Na 2CO 3溶液中加入少量Ca(OH)2固体,CO 2-3水解程度减小,溶液的pH 减小( ) (3)(2012·江苏)明矾能水解生成Al(OH)3胶体,可用作净水剂( )(4)(2013·天津)在Na 2S 稀溶液中,c (H +)=c (OH -)-2c (H 2S)-c (HS -( ) (5)(2011·山东)制备AlCl 3、FeCl 3、CuCl 2均不能采用将溶液直接蒸干的方法。
( ) [典例] (2013·四川高考)室温下,将一元酸HA 的溶液和KOH 溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是( A .实验①反应后的溶液中:c (K +)>c (A -)>c (OH -)>c (H +) B .实验①反应后的溶液中:c (OH -)=c (K +)-c (A -)=K W 1×10-9 mol/LC .实验②反应后的溶液中:c (A -)+c (HA)>0.1 mol/LD .实验②反应后的溶液中:c (K +)=c (A -)>c (OH -)=c (H +)[演练1] (2013·广东)50 ℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )A .pH =4的醋酸中:c (H +)=4.0 mol·L -1B .饱和小苏打溶液中:c(Na +)=c (HCO -3)C .饱和食盐水中:c (Na +)+c (H +)=c (Cl -)+c (OH -) D .pH =12的纯碱溶液中:c (OH -)=1.0×10-2mol·L-1[演练2] (2013·安徽)已知NaHSO 3溶液显酸性,溶液中存在以下平衡: HSO -3+H 2O H 2SO 3+OH - ① HSO -3H ++SO 2-3 ②向0.1 mol·L-1的NaHSO 3溶液中分别加入以下物质,下列有关说法正确的是( )A .加入少量金属Na ,平衡①左移,平衡②右移,溶液中c (HSO -3)增大 B .加入少量Na 2SO 3固体,则c (H +)+c (Na +)=c (HSO -3)+c (OH -)+12c (SO 2-3) C .加入少量NaOH 溶液,c (SO 2-3)c (HSO -3)、c (OH -)c (H +)的值均增大D .加入氨水至中性,则2c (Na +)=c (SO 2-3)>c (H +)=c (OH -)三、难溶电解质的溶解平衡1.难溶电解质的沉淀溶解平衡与溶度积M m A n (s)m M n +(aq)+n A m -(aq),其溶度积K sp =c m (M n +)·c n (A m-)。
2.沉淀溶解平衡的应用(1)沉淀的溶解和生成:当溶液的浓度商Q c大于K sp时,会生成沉淀;当Q c小于K sp时,沉淀会溶解;2)沉淀的溶解:①酸溶法,②盐溶法③配合法,(3)沉淀的转化:转化沉淀的实质是①溶解度或K sp大的易向溶解度或K sp小的难溶电解质转化。
②当溶解度或K sp悬殊不是很大时,发生由溶解度小的向溶解度大的转化。
(1)(2013·天津)CaCO3难溶于稀硫酸,也难溶于醋酸()(2)(2012·江苏)向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,出现黄色沉淀,说明K sp(AgCl)>K sp(AgI) ()(3)(2012·北京)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,2AgCl+S2-===Ag2S↓+2Cl-()(4)(2012·浙江高考)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1 mol/L盐酸③0.1 mol/L氯化镁溶液④0.1 mol硝酸银溶液中,Ag+浓度:①>④=②>③()(5)(2013·重庆高考)AgCl沉淀易转化成AgI沉淀且K sp(AgX)=c(Ag+)·c(X-),故K sp(AgI)<K(AgCl()[典例](双选)(2013·江苏高考)一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。
已知:pM=-lg c(M),p(CO2-3)=-lg c(CO2-3)。
下列说法正确的是()A.MgCO3、CaCO3、MnCO3的K sp依次增大B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO2-3)C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO2-3)D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO2-3)[演练1](2013·北京高考)实验:①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是()A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶[演练2](2013·新课标)已知K sp(AgCl)=1.56×10-10,K sp(AgBr)=7.7×10-13,K sp(Ag2CrO4)=9.0×10-12。
某溶液中含有Cl-、Br-和CrO2-4,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()A.Cl-、Br-、CrO2-4B.CrO2-4、Br-、Cl-C.Br-、Cl-、CrO2-4D.Br-、CrO2-4、Cl-[典题](2012·上海)常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合。
下列判断一定错误的是()A.若c(OH-)>c(H+),a=b B.若c(K+)>c(CH3COO-),a>bC.若c(OH-)=c(H+),a>b D.若c(K+)<c(CH3COO-),a<b[针对训练] 1.已知常温下CH3COOH的电离平衡常数为K a。
