15-concerted reaction
第三章缩合反应CondensationReaction课件

(2) 酸催化的反应机理: (酸催化应用不多)
O RH2C C R' + HA
RH2C
OH C R'
OH RH2C C R' + A
OH -H
RH2C C R'
OH RHC C R'
OH RHC C R'
RH2C
OH C R' + RHC
限速步骤
OH C R'
OH
OH
RH2C C HC C R'
O
慢
C H + OH
O
O
CH CH2 C H
O
CH2 C H
快
+O
CH3 C H
+ 快
H2O
OH
O
CH3 CH CH2 C H + OH
H2O
O
CH3CH CH2 CH
3
4
5
对于活性醛,反应温度 较高或催化剂的碱性较 强,有利于进行消除脱
水得α, β-不饱和醛
NaOH 25℃
OH CHO
CHO
H3CO
H3CO OCH3
Ph OCH3
OCH3 OCH3
30
二、不饱和烃的α-羟烷基化反应(Prins反应)
1、定义与反应过程
在酸催化下,甲醛(等其它醛)和烯烃加成得到1,3-二醇 或进一步和甲醛反应生成环状缩醛(1,3-二氧六环)的反应称 为Prins(甲醛-烯加成)反应。
CH2O + H
CH2OH
13
CH3CH2CHO + (CH3)2CHCHO
NaOH 25 oC
CH3 H3CH2CHC C CHO
生物化学名词解释

生物化学名词解释《生物化学》——名词解释氨基酸(amino acids):是含有一个碱性氨基和一个酸性羧基的有机化合物,氨基一般连接在α-碳上。
氨基酸是肽和蛋白质的构件分子。
必需氨基酸(essential amino acids):指人(或其它脊椎动物)自己不能合成,需要从饮食中获得的氨基酸,例如赖氨酸、苏氨酸等氨基酸。
非必需氨基酸(nonessential amino acids):指人(或其它脊椎动物)自己能由简单的前体合成的,不需要由饮食供给的氨基酸,例如甘氨酸、丙氨酸等氨基酸。
等电点(pI,isoelectric point):使分子处于兼性分子状态,在电场中不迁移(分子的净电荷为零)的pH值。
茚三酮反应(ninhydrin reaction):在加热条件下,氨基酸或肽与茚三酮反应生成紫色(与脯氨酸反应生成黄色)化合物的反应。
肽键(peptide bond):一个氨基酸的羧基与另一个氨基酸的氨基缩合,除去一分子水形成的酰胺键。
肽(peptides):两个或两个以上氨基酸通过肽键共价连接形成的聚合物。
蛋白质一级结构(primary structure):指蛋白质中共价连接的氨基酸残基的排列顺序。
层析(chromatography):按照在移动相(可以是气体或液体)和固定相(可以是液体或固体)之间的分配比例将混合成分分开的技术。
离子交换层析(ion-exchange column chromatography):使用带有固定的带电基团的聚合树脂或凝胶层析柱分离离子化合物的层析方法。
透析(dialysis):通过小分子经半透膜扩散到水(或缓冲液)的原理将小分子与生物大分子分开的一种分离纯化技术。
凝胶过滤层析(gel filtration chromatography):也叫做分子排阻层析(molecular-exclusion chromatography)。
一种利用带孔凝胶珠作基质,按照分子大小分离蛋白质或其它分子混合物的层析技术。
呋喃和丙酮反应方程式

呋喃和丙酮反应方程式英文回答:The reaction between furan and acetone is a Diels-Alder reaction, which is a cycloaddition reaction between a conjugated diene and a dienophile. In this case, furan is the diene and acetone is the dienophile. The reaction proceeds through a concerted mechanism, in which the two reactants come together to form a single cyclic product.The product of the reaction is a substituted tetrahydrofuran. The substituent on the tetrahydrofuranring is the result of the addition of the acetone to the furan. The stereochemistry of the product is determined by the orientation of the reactants in the transition state.The Diels-Alder reaction is a powerful tool for the synthesis of cyclic compounds. It is a versatile reaction that can be used to form a wide variety of products. The reaction is also highly stereoselective, which makes it avaluable tool for the synthesis of complex molecules.中文回答:呋喃和丙酮的反应是狄尔斯-阿尔德反应,狄尔斯-阿尔德反应是共轭二烯与亲二烯体之间的环加成反应。
高等有机化学周环
杜瓦-齐默曼(Dewar-Zimmerman)规则
加热下(基态)的周环反应通过芳香过渡态进行; 而光照下(激发态)的周环反应通过反芳香过渡态进 行。
体系
4n
基态
Huckel 禁阻 Mobius 允许
激发态 Huckel 允许 Mobius 禁阻
4n+2
允许 禁阻
禁阻 允许
运用这个规则来分析周环反应,按以下步骤:
Huckel体系与Mobius体系
将一条纸带一端旋转180度,然后将两 端粘接,就成了Mobius带。在几何上, 它只有一个面和一个边,没有内外侧之 分。
Mobius带
将一个共轭多烯链扭转180度,再连接起来,在 接头处就出现一次符号的改变,相当于轨道的 节面。这样的体系称为Mobius体系。
在理论上可以想象,一个共轭环多烯可认为是被 类似地扭转多次(符号改变多次)构成的。将符号改 变零次和偶数次的称为Huckel体系;符号改变偶数次 的称为Mobius体系。
我们可以观察到,这些直链共轭多 烯的π分子轨道是有规律的。
共同特点:
1. Ψ1都是
Ψ2都是
A
B
对于任一个轨道Ψi,当i为奇数时,轨道对于镜面是 对称的(如A),当i为偶数时,轨道对于镜面是反对
称的(如B)。
2. 对于(4n+2)体系,其最高占据轨道(HOMO)
是A形式;最低空轨道(LUMO)是B形式。
例1:丁二烯顺旋,其过渡态有一个符号反转。为Mobius体系。 而4n个电子的Mobius体系是芳香性的,因而基态允许。
顺旋
符号反转
丁二烯对旋,其过渡态为Huckel体系,4个电子的Huckel体系 是反芳香性的,因而热反应禁阻,光反应允许。
有机反应大全

Chap. 10 allylic carbocation resonance stabilized
Reactions of Alkenes (Carey, Chap. 6 +) Reaction Product Notes
carbocation intermediate rearrangement possible
Reactions of Alkyl Halides (Carey, Chap. 8 +) Reaction Product Notes
SN2 with strong Nu: & polar aprotic solvent. SN1 with weak Nu: & protic solvent. Rearrangement possible when SN1. also Chap. 5 E2 elimination; requires anti-parallel conformation; no rearrangement
Syn. of cyclopropanes carbene intermediate
Reactions of Alcohols - II (Carey, Chap. 15) Reaction Product Notes
"Fischer esterification" equilibrium reaction
Transformations Flowsheet - Organic I (Carey, Chap. 4 - 9)
Reactions of Conjugated Dienes (Carey, Chap. 10) Reaction Product Notes
allylic carbocation; resonance-stabilized; 1,2-adduct major with "kinetic control" 1,4-adduct major with "thermodyn. control" allylic carbocation; resonance-stabilized; 1,2-adduct major with "kinetic control" 1,4-adduct major with "thermodyn. control" "Diels-Alder reaction" E must be conjugating group (eg, C=O or C=C); concerted reaction; stereospecific dienophile re
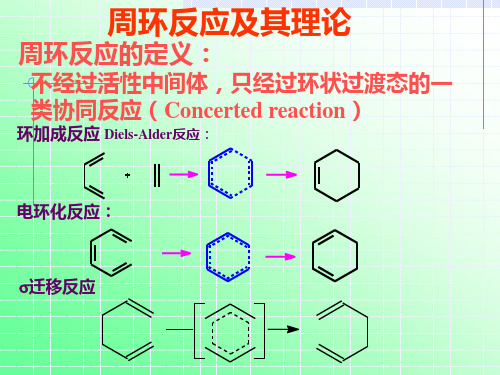
第十八章 协同反应

第二节
环加成反应
两分子烯烃或共轭多烯烃加成成为环状化合 物的反应叫环加成反应—— 双分子反应
CH 2 CH 2 + CH 2 CH 2 CHO + CHO hυ
新键的生成在反应体系的同面叫同面环 加成(suprafacial cycloaddition)
一般环加成为同面环加成
前线轨道理论(FMO)认为:
连接平面
O NH O
O
连接平面
1 2
* * * *
O
2 3
* * * *
H
2 O oC 90 O + NH 3 4 O
25o C
H H O
3
O
H
N H
外型产物
热力学控制
与烯键或炔键共 轭的不饱和基团
内型产物
动力学控制
内型加成产物:双烯体中的C(2)-C(3)键和亲双烯体中与 烯键或炔键共轭的不饱和基团处于连结平面同侧时的生 成物。(处于异侧为外型加成产物。)
1. 起决定性作用的轨道:一分子的HOMO,另一 分子的LUMO。两分子接近时,电子从HOMO流 入LUMO。 2. HOMO和LUMO轨道的对称性必须匹配, 环加 成反应才能发生 。
3. 相互作用的HOMO和LUMO应能量接近 (在6eV内)。
[ 2 + 2 ]环加成:
hν
+
LUMO HO MO
D C
结论:热反应(基态下的反应)—— 对旋有利。
光反应:其HOMO为ψ 4
A B 成键
C D
顺旋 A BC D
A 对旋 B 反键
D C
结论:光反应(激发态下的反应)—— 顺旋有利。
H
H hυ 顺旋 对旋 H
烯丙基取代反应英文

烯丙基取代反应英文英文回答:Allylic Substitution Reactions.Allylic substitution reactions are a class of organic reactions that involve the replacement of an allylic hydrogen atom with another group. Allylic positions are those carbons that are adjacent to a carbon-carbon double bond. Allylic substitution reactions are typicallycatalyzed by transition metals, such as palladium or nickel.The most common type of allylic substitution reactionis the allylic alkylation reaction. In this reaction, an allylic hydrogen atom is replaced by an alkyl group.Allylic alkylation reactions can be used to synthesize a variety of branched alkenes.Another common type of allylic substitution reaction is the allylic amination reaction. In this reaction, anallylic hydrogen atom is replaced by an amine group.Allylic amination reactions can be used to synthesize a variety of allylic amines.Allylic substitution reactions are a powerful tool for the synthesis of organic compounds. They can be used to synthesize a wide variety of branched alkenes and allylic amines.中文回答:烯丙基取代反应。
第19章周环反应

3) 电环化反应是可逆的,按微观可逆原则,正反应和逆反应 所经过的途径是相同的,所以成环反应的结果也适用于开 环反应。
说明:电环化反应是完全立体专属的,其具体立体化学表现,主 要取决于两种因素:
其一:多烯烃中的∏电子数目
其二:反应条件是加热还是光照
为什么电环化反应具有这样明显的立体化学专属性呢?在分子轨 道对称守恒原理提出之前是无法解释的,现在我们借助分子轨道 对称守恒原理,可以得到比较满意的解释。分子轨道对称守恒原 理是在总结了大量有机合成实验的经验规律基础上,把量子化学 的分子轨道理论引用到研究分子动态性质的结果,其表述的方法 有多种:①如前线轨道法、②能量相关理论以及③芳香过渡态理 论等。 其中前线轨道法较为简单而且形象,容易接受,。本章主 要介绍前线轨道法。所谓前线轨道法或叫前线分子轨道,一般据 分子中能量最高的电子占有轨道(HOMO)和能量最低的电子未占 有轨道(LOMO)而言。
C O O C 2H 5 + C O O C 2H 5 C O O C 2H 5 C O O C 2H 5 C O O C 2H 5 C O O C 2H 5
C 2H 5O
160° C 2 H 5 O
+ COOCH3 COOCH3
O O O O O O
O O O
内型(主产物)
C O O C 2H 5
π 6*
C H3
CH
CH
CH
CH
CH
CH
C H3
π 5*
C H3
CH
CH
CH
CH
CH
CH
C H3
* π5
LUMO
π 4*
C H3
CH
CH
CH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H2 molecule
σC-C
pi C=O
(3)电环化反应立体选择性的解释:
Me Me H 顺-3,4-二甲基环丁烯
CH3 CH3
CH3 C6H5 CD3
hv
100C
CH3 CH3
H
( hv)
H
H
H
H
H
(4)几点注意:
a. 电环化用顺旋和对旋来描述不同的立体化学过程。但
顺旋和对旋各有两种形式。
R H H R 顺时针顺旋 R 逆时针顺旋 R H H R 向内对旋 R H H R 向外对旋 R H H
采用那种顺旋或对旋方式,视产物的稳定性
Me
Me H
H
hv 对旋
Me
H Me
H
对旋:两个键朝相 反方向旋转
结论:4n π电子体系,加热-顺旋;光照-对旋
能 量
ψ6
己 三 烯 的 分 子 轨 道
ψ5
LUMO
ψ4
LUMO
HOMO
ψ3
HOMO
ψ2
ψ1 基态( ) 激发态(hv)
HOMO ψ3
Me H
Me H
对旋
Me H
H Me
HOMO ψ4
hv Me H Me H 顺旋
Me Me H H
结论:4n+2 π电子体系,加热-对旋;光照-顺旋
电环化选择性规则
π电子数 4n 4n+2 反应 热 光 热 光 方式 顺旋 对旋 对旋 顺旋
练习:完成下列反应式: C
C6H5 CH3 CD3 C6H5
CH3 CH3
hv
6H5
CH3 C6H5 CD3 C6H5
CH3 CO2CH3
.. O .. H2C .. R N ..
.. O ..
O ..
.. O ..
O ..
.. O ..
N N . . N N ..
H3C
H2C N N .. .. R N N N ..
C N N CH3 CO2CH3
H2C
N
N
C CH3O2C H2C Ph C N O C CH3
Ph C
当双烯体带有给电子基,亲双烯体带有吸电子基,选择性较 好。原因解释!
N(C2H5)2 + CH3CH2O +
CO2CH3
200C
N(C2H5)2 CO2CH3
160 0C CO2CH3
CH3CH2O CO2CH3
CH3 +
CO2CH3 CO2CH3
CH3 CO2CH3 CO2CH3 CH3 CO2CH3 CO2CH3
+ EtO2C
N N
N
+
NC O
CN CN
92%
+
N C6H5
C6H5 66%
e. 1,3-偶极环加成
1,3-偶极化合物 臭氧 O3 . O .. .. O .. .. N . .. N .
C
重氮甲烷 CH2N2 叠氮化物 RN3
H3C + CH3O2C
. H2C . R N ..
C
. O .. . N . . N .
CH3 + CH3O2C
CO2CH3
d. 其他双烯和亲双烯的环加成
双烯体系:
O C
C
C O
N C N
C
C
C O
C
N N
C N
O O
C
C
C
等
亲双烯体系:
N
C
N
N
等
+ O
800C O CO2Et 苯 O 10 C 乙醚 N CO2Et O 200C CN O N O 100%
0
CHO
45% CO2Et
P2O5
CH2 C CH2 C
C CH2 C CH2 O
H2 Pa-CaCO3
CH2 CH CH CH2 CH2 CH CH CH2 O
CH2 CH2
CH O CH
练习:完成反应式并写出生成主要产物的机理。
CHO CHO + H CH3 CH3 C H
H O CH3 H CH3 CH3 H
O H CH3 [3,3]σ 迁移
Et
练习:指出迁移类型
H D
[1,5]-D
H D
H
[1,5]-H
H
D
(2) 碳的[1, j] 迁移:相对复杂,sp3杂化态的C是有取向的
迁移碳的两种立体选择性:构型保持和构型翻转
R1 R2 R3 CH
2
C CH2
5
R2 R3
R1
C CH2
1
构型保持
CH2
1
CH
2
CH
3
CH
4
CH
3
CH
4
CH2
5
R1
R
一、电环化反应:
开链共轭多烯在光或热的条件下环合及其逆反应
Me Me H 顺-3,4-二甲基环丁烯 hv H HH
Me
Me H Me 反-3,4-二甲基环丁烯 H
Me (E,E)-2,4-己二烯
立体选择性的解释: (1)前线轨道理论FMO(Frontier Molecular Orbital)
1952年鬼子福井谦一:分子最高占有轨道HOMO(highest occupied molecular orbital)和能量最低空轨道LUMO(lowest unoccupied molecular orbital)
3
X CH
5
CH
2
CH
3
CH
4
CH
6
CH2
7
1
2
3
1
2
[1,5]σ 迁移 [3,3]σ 迁移
CH2 CH CH2
1
CH2 CH
3
CH2 CH
4
CH CH
2
CH2 CH
3
CH
2
CH2
5
CH2
1
CH
4
CH2
5
(1) 氢的[1, j] 迁移:
两种立体选择性:同面迁移和异面迁移 迁移前后的σ键在共轭平面同一侧的为同面迁移,反之为异面 迁移。
C CH
3
R2 R3 CH
4
构型翻转
CH2
1
CH
2
CH2
5
1
2
3
4
5
6
7
8
9
基态时,奇数碳 共轭体系的前线轨道
举例:
Me Me
1
2 3 4 5
Me
2 3 5 4
1
Me [1,5] H 同面
2 3 5 4
1
Me [1,5] C 同面
Me
H
练习:
a b H OAc
b
300 C
0
H
OAc a
(3) 碳的[3, 3] σ迁移:Cope Rearrangement
基态的 HOMO 对称性不匹配 基态的 LUMO 激发态的 HOMO 对称性匹配 基态的 LUMO
结论:同面-同面重叠[2+2]环加成,光照允许,加热禁阻
实例:
Me + Me Me hv Me Me Me Me Me + Me hv Me Me
Me
(2) [4+2] 环加成(Diels-Alder反应):加热允许 a. [4+2]环加成的FMO分析
能 量 新的反键轨道(α ' +△ E ) 能 量 LUMO(α')
(α)HOMO
HOMO(α')
(α)HOMO
新的成键轨道(α -△ E) 反应前体系的能量:2α +2α' 反应后体系的能量:2(α -△ E)+2(α +△ E ) ' =2α +2α'+2(△ E -△ E) 反应后能量升高:2(△ E -△ E)
1 2 3 1 2 3
CH2 CH2
1
CH CH
2
CD2 CD2
3
CH2 CH2
1
CH CH
2
CD2 CD2
3
C-C σ迁移
D D D D
D D D D
D D D D
COOEt COOEt
COOEt COOEt 100%
特点:具有高度的立体选择性
Me H H Me 225 C
0
H Me H Me (Z,E)-2,6-辛二烯
N O + CH3
C
C
CH3 H3C
C
练习:完成下列反应式:
O
O O +
O O O
O
H H O O
H H
- CO
O
O
O
O
D-A逆反应
H CH3 O C O C O H C2H5
O3
H + CH3
C
C
H C2H5
N
O
+ CH2 CHCOOCH3
N O COOCH3
N N
+ N2
三、σ迁移反应:一个σ键沿着共轭体系由一个位置转移到 另一个位置,同时伴随π键转移的反应。
H C6H5 C6H5 H 空间位阻大 不稳定 C6H5 逆时针顺旋 H H C6H5 顺时针顺旋 C6H5 H H C6H5 空间位阻小 稳定(主要)
