Pfizer公司自愿终止西他生坦在全球的销售和临床试验
国家药品监督管理局药品行政保护公告第153号(终止公告)

国家药品监督管理局药品行政保护公告第153号(终止
公告)
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2002.06.19
•【文号】国家药品监督管理局药品行政保护公告第153号
•【施行日期】2002.06.19
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局药品行政保护公告
(第153号终止公告)
申请人所在国:爱尔兰
申请人:杨森制药有限公司
申请药品名称:
通用名:西沙必利混悬剂(Cisapride Suspension)
商品名:普瑞博思混悬剂(Prepulsid Suspension)
授权号:B-IE94121924
授权日:1994年12月19日
该药品于1994年12月19日在中国获得的药品行政保护,已于2002年6月19日期限届满。
特此公告。
国家药品监督管理局药品行政保护办公室
二00二年六月十九日。
医药市场动态10.14

辉瑞制药计划将在法国和西班牙裁员核心提示:辉瑞制药发言人日前称,由于金融危机以及政府削减医药开支的影响,公司计划在法国裁员225人,在其西班牙的分支机构中裁员220人。
辉瑞制药发言人日前称,由于金融危机以及政府削减医药开支的影响,公司计划根据重组方案在法国裁员225人,在其西班牙的分支机构中裁员220人。
辉瑞目前在法国拥有雇员1493人,公司将在晚些时候公布更多信息。
辉瑞在法国中部地区经营一家生产厂。
辉瑞在西班牙的发言人帕斯库埃表示,此次裁员将影响行政管理、销售及研究部门,但辉瑞在马德里和西班牙东北部城市奥洛特的工厂不会受到影响。
脊髓灰质炎再次传入中国核心提示:世界卫生组织(W HO)称中国自1999年以来首次出现脊髓灰质炎疫情,本次疫情是从邻国巴基斯坦传入的。
世界卫生组织(WHO)9月20日称,中国自1999年以来首次出现脊髓灰质炎疫情,并且病毒很有可能随着前往沙特阿拉伯麦加朝圣的人群而进一步扩散。
本次疫情是从邻国巴基斯坦传入的。
WHO发言人表示,目前中国已有9例患者被确诊,而巴基斯坦全国都出现了脊髓灰质炎疫情,主要是因为局势不稳导致该国在Khyber部族区等地的疫苗接种工作受阻。
WHO认为,考虑到Haj(每年10月份的大规模麦加朝圣之旅)的即将到来和Umra(其他时间发生的麦加朝圣),野生脊髓灰质炎病毒株进一步发生跨国传播的风险很高。
评级机构下调辉瑞长期信用评级指其未如约还债核心提示:国际评级机构惠誉上周末宣布,将全球最大的制药企业——美国辉瑞制药公司的长期信用评级由AA-下调至A++;同时将辉瑞制药的评级展望由负面上调至稳定。
国际评级机构惠誉上周末宣布,将全球最大的制药企业——美国辉瑞制药公司的长期信用评级由AA-下调至A+;同时将辉瑞制药的评级展望由负面上调至稳定。
惠誉表示,辉瑞制药2009年收购惠氏公司以来未能如约偿还债务,目前企业的债务水平已经与更高的信用评级不符。
辉瑞制药二季报数据显示,截至8月底,公司的债务总额为其息税、折旧及摊销前利润的1.5倍。
西安杨森两代理药品遭召回强生质量监管屡失守

两款产品本身质量 和安全性 没有 问题 ,而是在生产过程 中管理存在缺陷 ,召 回和停售 只是为了最大
可能 降低风险 的预防性措施 。 “ 由于在 中国楷莱有替代药品 ,因此 西安杨森会进行全面的召 回行为 , 而万珂在华暂时还没有替代 药 ,因此 目前是采取加强安全监管的措施 。 ”西安杨森公关部表示 , 目前 万珂全球 的 3 家工 厂分 别位于美 国、法 国和意大利 ,国内使用产 品全部从美 国工 厂进 口,后续 只需
Y
西 安杨 森两 代理药 品遭 召 回
强 生 质理局最新公告指 出 ,英 国 、法国药品监管机构和美 国食 品药品管理
局 (D ) 于 2 1 年 1 FA 01 1月 7日 1 1日对 B nV n s aoa r s 司 ( e e u b r o e 公 L ti 下称 “ V B L公 司” )在美 国的 生产场地进行 联合 G P ( 品生产质量管理规范)检查 ,发现其无菌灌装过程质量 管理存在缺陷 。 M 药
查 1 0项不合 格。 “ 6月的检查之后 ,1 月 的中期检查发现还有一些灌装工艺方 面的问题 ,目前 ” 在 1
也正在针对这些问题进行改进。 ”任 可 可 告 诉 记 者 。
3 1
B L公 司生产的楷莱 ( V 通用名 “ 盐酸多柔 比星脂质体注射液 ” 、万珂 ( ) 通用名 “ 注射用硼替佐
米” )在 我国均 已经上市使用 ,前者在临床上用 于治疗艾滋病相关的卡波氏肉瘤 ,后者则用于治疗多
发性骨髓瘤和套细胞淋 巴瘤 。西 安杨 森正是这两种药物的国 内进 口代理销售商 。国家药 监局 8日要 求西安杨森立 即按 照 《 药品召回管理办法》 的规定主动召 回市场上所有批号 的楷莱 ;立即停止销售 万珂 ,不再使用于新患者 。 “ 我们 目前对 楷莱和万珂分别实施召 回和停止 向新患者使用 的措施 ,但 具体涉及 的召 回数量 和所需要时 间,还没有最终的统计结果 。 ”西安杨森公关部负责人任可可就此事
辉瑞公司吸入性胰岛素Exubera重要历史事件回顾
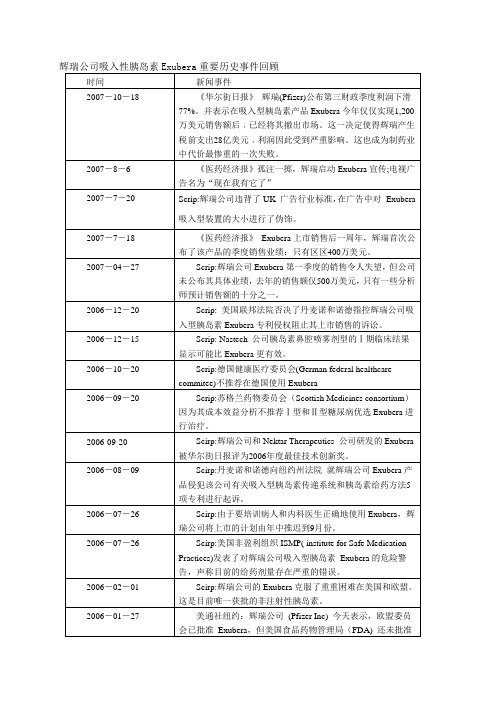
辉瑞公司吸入性胰岛素Exubera重要历史事件回顾时间新闻事件2007-10-18 《华尔街日报》辉瑞(Pfizer)公布第三财政季度利润下滑77%。
并表示在吸入型胰岛素产品Exubera今年仅仅实现1,200万美元销售额后﹐已经将其撤出市场。
这一决定使得辉瑞产生税前支出28亿美元﹐利润因此受到严重影响。
这也成为制药业中代价最惨重的一次失败。
2007-8-6 《医药经济报》孤注一掷,辉瑞启动Exubera宣传;电视广告名为“现在我有它了”2007-7-20 Scrip:辉瑞公司违背了UK 广告行业标准,在广告中对Exubera吸入型装置的大小进行了伪饰。
2007-7-18 《医药经济报》Exubera上市销售后一周年,辉瑞首次公布了该产品的季度销售业绩:只有区区400万美元。
2007-04-27 Scrip:辉瑞公司Exubera第一季度的销售令人失望,但公司未公布其具体业绩,去年的销售额仅500万美元,只有一些分析师预计销售额的十分之一。
2006-12-20 Scrip: 美国联邦法院否决了丹麦诺和诺德指控辉瑞公司吸入型胰岛素Exubera专利侵权阻止其上市销售的诉讼。
2006-12-15 Scrip: Nastech 公司胰岛素鼻腔喷雾剂型的Ⅰ期临床结果显示可能比Exubera更有效。
2006-10-20 Scrip:德国健康医疗委员会(German federal healthcarecommitee)不推荐在德国使用Exubera2006-09-20 Scrip:苏格兰药物委员会(Scottish Medicines consortium)因为其成本效益分析不推荐Ⅰ型和Ⅱ型糖尿病优选Exubera进行治疗。
2006-09-20 Scirp:辉瑞公司和Nektar Therapeutics 公司研发的Exubera被华尔街日报评为2006年度最佳技术创新奖。
2006-08-09 Scirp:丹麦诺和诺德向纽约州法院就辉瑞公司Exubera产品侵犯该公司有关吸入型胰岛素传递系统和胰岛素给药方法5项专利进行起诉。
2024年西妥昔单抗市场分析现状

2024年西妥昔单抗市场分析现状引言西妥昔单抗(Sutiximab)是一种具有靶向作用的免疫调节药物,主要用于治疗恶性肿瘤和自身免疫性疾病。
本文将对西妥昔单抗市场进行分析,包括市场规模、竞争对手和市场前景等。
市场规模西妥昔单抗作为一种创新性药物,其市场规模呈现稳步增长的趋势。
根据市场研究机构的数据,全球西妥昔单抗市场规模在2020年达到了X亿元。
预计在未来几年,西妥昔单抗市场将持续增长,预计到2025年将达到X亿元。
竞争对手目前,西妥昔单抗市场存在着激烈的竞争环境。
主要竞争对手包括:1.全球制药巨头A公司:该公司在西妥昔单抗的研发和生产方面拥有较大的优势,并已获得多个国际市场的批准。
2.B公司:B公司是一家国内制药公司,已成功将自主研发的西妥昔单抗推向市场,并取得了一定的市场份额。
3.C公司:C公司是一家新兴的生物医药企业,正在积极开展西妥昔单抗的研发工作,有望成为未来的竞争对手。
尽管存在激烈的竞争,但由于西妥昔单抗具有较高的疗效和安全性,仍有很大的市场需求,因此,市场份额的争夺将继续激烈。
市场前景西妥昔单抗在治疗恶性肿瘤和自身免疫性疾病方面表现出良好的疗效,具有广阔的市场前景。
随着人们对健康意识的提高和医疗水平的不断提升,对创新性药物的需求也在增加。
因此,西妥昔单抗市场将继续保持较快的增长速度。
此外,随着科技的不断发展和医学研究的深入,西妥昔单抗还有望在其他领域获得更多应用。
例如,一些初步研究已发现西妥昔单抗对其他类型的肿瘤和自身免疫性疾病也具有一定的治疗效果,这为西妥昔单抗的市场前景提供了更大的空间和机遇。
结论西妥昔单抗作为一种创新性药物,在全球市场上具有较大的市场规模和潜力。
尽管面临激烈的竞争,但由于其较高的疗效和安全性,仍有很大市场需求。
未来几年,西妥昔单抗市场有望继续保持快速增长,并在不同领域获得更多应用,进一步拓展市场前景。
(以上内容仅为分析市场现状,不构成投资建议。
)。
Abbott公司自愿终止西布曲明在美、加和澳洲的市场销售

高脂 质体药 物的稳定性 和保质期 。 期待 临床专家深 入探索抗肿瘤药 物脂质体 的临床评 价方法 ,根据脂质体药物 的特点发现其 临床应用 的规律 ,
以科 学 方 法 来 评 价 脂 质 体 药 物 的性 能 ,更 好 地 造 福 于 肿 瘤患 者。 参 考 文 献
[] Ba g ma 1 n h n AD,S a d s tn ih MM ,Wak n C.Dif so f t i sJ fu i n o
杂 志 ,2 0 ,2() 9 — 9 . 0 3 52 :10 12 [】 周 卫 , 吕琦 ,翁 帼 英 ,等 . 7 紫杉 醇 脂 质 体 在 大 鼠体 内 的药
动学 [ ] J .中国药科大学学 报 ,2 0 ,3 () 4 3 4 6 0 0 1 : 4 —4 . 6 [] 胡歌 ,王华庆 ,阎昭 ,等 . 8 长春新碱脂质 体 1 临床单 次 期 耐受性试验 [ ] J .中国新药杂志 ,2 0 ,1() 6 8 6 1 09 8 : 2—3. 7
【] A d ee L e s nS ,J re s nK . d a c ds a ge 9 n rsnT ,J n e S og ne A v n e rt is t e
i i s malc n e h a n lpo o a c rterpy :Pr b e nd p o p cso c ie o l msa r s e t fa tv
要在 体 内有足够 的滞 留时间 ,同时不仅 对肿瘤 细胞有 主 动 靶 向性 ,且 能在肿 瘤组 织 中适 时释放 出抗 肿瘤 药物 。 显然 ,目前 已上市 的脂质体药物均不具有上述所有特点 。
p l me im ie lrpa ltx lfr o y rc c la cia e o multo :To ct n f c c a in xiiya d e a y i
阿斯利康停止胆固醇药物临床试验

阿斯利康停止胆固醇药物临床试验*导读:制药业巨头阿斯利康宣布,前期的研究结果发现Crestor(瑞舒伐他汀钙)与安慰剂相比,可以降低心脏存在问题患者的发病率和死亡率,故阿斯利康已经停止了降胆固醇药物Crestor的临床试验JUPITER。
……美国FDA早在2003年8月根据临床试验结果,批准了Crestor(瑞舒伐他汀)上市。
临床试验结果显示,该药物可以降低总胆固醇、LDL-甘固醇以及甘油三酸酯水平,并可以升高HDL-甘固醇(有益甘固醇)水平。
该药物最常见的副作用包括肌肉疼痛、胃痛、恶心、便秘以及虚弱等。
2005年FDA发布了一项警告,声明服用Crestor的患者在同时服用其他他汀类药物的情况下,可出现横纹肌溶解(严重肌肉损伤)的不良反应。
该声明还表示,与其他已上市他汀类药物相比,使用Crestor的风险并未超过其他药物。
但要求修改药品标签,显著标识关于Crestor安全使用的用药信息,降低出现肌病/横纹肌溶解(严重肌肉损伤)的风险,尤其是在40mg高剂量情况下,更应关注用药安全。
而目前开展JUPITER临床试验,仅针对他汀类药物的初步预防作用,是在26个国家超过1200个地点同时开展的一项对瑞舒伐他汀进行评价的干预性试验。
该项试验设计用于评价Crestor在20mg/天剂量下,是否可以降低无症状心血管疾病患者的主要心血管事件的发生机率,是否可以降低正常LDL胆固醇(所谓不良胆固醇)和较高的C-反应蛋白(CRP)水平。
它是被称为GALAXY的Crestor全球系列临床试验的一部分,GALAXY在55个国家共纳入超过64000名患者。
该公司网站的一份声明表示,临床实验管理委员会以及独立数据检测委员会建议,临床试验JUPITER应该早些停止,因为已有明确迹象表明,与服用安慰剂的患者相比,服用Crestor患者在心血管方面的发病率和死亡率更低。
现在负责该试验的小组已赴各地停止试验程序,将对超过15000名患者进行最终评价。
培高利特因安全性问题撤出美国市场

发布日期20070428栏目化药药物评价>>临床安全性和有效性评价标题培高利特因安全性问题撤出美国市场作者赵建中许真玉部门正文内容审评四部八室赵建中许真玉美国FDA网站2007年3月29日发布消息,由于培高利特可导致患者心脏瓣膜损害,企业自愿将该产品撤出美国市场,撤市的产品包括原发厂礼来公司的产品和两家仿制产品。
关于培高利特存在的心脏瓣膜损害的风险,在2003年已经增加到美国上市产品说明书中,2006年又增加了黑框警告,2007年两篇发表在《新英格兰医学杂志》上的文章进一步证实了培高利特可增加二尖瓣、三尖瓣、主动脉瓣反流的风险。
根据有关文献:1. 服用多巴胺受体激动剂的帕金森病人中,进行了一项流行病学研究,并采用超声心动图进行检查。
发现与对照组比较,培高利特和卡麦角林与中重度瓣膜反流(3/4级)风险的增加有关。
研究中观察了90例对照组,和155例多巴胺受体激动剂组病人,这些病人多巴胺受体激动剂的暴露时间在12个月以上并且未服用其它药物:64例使用培高利特,49例使用卡麦角林,42例使用非麦角类激动剂(罗匹尼罗等)。
受试者主要为男性(平均年龄63岁)。
帕金森病病史和服用药物的时间培高利特组比卡麦角林组和非麦角类激动剂组更长(培高利特组62.7 +/- 28.3 月,卡麦角林组24.4 +/- 15.4月)。
培高利特组和卡麦角林组中重度瓣膜反流(3级或者4级)发生率(23.4%和28.6%)显著高于非麦角类激动剂(0%)和对照组(5.6%)。
非麦角类激动剂(0%)和对照组(5.6%)之间无统计学差异。
中重度二尖瓣和主动脉瓣反流的相关风险在培高利特组和卡麦角林组比对照组也显著升高。
心脏瓣膜反流的严重程度与培高利特和卡麦角林的平均累积剂量相关。
与对照组比较,培高利特和卡麦角林中重度瓣膜反流的相对风险(Zanettini et al, 2007)如下:2. 使用来源于英国General Practice Research Database (GPRD)的数据进行了一项基于人群的病例对照分析(n=31),使用培高利特和卡麦角林与增加新诊断的心脏瓣膜反流的风险有显著的相关性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[】 中华 内科杂 志编辑委员会 . 1 血液病 / 恶性肿瘤患者侵袭性 真 菌感染 的诊断标 准与 治疗 原则 ( 订版 )[ ] 中华 内 修 J. 科杂志 ,2 0 ,4 () 6 7 6 0 0 7 67 : 0 — 1.
[] B w E , L v r ir ,L s irN, e a .A t u g l 2 o J a e deeM u se t ni n a 1 f
a pe g lo i :Clni a r c i ui ln s o he I f ci us s r il s s i c lp a tce g de i e ft n e to
D sae oit o meia[ .C i Ifc D s 0 8 i ssS ce f e y A r c J] l net i,2 0 , n
患者的 II F 预防已开始使用泊沙康唑 。II F 确诊后 的治疗 , 临床几无争议 , 只要按照 II F 真菌感染 的种类和药敏结果 、 病情轻重 以及患者的脏器功能进行综合判断后 即可给药 。 临床最常见和最难 把握 的是经验 治疗 和先发治疗 的药物 选择 ,需考虑患者 的病 情情况 和经济条件 ,结合 医师 的 临床经验 ,同时参照有关 指南合理选 择药物 ,最基本 的 原则是选用广谱抗 II F 药物 ,并尽可能选 用不 良反应小 、 安全 的药物 。 如果患 者为拟 诊或者 临床诊 断为 II F 且病 原可疑 或 者有一定倾 向性 ,可 以根据感染病原 的可能性 给予 广谱 抗 真菌药 物。美 国 I S D A指南 建议 ,对 于非 粒缺 患者 的 可疑念珠 菌感染 ,推荐 选用氟康唑 、卡泊芬净 、米 卡芬 净或 阿尼芬净进行治疗 ,如果不能耐受 或无药则可选 用 A B或脂 质体 A B; 于粒缺 患者的可 疑念珠菌感 染 , m m 对 应 以卡泊 芬净 或脂 质体 A b为一 线选 择 ( a r 推荐级 别 最 高) ,也可选 用伏立康唑 、氟康唑或伊 曲康唑 ( 推荐级别 稍低 )_ 4 】 。对于持 续粒 缺发 热 、广谱 抗菌 药无 效 、可 疑 曲霉菌感染 的 II F 患者 ,I S D A推荐使 用 的经 验性治疗 药 物包括 A 、脂 质体 A 、伏立 康唑 、伊 曲康 唑和卡泊 mB mB 芬净 。 对 于拟诊 或者 临床诊 断 为 II F 、但感 染病 原完 全不 明的患者 ,抗真菌 药物 的选择需 更慎重 的综 合考虑 。在 B S ( 0 8 )和 E I 欧洲 白血 病感染 会议 ,2 0 CH 20 年 CL( 09 年 )的最 新 指 南 ( 参 见 ht: w . sg i l e. n 请 t / wb h u e n s o p/ w c di c 和 h p/w . m .g 的有关 指南 )中,均推荐应 以卡 t : we t r 上 t/ w b o 泊芬净或脂 质体 A mB作为一线药物 ,其 中卡泊芬净的推 荐级别很高 ,疗效与脂质体 A B相当而安全性更好 。同 m 属棘 白菌素类 药物 的米 卡芬净也获得 推荐 ,但 因临床 证 据较少而推荐级别较低 。伏立康唑在与脂质体 A B进行 a r
n urp ncp t ns: a dmie ,c nrl dt a J . e t ei ai t A rn o zd o t l il[ ] o e oe r
Ci f t i,2 0 ,4 () 14 — 0 1 l I e s 0 9 88 : 0 2 15 . n n cD
z r 司自愿终止西他生坦在全球的销售和临床试验 e/ 公
21 0 0年 1 2月 1 日,Pi r 司 就其 肺 动脉 高压 治 疗 药物 西他 生 坦 ( i x na/h l 发表 声 明称 : 0 fe 公 z sa e tn en) t T i 因存 在 不 能预
测 的严 重肝 损伤 、甚至 使患 者 因此 死亡 的严 重 副反 应 ,将从 即 日起 自愿 自全球 市场 上撤 出西他 生坦 ,同时 终止 正在 进 行 的
( 马培 奇 )
( 稿 日期 : 0 0 2 1 ) 收 2 1-1 - 1
上海医药
2 1年 01
第3 卷 2
第l 期
6
teIfci sD sae o iyo eia[ ] l net h net u i ssSce f o e t Am r c J .Ci Ifc n
D s 0 9 85 5 3 5 5 i,2 0 ,4 ( ): 0 - 3 .
[ Was J n i i E ,D n igD ,e a . ram n f 5 ] l T ,A as e J e nn W h s t Tet e t 1 o
所 有西他 生坦 相关 临床试 验。 西他 生坦 属 选择 性 内皮 素 A 受体拮 抗 剂 ,2 0 0 6年 8月起 先 后在 欧 盟和 澳 、加 等地 区和 国家 获得 批; 隹,用于 一 日 1次
口服 治疗 肺动脉 高压 患者 以改 善活动 能 力。据 查 ,西他 生坦没 有获 准进 入过 中 国市场 ,也 未在 中国进 行过 相关 临床试 验。
【பைடு நூலகம் P p a G,K u m n A,A d s 4 a ps P af a f C n e D,e a . l ia p a t e t 1 C i c l rc c n i
g dei sfrt e ma a e e to a di a i :2 09 u a eb ui l ne h n g m n fc n diss o 0 pd t y
临崩 导 滞 _
药物 。 抗真菌谱包括念珠菌和 曲霉菌等 , 对新生 隐球菌 、 但 镰霉菌和毛霉菌无活性 。 4) 氟胞嘧 啶 : 抗真菌谱窄 , 主要覆 盖念珠 菌和新生 隐球 菌等 。由于单 用该 药易诱 导真 菌 耐药 ,故 治疗 II F
时需联合用药 。 2 . 常 用抗 II .2 2 F 药物 的选择 通常选用氟康唑预防 II F ,而国外 对造血 干细胞移植
C ne ,20 ,9 (2 : 2 0 34 . a cr 0 2 41) 3 3 - 2 6
[] C r o n e 3 o d n i rC,P u a a t s C, Ma r , e a . mp rc l u yS t 1 E i a i
v ru r e t e a t u g l h r p o ih rs e s s p e mp i n i n a e a y f rh g — ik, f b i v f t e rl e,
4( : 2—6 . 63 3 7 3 0 )
( 稿 日期 : 2 1 - 5 1 收 0 0 0 - 4)
一■一一一一■●一一一一■一一一■●一一一●■■■一一一一一 !一!蔓翼笪■一一一一一一一一一一一■一一一■一■一一一一一一一一一一■一一●一■一■■一一一一一●一一■■●一一●一一 一●■一一一■一■一一■■一■■一一■一一■一■■一一一i
的临床对 照研究 中失利 ,伊 曲康唑则 存在与 三唑类药 物 的交叉 耐药性 ,故此 两药在 II F 经验治疗 中均 只获得 较 低级别 的推荐 ,但在 国内指南 中仍都 获得 了推荐 。氟康 唑因抗 真菌谱 窄 ,一般不用 于 II F 经验治疗 。 结合 上述 3 临床 实例 ,例 1 个 患者 因痰涂片和痰 培 养提示存在 白色念珠 菌 ,虽然可能属定植 ,未必是感染 , 但倾 向于 白色念珠菌感 染 ,故选用较 为广谱 的伊 曲康唑 治疗 ; 2患者为粒缺合并感染患者 ,因真菌类型不明 , 例 故选 用广谱 和较 为 安全 的卡 泊芬净 进行 II F 经验 治疗 ; 例 3患者治疗 属早期经验 治疗 ,考虑 到异基 因造血于 细 胞移植 后 曲霉菌感 染发生 率较 高 ,在 积极进行 c T检查 和G M试验 的同时给予 对 曲霉菌感染 疗效较 优的伏立康 唑治疗 ,后 G 试验强 阳性结果证 实 曲霉菌感 染可能性 M 大。以上 3 患者治疗均获得 了较为满意 的疗效。 例
p o h lx sfrs v r l e to e i h moh r p e i in s: r p ya i o e e e yn u rp n c c e t e a y r cp e t
A m t aayio n o i d cnrl dcii lr l J . ea nls f ad m z — ot l l c i s[ ] s r e o e n a ta
