高中化学物质、方程式大总结
高中化学方程式归纳总结大全

高中化学方程式归纳总结大全
一、酸-碱反应:
1、金属与碱反应:金属与强碱反应,产生金属离子和氢气,其反应方
程式为:M+2OH--->M(OH)2+H2↑
2、无机酸与碱反应:无机酸与碱反应,发生交换反应,产生对应的
盐和水,其反应方程式为:HX+M(OH)Y--->M(X)Y+H2O
3、盐酸反应:盐酸与碱反应,会发生水解反应,产生碱性盐和氢气,其反应方程式为:HCl+M(OH)2--->MCl+H2O+H2↑
4、有机酸与碱反应:有机酸与碱反应会发生碱溶解反应,产生对应
的盐和水,其反应方程式为:R-COOH+M(OH)Y--->RCOO-M+H2O
二、碱与金属盐反应:
1、金属碱与氧化物反应:金属碱与氧化物反应,产生金属盐和水,
其反应方程式为:M(OH)2+MO--->M2O+H2O
2、金属碱与酸反应:金属碱与酸反应,产生金属盐和水,其反应方
程式为:M(OH)2+HX--->MX+H2O
3、金属碱与溶液反应:金属碱与溶液反应,产生金属盐和水,其反
应方程式为:M(OH)2+MX--->M2X+H2O
三、水的溶解反应:
1、非金属氧化物溶解:非金属氧化物溶解于水,可以产生质子和氧
离子,其反应方程式为:MO+H2O--->H3O++M
2、金属氧化物溶解:金属氧化物溶解于水,会产生金属离子和氢氧离子,其反应方程式为:M2O+2H2O--->2H3O++2M。
高中化学方程式总结(共325个)

高中化学方程式化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 412、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHS O S O H NaCl 442(浓) 15、↑+−→−+∆HCl S O Na NaCl NaHS O 42416、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324S O H 15PO H 6P Cu 5O H 24CuS O 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀)27、O H 31S O K S O Fe 9S O Cr S O H 31O Fe 6O Cr K 2423423424243722+++→++)()( 28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃 43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆49、2CS C S −−→−+高温50、22S O O S −−→−+点燃51、O H 3S O K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 2253、2222S O 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足)55、↓+−−→−+S 3O H 2S O S H 2222点燃56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224S O H CuS S H CuS O +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合)63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeS O FeS S O H 2442(稀) 65、3222S O H O H S O ⇔+66、3O V 22SO 2O SO 252∆−−→←+ 67、4223S O H O H S O →+68、↑++→+22424232S O O H S O Na S O H S O Na69、O H S O Na NaOH 2S O 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2S O 2322+↓→+)( 72、23232HS O Ca O H CaS O S O )(→++73、O H 2S 3S H 2S O 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222S O 8O Fe 2O 11FeS 4高温78、3O V 22SO 2O SO 252∆−−→←+ 79、4232S O H S O O H →+第四节 硫酸 硫酸盐80、O H 2S O 2CO S O H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2S O 3S O H 2S 2242+↑−→−+∆(浓) 82、O H 2S O PO H S O H P 224342+↑+−→−+∆(浓) 83、O H 2S O S S O H S H 22422++−→−+∆(浓) 84、O H 2S O CuS O S O H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaS O S O H BaCl 4422+↓→+86、NaCl 2BaS O S O Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na S O H CO Na91、42232S O H 2O S O H 2→+92、42232S O Na 2O S O Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3S O Fe S O H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H S O Na S O Br S O H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓) 97、O H 11C 12O H C 2SO H 11221142+−−−→−浓第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃2102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuS O O H 2Na 2)( 第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)( 120、O H S O NaCl HCl NaHS O 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃22123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
高中化学方程式总结7篇

高中化学方程式总结7篇篇1一、非金属单质(F2,Cl2,O2,S,N2,P4,C,Si)二、非金属氧化物(SO2,SO3,CO2,CO,NO2,N2O,P4O6,P4O10)三、金属氧化物(Na2O,Na2O2,MgO,Al2O3,FeO,Fe2O3,CuO)四、盐(氯化物、硫酸盐、硝酸盐、碳酸盐、硅酸盐)五、碱(NaOH,KOH,Ba(OH)2,NH3·H2O)六、酸(HCl,H2SO4,HNO3,H3PO4)在化学学习和实验中,我们经常接触到各种化学方程式。
掌握化学方程式是理解化学反应原理、进行化学计算和解决化学问题的关键。
以下是对高中化学方程式的总结:一、非金属单质氟气与水的反应:2F2 + 2H2O = 4HF + O2;氯气与氢氧化钠的反应:2Cl2 + 2NaOH = NaCl + NaClO + H2O;氧气的还原反应:O2 + 2H2 = 2H2O;硫的燃烧反应:S + O2 = SO2;氮气与氧气的反应:N2 + O2 = 2NO;磷与氧气的反应:4P + 5O2 = 2P2O5;碳的燃烧反应:C + O2 = CO2;硅与氧气的反应:Si + 2O2 = SiO2。
二、非金属氧化物二氧化硫与氧气的反应:2SO2 + O2 = 2SO3;二氧化碳与水的反应:CO2 + H2O = H2CO3;一氧化碳与氧气的反应:CO + O2 = CO2;二氧化氮与水的反应:3NO2 + H2O = 2HNO3 + NO;四氧化三铅与氧气的反应:4PbO3 + O2 = 6PbO。
三、金属氧化物钠与氧气的反应:4Na + O2 = 2Na2O;过氧化钠与水的反应:2Na2O2 + 2H2O = 4NaOH + O2↑;氧化镁与水的反应:MgO +H2O = Mg(OH)2;氧化铝与水的反应:Al2O3 + 3H2O = 6HAlO;氧化亚铁与氧气的反应:4FeO + O2 = 6FeO;氧化铁与氧气的反应:3FeO + O2 = 3Fe;氧化铜与水的反应:CuO + H2O = Cu(OH)2。
(完整版)高中有机化学方程式总结
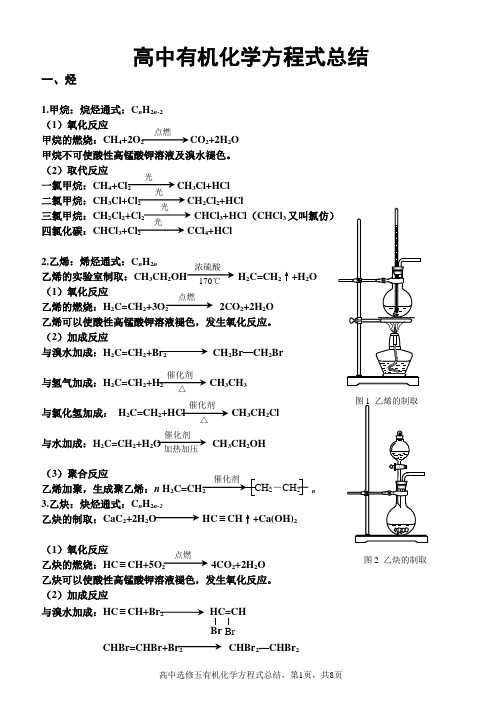
高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯:烯烃通式:C n H 2n乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2 n3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr点燃光光光光浓硫酸170℃ 点燃催化剂△催化剂加热加压 2-CH 2点燃图2 乙炔的制取Br 催化剂△与氢气加成:HC ≡CH+H 2 H 2C=CH2与氯化氢加成:HC ≡CH+HCl CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯:苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高中化学必背方程式大全

高中化学必背方程式大全高中化学中的方程式是学生必须掌握的基本内容之一,以下是一份化学方程式的大全,希望对你有所帮助。
1.物质转化反应方程式化学方程式描述了物质之间的转化过程。
以下是常见的物质转化反应方程式。
(1)金属和非金属的反应氧化反应:2Mg + O2 → 2MgO2Na + Cl2 → 2NaCl3Fe + 4H2O → Fe3O4 + 4H2(2)酸和碱的反应酸碱中和反应:HCl + NaOH → NaCl + H2OH2SO4 + 2NaOH → Na2SO4 + 2H2O2HCl + Ca(OH)2 → CaCl2 + 2H2O(3)氧化还原反应单质氧化反应:2Mg + O2 → 2MgO2Fe + 3Cl2 → 2FeCl3Cu + 2AgNO3 → Cu(NO3)2 + 2Ag(4)不同酸的反应强酸和弱酸中和反应:HCl + CH3COOH → CH3COOH + HClHCl + HF → HClF22HClO4 + 3H2SO3 → Cl2 + H2SO4 + 4H2O (5)氧化还原反应还原反应:2KClO3 → 2KCl + 3O22Na + Cl2 → 2NaCl2MnO4- + 5C2O42- + 16H+ → 2Mn2+ + 10CO2 + 8H2O 2.气体反应方程式气体反应方程式描述了与气体有关的反应过程。
(1)气体生成反应CO2 + 2H2 → CH4 + H2O2H2 + O2 → 2H2OC6H12O6 → 2C2H5OH + 2CO2(2)气体燃烧反应CH4 + 2O2 → CO2 + 2H2OC3H8 + 5O2 → 3CO2 + 4H2OC4H10 + 6.5O2 → 4CO2 + 5H2O(3)酸和碱气体反应NH3 + HCl → NH4ClHI + NaOH → NaI + H2OH2S + 2KOH → K2S + 2H2O(4)气体的溶解反应CO2 + H2O → H2CO3SO2 + H2O → H2SO3NO2 + H2O → HNO33.酸碱中和反应方程式酸碱中和反应是化学中的一种重要反应类型,以下是一些常见的酸碱中和反应方程式。
高中化学方程式大全(完整版)

高中化学方程式大全(完整版) 高中化学方程式总结第1页共21页第一章卤素第一节氯气1、2Na + Cl2 → 2NaCl2、Cu + Cl2 → CuCl23、2Fe + 3Cl2 → 2FeCl3 (点燃)4、H2 + Cl2 → 2HCl5、2P + 3Cl2 → 2PCl3 (点燃)6、PCl3 + Cl2 → PCl57、Cl2 + H2O → HCl + HClO8、2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O9、Ca(ClO)2 + CO2 + H2O → CaCO3↓ + 2HClO10、2NaOH + Cl2 → NaClO + NaCl + H2O (点燃)11、MnO2 + 4HCl → MnCl2 + 2H2O + Cl2↑12、2KMnO4 + 16HCl (浓) → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O13、2HClO → 2HCl + O2↑第二节氯化氢14、NaHSO4 + HCl↑ → NaCl + H2SO415、NaCl + H2SO4 (浓) → Na2SO4 + HCl↑16、2NaCl + H2SO4 (浓) → Na2SO4 + 2HCl↑ (14、15结合)17、HCl + AgNO3 → AgCl↓ + HNO318、NaCl + AgNO3 → AgCl↓ + NaNO319、KCl + AgNO3 → AgCl↓ + KNO320、2HCl + CaCO3 → CaCl2 + H2O + CO2↑第三节氧化还原反应21、CuO + H2 → Cu + H2O22、C + 4HNO3 → CO2↑ + 4NO2↑ + 2H2O23、4Zn + 10HNO3 (极稀) + NH4NO3 → 4Zn(NO3)2 + NH4Cl + 3H2O24、11P + 15CuSO4 + 24H2O → 5Cu3P + 6H3PO4 +15H2SO425、KClO3 + 6HCl (浓) → 3Cl2↑ + KCl + 3H2O26、4Mg + 10HNO3 (极稀) + NH4NO3 → 4Mg(NO3)2 + NH4Cl + 3H2O27、K2Cr2O7 + 6Fe3O4 + 8H2SO4 → 3Fe2(SO4)3 +Cr2(SO4)3 + K2SO4 + 8H2O31H2SO4和9Fe(2SO4)3和2K2SO4反应生成Cr(2SO4)3.这是一种化学反应方程式。
(完整版)高中化学物质反应方程大全全解

(完整版)高中化学物质反应方程大全全解---一、酸碱中和反应1. 强酸与强碱反应- 方程式:HCl + NaOH → NaCl + H2O- 反应类型:酸和碱的中和反应- 说明:盐(NaCl)和水(H2O)是中和反应的产物。
2. 强酸与强碱生成盐的反应- 方程式:H2SO4 + 2NaOH → Na2SO4 + 2H2O- 反应类型:酸和碱生成盐的反应- 说明:硫酸钠(Na2SO4)和水(H2O)是该反应的产物,反应为中和反应。
---二、氧化还原反应1. 燃烧反应- 方程式:C3H8 + 5O2 → 3CO2 + 4H2O- 反应类型:燃烧反应- 说明:燃料丙烷(C3H8)与氧气(O2)反应生成二氧化碳(CO2)和水(H2O)。
2. 金属与非金属氧化物的反应- 方程式:2Zn + O2 → 2ZnO- 反应类型:金属与非金属氧化物的反应- 说明:锌(Zn)与氧气(O2)反应生成氧化锌(ZnO)。
---三、沉淀反应1. 两种溶液反应生成沉淀的反应- 方程式:BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl- 反应类型:两种溶液反应生成沉淀的反应- 说明:硫酸钡(BaSO4)是沉淀反应的产物。
2. 酸与碳酸盐反应生成的沉淀- 方程式:2HCl + CaCO3 → CaCl2 + CO2↑ + H2O- 反应类型:酸与碳酸盐反应生成的沉淀- 说明:二氧化碳(CO2)和水(H2O)是该反应的产物,同时生成氯化钙(CaCl2)以及产生的白色沉淀。
---四、还原析气反应1. 金属与酸的反应生成的气体- 方程式:2HCl + Zn → ZnCl2 + H2↑- 反应类型:金属与酸的反应生成的气体- 说明:氢气(H2)是还原析气反应的产物。
2. 金属与水反应生成的气体- 方程式:2Na + 2H2O → 2NaOH + H2↑- 反应类型:金属与水反应生成的气体- 说明:氢气(H2)是还原析气反应的产物。
高中有机化学方程式总结(默写版)

高中有机化学方程式总结(默写版) 高中有机化学方程式默写一、烃1.甲烷烷烃通式:1) 氧化反应甲烷燃烧产生二氧化碳和水:CH4 + 2O2 -。
CO2 + 2H2O甲烷不能使酸性高锰酸钾溶液和溴水褪色。
2) 取代反应一氯甲烷:CH3Cl二氯甲烷:CH2Cl2三氯甲烷:CHCl3四氯化碳:CCl42.乙烯烯烃通式:乙烯的制取:1) 氧化反应乙烯燃烧产生二氧化碳和水:C2H4 + 3O2 -。
2CO2 + 2H2O乙烯能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H4 + Br2 -。
C2H4Br2 与氢气加成:C2H4 + H2 -。
C2H6与氯化氢加成:C2H4 + HCl -。
C2H5Cl 与水加成:C2H4 + H2O -。
C2H5OH 3) 聚合反应乙烯加聚,生成聚乙烯。
3.乙炔乙炔的制取:1) 氧化反应乙炔燃烧产生二氧化碳和水:C2H2 + 5/2O2 -。
2CO2 + H2O乙炔不能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H2 + Br2 -。
C2H2Br2与氢气加成:C2H2 + H2 -。
C2H4与氯化氢加成:C2H2 + HCl -。
C2H3Cl3) 聚合反应氯乙烯加聚,得到聚氯乙烯。
乙炔加聚,得到聚乙炔。
4.苯苯的同系物通式:1) 氧化反应苯燃烧产生二氧化碳和水:2C6H6 + 15O2 -。
12CO2 + 6H2O苯能使溴水和酸性高锰酸钾溶液褪色。
2) 取代反应①苯与溴反应②硝化反应3) 加成反应5.甲苯1) 氧化反应甲苯燃烧产生二氧化碳和水:C7H8 + 9O2 -。
7CO2 + 4H2O甲苯能使溴水褪色和酸性高锰酸钾溶液褪色。
2) 取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯(TNT)。
二、烃的衍生物烃的衍生物的重要类别和主要化学性质:类别通式代表性物质分子结构特点主要化学性质卤代烃 R—X 溴乙烷 C-X键有极性,易断裂 1.取代反应 2.消去反应醇 R—OH 乙醇有C-O键和O-H键,有极性;-OH与链烃基直接相连 1.与钠反应,生成醇钠并放出氢气 2.氧化反应:生成乙醛 3.脱水反应:乙醚、乙烯 4.酯化反应酚 -OH 苯酚 -OH直接与苯环相连取代反应醛 O || CH3-C-H C=O双键有极性,具有不饱和性氧化反应:生成酮羧酸 COOH 乙酸有C=O双键和C-OH单键,有极性 1.与碱反应,生成盐 2.酯化反应酯 R-COOR' 乙酸乙酯 C=O双键和O-C单键,有极性 1.水解反应:生成醇和羧酸 2.酸催化下的加成反应注:删除了明显有问题的段落,对每段话进行了小幅度的改写。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学有机物总结一、物理性质甲烷:无色无味难溶乙烯:无色稍有气味难溶乙炔:无色无味微溶(电石生成:含H2S、PH3 特殊难闻的臭味)苯:无色有特殊气味液体难溶有毒乙醇:无色有特殊香味混溶易挥发乙酸:无色刺激性气味易溶能挥发二、实验室制法甲烷:CH3COONa + NaOH →(CaO,加热) → CH4↑+Na2CO3 注:无水醋酸钠:碱石灰=1:3固固加热(同O2、NH3)无水(不能用NaAc晶体)CaO:吸水、稀释NaOH、不是催化剂乙烯:C2H5OH →(浓H2SO4,170℃)→ CH2=CH2↑+H2O注:V酒精:V浓硫酸=1:3(被脱水,混合液呈棕色)排水收集(同Cl2、HCl)控温170℃(140℃:乙醚)碱石灰除杂SO2、CO2碎瓷片:防止暴沸乙炔:CaC2 + 2H2O → C2H2↑ + Ca(OH)2注:排水收集无除杂不能用启普发生器饱和NaCl:降低反应速率导管口放棉花:防止微溶的Ca(OH)2泡沫堵塞导管乙醇:CH2=CH2 + H2O →(催化剂,加热,加压)→CH3CH2OH (话说我不知道这是工业还实验室。
)注:无水CuSO4验水(白→蓝)提升浓度:加CaO 再加热蒸馏三、燃烧现象烷:火焰呈淡蓝色不明亮烯:火焰明亮有黑烟炔:火焰明亮有浓烈黑烟(纯氧中3000℃以上:氧炔焰)苯:火焰明亮大量黑烟(同炔)醇:火焰呈淡蓝色放大量热四、酸性KMnO4&溴水烷:都不褪色烯炔:都褪色(前者氧化后者加成)苯:KMnO4不褪色萃取使溴水褪色五、重要反应方程式烷:取代CH4 + Cl2 →(光照)→ CH3Cl(g) + HClC H3Cl + Cl2 →(光照)→ CH2Cl2(l) + HClCH2Cl + Cl2 →(光照)→ CHCl3(l) + HClCHCl3 + Cl2 →(光照)→ CCl4(l) + HCl现象:颜色变浅装置壁上有油状液体注:4种生成物里只有一氯甲烷是气体三氯甲烷= 氯仿四氯化碳作灭火剂烯:1、加成CH2=CH2 + Br2 → CH2BrCH2BrCH2=CH2 + HCl →(催化剂) → CH3CH2ClCH2=CH2 + H2 →(催化剂,加热) → CH3CH3 乙烷CH2=CH2 + H2O →(催化剂,加热加压) → CH3CH2OH 乙醇2、聚合(加聚)nCH2=CH2 →(一定条件) → [-CH2-CH2-]n(单体→高聚物)注:断双键→两个―半键‖高聚物(高分子化合物)都是【混合物】炔:基本同烯。
苯:1.1、取代(溴)◎+ Br2 →(Fe或FeBr3)→◎-Br + HBr注:V苯:V溴=4:1长导管:冷凝回流导气防倒吸NaOH除杂现象:导管口白雾、浅黄色沉淀(AgBr)、CCl4:褐色不溶于水的液体(溴苯)1.2、取代——硝化(硝酸)◎ + HNO3 →(浓H2SO4,60℃)→◎-NO2 + H2O注:先加浓硝酸再加浓硫酸冷却至室温再加苯50℃-60℃【水浴】温度计插入烧杯除混酸:NaOH硝基苯:无色油状液体难溶苦杏仁味毒1.3、取代——磺化(浓硫酸)◎ + H2SO4(浓) →(70-80度)→◎-SO3H + H2O2、加成◎ + 3H2 →(Ni,加热)→○(环己烷)醇:1、置换(活泼金属)2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑钠密度大于醇反应平稳{cf.}钠密度小于水反应剧烈2、消去(分子内脱水)C2H5OH →(浓H2SO4,170℃)→ CH2=CH2↑+H2O3、取代(分子间脱水)2CH3CH2OH →(浓H2SO4,140度)→ CH3CH2OCH2CH3 (乙醚)+ H2O(乙醚:无色无毒易挥发液体麻醉剂)4、催化氧化2CH3CH2OH + O2 →(Cu,加热)→ 2CH3CHO(乙醛) + 2H2O现象:铜丝表面变黑浸入乙醇后变红液体有特殊刺激性气味酸:取代(酯化)CH3COOH + C2H5OH →(浓H2SO4,加热)→ CH3COOC2H5 + H2O (乙酸乙酯:有香味的无色油状液体)注:【酸脱羟基醇脱氢】(同位素示踪法)碎瓷片:防止暴沸浓硫酸:催化脱水吸水饱和Na2CO3:便于分离和提纯卤代烃:1、取代(水解)【NaOH水溶液】CH3CH2X + NaOH →(H2O,加热)→ CH3CH2OH + NaX注:NaOH作用:中和HBr 加快反应速率检验X:加入硝酸酸化的AgNO3 观察沉淀2、消去【NaOH醇溶液】CH3CH2Cl + NaOH →(醇,加热)→ CH2=CH2↑ +NaCl + H2O注:相邻C原子上有H才可消去加H加在H多处,脱H脱在H少处(马氏规律)醇溶液:抑制水解(抑制NaOH电离)六、通式CnH2n+2 烷烃CnH2n 烯烃/ 环烷烃CnH2n-2 炔烃/ 二烯烃CnH2n-6 苯及其同系物CnH2n+2O 一元醇/ 烷基醚CnH2nO 饱和一元醛/ 酮CnH2n-6O 芳香醇/ 酚CnH2nO2 羧酸/ 酯七、其他知识点1、天干命名:甲乙丙丁戊己庚辛壬癸2、燃烧公式:CxHy + (x+y/4)O2 →(点燃)→ x CO2 + y/2 H2O CxHyOz + (x+y/4-z/2)O2 →(点燃)→ x CO2 + y/2 H2O3、反应前后压强/ 体积不变:y = 4变小:y < 4变大:y > 44、耗氧量:等物质的量(等V):C越多耗氧越多等质量:C%越高耗氧越少5、不饱和度(欧买嘎~)=(C原子数×2+2 – H原子数)/ 2双键/ 环= 1,三键= 2,可叠加6、工业制烯烃:【裂解】(不是裂化)7、医用酒精:75%工业酒精:95%(含甲醇有毒)无水酒精:99%8、甘油:丙三醇9、乙酸酸性介于HCl和H2CO3之间食醋:3%~5%冰醋酸:纯乙酸【纯净物】10、烷基不属于官能团高一化学方程式`部分`总结1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na + O2 △ Na2O2钠与氧气反应:4Na + O2 = 2Na2O8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O210、钠与水反应:2Na + 2H2O = 2NaOH + H2↑11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑13、氧化钙与水反应:CaO + H2O = Ca(OH)214、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3 △ Fe2O3 + 3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3?H2O = 2Al(OH)3↓ + 3(NH3)2SO422、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O24、氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2O25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl226、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl327、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO329、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓32、氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl333、氯气与金属铜反应:Cu + Cl2 点燃CuCl234、氯气与金属钠反应:2Na + Cl2 点燃2NaCl35、氯气与水反应:Cl2 + H2O = HCl + HClO36、次氯酸光照分解:2HClO 光照2HCl + O2↑37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O39、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO340、漂****长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO41、二氧化硫与水反应:SO2 + H2O ≈ H2SO342、氮气与氧气在放电下反应:N2 + O2 放电2NO43、一氧化氮与氧气反应:2NO + O2 = 2NO244、二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂2SO346、三氧化硫与水反应:SO3 + H2O = H2SO447、浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑48、浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2 ↑+ 2SO2↑ + 2H2O49、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑50、稀硝酸与铜反应:3Cu + 8HNO3(稀) △ 3Cu(NO3)2 + 4H2O + 2NO↑51、氨水受热分解:NH3?H2O △ NH3↑ + H2O52、氨气与氯化氢反应:NH3 + HCl = NH4Cl53、氯化铵受热分解:NH4Cl △ NH3↑ + HCl↑54、碳酸氢氨受热分解:NH4HCO3 △ NH3↑ + H2O↑ + CO2↑55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NH3↑ + NaNO3 + H2O56、氨气的实验室制取:2NH4Cl + Ca(OH)2 △ CaCl2 + 2H2O + 2NH3↑57、氯气与氢气反应:Cl2 + H2 点燃2HCl58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O59、SO2 + CaO = CaSO360、SO2 + 2NaOH = Na2SO3 + H2O61、SO2 + Ca(OH)2 = CaSO3↓ + H2O62、SO2 + Cl2 + 2H2O = 2HCl + H2SO463、SO2 + 2H2S = 3S + 2H2O64、NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2O65、Si + 2F 2 = SiF466、Si + 2NaOH + H2O = Na2SiO3 +2H2↑67、硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉Si + 2CO(石英沙)(焦碳)(粗硅)粗硅转变为纯硅:Si(粗)+ 2Cl2 △ SiCl4SiCl4 + 2H2 高温Si(纯)+ 4HCl。
