用Excel进行溶剂萃取工艺计算
简述溶剂萃取的常见工艺流程及其特点

简述溶剂萃取的常见工艺流程及其特点溶剂萃取是一种常见的分离和提纯技术,广泛应用于化工、制药、食品等领域。
其基本原理是利用溶剂与混合物中的某些成分具有不同的亲和力,从而实现分离和提纯。
下面将简述溶剂萃取的常见工艺流程及其特点。
一、常见工艺流程1.单级溶剂萃取单级溶剂萃取是最简单的溶剂萃取方法,其流程包括混合物与溶剂的混合、搅拌、分离和回收。
该方法适用于分离混合物中只有少量目标成分的情况。
2.多级溶剂萃取多级溶剂萃取是在单级溶剂萃取的基础上进行改进的方法,其流程包括多次使用不同的溶剂进行萃取,从而提高目标成分的纯度。
该方法适用于分离混合物中含有多种目标成分的情况。
3.逆流萃取逆流萃取是一种连续的溶剂萃取方法,其流程包括混合物与溶剂的混合、搅拌、分离、回收和再次混合。
该方法适用于分离混合物中含有多种目标成分且需要高纯度的情况。
4.超临界萃取超临界萃取是一种利用超临界流体作为溶剂进行萃取的方法,其流程包括将混合物与超临界流体混合、加热、分离和回收。
该方法适用于分离高沸点、高分子量的物质。
二、特点1.高效性溶剂萃取是一种高效的分离和提纯技术,能够在较短的时间内实现高纯度的目标成分。
2.灵活性溶剂萃取方法可以根据不同的混合物和目标成分进行调整,具有较高的灵活性。
3.成本低溶剂萃取方法的成本相对较低,因为其所需的设备和溶剂都比较常见和便宜。
4.易于控制溶剂萃取方法的操作比较简单,易于控制,因此适用于大规模生产。
5.环保性溶剂萃取方法相对于其他分离和提纯技术来说,对环境的影响较小,因为其所需的溶剂可以回收和再利用。
总之,溶剂萃取是一种常见的分离和提纯技术,其常见工艺流程包括单级溶剂萃取、多级溶剂萃取、逆流萃取和超临界萃取。
其特点包括高效性、灵活性、成本低、易于控制和环保性。
5.2液液萃取过程计算

5.2-
7
5 液液萃取
5.2 液液萃取过程的计算
式中 cx 是与萃取相主体中溶质浓度成平衡的萃余相溶质浓度。
*
边界条件为: 在 z= 0: V x c xF = V x c xo − E x
dc y / dz = 0
dc x / dz = 0
dc x dz
dc y dz
(5-31) (5-32) (5-33) (5-34)
组分 k 留在萃取相的 (相对 )分数:
(5-4)
1 − ΦU =
ue − 1 ueN +1 − 1
(5-5)
1/ 2 式中: u e = [u N (u1 + 1) + 0.25] − 0.5 (5-6)
计算 ε 1 和 ε N 需要 L1、 LN, 假定两相线性分布, 由总物料衡算确定。 在塔顶:
H =∫ =
x A1
(1 − xA )lm dxA L ⋅ SK oxα (1 − xA )lm (1 − xA )( xA − x* A)
L SK oxα (1 − xA )lm
yA2 y A1
∫
xA 2
x A1
(1 − xA )lm dxA (1 − xA )( xA − x* A)
H =∫ =
(5-27)
ε
( NTU ) oy
⎤ ⎡⎛ y A1 − mx A1 ⎞ ⎟ ( ) ε ε ln ⎢⎜ 1 − + ⎥ ⎜ y − mx ⎟ A1 ⎠ ⎝ A2 ⎦ ⎣ = 1− ε
(5-28)
一般情况的积分计算采用图解法或数值积分的方法计算 (5- 19)的积分值。 二、 轴向扩散模型 活塞流模型没有考虑轴向混合或扩散, 与实际情况偏差较大。 轴向扩散模型假定: ①相际连续逆流传质传质; ②每一相中都存在着从高浓度到低浓度的传递过程, 相内的扩散通量服从 费克定律, 用连续相和分散相的轴向扩散系数两个参数描述。 萃取塔中连续相的轴向混合由扩散模型得到较好描述。但分散相的轴向混
萃取过程的计算

萃取过程的计算
2. 解析法
对于原溶剂B与萃取剂S不互溶的物系,若在操作范围内,以质
量比表示的分配系数K 为常数,则平衡关系可表示为
Y=KX
(8-16
式中 Y——萃取相E中溶质A的质量比分数;
X——萃余相R中溶质A的质量比分数;
K——相组成以质量比分数表示时的分配系数。
即分配曲线为通过原点的直线。在此情况下,当错流萃取的各
萃取过程的计算
图8-14 三级错流萃取三角形坐标图解
萃取过程的计算
(3)以R1为原料液,加入纯的萃取剂S,依杠杆规则找出 两者混合点M2,按与(2)类似的方法可以得到E2和R2,此即第二 个理论级分离的结果。
(4)以此类推,直至某级萃余相中溶质的组成等于或小于规 定的组成xR为止,重复作出的联结线数目即为所需的理论级数。
(1)由已知的相平衡数据在等腰直角三角形坐标图中绘出溶解度曲线 和辅助线,如图8-11所示。
(2)在三角形坐标的AB边上根据原料液的组成确定点F,根据萃取剂 的组成确定点S(若为纯溶剂,则为顶点S),联结点F、S,则原料液与 萃取剂的混合物系点M必落在FS连线上。
萃取过程的计算
(3)由已知的萃余相组成xR,在图上确定点R,再由点R利用辅助曲 线求出点E,作R与E的联结线,显然RE线与FS线的交点即为混合液的组 成点M。
(8-12)
联立求解式(8-6)和式(8-12) 得
萃取过程的计算
同理,可得萃取液和萃余液的量E′、R′,即 上述诸式中各股物流的组成可由三角形相图直接读出。
萃取过程的计算
二、 多级错流萃取的计算
单级萃取所得的萃余相中往往还含有较多的溶质,为进一步降低萃 余相中溶质的含量,可采用多级错流萃取。其流程如图8-13所示。
溶剂萃取工艺流程

溶剂萃取工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classicarticles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!溶剂萃取是一种常用的分离和提纯化合物的工艺方法,通常应用于化工、制药、食品等行业。
液液萃取(溶剂萃取).

11 液液萃取(溶剂萃取)Liquid-liquid extraction(Solventextraction)11.1 概述一、液液萃取过程:1、液液萃取原理:根据液体混合物中各组分在某溶剂中溶解度的差异,而对液体混合物实施分离的方法,也是重要的单元操作之一。
溶质 A + 萃取剂 S——————〉S+A (B) 萃取相 Extract分层稀释剂 B B + A (S…少量) 萃余相 Raffinate(残液)一般伴随搅拌过程 => 形成两相系统,并造成溶质在两相间的不平衡则萃取的本质:液液两相间的传质过程,即萃取过程是溶质在两个液相之间重新分配的过程,即通过相际传质来达到分离和提纯。
溶剂 extractant(solvent)S 的基本条件:a、S 不能与被分离混合物完全互溶,只能部分互溶;b、溶剂具有选择性,即溶剂对A、B两组分具有不同溶解能力。
即(萃取相内)(萃余相内)最理想情况: B 与 S 完全不互溶 => 如同吸收过程: B 为惰性组分相同:数学描述和计算实际情况:三组分分别出现于两液相内,情况变复杂2 、工业萃取过程:萃取不能完全分离液体混合物,往往须精馏或反萃取对萃取相和萃余相进行分离,而溶剂可循环使用。
实质:将一个难于分离的混合物转变为两个易于分离的混合物举例:稀醋酸水溶液的分离:萃取剂:醋酸乙酯3 、萃取过程的经济性:取决于后继的两个分离过程是否较原液体混合物的直接分离更容易实现( 1 )萃取过程的优势:(与精馏的关系)a、可分离相对挥发度小或形成恒沸物的液体混合物;b、无相变:液体混合物的浓度很低时,精馏过于耗能(须将大量 B 汽化);c、常温操作:当液体混合物中含有热敏性物质时,萃取可避免受热;d、两相流体:与吸附离子交换相比,操作方便。
( 2 )萃取剂的选择——萃取过程的经济性a、分子中至少有一个功能基,可以与被萃取物质结合成萃合物;b、分子中必须有相当长的烃链或芳香环,可使萃取剂和萃合物容易溶解于有机相,一般认为萃取剂的分子量在350-500之间较为合适。
溶剂萃取法

溶剂萃取法
溶剂萃取法(一般称:萃取法),是指利用溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从另一溶剂所组成的溶液里提取出来的操作方法。
例如,用四氯化碳从碘水中萃取碘,就是采用萃取的方法。
萃取分离物质的操作步骤是:把用来萃取(提取)溶质的溶剂加入到盛有溶液的分液漏斗后,立即充分振荡,使溶质充分转溶到加入的溶剂中,然后静置分液漏斗。
待液体分层后,再进行分液.如要获得溶质,可把溶剂蒸馏除去,就能得到纯净的溶质。
萃取的机理既有物理的溶解作用,又有化学的配合作用,是一个复杂的物理溶解过程。
按照萃取机理的不同,可分为五种类型:简单分子萃取、中性配合萃取、酸性配合萃取、离子缔合萃取和协同萃取。
4.3 萃取计算

萃余相 R
4.3.1 单级萃取
1、原溶剂和萃取剂部分互溶的体系(杠杆规则)
原料 A+B 萃取剂 S
萃取相 E
S用量的计算:
S = F(MF / MS)
R、E的计算:
萃余相 R
A E’m E’
R+E=F+S
R / E = ME / MR R’、E’组成计算:
F
B R’ R M
Y2 =
Y3 =
( B / S 1 )( X
( B / S 1 )( X
2
- X 1)
- X 2)
3
··· ··· ···
YN = ( B / S 1 )( X
N
- X
N
1
)
(4-8c)
12.3.2 多级错流萃取
(1)图解法
Y 1 = - ( B / S 1 )( X 1 - X F )
Y1
E1 E2 E3
(2)解析法
平衡线 Y=mX
1
Y 1 = mX
Y 1 = - ( B / S 1 )( X 1 - X F )
Y1
Y2 Y
E2 E3 E4
E1
E
mS X1 = X
F
/( B
1
+ 1)
萃取因数
令 b1=mS1/B ,则X1=XF/( b1 +1)
Y1 = mX
F
Y3 Y4
0
/( b1 + 1 )
/( b 1 + 1 )
例4-4 含丙酮20%(质量百分率,下同)的水溶液,流量 F=800kg/h,按错流萃取流程,以1,1,2-三氯乙烷萃取其中的丙酮, 每一级的三氯乙烷流量S1=320kg/h。要求萃余液中的丙酮含量降到 5%以下,求所需的理论级数和萃取相、萃余相的流量。操作温度为 25℃,此温度下的平衡数据示于下表。
8-3-2萃取计算
2.18
1.02 0.44
55.97
71.80 99.56
41.85
27.18 0
附表2
xA 5.96 yA 8.75
联结线数据
10.0 15.0 14.0 21.0 19.1 27.7 21.0 32.0 27.0 40.5 35.0 48.0
解: (1)由题中数据作溶解度曲线和辅助曲线; (2)由题丙酮含量40%,确定F点位置; (3)连结FS,有杠杆规则确定M1点位置; (4)试差法求R1与E1位置:以M1点为轴,转动 联结线R1与E1,当点T恰好落在辅助曲线上时, 停止转动,此时该直线与溶解度曲线的交点就是 所求的R1与E1; (5)杠杆规则求R1的质量: 以E1为支点:
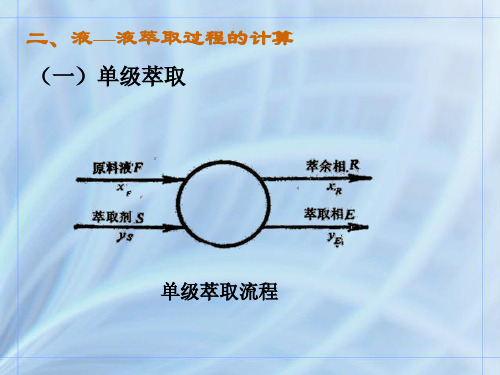
二、液—液萃取过程的计算 (一)单级萃取
单级萃取流程
实际上,对于某一个萃取分离任务,通 常已知料液量F及其组成xF,且规定了 萃余相的浓度xR ,求萃取剂用量S,萃 取相的量E和组成yE,及萃余相的量R。
也就是,已知: (1)料液量F;
P
(2பைடு நூலகம் F点相图位置;
(3)萃余相R点的位置。 (1)萃取剂用量S; 求: (2)萃余相的量R;
(3)萃取相的量E;
(4)萃取相E的相图位置。
F+S
物料衡算: 杠杆规则求 各流股的量:
M
E R
E’ R’
F+S=M=E+R
S×MS = F×MF E×ER = M×MR
(以M点为支点)
(以R点为支点)
E’×E’R’ = F×FR’ (以R’点为支点)
溶质A物料衡算:
FxF = MxM = EyE + RxR= E’yE’ + R’xR’
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
计算机应用用Excel 进行溶剂萃取工艺计算胡 亮(昆明理工大学化学工程系 昆明 650051)胡 亮 男,36岁,博士,从事化学工程教学和科研工作。
E 2mail :lhu @云南省应用基础研究基金(98B004R )和昆明理工大学科研发展基金(98234)资助项目2000212204收稿,2001204211修回摘 要 介绍了溶剂萃取工艺计算的Excel 电子表格方法,无需手工绘图和编程就可方便地得到计算结果。
这种方法可用于教学和工程计算。
关键词 Excel 溶剂萃取 化学工艺计算Abstract This paper introduces a method of the extraction process calculating by using excel spreadsheet ,which is easy 2to 2use without calculating or graphing in manual and without programming.The method can be applied in teaching and engineering calculating.K ey w ords Excel ,S olvent extraction ,Chemical process calculating溶剂萃取是化工基本分离方法之一,已广泛应用于无机化工、有机化工、石油、生化、环保和分析等广阔的生产领域。
其工艺计算方法有代数公式法、图解法和逐级计算法[1~3]。
代数公式法要求萃取体系溶剂不互溶,各级萃取因子和所用的有机溶剂量相等;图解法仅限于三元体系,且手工绘图繁琐和不精确,甚至有些情况下需要试差法作图;逐级计算法借助于计算机可解决复杂萃取体系的计算,精度高、速度快,方便共享。
目前,可视化技术使编程变得轻松,各种应用程序更是方便了计算机使用。
Excel 已为人们所熟知,具有卓著的图表和数值计算功能,并将编程变成了方便形象的菜单和工具栏操作,可充分发挥计算机的高效特性[4]。
因此,为了方便教学和具体应用计算,本文特介绍萃取工艺计算的Excel 电子表格方法。
1 计算方法溶剂萃取分离通常采用“错流”与“逆流”两种多级萃取方式。
错流萃取是将一次萃取后的萃余水相再次和新鲜萃取剂接触进行萃取,而逆流萃取过程是将多次萃取操作串联起来,实现水相与有机相的逆流操作。
逐级计算法原理为逐级交替利用平衡关系式和物料衡算式进行浓度计算。
对N 级逆流(错流)萃取过程任意一级i 来说,体系内被萃组分有两个方程式:第一个是分配平衡关系式,也就是被萃组分离开级的浓度y i 与离开该级的萃余相组成x i 之间的关系:y i =f (x i )或y i =αi x i (1)式中x i =(x 1,i ,x 2,i ,…,x m ,i ),m 为独立组分数,αi 为第i 级分配系数。
第二个是物料衡算式,分为错流和逆流两种情况。
对于逆流萃取过程:Lx i-1+Vy i+1=Lx i+Vy iy i+1=(LΠV)(x i-x i-1)+y i或x i=(VΠL)(y i+1-y i)+x i-1(2)式中,L为料液量,V为萃取剂用量,yi+1和x i-1分别为第i级进口两物流的组成。
(2)式就是逆流萃取的级操作线方程。
若用xf 和y分别表示原料液和萃取剂的初始浓度,即x=x f,y N+1=y0,对第1级到第i级作物料衡算,得到:y i+1=(LΠV)x i+[y1-(LΠV)x f]或x i=(VΠL)(y i+1-y1)+x f(3)对第i级到第N级作物料衡算,则得:y i+1=(LΠV)x i+[y0-(LΠV)x N]或x i=(VΠL)(y i+1-y0)+x N(4) (3)和(4)式是图解法的基础,即为多级逆流萃取流程的操作线方程。
对于错流萃取过程:Lxi-1+V i y0=Lx i+V i y iy i=-(LΠV i)(x i-x i-1)+y0或x i=-(V iΠL)(y i-y0)+x i-1(5)式中Vi为第i级萃取剂用量,其余符号与逆流过程计算相同。
由已建立的关系式,可以在Excel中进行多级萃取流程工艺计算。
首先要确定平衡式(1)的具体形式,这可利用各种活度系数关联式求得[1,3],但是可能得到的是平衡数据表,此时将平衡数据输入到Excel工作表中,插入图表,添加趋势线,可得拟合关系式。
然后在新工作表中,输入已知量、未知量初始值和各关系式。
对于错流萃取,如图1所示x列输入已知值和未知量初始值,x′列输入(5)式计算出的xi,Δx列计算x i与其计算值x′i之差。
y列输入已知值和(1)式,第二行为已知值。
启动工具菜单中的“单变量求解”逐级计算浓度分布,其中设置Δxi为目标单元格,目标单元格的值取零,可变单元格取xi。
当级数N给定,限定某一组成的最终含量求萃取剂加量时,则需用工具菜单中的“规化求解”进行求解,并以中间各级浓度和萃取剂加量Vi为可变单元格,这可避免图解法中的试差法作图。
对于逆流萃取,如图2所示xi和y i的已知值和相应的公式输入两列单元格中,其中x列输入物料衡算式,y列输入分配平衡式。
由于原料液和萃取剂组成可知,当萃余液组成要求在某一数值以下求理论级数时,则y1可由物料衡算求得:y1=(LΠV)(x f-x N)+y0。
但是当级数已知,求浓度分布时,要求得y1就必须用试差法设定x N。
因此物料衡算式宜采用不含y1的(2)或(4)式,并且图1 错流萃取计算的Excel输入表格示例图2 逆流萃取计算的Excel输入表格示例应从(x N ,y 0)反算到第一级,这不同于由点(x f ,y 1)开始作梯级的图解法。
输入公式时,起初一行公式输入后,以下公式用自动填充功能完成。
第二行为已知值。
求解过程中需要用试差法确定x N ,可启动工具菜单中的“单变量求解”自动完成,当组分数增加时,则利用工具菜单中的“规化求解”自动求解。
2 计算实例例1 以含苯甲酸0.2g ΠL 的苯液对苯甲酸水溶液进行错流萃取,使水中苯甲酸浓度由1.5g ΠL 降到0.2g ΠL ,每级所用的苯液体积皆为初始水液的一半,求理论级数和每级的萃余液浓度。
物系的平衡数据如下:表1 苯甲酸(A)2水(B)2苯(S)平衡数据x A Πg ・L -10.1040.4560.707 1.32 1.56y A Πg ・L -10.182 2.45 6.1218.224.5 x A 为苯甲酸在水中的浓度;y A 为苯甲酸在苯中的浓度先求得两相平衡关系拟合式:y A =8.7564x A 2+2.1228x A 然后按照图1将已知值输入表格,逐行计算各级浓度。
设未知量x i 初始值为0.2,并作为“单变量求解”工具中的可变单元格,计算得每级的萃余液浓度为:x A1=0.41g ΠL ,x A2=0.18g ΠL 。
可见2级已达到要求。
例2 用25(wt )%T BP 2煤油溶液通过多级逆流萃取过程提取钍。
已知原料液内含钍为48g ΠL ,新鲜T BP 萃取剂中不含钍,相比V ΠL =2,钍的平衡数据如表2所示。
现要求水相出口钍的浓度必须小于0.4g ΠL ,求理论级数。
表2 TBP 2煤油萃取钍时的两相平衡数据y Πg ・L -11.587 5.6011.2716.821.0224.829.5x Πg ・L -10.8262.67 5.239.7514.4017.5024 酸度:4m ol ΠL HNO 3其两相平衡关系拟合式:y =1.545×10-3x 3-8.750×10-2x 2+2.443x 为了提高低浓度下的拟合精度,根据萃取分配原理,在稀溶液中分配系数为常数,因而为线性关系。
x 在0~5.23g ΠL 范围内拟合得:y =2.139x表3 例2Excel 表格计算结果N 43210x 0.170.89417.1y 00.36 1.918.4723.9248为了求理论级数,先设定x N =0.4g ΠL ,按照图2在表格中输入已知值和公式,其中操作线方程用(4)式,平衡式先用线性式,自动填充计算到x 超过5.23g ΠL 时改用第二式。
当x 值刚好超过x f =48g ΠL 为83.887g ΠL 时,求得理论级数为4。
为了求相应的浓度分布值,启动工具菜单中的“单变量求解”,并设x f =83.887g ΠL 所在单元格为目标单元格,其值x f 设为48。
x 4=0.4g ΠL 所在单元格为可变单元格。
计算结果见表3。
(下转第56页)入量多于1.5(wt)%,有助于木材染成浅色;而少于1.5(wt)%时,有助于木材染成深色。
木材的密度决定了染色的难易程度。
密度较小的中、软阔叶材较适合酸性染料染色。
参考文献[1] K ollmann F F P.Principles of W ood Science&T echnologyⅡ.S pringer2verleg New Y ork,1975:83~135.[2] R owell R M.The Chem istry of S olid W ood.W ashington,D.C:American Chem ical S ociety,1984:42~212.[3] 北京林学院主编.木材学.北京:中国林业出版社,1983:22~25.[4] 南京林学院主编.木制品生产工艺学.北京:中国林业出版社,1983:319~325.[5] 上海市纺织工业局《染料应用手册》编写组编.染料应用手册(第二分册).北京:纺织工业出版社,1983:32~38[6] 周春隆.酸性染料及酸性媒介染料.北京:化学工业出版社,1988:29~46[7] 杨锦宗.染料的分析与剖析.北京:化学工业出版社,1987:32~105.[8] 张江鸣.工业产品着色与配色技术.北京:中国轻工业出版社,1999:171~448.[9] 罗良才.云南经济木材志.昆明:云南人民出版社,1989:40~108.・信息服务・招收博士研究生及招聘博士后段雪教授现任长江学者奖励计划特聘教授,北京化工大学博士生导师,可控化学反应科学与技术基础教育部重点实验室主任和应用化学研究所所长。
主要研究方向为:(1)超分子结构层柱型无机功能材料的插层组装;(2)新型催化材料合成及应用;(3)无机功能材料基础与应用基础研究。
同时,还注重边缘学科及交叉学科的研究。
实验室现承担30余项国家级重点科研项目,取得了一批具有显示度的成果。
段雪教授领导的实验室与法国、英国、德国等国家的高等院校及研究机构保持着密切的学术联系并开展了卓有成效的合作,现与法国Pascal大学的国家研究中心联合培养双学位博士研究生。
