实验报告:蟾蜍坐骨神经干动作电位引导及传导速度测定
实验3-蟾蜍坐骨神经干电生理实验

实验3 蟾蜍坐骨神经干电生理实验【摘要】目的运用电生理实验技术测定蛙类坐骨神经干的单相、双相动作电位和其中A类纤维冲动的传导速度,并观察机械损伤、药物对神经兴奋和传导的影响。
方法采用RM6240微机生物信号处理系统,通过电生理的方法来测定蛙坐骨神经干的单相、双相动作电位的电位和时程以及其中A类纤维冲动的传导速度。
并采用夹伤神经和加不同药物等处理措施,记录一定刺激强度下坐骨神经动作电位的大小变化,从而分析坐骨神经干动作电位的影响因素及机制。
结果动作电位的传导速度为31.76±3.63 m/s,阈刺激强度为0.28±0.03 V,最大刺激强度为1.21±0.36 V。
中枢端引导动作电位正相和负相振幅分别为3.15±1.87mV和 2.11±1.46mV,末梢端引导动作电位正负相振幅分别为7.04±2.01 mV和 3.89±1.46 mV,与中枢端引导时的动作电位振幅比有显著性差异(p<0.01);夹伤神经干后,动作电位振幅为8.49±2.48 mV,时程为 1.73±0.40 ms,与末梢端引导时正相波时程比有显著性差异(p=0.002<0.01)。
引导电极间距离分别等于10mm、20mm和30mm时,动作电位正相振幅:A110为 7.07±1.87 mV,A120为 9.57±3.08 mV,A130为 9.75±3.33 mV,负相振幅:A210为 3.87±1.19 mV, A220为 5.35±2.23 mV,A230为 4.44±2.39 mV,A120、A130分别与A110比均有显著性差异(p<0.05),A220与A210比有显著性差异(p<0.05),A230与A210以及A220与A230比没有显著性差异(p>0.05)。
生理实验报告!

生理实验报告!蟾蜍坐骨神经干动作电位的引导、传导速度和兴奋不应期的测定【实验目的】1. 观察蟾蜍坐骨神经动作电位的基本波形,加深理解兴奋传导的概念,理解可兴奋性在兴奋过程中的变化过程;2. 进一步掌握坐骨神经—腓神经标本的制备方法与引导动作电位的方法;3. 进一步熟悉实验室里仪器设备的操作。
【实验原理】1. 神经干动作电位是神经兴奋的客观标志。
当神经受到有效刺激时,处于兴奋部位的膜外电位负于静息部位,当动作电位通过后,兴奋处的膜外电位又恢复到静息时的水平。
神经干兴奋过程所发生的这种膜电位变化称神经复合动作单位。
如果将两个引导电极置于神经干表面时(双极引导),动作电位将先后通过两个引导电极,可记录到两个相反的电位偏转波形,称为双向动作电位;2. 神经纤维兴奋的标志是产生一个可传播的动作电位。
测定神经干上的神经冲动的传导速度,可以了解神经的兴奋状态。
在示波器上测量动作电位传导一定距离所耗费的时间,便可计算出兴奋的传导速度;3. 神经与肌肉等可兴奋组织的兴奋性在一次兴奋过程中可发生一系列变化,及绝对不应期、相对不应期、超常期和低常期,组织的兴奋性才可恢复。
为了测定神经干在兴奋过程中的兴奋性变化,可用双刺激法检查刺激引起的兴奋阙值和电位变化,即可观察到神经组织兴奋性的变化过程。
【实验对象】蟾蜍【实验器材】蛙类手术器械,BL-410生物信号记录分析系统,神经屏蔽盒,任氏液(林格液)等。
【实验步骤】制备蟾蜍坐骨神经-腓神经标本,并放入神经屏蔽盒内;(一)双相动作电位1.打开BL-410?实验项目?神经肌肉实验?神经干动作电位引导?记录出双相动作电位;2.由小到大改变刺激强度,记录阈强度和最大刺激强度;3.观察双相动作电位波形,测量最适刺激强度时的潜伏期、时程和波幅; (二)引导出最大刺激强度时的动作电位波形1.BL-410仪器操作:实验项目?神经肌肉实验?神经干动作电位传导速度测定?输入两电极之间的距离分别用潜伏期法和潜峰法测量其传导速度;2.潜伏期法:测量第一个通道动作电位潜伏期的时间(t),输入刺激电极到第一个引导电极间的距离(S),屏幕右上角显示传导速度和根据速度的公式计算传导速度:v=S/t;3.潜峰法:测量两个通道电位的动作电位的波峰间的时间差,为(t2-t1),测量并输入两对引导电极间的距离为(S2-S1),屏幕右上角显示传导速度和用公式计算传导速度:v=(S2-S1)/(t2-t1)。
4神经干动作电位的引导及神经兴奋传导速度的测定

4神经干动作电位的引导及神经兴奋传导速度的测定西安交通大学医学院教案, 引导蟾蜍坐骨神经动作电位,并观察其基本波形(包括双相和单相动作电位)。
, 学习和掌握神经干动作电位传导速度测定的原理和方法。
, 学习和掌握蟾蜍坐骨神经-腓神经标本制备方法。
, 复习讲解神经干动作电位和神经纤维动作电位的区别、神经干动作电位形成的过程及神经干兴奋传导速度的测定原理等。
, 制备坐骨神经—腓神经标本。
, 引导单、双相动作电位及测定兴奋传导速度。
, 神经干双相动作电位的形成机制。
, 兴奋传导速度的测定原理。
【】1. 引导蟾蜍坐骨神经动作电位,并观察其基本波形(包括双相和单相动作电位)。
2. 学习和掌握神经干动作电位传导速度测定的原理和方法。
3. 学习和掌握蟾蜍坐骨神经-腓神经标本制备方法。
【】动作电位是神经细胞兴奋的客观标志,当神经纤维或神经干受到有效刺激时,必然会产生可传导的动作电位,也称为神经冲动。
由于神经干动作电位是许多单根神经纤维动作电位的复合,所以它的特征不同于单根神经纤维的动作电位。
本实验采用离体细胞外记录法,记录神经干兴奋时两个记录电极之间的电位变化。
动作电位可沿神经纤维进行双向传导,其传导速度取决于纤维直径、内阻、有无髓鞘等因素。
通过测定动作电位传导的距离和时间,可算出动作电位在神经纤维上的传导速度。
【】1. 动物蛙或蟾蜍。
2. 试剂和药品任氏液3. 装置和器材计算机、蛙类手术器械、神经屏蔽盒、直尺、圆规、培养皿。
【】1. 神经干动作电位的引导1)制备坐骨神经-腓神经标本制备方法与制备坐骨神经-腓肠肌标本基本相同,只是当把坐骨神经游离至膝关节后,在腓肠肌一侧继续分离腓神经至足趾,用线结扎,并在结扎线远端剪断。
将制备好的坐骨神经-腓神经标本浸入盛有任氏液的培养皿内备用。
2)将神经标本置于神经屏蔽盒的电极上。
将神经的近中枢端置于刺激电极一侧,外周端置于记录电极侧。
3)进入BL-410生物信号采集、处理系统,单击菜单栏中实验项目,在肌肉、神经实验中选择神经干动作电位的引导。
动物生理实验报告

实验名称:蟾蜍坐骨神经干复合动作电位(CAP)的测定实验目的:1. 确定蟾蜍坐骨神经干复合动作电位(CAP)的临界值和最大值。
2. 测定蟾蜍坐骨神经干CAP的传导速度。
3. 确定蟾蜍坐骨神经干CAP的不应期(相对不应期和绝对不应期)。
实验材料:1. 实验动物:蟾蜍(Bufo bufo gargarizans)2. 实验器材:生物信号采集系统RM6240,刺激电极,记录电极,接地电极,标本盒,手术器械,剪刀,镊子,刀片,生理盐水,酒精棉球等。
实验方法:1. 蟾蜍坐骨神经标本的制作:- 双毁髓处死蟾蜍后,剥去皮肤,暴露腰骶丛神经。
- 游离大腿肌肉之间的坐骨神经干及其下行到小腿的两个分支:胫神经和腓神经。
- 三段结扎,剪去无关分支后离体。
- 注意保持神经湿润。
2. 神经标本的连接:- 将神经搭于标本盒内,保证神经与电极充分接触。
- 中枢端接触刺激电极S1和S2,外周端接触记录电极R1-R2,之间接触接地电极。
3. 刺激输出线的连接:- 刺激输出线两夹子分别连接标本盒的刺激电极S1和S2。
- 插头接生物信号采集系统RM6240的刺激输出插口。
4. 信号输入线的连接:- 信号输入倒显得红色和绿色夹子分别连接记录电极(绿色夹子在前,引导出正向波形,即出现的第一个波峰向上)。
- 黑色夹子连接接地电极,插头接通道1。
5. 实验步骤:- 设置刺激参数:刺激频率、刺激强度、时间间隔等。
- 记录蟾蜍坐骨神经干复合动作电位(CAP)的波形。
- 逐渐增加刺激强度,观察CAP波形的变化。
- 确定CAP的临界值和最大值。
- 逐渐增加刺激强度,观察CAP传导速度的变化。
- 确定CAP的传导速度。
- 逐渐增加刺激强度,观察CAP不应期的变化。
- 确定CAP的相对不应期和绝对不应期。
实验结果:1. CAP临界值和最大值:- 当刺激强度为1.0 mA时,CAP的临界值为0.6 mV。
- 当刺激强度为1.5 mA时,CAP的最大值为1.2 mV。
蟾蜍坐骨神经干动作电位的引导 (自动保存的)
蟾蜍坐骨神经干动作电位的引导、传导速度和兴奋性不应期的测定一、实验目的1、熟悉仪器设备的操作。
2、掌握神经干动作电位的引导及传导速度的测定方法。
3、测定神经干不应期,理解可兴奋组织的兴奋性在兴奋过程中的变化过程。
二、实验原理1、将两个引导电极置于神经干表面时,动作电位将先后通过两个电极引导处,可记录到电位偏转波形。
2、在示波器上测量动作电位传导一定距离所耗费的时间,可计算出兴奋的传导速度。
3、神经与肌肉等可兴奋组织的兴奋性在一次兴奋过程中可发生一系列变化,即绝对不应期、相对不应期、超常期和低常期,组织的兴奋性才逐渐恢复。
可先给一个条件刺激以引起兴奋,然后再用另一检验性刺激在前一兴奋的不同时相给予刺激,检查神经对检验性刺激反应的兴奋阈值以及所引起的动作程度,即可观察到神经组织兴奋性的变化过程。
三、实验对象:蟾蜍。
四、实验器材:蛙类手术器械,BL-410生物信号记录分析系统,神经屏蔽盒,任氏夜等。
五、实验步骤1、制备蟾蜍坐骨神经干标本(1)脊髓捣毁法处死蟾蜍,剪除躯干上部和内脏,注意勿损伤到坐骨神经,仅留下下后肢、骶骨、脊柱和坐骨神经。
(2)剥皮:握住脊柱断面(不要触碰神经),剥掉蟾蜍的皮肤。
(3)游离坐骨神经:沿脊柱一侧用玻璃探针分离坐骨神经,将其结扎并剪断。
再将坐骨神经大腿部分从坐骨神经沟中游离出来,将坐骨神经一直游离到腘窝处。
(4)游离腓神经,在此过程中动作要轻,切勿损伤神经。
2、仪器连接。
3、实验观察。
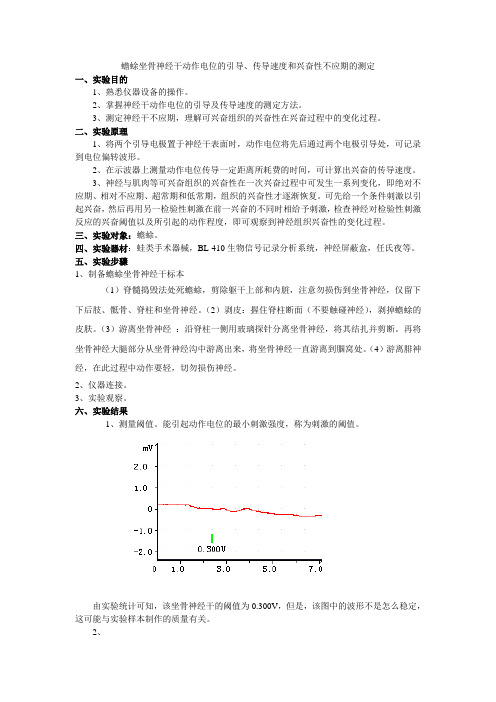
六、实验结果1、测量阈值。
能引起动作电位的最小刺激强度,称为刺激的阈值。
由实验统计可知,该坐骨神经干的阈值为0.300V,但是,该图中的波形不是怎么稳定,这可能与实验样本制作的质量有关。
2、(1)(2)(3)(4)图(1)为潜峰法测得的神经干动作电位的传导速度,两个通道的动作电位波峰的时间差为t2-t1=0.6ms,两对引导电极间的距离为S2-S1=1.8cm.屏幕上显示的传导速度为28.3m/s,利用公式计算的传导速度v=(S2-S1)/(t2-t1)=30m/s.图(2)为双相动作电位图。
蟾蜍坐骨神经干动作电位传导速度和兴奋性不应期的测定实验报告

神经干双向动作电位的引导传导速度及不应期的测定组员:陈良鹏肖瑶伍思静袁果曼罗冰清实验目的:观察蟾蜍坐骨神经动作电位的基本波形,掌握坐骨神经制备方法与引导动作电位的方法,理解与刺激和最大刺激强度的概念测定潜伏期时程和波幅,学会通过潜伏期法和潜峰法测定神经冲动的传导速度,通过测定神经干不应期理解兴奋性在兴奋过程中的变化过程。
实验对象:蟾蜍实验药品和器材:蛙类手术器械,BL-410生物信号记录分析系统,神经屏蔽盒,任氏液等。
实验原理:1、神经动作电位是神经兴奋的客观标志。
当神经受到有效刺激时,处于兴奋部位的膜外电位负于静息电位;当动作电位通过后,兴奋处的膜外电位又恢复到静息时水平。
神经干兴奋过程所发生的膜电位变化称神经复合动作电位。
如果将两个引导电极置于神经干表面时(双极引导),动作电位将先后通过两个引导电极处,可记录到两个相反的电位偏转波形,称为双向动作电位。
2、神经纤维兴奋的标志是产生一个可传播的动作电位。
测定神经干上的神经冲动的传导速度,可以了解神经的兴奋状态。
在示波器上测量动作电位传导一定距离所耗费的时间,便可计算出兴奋的传导速度。
3、神经与肌肉等可兴奋组织兴奋性在一次兴奋过程中可发生系列变化,即绝对不应期相对不应期超常期和低常期,组织的兴奋性才逐渐恢复。
为了测定神经干在兴奋过程中的兴奋性变化,可先给一个条件刺激以引起神经兴奋,然后再用另一检验性刺激,检查神经对检验性刺激反应的兴奋阈值以及所引起的动作电位(AP)幅度,即可观察到神经组织兴奋性的变化过程。
在本次实验中,主要观察的是不应期的变化,而非整个兴奋性的周期性变化。
实验对象:蟾蜍实验步骤及方法:1.坐骨神经—腓神经标本的制备。
2.将标本放入神经屏蔽盒,(注意刺激电极端为神经干的中枢端)。
3.仪器连接。
4.BL-410的操作。
实验内容:1、刺激坐骨神经时诱发产生的动作电位由在最适刺激强度时动作电位原图上进行区间测量可知,潜伏期为0.32ms,时程t1为 1.92ms ,波幅为11.08mV。
蟾蜍坐骨神经干动作电位传导速度和兴奋性不应期的测定

蟾蜍坐骨神经干动作电位传导速度和兴奋性不应期的测定【实验目的】:1. 熟悉两栖类动物的手术实验操作2. 学习制备蟾蜍坐骨神经干标本3. 掌握测定神经干动作电位传导速度的方法4. 掌握兴奋性不应期的测定方法【实验对象】: 蟾蜍【实验结果】:1.潜伏期概念: 潜伏期是指从刺激开始到神经干产生动作电位前伪迹所用的一段时间. 如图1,潜伏期为0.64ms.2.时程概念: 时程是指从神经干产生动作电位到恢复原状的一段时间。
如图2,时程为2.02ms.3.幅值概念: 幅值是指从波峰到波谷的数值。
如图3可知: 幅值=6.48-(-4.96)=11.44mv.4.神经干动作电位的传导速度潜伏期是指从刺激开始到神经干产生动作电位前伪迹所用的一段时间.故一通路的潜伏期t=0.58ms.做实验时记录的输入刺激的电极到第一个引导电极间的距离s=0.8cm. 所以传导速度v=s/t=13.79m/s.5.总不应期概念:总不应期是指当两个刺激的间隔逐渐缩短时,第二个刺激引起的动作电位的幅度刚好开始降低时,两个刺激的间隔时间即为总不应期,如图5,总不应期t1=19.00ms.6。
绝对不应期概念:绝对不应期是指在组织受到刺激发生兴奋后的一个较短的时间内,无论给予多么强大的刺激,都不能产生新的兴奋的时期。
如图6,即为绝对不应期t2=1.00ms.7。
相对不应期概念:相对不应期是指,在绝对不应期之后,神经干所产生的动作电位有所恢复,用较强的刺激可使神经干产生新的兴奋,这一时期即为相对不应期。
所以,相对不应期=总不应期—绝对不应期,即,相对不应期t3=19.00—1.00=18.00ms.。
蟾蜍实验报告

蟾蜍的解剖与观察生命科学院张茜 111070094一、实验目的意义两栖动物绝大多数都是对人类有益的,例如消灭害虫、作药用资源等等。
蟾蜍作为医学、生理学重要的实验动物则使用更为广泛。
通过观察两栖类外形、皮肤、消化、呼吸、泄殖和循环等系统,了解两栖动物z 在生理学、药理学、毒理学等实验中常用组的准确取材。
重点:了解在摄食方式、营养、呼吸、排泄、生殖及血液循环器官系统的形态特征。
难点:理解两栖动物了解两栖动物由水生发展到陆地生活的各个器官结构与功能的适应性。
二、实验对象的获得与麻醉获得途径主要是由野外捕获或从特种养殖场购买(如牛蛙养殖场)。
抓取方法: 抓住其后腿,有经验者也可抓住其身体或借助一块布来抓,因蛙体表粘滑且蟾蜍体表有毒液分泌。
麻醉:两栖类皮肤有渗透性,放入含麻醉剂的溶液中就很容易麻醉。
0.1%的甲磺酸—三卡因(ms—222)水溶液在几分钟内即可麻醉动物,所需时间因身体大小而异。
也可用呼吸性麻醉剂,将蛙或蟾蜍放进玻璃罩或标本瓶内,同时放人浸有乙醚的棉花,几分钟后,即可发生作用。
三、实验操作与观察(一)外形观察将活蛙(或蟾蜍)静伏于解剖盘内,观察蛙(蟾蜍)的身体,可区分为头部、躯干和四肢三部分。
1.头部头:呈扁等腰三角形。
眼睛:在头两侧,稍向背部突出,有上下眼睑。
瞬膜:在下眼睑的内侧,为一半透明的薄膜,该膜向上延展可覆盖眼球。
外鼻孔:两眼的前方,近于头的前端的一对小孔内鼻孔:拉开下颌,在口腔顶壁的前端有一小孔鼻膜:在外鼻孔外缘的一对瓣状膜口:头端腹面有一很大的横裂鼓膜:眼后有一明显的褐色而稍下凹的圆形膜,是中耳腔与外界接触的地方。
蟾蜍的鼓膜较小,不明显耳后腺:蟾蜍鼓膜后上方有一对椭圆形的隆起,是由若干毒腺集合而成的,故又叫毒腺。
在受到压挤时,可分泌出一种乳白色的粘稠液,经加工之后即为中药“蟾酥”舌:在下颌前端内侧着生一柔软粘滑的舌,折向口腔内部,用镊子轻轻将舌拉出展平,可以看到蟾蜍的舌尖钝圆状。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、蟾蜍坐骨神经干动作电位引导及传导速度测定
实验目的:加强理解兴奋传导的概念,掌握测定神经干动作电位传导速度的方法。
熟悉仪器设备的操作。
实验原理:通过测出示波器上动作电位传导的距离和传导所需的时间,计算传导速度。
1.潜伏期法:测量第一个通道动作电位潜伏期的时间t,输入刺激电极到第一个引导
电极间的距离s,v=s/t。
2.潜峰法:测量两个通道的动作电位波峰间的时间差和两对引导电极间的距离,v=
(s2-s1)/(t2-t1)。
实验步骤:1.制备坐骨神经-腓神经标本,放入神经屏蔽盒。
2.连接仪器,引导动作电位波形。
3.剪裁编辑图形,计算传导速度。
实验结果:1.图形
2.计算
S=10mm, t=0.33ms, v=10mm/0.33ms=33m/s
分析讨论:
1. 当刺激端和记录端离得较远时,引导的复合动作电位波形会发生什么改变,为什么?
2.用什么方法可使复合动作电位传导速度的测量更准确?
实验结论:神经干动作电位的传导速度为33m/s.
二、兴奋性不应期的测定
实验目的:了解测定不应期的方法和原理,并加深对兴奋性在兴奋过程中的变化过程的理解。
实验原理:神经纤维受到适宜刺激后,产生兴奋,即动作电位。
一次兴奋产生后,必须经绝对不应期、相对不应期、超常期等变化后,兴奋性才能恢复。
本实验通过生物电放大器引导并记录神经干复合动作电位,验证和测量动作电位的不应期。
先给一个条件刺激,再用另一个检验刺激在兴奋的不同时期给予刺激,检查兴奋未阈值及所引起动作电位的幅度。
实验步骤:
1.制备坐骨神经-腓神经标本,并浸在任氏液中约5分钟,待其兴奋性稳定后实验。
2.连接仪器,设置实验参数,观察并测量神经干的不应期。
实验结果:(见图)
分析讨论:
1.为什么要先引导神经纤维的单向复合动作电位,然后再测量其兴奋性的不应期?
2.神经干不应期与单根神经纤维的不应期有何不同?
实验结论:兴奋性的不应期包括绝对不应期、相对不应期、超常期、低常期。
