细胞生物学实验报告——动物细胞融合
细胞融合实验报告

细胞融合实验报告细胞融合是一种重要的生物学实验技术,通过将两个不同细胞的质膜融合在一起,使它们的细胞质混合,从而产生新的细胞。
本实验旨在探究细胞融合对细胞生长和功能的影响,为细胞生物学研究提供实验依据。
首先,我们选择了两种不同类型的细胞进行融合实验,一种是小鼠胚胎成纤维细胞,另一种是人类胃腺癌细胞。
这两种细胞具有不同的形态和生长特性,我们希望通过它们的融合,观察新细胞的特性变化。
实验过程中,我们采用了聚乙烯醇融合剂将两种细胞进行融合处理,然后将融合后的细胞进行培养。
在培养的过程中,我们观察到融合后的细胞呈现出明显的形态变化,细胞质内出现了新的结构,并且细胞的生长速度也有所增加。
接着,我们对融合后的细胞进行了功能性实验。
结果显示,融合后的细胞在细胞分裂和增殖方面表现出了更活跃的特性,且对外界环境的适应能力也有所提高。
这表明,细胞融合可以增强细胞的生长和功能,为细胞的应用研究提供了新的可能性。
在实验的过程中,我们还发现了一些有趣的现象。
比如,融合后的细胞在形态上呈现出了中间态,既有小鼠胚胎成纤维细胞的形态特征,又具有人类胃腺癌细胞的特性。
这为我们深入研究细胞融合的机制提供了有益的线索。
综合以上实验结果,我们得出结论,细胞融合可以显著影响细胞的形态和功能,使其表现出新的特性。
这对于细胞生物学的研究具有重要意义,也为细胞治疗和再生医学领域提供了新的思路和方法。
总之,本实验通过对细胞融合的观察和分析,揭示了细胞融合对细胞生长和功能的影响,为细胞生物学领域的研究提供了新的启示。
希望本实验结果能够为相关领域的研究工作提供参考,推动细胞融合技术的进一步应用和发展。
动物细胞融合特有的方法

动物细胞融合特有的方法动物细胞融合是一种重要的实验技术,用于研究细胞的功能和特性。
它通过将两个或多个细胞融合成一个细胞,使得不同细胞的特性得以合并和表达。
以下将介绍动物细胞融合的几种特有方法。
1. 电融合法电融合法是一种利用电脉冲作用于细胞膜,使细胞融合的方法。
在这种方法中,需要将待融合的细胞放置在融合腔中,并通过电极对其施加高电压脉冲。
电脉冲会破坏细胞膜的完整性,使细胞融合在一起。
这种方法可以用于融合细胞间的染色体、融合细胞和细胞器等。
2. 化学融合法化学融合法是利用化学物质使细胞融合的方法。
常用的化学物质包括聚乙二醇(PEG)和多种离子化合物。
在这种方法中,待融合的细胞被置于含有化学物质的培养液中,化学物质破坏了细胞膜的完整性,从而使细胞融合。
化学融合法可以用于融合不同种类的细胞,也可以用于融合细胞和细胞团块。
3. 病毒介导融合法病毒介导融合法是利用病毒作为载体,将目标细胞和融合细胞融合的方法。
在这种方法中,病毒携带着融合蛋白或融合基因,将目标细胞和融合细胞融合在一起。
病毒介导融合法可以用于融合特定类型的细胞,也可以用于融合细胞和外源DNA。
4. 胞质融合法胞质融合法是一种将两个细胞的胞质融合在一起的方法。
在这种方法中,细胞膜完整的细胞与细胞膜破损的细胞融合,使得两个细胞的胞质混合。
胞质融合法可以用于融合具有不同特性的细胞,以研究胞质因子的相互作用和调控。
5. 光融合法光融合法是一种利用激光或激光束作用于细胞膜,使细胞融合的方法。
在这种方法中,待融合的细胞被置于激光束中,激光的能量破坏了细胞膜的完整性,使细胞融合。
光融合法可以用于融合细胞和胞器,以及融合不同类型的细胞。
总结起来,动物细胞融合具有多种特有的方法,包括电融合法、化学融合法、病毒介导融合法、胞质融合法和光融合法。
这些方法各自有其适用的场景和特点,可以用于研究细胞的特性和功能。
通过这些融合方法,我们可以获得融合细胞,进一步研究细胞的信号传导、细胞分化和细胞生长等重要过程,为细胞生物学和医学研究提供重要的实验手段。
细胞融合实验报告讨论

一、实验目的本实验旨在通过细胞融合技术,探讨细胞融合的基本原理、方法及其应用。
通过实验,观察细胞融合过程中细胞的行为与变化,了解不同细胞类型融合的差异,以及细胞融合在生物技术领域的应用前景。
二、实验原理细胞融合是指两个或多个细胞通过质膜融合形成单个双核或多核细胞的现象。
细胞融合技术在生物技术、医学、生物工程等领域具有广泛的应用前景。
本实验采用聚乙二醇(PEG)作为细胞融合的诱导剂,通过改变细胞膜的通透性,使细胞发生融合。
三、实验材料与方法1. 实验材料(1)细胞:小鼠胚胎成纤维细胞、鸡红细胞、人骨髓间充质干细胞等。
(2)试剂:聚乙二醇(PEG)、Hanks液、生理盐水、双蒸水等。
(3)器材:显微镜、离心机、水浴箱、离心管、滴管、载玻片、盖玻片等。
2. 实验方法(1)细胞培养:将小鼠胚胎成纤维细胞、鸡红细胞、人骨髓间充质干细胞等细胞分别培养于DMEM培养基中,置于37℃、5%CO2培养箱中。
(2)细胞融合:将细胞以1×10^6个/mL的浓度接种于培养皿中,待细胞生长至约70%融合时,加入一定浓度的PEG溶液,使细胞发生融合。
(3)观察与检测:通过显微镜观察细胞融合情况,采用流式细胞仪检测融合细胞的DNA含量,分析细胞融合的效果。
四、实验结果1. 显微镜观察在显微镜下,观察到细胞融合现象明显,部分细胞出现双核或多核现象。
2. 流式细胞仪检测流式细胞仪检测结果显示,融合细胞的DNA含量与正常细胞相似,说明细胞融合成功。
五、讨论1. 细胞融合的基本原理细胞融合是细胞生物学领域的一个重要研究方向。
细胞融合的基本原理是:通过改变细胞膜的通透性,使细胞发生质膜融合,进而实现细胞内容物的相互交换。
本实验采用PEG作为细胞融合的诱导剂,其作用机理是改变细胞膜的通透性,使细胞内物质外泄,进而促进细胞融合。
2. 不同细胞类型融合的差异本实验观察到小鼠胚胎成纤维细胞、鸡红细胞、人骨髓间充质干细胞等细胞均能发生融合。
动物细胞融合实验实验报告

动物细胞融合实验实验报告
实验目的:1、了解动物细胞融合的常用方法
2、学习化学融合的基本操作过过程
3、观察动物细胞融合过程中的细胞行为和变化
实验材料:鸡血红细胞、50%PEG溶液、0.85%氯化钠溶液、显微镜、离心机、载玻片、盖玻片等
实验原理:聚乙二醇(PEG)能够改变细胞膜脂质分子的排列,在去除这些物质之后,细胞膜趋向于恢复原有的有序结构。
在恢复过程中相接触的细胞由于接口处脂质双分
子层的互相亲和与表面张力,细胞膜融合,胞质流通,发生融合。
实验步骤:1、取鸡血,离心后去除上清液,以0.85%氯化钠溶液制成5%~10%的悬液
2、加入GKN液4ml,混匀
3、加入14滴PEG液,静置3~5min后混匀,放于显微镜下观察
实验结果:显微镜下可观察到有些细胞发生质膜融合
分析与讨论:细胞融合的应用有微生物原生质体融合构成新菌株、利用原生质体融合和培养技术培育新植物、细胞杂交瘤技术与单克隆抗体、用于基因定位和绘制人类基因
图谱、用于生产树突状细胞抗肿瘤疫苗、用于动物育种、用于细胞疗法等。
医学细胞生物学设计性实验:动物细胞的融合

医学细胞生物学设计型实验设计报告班级10级k-7班评分实验项目:动物细胞融合实验原理:两个以上保持完整的细胞在特殊融合诱导物作用下,相互接触细胞发生膜融合,最终使细胞融合成双核或多核细胞的现象称细胞的融合。
细胞的融合不限于同种之间,不同种类生物的细胞都可以发生融合。
因此,细胞融合技术对医学,生物学,科研等发展都有重要的作用。
诱导融合方法包括物理法(电激、振动、离心)、化学法(聚乙二醇,即PEG)、生物法(灭活的病毒,如:仙台病毒)。
步骤:(一)、50%PEG液的制备,根据实验需要,称取一定量的PEG (MV=4000)放入刻度离心管内,在酒精灯焰上加热,使其溶化,冷却至50℃时,加入等体积病预热的无血清1640液混匀,置之37℃水浴箱中保温待用。
(二)、融合方法:1、取肝素抗凝的弃血清鸡血0.1ml本(验式是进行同种细胞融合)。
2、将悬液移入离心管中,以800r/min离心7~8min,倾去上清液,加入8~10ml Hanks液,再次悬浮细胞,离心洗涤一次,倾去上清液后将离心管倒置与滤纸上,尽量流尽剩余液体(者一步骤很重要,因为残留液体会改变PEG的浓度)。
3、用手指轻弹离心管底壁,使沉淀物松散,然后吸取制备好的50%PEG0.4ml,在37℃水浴中,于90s内逐滴加入离心管中,边加边振摇离心管,使之与细胞混匀,然后加入8~10ml Hanks 液,轻轻吸打混匀,在37℃水浴中静置5min 以稀释PEG。
离心弃去上清液后,加入2~3ml含小牛血清的1640培养液,在37℃水浴中孵育30min。
注意事项:1、制备的5%PEG一定要保存于37℃水浴中,不然冷却后结晶析出。
2、在理想管中加PEG之前,一定要将离心管倒置于滤纸上,流尽剩余液体,否则残留液会改变PEG的浓度。
预期结果:(一)融合过程观察:分别于温育5min、10min、20min、30min 取细胞悬液一滴制成临时装片,以0.2%次甲基蓝染液染色,在显微镜下观察细胞融合的不同阶段,通常可把融合过程分为5个阶段:1、两个细胞的细胞膜相互接触,粘连。
细胞生物学实验细胞融合
• 异核体其细胞膜融合在一起,而融合细胞 含有两个不一样细胞核。
细胞生物学实验细胞融合
第39页
动物细胞融合影响原因
动物细胞融合中,除促融剂外,其它如细胞性质、温度、 pH、离子强度及离子种类等均全影响细胞融合效率。
• ①亲本细胞表面性质影响较大
• ⑥最适合pH为7.4-7.8之间,在此范围之外,融合 率均较低。
细胞生物学实验细胞融合
第41页
比较惯用杂种细胞筛选方法
1遗传互补筛选法:
2营养互补筛选:
3温度敏感筛选法
细胞生物学实验细胞融合
第42页
1)遗传互补筛选法:利用每一亲本贡献一个功 效正常等位基因,纠正另一亲本缺点,令杂 种细胞表现正常。
第2页
细胞生物学实验细胞融合
第3页
人心肌细胞 人肝脏细胞
人细胞
鼠细胞
细胞生物学实验细胞融合
种内杂交细胞பைடு நூலகம்
种间杂交细第4页胞
在适当条件下,细胞融合在一起,产生含有原 来两个细胞基因信息单个核细胞,称为杂交细 胞(hybrid cell)。
种内杂交细胞(intraspecific hybrid cell):同种细胞融合而成细胞
细胞生物学实验细胞融合
第47页
The Nobel Prize in Physiology or Medicine 1984 "for the discovery of the principle for production of monoclonal antibodies"
科莱尔
Georges J.F. Koehler Federal Republic of Germany Basel Institute for Immunology Basel, Switzerland b. 1946 d. 1995
细胞生物学实验报告——动物细胞融合
山东大学细胞生物学实验报告聚乙二醇(PEG )法诱导的动物细胞融合实验2012/9/11实验目的:了解细胞融合技术的发展过程和主要方法的基本原理,用聚乙二醇(PEG)化学诱导法进行鸡血红细胞的融合实验,掌握实验的基本操作,观察鸡血红细胞融合的不同时期。
实验原理:1. 细胞融合的概念两个或两个以上的细胞或原生质体在自然或人为诱导的情况下细胞质膜相互融合,细胞质相互混合成为一个整体杂合细胞的现象被称为细胞融合。
细胞融合可以发生在同种细胞之间也可以在不同物种间实现。
2. 细胞人工融合的主要方法及基本原理细胞体外融合的主要方法分为病毒诱导,化学诱导和物理诱导。
1953年,M. Kuroya 在临床中第一次分离到仙台病毒(HVJ )[1]。
1958年,日本学者Okada 发现仙台病毒(HVJ )能诱导动物细胞融合[2],其基本原理是仙台病毒的衣壳上有细胞表面受体的结合位点,可以诱导不同细胞凝集,最终使不同细胞的细胞膜相互融合。
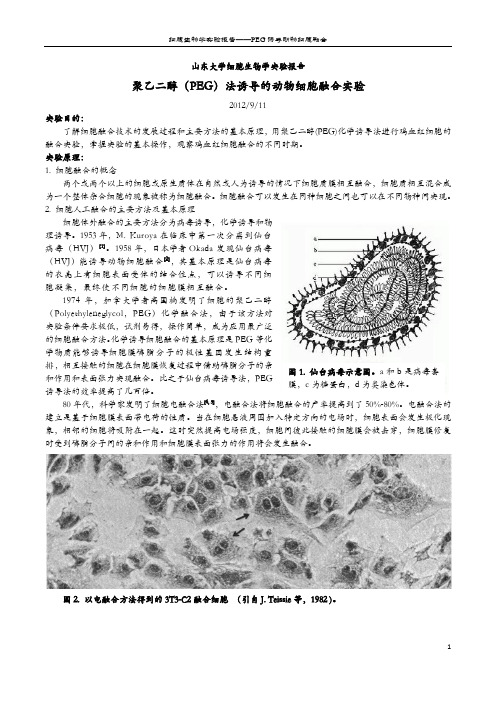
1974年,加拿大学者高国楠发明了细胞的聚乙二醇(Polyethyleneglycol ,PEG )化学融合法,由于该方法对实验条件要求极低,试剂易得,操作简单,成为应用最广泛的细胞融合方法。
化学诱导细胞融合的基本原理是PEG 等化学物质能够诱导细胞膜磷脂分子的极性基团发生结构重排,相互接触的细胞在细胞膜恢复过程中借助磷脂分子的亲和作用和表面张力实现融合。
比之于仙台病毒诱导法,PEG 诱导法的效率提高了几百倍。
80年代,科学家发明了细胞电融合法[4, 5],电融合法将细胞融合的产率提高到了50%-80%。
电融合法的建立是基于细胞膜表面带电荷的性质。
当在细胞悬液周围加入特定方向的电场时,细胞表面会发生极化现象,相邻的细胞将吸附在一起。
这时突然提高电场强度,细胞间彼此接触的细胞膜会被击穿,细胞膜修复时受到磷脂分子间的亲和作用和细胞膜表面张力的作用将会发生融合。
图2. 以电融合方法得到的3T3-C2融合细胞 (引自J. Teissie 等,1982 )。
细胞融合实验

LOGO
实验结果:
第9页
恳请各位同学批评指正!
汇报人:玉苏普·胡加阿布拉 2019年11月22日
LOGO
三,实验材料与用品:
第5页
1、材料: 鸡血红细胞
2、试剂 : 50%PEG、GKN溶液、Alsever's细胞保存液、0.85%氯化钠 溶液。
3、 器材 : 倒置显微镜、离心机、载玻片、盖玻片、离心管、废液缸、 滴管等。
四,实验步骤:
在本次实验中采用 的是化学诱导融合 的方法,利用PEG使 鸡血红细胞发生融 合。具体实验步骤
3、化学诱导融合
很多化学试剂能够诱导细胞融合,如聚乙二醇(PEG)、二甲基亚砜、山梨醇、甘油、溶血性卵磷脂、 磷脂酰丝氨酸等。这些物质能够改变细胞膜脂质分子的排列,在去除这些物质之后,细胞膜趋向 于恢复原有的有序结构。在恢复过程中想接触的细胞由于接口处脂质双分子层的相互亲和与表面 张力,细胞膜融合,胞质流通,发生融合。化学诱导方法,操作方便,诱导融合的概率比较高, 效果稳定,适用于动、植物细胞,但对细胞具有一定的毒性。PEG是广泛使用的化学融合剂。
如下:
取鸡血 2ml+2mlAlsever液, 再加入6mlAlsever 液,混匀后制悬液
(4℃保存)
老师已做 好,可直 接使用
LOGO
四,实验步骤:
第7页
第二步
第三步
第四步
第五步
取(1)中悬液1ml+4ml的 0.85%的NaCl溶液,进行以下 三次离心处理:
①在1200r/min下离心5min,去 掉上清液,再加入0.85%的NaCl 溶液至5ml; ②1000-1200r/min下离心5min, 去掉上清液,再加入0.85%的 NaCl溶液至5ml; ③1000-1200r/min下离心7min
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
山东大学细胞生物学实验报告
聚乙二醇(PEG )法诱导的动物细胞融合实验
2012/9/11
实验目的:
了解细胞融合技术的发展过程和主要方法的基本原理,用聚乙二醇(PEG)化学诱导法进行鸡血红细胞的融合实验,掌握实验的基本操作,观察鸡血红细胞融合的不同时期。
实验原理:
1. 细胞融合的概念
两个或两个以上的细胞或原生质体在自然或人为诱导的情况下细胞质膜相互融合,细胞质相互混合成为一个整体杂合细胞的现象被称为细胞融合。
细胞融合可以发生在同种细胞之间也可以在不同物种间实现。
2. 细胞人工融合的主要方法及基本原理
细胞体外融合的主要方法分为病毒诱导,化学诱导和物
理诱导。
1953年,M. Kuroya 在临床中第一次分离到仙台
病毒(HVJ )[1]。
1958年,日本学者Okada 发现仙台病毒
(HVJ )能诱导动物细胞融合[2],其基本原理是仙台病毒
的衣壳上有细胞表面受体的结合位点,可以诱导不同细
胞凝集,最终使不同细胞的细胞膜相互融合。
1974年,加拿大学者高国楠发明了细胞的聚乙二醇
(Polyethyleneglycol ,PEG )化学融合法,由于该方法对
实验条件要求极低,试剂易得,操作简单,成为应用最广泛
的细胞融合方法。
化学诱导细胞融合的基本原理是PEG 等化
学物质能够诱导细胞膜磷脂分子的极性基团发生结构重
排,相互接触的细胞在细胞膜恢复过程中借助磷脂分子的亲和作用和表面张力实现融合。
比之于仙台病毒诱导法,PEG 诱导法的效率提高了几百倍。
80年代,科学家发明了细胞电融合法[4, 5]
,电融合法将细胞融合的产率提高到了50%-80%。
电融合法的建立是基于细胞膜表面带电荷的性质。
当在细胞悬液周围加入特定方向的电场时,细胞表面会发生极化现象,相邻的细胞将吸附在一起。
这时突然提高电场强度,细胞间彼此接触的细胞膜会被击穿,细胞膜修复时受到磷脂分子间的亲和作用和细胞膜表面张力的作用将会发生融合。
图2. 以电融合方法得到的3T3-C2融合细胞 (引自J. Teissie 等,1982 )。
图1. 仙台病毒示意图。
a 和b 是病毒套膜,c 为糖蛋白,d 为类染色体。
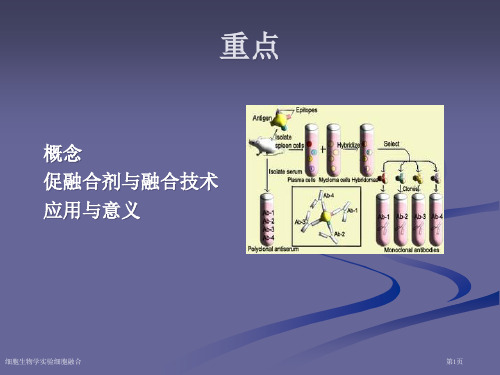
3. 细胞融合的应用
细胞融合最成功的应用是实现了大量制备单克隆抗体(Kohler& Milstein,1975)。
图3. 以细胞融合技术制备单克隆抗体的流程示意图。
1975年,G. Kohler和C. Milstein首次成功使用细胞融合技术制备了抗绵羊血红细胞(SRBC)的抗体。
他们首先用灭活的仙台病毒(HVJ)诱导小鼠对羊血红细胞免疫的脾细胞与小鼠多发性骨髓瘤细胞发生融合,然后以选择培养基(HAT)选择出杂交细胞,进而以SRBC作为免疫原筛选产生特异抗羊血红细胞的杂交细胞,最终获得了既能产生特异抗体又能无限增殖的杂交瘤细胞[3]。
此外,细胞融合技术在种质资源开发、膜蛋白研究等领域也有重要应用。
材料试剂:
新鲜鸡血,GKN 缓冲液,Alsever抗凝液,0.85% NaCL溶液,0.5ml 50%聚乙二醇(PEG,4000Da)溶液仪器:
离心机,普通光学显微镜,玻璃刻度离心管,5ml注射器,胶头吸管,普通玻片
实验步骤:
1.用注射器在公鸡翼下静脉处抽取新鲜鸡血2ml,加入8ml 抗凝剂Alsever溶液,混匀得细胞悬液。
2.取1ml上述悬液加入4ml 0.85% NaCL溶液,以约1000r/ min 离心5min,弃上清后加入5ml 0.85% NaCL
溶液再次以约1000r/ min 离心5min。
弃上清,加入5ml 0.85% NaCL溶液以约1000r/ min 离心7min,弃上清。
3.向细胞沉淀中加入1-2ml GKN缓冲液,得到约10%的鸡血红细胞悬液。
4.向上一步的悬液中加入约3ml GKN缓冲液使细胞悬液中鸡血红细胞的浓度达到1.5×107左右。
5.取上一步悬液0.5-1.0 ml,贴壁加入0.5ml 50%聚乙二醇(PEG),静置约3min,混匀,加入1ml GKN缓
冲液混匀静置约2min后涂片观察。
6. 将肺癌细胞悬液与第4步处理后的鸡血红细胞悬液等体积混合,充分混匀后进行第5步诱导处理,涂片
观察肺癌细胞与鸡血红细胞的融合情况。
实验结果:
图4. PEG诱导下鸡血红细胞发生细胞融合的过程(a,b,c)和肺癌细胞融合(d)。
a.两个相互接触的鸡血红细胞在PEG诱导下细胞膜开始发生融合。
b.发生部分细胞质融合的两个鸡血红细胞,此时两个细胞核尚未接触。
c.细胞融合接近完成的两个鸡血红细胞,两个细胞的细胞核开始融合。
d.在PEG诱导下开始发生细胞融合的两个肺癌细胞。
从实验照片(图4)中可以看到,实验中鸡血红细胞涂片上可以观察到细胞融合不同时期的血红细胞。
但是发生融合的细胞只占细胞总数的极小比例,寻找融合细胞的过程十分困难,这说明实验中细胞的实际融合率非常低。
由于实验条件所限,照片(图4)未标明比例尺,不同照片之间实际放大比例不一致,图d 中的肺癌细胞实际上比图a、b、c中的鸡血红细胞大很多。
讨论:
实验基本验证了PEG化学诱导法诱导动物细胞融合的全过程,但是实验中主要的问题是PEG诱导成功率太低。
对比PEG诱导的最适宜条件(PEG浓度40%-60%,诱导温度38-40℃),实际实验操作时的PEG 浓度最高只有约25%,而且融合温度不到30℃(较低的温度会使细胞膜流动性变差),这直接导致细胞融合率降低。
考虑到即使在使用最适宜条件的情况下,PEG诱导细胞融合的融合率也远远达不到30%,所以在本次实验的条件下,融合率极低是可以理解的。
保证实验中细胞的融合率还有一点就是在使用PEG处理的一步,PEG需要与血红细胞充分作用。
实际使用时发现,50%的PEG溶液密度相当大,加入离心管后会自动与红细胞悬液分层。
所以要使红细胞与PEG 充分接触,有必要在加完PEG后充分吹打或震荡,或者在加入PEG的同时震荡细胞悬液。
本次实验的观察条件相当不理想,这使区分融合细胞的工作变得有点艰难。
主要原因是显微镜设备陈旧且光源质量不高,很难使用高倍镜看清相互接触的两个细胞到底是发生了融合还是相互叠加。
所以如果条件允许,细胞融合的观察应使用相差显微镜,以求达到最好的观察效果。
参考文献:
[1].Kuroya M, Ishida N, Shiratorit. Newborn virus pneumonitis (type Sendai). II. The isolation of a new virus. Tohoku
J Exp Med [J]
. 58(1):62, Jun, 1953.
[2]. Y Okada, J Bikens. The introduction of cell fusion with non-activity Xitai virus. Nature, (1): 103-110, 1958.
[3]. G. Kohler, C. Milstein. Continuous cultures of fused cells secreting antibody predefined specificity. Nature Vol,
256, Aug, 1975.
[4]. Hollaender A. The method of cell fusion with the electric pulse [M]. New York: Plenum Press, 58-67, 1982.
[5]. J Teissie, VP Knutson, TY Tsong, Electric Pulse-Induced Fusion of 3T3 Cells in Monolayer Culture. Science Vol,
216, Jan, 1982.。
