分子结构1
1.分子结构-共价键

反应生成2molHCl 2molHCl时 1 molH2与1molCl2反应生成2molHCl时,其理论分析数 据与实验数据略有差异, 据与实验数据略有差异,下图表示上述反应能量变化 的理论分析示意图: 的理论分析示意图:
释放” 吸收” ①化学键断裂需要 (填“释放”或“吸收”)能 量; ②图中共释放的能量 kJ/mol; kJ/mol; 大于” ③该反应的反应物的总能量 (填“大于”、“ 等于” 小于” 反应产物的能量, 等于”或“小于”)反应产物的能量,所以该反应是 __反应 __反应
1.经验规律: 1.经验规律:象一氧化碳和氮分子这样具有 经验规律 相同电子数( 相同电子数(指分子或离子中全部电子总数或 价电子总数) 价电子总数)和相同原子数的两个或两个以上 的分子或离子,它们的分子结构相似, 的分子或离子,它们的分子结构相似,性质 相似。这条规律就叫做等电子原理。 相似。这条规律就叫做等电子原理。具有等 电子的物质, 电子的物质,如一氧化碳和氮分子就彼此叫 做等电子体。 做等电子体。 2.互为等电子体应该满足的条件 互为等电子体应该满足的条件: 2.互为等电子体应该满足的条件: 在微粒的组成上, ①在微粒的组成上,微粒所含原子数目相同 在微粒的构成上, ②在微粒的构成上,微粒所含电子数目相同 在微粒的结构上, ③在微粒的结构上,微粒中原子的空间排列 方式相同
3.应用:应用等电子原理, 3.应用:应用等电子原理,可利用已知的分子的 应用 构型(几何构型、电子构型) 构型(几何构型、电子构型)和物理性质对相应 等电子分子的构型和物理性质进行预测。 等电子分子的构型和物理性质进行预测。 4.典型事例 典型事例: 4.典型事例: ① N2O与CO2是等电子体 硅和锗是良好的半导体材料, ②硅和锗是良好的半导体材料,他们的等电子体 磷化铝(AlP)砷化镓(GaAs) 磷化铝(AlP)砷化镓(GaAs)也是很好的半导体 材料 白锡(β (β与锑化锢是等电子体, ③白锡(β-Sn2)与锑化锢是等电子体,它们在低温 下都可转变为超导体 ④SiCl4、SiO44-、SO42-的原子数目和价电子总数都 相等,它们互为等电子体, 相等,它们互为等电子体,都形成正四面体立体 构型。 构型。
第2节DNA分子的结构1

小麦、大肠杆菌、噬菌体、酵母菌、HIV的遗传物 质分别是 。
艾弗里实验证明:S型菌的DNA才是使R型菌产生 稳定遗传变化的物质。其实验设计中的关键思路 是 。
噬菌体侵染细菌实验中,噬菌体将 内,利用 ,合成出 该实验的结论是 注入细菌 。
。
第 2 节
D N A
的 结 构
脱氧. 4.
5.
目的要求: 材料用具: 模型设计: 用 代表 三种小分子如何连接? 每条链的脱氧核苷酸如何连接? 如何体现反向平行? 如何体现两条链间的互补配对?
。
若某DNA分子片 断中含有100个碱基 对,问有多少种可能 的碱基对排列次序?
A T C G
1951年
威尔金 斯 DNA的X射 线衍射图
两人对DNA结构怀有浓厚的兴趣,受威尔金 斯启发,两人进行了大量的模型构建的工作。
1962年
威尔金斯 沃森 和克里克获诺贝尔奖
模型构建:制作DNA双螺旋结构模型
能使生物大分子非常复杂的空间结构以完整的、 简明扼要的形象表示出来
化学键与分子结构1

共价键的形成与类型
1s
↑↓
↑↓ ↑↓ ↑↓
2s
2p
HF
H
F
s - p σ键
共价键的形成与类型
心键等。
σ键的特点是重叠的电子在两核连线上,受原子核束 缚力较大,重叠程度也大,比较牢固,σ键绕轴旋转 时,电子云重叠程度不受影响。
π键的特点是重叠的电子云分布在两核连线的两方, 受原子核束缚力小,电子云重叠程要比σ键小得多, 所以π键不如σ键牢固。π键绕键轴(两轴连线)旋转后 会发生破裂。 所以π键电子的能量较高,易活动,其化学性质较σ 键活泼。 一般来说,π健不能独立存在,总是和σ键一起形成 双键或叁键。
复杂分子的路易斯结构式确定:
有时,一个分子在不改变其中的原子的排列的
情况下,可以写出一个以上合理的路易斯结构
式,为解决这一问题,鲍林提出所谓的“共振”
的概念,认为该分子的结构是所有这些正确的 路易斯结构式的总和,真实的分子结构是这些 结构式的“共振混合体”。
共振论在有机化学中仍有广泛应用。有助于理 解路易斯结构式的局限性。
计算可用价电子的数目。在分子中为每一个原 子贡献的价电子相加,对于负离子要加上离子 的电荷数,对于正离子要减去离子的电荷数。 + 以NH4 和NO3 为例:
画出分子或离子的结构草图,用单键把原子连 接起来,使每个原子的电子总数为8(含成键电 子对和非成键电子对)。如原子的排列有几种可 能,则用化学或物理方法确定哪一种可能的结 构是正确的,它一般分子形成过程的能量变化
共价键的形成与类型
根据共价键形成的本质,请解释氢分子为 H 2 而 不是H3?
↑↓
1s
H2
根据H2分子的形成过程,讨论HF分子、H2O分 子和NH3分子的形成
dna分子的结构1

你注意到了吗?
两条长链上的脱 氧核糖与磷酸交 替排列的顺序是 稳定不变的。
A
G
T
C
长链中的碱基对 的排列顺序是千 变万化的。
你注意到了吗?
两条长链上的脱 氧核糖与磷酸交 替排列的顺序是 稳定不变的。
DNA分子的 特异性就体现在特 定的碱基(对)排 列顺序中。
长链中的碱基对 的排列顺序是千 变万化的。
• 此时,生物大分子结构会议在意大利举行, 威尔金斯在富兰克林不知情的情况下在报 告中展示了DNA的X射线衍射照片,这 给沃森留下了极深的印象。不久后,沃森 来到剑桥大学遇到了克里克,他们的配合 成为科学家合作的典范。物理学家出身的 克里克可以帮助沃森分析衍射图谱,而沃 森可以帮助克里克理解生物学的内容。
沃森和克里克在构建模型的过程中, 利用了他人的哪些经验和成果? 沃森和克里克在构建模型的过程 中,出现了哪些错误?他们是如 何对待和纠正错误的?
思考与讨论:
• 1、请你根据前面的资料回答有关问题 • (1)DNA是由几条链构成的,它具有 怎样的立体结构? • (2)DNA的基本骨架是由哪些物质组 成的?它们位于DNA的什么部位? • (3)DNA中的碱基是如何配对的?它 们位于DNA的什么部位?
• 在那时候,人们已经知道了脱氧核糖核酸( DNA) 可能是遗传物质,但是对于DNA的结构,以及它 如何在生命活动中发挥作用的机制还不甚了解。 就在这时,富兰克林加入了研究DNA结构的行 列——在相当不友善的环境下。她负责起实验室 的DNA项目时,有好几个月没有人干活。同事威 尔金斯不喜欢她进入自己的研究领域,但他在研 究上却又离不开她。他把她看作搞技术的副手, 她却认为自己与他地位同等,两人的私交恶劣到 几乎不讲话。在那时的科学界,对女科学家的歧 视处处存在,女性甚至不被准许在大学的高级休 息室里用午餐。她们无形中被排除在科学家间的 联系网络之外,而这种联系对了解新的研究动态、 交换新理念、触发灵感极为重要。
双原子分子的结构1

1 R
aa ab
1 Sab
因为aa ≈1/R,故只有依靠 ab 才能使E1<EH ,而 ab又
是φa 、 φb相互重叠而产生的,所以φa 、 φb相互
重叠是使H+与H之间有可能成键的基本原因。
对H2+中共价键较全面的分析--收缩效应及极化效应
基态
1
1
(era erb )
2(1 Sab )
成键分子轨道吸引态
解久期方程式可得:
E1,2
1 2
(a
b
)
(a b)2 4 2
即: E1 b h
在上两式中
E2 a h
h 1 2
(a b )2 4 2 (a b )
1). 对称性一致(匹配)原
则
原子轨道具有各种类型,因而也有着各种不同的空间对称性(指原子轨 道的角度部分)。由下两图可见:由于相互组合的原子轨道的空间对称
将上式分别对 c1,c2 求偏导得久期方程组:
c1(H aa ESaa ) c2(H ab ESab ) 0 c1(H ab ESab ) c2(H bb ESbb ) 0
由久期方程组的非零解要求,得到久期行列式(方程):
H aa ESaa H ab ESab
H ab ESab H bb ESbb
变分原理 对于给定体系的哈密顿算符Ĥ,如果存在任意归一化的
品优波函数(即合格波函数)φ,则有
(式中为变分函数,
E0 为Ĥ 的最低本征值, 即体系基态能量)
此式表明,体系的哈密顿算符Ĥ关于φ的平均能量Ē必是体系基态能量E0 的上限,这就是变分原理。如果φ不是归一化的,则有
线性变分法 选择若干个已知函数进行线性组合,即
按照定核近似,H2+的核间距可作为常数,核间排斥能成为恒 值,这样电子在核势场中的哈密顿算符和薛定谔方程分别为
第2章 分子结构1-离子键

性越强。
6
3.离子极化作用对离子化合物性质的影响 化学键的性质由离子键逐渐向共价键过渡,表现
出化合物的熔沸点降低、在极性溶剂中溶解度减小 、颜色逐渐加深等性质变化。
例如AgF,AgCl,AgBr, AgI: 熔沸点: AgF > AgCl > AgBr > AgI
溶解度: AgF > AgCl > AgBr > AgI 颜色: AgF < AgCl < AgBr < AgI
分子结构 (在线1:离子键)
化学键:分子内或原子、离子晶体中相邻原 子或相邻离子间强烈的相互作用力称为~。
离子键:正、负离子间通过静电引力形成。 化学键 金属键:通过共用能流动的自由电子形成。
共价键:通过共用电子对形成。 人类发现和合成的化合物90%以上都是 以共价键相结合的。
2
第一节 离子键
一、离子键的形成 Δχ >1.7的非金属和金属原子相遇时,有达到稳定结 构倾向,发生电子的转移,形成正、负离子;正、 负离子间以静电引力形成离子键。
7
二、离子键的特点 离子键没有饱和性和方向性。
三、影响离子键强弱的因素 离子的电荷、半径和电子构型。
1.离子的电荷 电荷越高,化合物离子键越强。
3
2.离子的半径 (1)电子层越多,离子半径越大; (2)同一周期正离子的离子半径比负离子小; (3)同一周期正、负离子的离子半径都随核电荷数的
增大而减小。
离子半径越小,化合物的离子键越强。离子键强弱 用晶格能(U)来衡量:
U Z Z r0
4
3.离子的电子构型 1)正离子的电子层构型一般有5种: (1) 2电子构型Li+、Be2+ (2) 8电子构型Na+、Mg 2+ (3) 9~17电子构型Mn 2+ 、Fe2+ (4)18电子构型Ag+、Cu+ (5) (18+2)电子构型Pb2+ 、Sn2+ 2)不同构型的正离子与负离子的离子键强弱: 18+2或18构型 > 9~17构型 > 8电子层构型 因为正离子电子构型越大,半径越小,离子键越强。
DNA的分子结构1

富县高级中学集体备课教案年级:高三级科目:生物授课人:课题DNA的分子结构第 1 课时三维目标知识与技能:概述DNA分子结构的主要特点。
过程与方法:能够尝试建立DNA 分子结构模型,体会建模思想,提高建模能力。
情感态度价值观:体会生命的物质性,体验建立DNA 双螺旋结构模型的艰辛与曲折和科学家的奉献精神。
重点碱基互补配对原则及其应用中心发言人谢文娟难点碱基互补配对原则及其应用教具课型复习课课时安排 2 课时教法讲授法,讨论法、分析比较法、提问引导法学法自主学习合作交流个人主页教学过程一、考纲解读:1、DNA分子结构的主要特点(Ⅱ)。
二、热点提示:1、碱基互补配对的相关计算;2、DNA的基本结构三、自主梳理,查清知识:1、学生课前自主完成学生资料P125【备考基础·查清知识】知识点一DNA分子的结构。
2、课堂上教师利用【备考基础·查清能力】部分对学生的预习进行检查。
四、回归课本,全面复习:(一)DNA的结构模型1、DNA分子的平面结构学生活动一:提问预习问题是由几条链构成的?外侧、内侧的结构是什么?两条链是怎样连接的?学生活动二:请同学们仔细分析刚才上所提供的信息,在草稿本上构建一个DNA分子平面结构模型(绘图)。
比较展示后教师总结示范。
并投影展示DNA分子平面结构模式图。
提问:在细胞内的DNA结构是这样的吗?投影展示DNA分子空间结构——双螺旋结构学生活动三:指导学生阅读课本,并结合DNA双螺旋结构模型逐句理解DNA分子结构特点。
提问:1.你能看出来DNA分子空间结构是怎样变化来的吗?反相平行螺旋,(向右螺旋);2.双螺旋结构有什么特点?两条链反向平行;脱氧核糖与磷酸交替相连,排列在外侧;碱基排列在内侧,且遵循碱基互补配对原则:腺嘌呤(A)与胸腺嘧啶(T)配对;鸟嘌呤(G)与胞嘧啶(C)配对;教师总结:展示DNA空间结构模型,并讲析各种数据。
学生活动四:1、分析DNA结构多样性的原因。
高分子的结构1
3.2.4 高聚物的分子量及分子量分布
(1) 高聚物的分子量
聚合物的分子量具有统计平均的意义,不同的 统计方法得到不同的平均分子量。
设一块高聚物总共有N个分子,质量为W。 其中相对分子质量为M1 的分子有N1个,占总分 子数的分数为x1,质量为W1 = N1M1,占总质量的 分数为w1;
相对分子质量为M2 的分子有N2个,占总分子 数的分数为x2,质量为W2 = N2M2,占总质量的 分数为w2;
习题:
1 均聚物结构单元的键接方式有哪些?共聚物 的序列结构与其类型的关系?
2 什么是高分子链的构型?聚苯乙烯和聚丁二 烯分别可以有那些构型?
3 高分子的构象的定义是什么? 能否通过改 变构象的方式改变聚丙烯的等规度?
4 高分子链的柔顺性是由什么引起的?如何表 征高分子链的柔顺性?
5 影响高分子链的柔顺性有哪些因素?它们如 何影响?
聚合物的单晶一般在极稀溶液(<0.1%)中缓慢结晶形成
B、聚合物球晶
聚合物在没有外力或流动的情况下,由熔体冷却或从浓 溶液(>1%)中结晶,倾向于形成球状晶体,称为球晶。
黑十字消光图案是聚合物球晶的 双折射性和对称性的反映
球晶模型及PE球晶的电镜照片
当聚合度一定时, 均方末 端距或均方根末端距越 小, 链越柔顺.
柔性链, 刚性链.
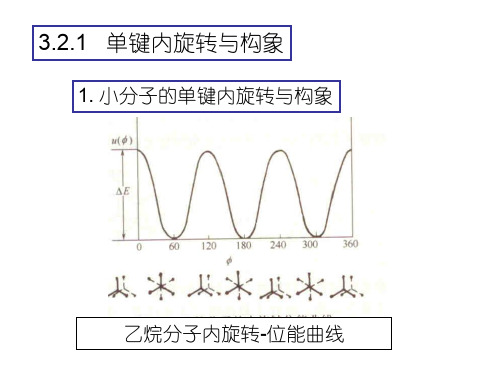
3.2.3 高分子(单)链的柔性及影响因素
高分子链通过单键内旋转而改变其构象 的性质,称为柔性。
高分子链的柔性大小取决于单键内旋 转的难易.
高分子链的柔性有平衡态柔性和动态 柔性之分
(1)主链结构
主链中含有C-O,C-N,Si-O、-O-以及 孤立C=C键,内旋转容易,大分子链柔顺
如:聚丙烯通常形成单斜晶胞,但是在一定的温度 范围内,特别是在一些特殊成核剂存在时或特定的 结晶条件下,可结晶形成六方和三方晶胞。三种晶 跑中,分子链都旋转形成H31螺旋链,所不同的是 相邻结构单元的相对位置以及左旋或右旋的差别。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子的立体构型(1)
(新授课)
【学习目标】
1.认识共价分子的多样性和复杂性。
2.初步认识价层电子对互斥模型,能用VSEPR模型预测简单分子或离子的立体构型。
【学习重难点】利用价层电子对互斥模型预测分子的立体构型
启学案
1.中心原子的价电子全都用于形成共价健(无孤对电子)的分子的立体构型
2.中心原子上有孤对电子的分子的立体构型
中心原子的和均占据中心原子的周围的空间,参与互相排斥。
HCHO
测学案
分子或离
子
价层电子对数
δ键数+孤电子对数目
VSEPR模型
图示
立体构型
图示(标出键角)
立体构型名称
H2S
PH3
CC l4
NH4+
H3O+
CO32-
NH2-
2.O3能吸收有害紫外线,保护人类赖以生存的空间。
O3分子的结构如右图:呈V型,键角116.5o。
三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)——三个O原子均等地享有这4个电子。
请回答:
(1)臭氧与氧气的关系是;
(2)下列物质的分子与O3分子的结构最相似的是;
A.H2O B.CO2C. SO2D. BeCl2
(3)O3分子有对孤对电子。
分子的立体构型(2)
(新授课)
学习目标:
1.认识杂化轨道理论的要点,能根据杂化轨道理论判断简单分子或离子的构型
2.进一步了解有机化合物中碳的成键特征
学习重难点:应用杂化轨道理论判断简单分子或离子的构型
启学案
1.sp3杂化-----四面体形
⑴碳的价电子排布式,价电子排布图。
按价键理论分
析,可以形成的共用电子对数为。
⑵根据VSEPR模型甲烷的分子空间构型为,键角是。
分子中的4个C—键是,共价键的个数为
⑶
CH4→→→→正四面体
NH3→→→
2.sp杂化——平面三角形
BF3→→→→平面三角形4个δ键
0个孤电
子对
4个杂化
轨道
sp3杂化
个δ键
个孤电
子对
3个杂化
轨道
Sp2杂化
个δ键
个孤
电子对
4个杂化
轨道
sp3杂化
SO2→→→→形
3.sp杂化——直线形
CO2→→→直线型
4.☆中心原子杂化类型的常用判断方法
⑴看中心原子有没有形成双键或三键:如果有1个三键,则其中有2个π键,用去了2个p
轨道,形成的是杂化;如果有1个双键,则其中有1个π键,形成的是杂化;如果全部是单键,则形成的是杂化。
⑵通过VSEPR模型来判断杂化类型:
sp3杂化VSEPR模型为;sp2杂化VSEPR模型为;sp杂化VSEPR模型成。
或应用等电子体原理,互为等电子体的分子结构相似也是判断的重要依据。
测学案
1.填写下表
原子的杂化方式分别是
中心原子孤对电子数代表物杂化轨道数杂化轨道类型VSEPR模型分子构型0
CO2+2
CH2O +3
CH4+4
1
SO2+2
NH3+3
2 H2O +2
个δ键
个孤电
子对
3个杂化
轨道
Sp2杂化
个δ键
个孤
电子对
2个杂化
轨道
sp杂化
3.A、B、C三种元素形成的一种化合物叫三聚氰胺(结构如右图),由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。
三聚氰胺中二种环境的N原子的杂化形式分别是。
