物质在氧气中燃烧现象归纳
九年级化学上册SFeCP等物质在氧气中的燃烧知识点深度解析粤教版

S,Fe,C,P等物质在氧气中的燃烧∙氧气的化学性质很活泼,很多物质都能与氧气发生化学反应。
∙部分物质在空气中和氧气中反应的对比:a)碳和氧气反应方程式:C + O2CO2现象:剧烈燃烧,发白光,放热,生成使澄清石灰水变浑浊的气体b)硫和氧气反应方程式:S + O2SO2现象:发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体注意:实验前应在瓶底放少量水,用来吸收生成的有毒气体。
c)红磷和氧气反应:方程式:4P + 5O22P2O5现象:发出耀眼的白光,放热,生成大量白烟生成的P2O5是固体小颗粒,现象为白烟,不是白雾。
d)铁和氧气的反应:方程式:3Fe + 2O2Fe3O4现象:剧烈燃烧,火星四射,放出热量,生成黑色物质注意:集气瓶底放一层细沙或少量水。
e)镁和氧气反应:方程式:2Mg + O22MgO现象:剧烈燃烧,发出耀眼的白光,放出热量,生成白色粉末状固体,有白烟。
注意:不能手持镁条,应用坩埚钳夹持。
f)石蜡和氧气反应文字表达式:石蜡+氧气水+二氧化碳现象:剧烈燃烧,放出热量,发出白光,如果在火焰上方罩一个干冷烧杯,烧杯内壁有水珠,生成使澄清石灰水变浑浊的气体。
∙烟和雾的区别:a)烟:大量固体小颗粒分散在空气长产生烟。
红磷燃烧产生大量白烟,是燃烧生成的固体P2O5分散在空气中形成的b)雾:大量小液滴分散在气体中产生雾。
打开盛浓盐酸的瓶塞,瓶口有白雾,是挥发的HCl气体遇到空气中的水蒸气形成了盐酸小液滴。
a)光:固体物质燃烧使发光。
镁条燃烧发出耀眼的强光,木炭在氧气中燃烧产生白光b)气体物质和容易气化的物质燃烧时产生火焰。
蜡烛在氧气中燃烧产生白色的火焰,是石蜡熔化后生成的气体燃烧而产生的。
描述物质在氧气中燃烧的现象的技巧:可按三个顺序从三个方面进行:(1)剧烈燃烧,有什么颜色的光,火焰;(2)放热;(3)生成物的特性。
初中化学知识点归纳燃烧的基本概念与特征分析

初中化学知识点归纳燃烧的基本概念与特征分析初中化学知识点归纳——燃烧的基本概念与特征分析燃烧是化学学科中一个非常重要的基本现象,也是我们日常生活中常见的现象之一。
通过研究燃烧,我们可以更好地理解物质的性质和变化过程。
本文将对初中化学中关于燃烧的基本概念和特征进行归纳与分析。
一、燃烧的基本概念燃烧是物质与氧气或氧化剂反应,放出大量的光和热能,并伴随着产生新的物质的过程。
要发生燃烧,需要同时具备以下三个条件:燃料、助燃剂和点火源。
1. 燃料:燃烧过程中能够提供能量的物质称为燃料。
常见的燃料有木柴、煤、石油、天然气等。
这些物质中含有大量的化学能,通过与氧气反应释放出来。
2. 助燃剂:助燃剂是一种能够提供氧气供给燃料的物质。
在大气中,氧气是最主要的助燃剂,它占据了空气中的21%。
在一些特殊情况下,也可以使用其他氧气化合物作为助燃剂。
3. 点火源:点火源是引发燃烧的外部能量,它能够使燃料达到着火温度。
常见的点火源有火柴、火焰、电火花等。
二、燃烧的特征分析1. 需要氧气或氧化剂:燃烧是一种氧化反应,必须有氧气或氧化剂的参与才能进行。
在空气中,氧气是最常见的氧化剂,但并非所有物质都能够与氧气直接反应,因此一些物质需要配合其他氧化剂才能发生燃烧。
2. 放出热能和光能:燃烧是一种放热反应,随着反应进行,会释放大量的热能。
这种热能的释放是由于化学键的断裂和新键的形成所带来的能量变化。
同时,也会伴随着光能的释放,从而产生明亮的火焰。
3. 产生新物质:燃烧过程中,燃料与氧气反应生成新的物质。
例如,木材燃烧时会生成二氧化碳和水。
在完全燃烧的情况下,燃料中的所有碳和氢都将完全氧化,生成二氧化碳和水。
4. 可燃物质与不可燃物质:根据物质的燃烧性质,我们将物质分为可燃物质和不可燃物质。
可燃物质是指能够与氧气反应发生燃烧的物质,如木材、煤、石油等。
而不可燃物质则是指不能与氧气反应发生燃烧的物质,如金属、石英等。
5. 燃烧的分类:按燃烧方式的不同,燃烧可以分为明火燃烧和隐火燃烧。
物质与氧气反应实验现象的总结
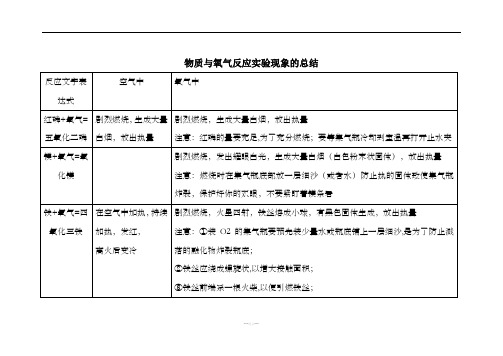
在空气中加热,持续加热ห้องสมุดไป่ตู้发红,
离火后变冷
剧烈燃烧,火星四射,铁丝熔成小球,有黑色固体生成,放出热量
注意:①装O2的集气瓶要预先装少量水或瓶底铺上一层细沙,是为了防止溅落的融化物炸裂瓶底;
②铁丝应绕成螺旋状,以增大接触面积;
③铁丝前端系一根火柴,以便引燃铁丝;
④待火柴将要燃尽时,才能将铁丝由上向下缓慢伸入瓶中;
物质与氧气反应实验现象的总结
反应文字表达式
空气中
氧气中
红磷+氧气=五氧化二磷
剧烈燃烧,生成大量白烟,放出热量
剧烈燃烧,生成大量白烟,放出热量
注意:红磷的量要充足,为了充分燃烧;要等集气瓶冷却到室温再打开止水夹
镁+氧气=氧化镁
剧烈燃烧,发出耀眼白光,生成大量白烟(白色粉末状固体),放出热量
注意:燃烧时在集气瓶底部放一层细沙(或者水)防止热的固体致使集气瓶炸裂,保护好你的双眼,不要紧盯着镁条看
⑤铁丝上不能有漆或有锈,使用前先用砂纸打磨干净.
铁锈是Fe2O3,不会跟O2反应,所以,要除去铁丝表面的锈
碳+氧气=二氧化碳
木炭红热,无烟无焰,生成无色无味的能使澄清石灰水变浑浊的气体,放出热量
剧烈燃烧,发出白光,生成无色无味的,能使澄清石灰水变浑浊的气体,放出热量
注意事项:先将木炭在空气中烧至红热,然后由上到下缓缓伸入充满氧气的集气瓶.这是为了防止因受热膨胀的氧气溢出集气瓶,也可以使木炭充分与氧气接触.
硫+氧气 =二氧化硫
剧烈燃烧,发出淡蓝色火焰,生成有刺激性气味的气体,放出热量
剧烈燃烧,发出蓝紫色火焰,生成有刺激性气味的气体,放出热量
注意:需要给集气瓶内装上少量水,因为硫在氧气中点燃生成二氧化硫,是有毒气体,它溶于水.
炭,铁,磷,硫在氧气中燃烧的实验及现象
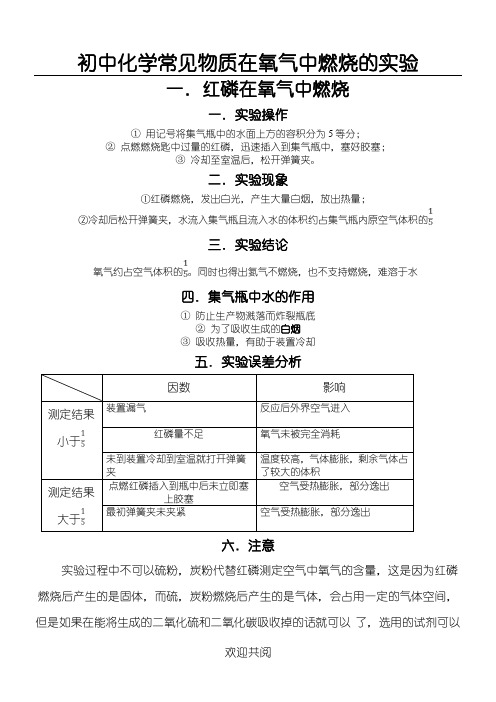
初中化学常见物质在氧气中燃烧的实验
一.红磷在氧气中燃烧
一.实验操作
①用记号将集气瓶中的水面上方的容积分为5等分;
②点燃燃烧匙中过量的红磷,迅速插入到集气瓶中,塞好胶塞;
③冷却至室温后,松开弹簧夹。
二.实验现象
四.集气瓶中水的作用
小于
大于
六.注意
实验过程中不可以硫粉,炭粉代替红磷测定空气中氧气的含量,这是因为红磷燃烧后产生的是固体,而硫,炭粉燃烧后产生的是气体,会占用一定的气体空间,但是如果在能将生成的二氧化硫和二氧化碳吸收掉的话就可以了,选用的试剂可以
是氢氧化钠
二.铁丝在氧气中燃烧
一.实验现象
①在空气中加热铁丝只能烧到发红,不燃烧
②在氧气中剧烈燃烧,火星四射,放出大量热,生产黑色固体
二.实验操作
①
a.
硫(淡黄色固体)
硫的熔点很低,所以燃烧时为液态
在空气中燃烧:淡蓝色;在氧气中燃烧:蓝紫色
二.实验现象
蓝紫色火焰,放出热量,生产有刺激性气味的气体
三.注意事项
硫的用量不能过多,防止造成空气污染
四.集气瓶底部留有少量水的作用
①吸收有毒气体二氧化硫
四.木炭在氧气中燃烧
..
④。
(完整版)物质在氧气中燃烧现象归纳
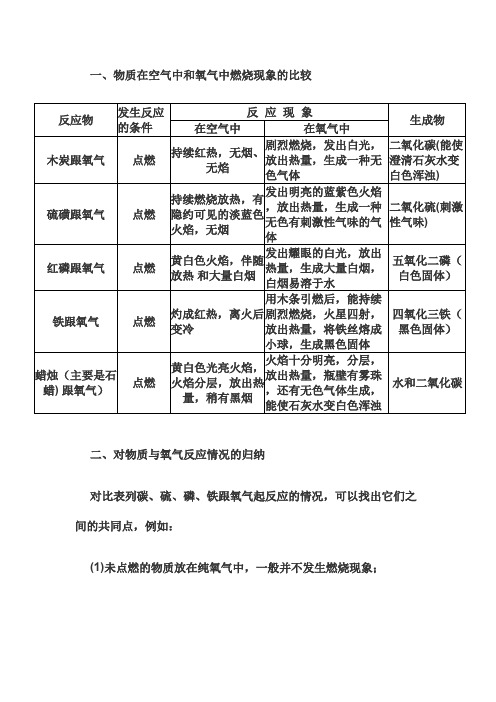
一、物质在空气中和氧气中燃烧现象的比较
二、对物质与氧气反应情况的归纳
对比表列碳、硫、磷、铁跟氧气起反应的情况,可以找出它们之间的共同点,例如:
(1)未点燃的物质放在纯氧气中,一般并不发生燃烧现象;
反 应 现 象
反应物发生反应的条件在空气中在氧气中
生成物木炭跟氧气
点燃
持续红热,无烟、
无焰
剧烈燃烧,发出白光,
放出热量,生成一种无
色气体
二氧化碳(能使澄清石灰水变白色浑浊)硫磺跟氧气点燃
持续燃烧放热,有
隐约可见的淡蓝色
火焰,无烟
发出明亮的蓝紫色火焰
,放出热量,生成一种
无色有刺激性气味的气
体
二氧化硫(刺激性气味)红磷跟氧气点燃
黄白色火焰,伴随
放热 和大量白烟
发出耀眼的白光,放出
热量,生成大量白烟,
白烟易溶于水
五氧化二磷(白色固体)铁跟氧气点燃
灼成红热,离火后变冷用木条引燃后,能持续
剧烈燃烧,火星四射,放出热量,将铁丝熔成
小球,生成黑色固体四氧化三铁(黑色固体)
蜡烛(主要是石蜡) 跟氧气)
点燃黄白色光亮火焰,
火焰分层,放出热
量,稍有黑烟
火焰十分明亮,分层,
放出热量,瓶壁有雾珠
,还有无色气体生成,
能使石灰水变白色浑浊
水和二氧化碳
(2)物质在燃烧时有的有火焰、有的无火焰,有的冒烟、有的不冒烟,烟和焰色也各有不同;
(3)在空气中原来不能燃烧(或不能持续燃烧)的物质,在纯氧气中却能燃烧起来,且燃烧得十分剧烈;
(4)前四个实验都是某物质跟氧气相互起化学反应,产生了一种新物质,属于化合反应;
(5)这五种物质都是与氧发生了化学反应,故都属于氧化反应。
物质在氧气中燃烧现象归纳

二、对物质与氧气反应情况的归纳
对比表列碳、硫、磷、铁跟氧气起反应的情况,可以找出它们之间的共同点,例如:
(1)未点燃的物质放在纯氧气中,一般并不发生燃烧现象;
(2)物质在燃烧时有的有火焰、有的无火焰,有的冒烟、有的不冒烟,烟和焰色也各有不同;
(3)在空气中原来不能燃烧(或不能持续燃烧)的物质,在纯氧气中却能燃烧起来,且燃烧得十分剧烈;
(4)前四个实验都是某物质跟氧气相互起化学反应,产生了一种新物质,属于化合反应;
(5)这五种物质都是与氧发生了化学反应,故都属于氧化反应。
化学燃烧知识点归纳总结

化学燃烧知识点归纳总结一、化学燃烧的基本概念1. 燃烧的定义燃烧是指物质在氧气的作用下,放出热和光的化学反应。
在燃烧过程中,物质被氧气氧化,放出大量能量,通常伴随着火焰、烟雾等现象。
2. 燃烧的必要条件燃烧是一种与空气中氧气发生的氧化反应,因此燃烧需要具备以下三个必要条件:燃料、氧气和足够高的温度。
3. 燃料的分类根据物质的化学性质和物理状态,燃料可以分为固体燃料、液体燃料和气体燃料。
4. 燃烧反应的方程式燃烧反应的方程式通常以通用化学式表示,例如:燃料+氧气→氧化产物+能量。
5. 燃烧产物燃烧产物通常为二氧化碳、水和其他气态或固态的氧化物,同时释放出大量的热和光。
二、燃烧的热学特性1. 燃烧热效应燃烧是一种放热反应,是一种释放能量的化学反应。
燃烧反应放出的热量称为燃烧热,通常用单位质量的燃料所释放的热量来表示。
2. 燃烧热的计算燃烧热可以通过实验室测量或理论计算来确定。
测量方法通常采用燃烧热量计,而理论计算方法则利用燃烧反应的方程式和反应热的数据来计算。
3. 燃烧热和燃烧温度燃烧热和燃烧温度之间存在一定的关系,通常情况下,燃烧热越大的燃料,其燃烧温度也越高。
4. 燃烧热的应用燃烧热是衡量燃料能源利用效率的重要参数,也是工业生产和生活用能的重要参考指标。
通过燃烧热的计算和应用,可以对各种燃料的能源利用价值进行评估和比较。
三、燃烧的动力学特性1. 燃烧过程燃烧过程包括燃烧反应的开始、进行和结束三个阶段。
在开始阶段,燃料和氧气进行反应并产生初次燃烧;在进行阶段,燃料和氧气的供给能够维持燃烧反应进行;在结束阶段,燃料和氧气的供给减少,燃烧反应逐渐减弱并最终停止。
2. 燃烧速率燃烧速率是燃料与氧气反应形成燃烧产物的速度,通常使用质量或体积单位的反应物在单位时间内参与反应的量来表示。
3. 燃烧速率的影响因素燃烧速率受到多种因素的影响,主要包括燃料的性质、氧气的浓度、温度、燃料颗粒的大小和形状、燃料与氧气的接触面积等。
物质在氧气中燃烧现象归纳

一、物质在空气中和氧气中燃烧现象的比较
二、对物质与氧气反应情况的归纳
对比表列碳、硫、磷、铁跟氧气起反应的情况,可以找出它们之间的共同点,例如:
(1)未点燃的物质放在纯氧气中,一般并不发生燃烧现象;
(2)物质在燃烧时有的有火焰、有的无火焰,有的冒烟、有的不冒烟,烟和焰色也各有不同;
(3)在空气中原来不能燃烧(或不能持续燃烧)的物质,在纯氧气中却能燃烧起来,且燃烧得十分剧烈;
(4)前四个实验都是某物质跟氧气相互起化学反应,产生了一种新物质,属于化合反应;
(5)这五种物质都是与氧发生了化学反应,故都属于氧化反应。
X。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、物质在空气中和氧气中燃烧现象的比较
二、对物质与氧气反应情况的归纳
对比表列碳、硫、磷、铁跟氧气起反应的情况,可以找出它们之间的共同点,例如:
(1)未点燃的物质放在纯氧气中,一般并不发生燃烧现象;
(2)物质在燃烧时有的有火焰、有的无火焰,有的冒烟、有的不冒烟,烟和焰色也各有不同;
(3)在空气中原来不能燃烧(或不能持续燃烧)的物质,在纯氧气中却能燃烧起来,且燃烧得十分剧烈;
(4)前四个实验都是某物质跟氧气相互起化学反应,产生了一种新物质,属于化合反应;
(5)这五种物质都是与氧发生了化学反应,故都属于氧化反应。
