第十九章配合物习题
配合物练习题

1、2-氨基-1-乙醇分子HO-CH2-CH2-NH2通常以O和N原子与金属原子结合,如Cu(ae)2BrCl,其中铜离子呈八面体配位,ae=-O-CH2-CH2-NH2。
图示Cu(ae)2BrCl的几何异构体和旋光异构体。
2、下列说法错误的是:(A)配体是一种含有电子对给予体的原子或原子团(B)配位数是指直接与中心原子连接的配体总数(C)广义地说,所有的金属都有可能形成配合物(D)配离子既可存在于溶液中,也有可能存在于晶体中3、对[Co(en)2Cl2]Cl下列说法正确的是:(A)中心原子的杂化方式为d2sp3(B)中心原子的杂化方式为sp3d2(C)中心原子的杂化方式为sp3(D)形成体的电荷为+14、已知[PdCl2(OH)2]2–有两种不同的结构,成键电子所占据的杂化轨道应该是:(A)d2sp3(B)sp3和d2sp2(C)sp3(D)dsp25、下列说法不对的是:(A)配合物中,中心原子本身只能带正电荷(B)配体除带负电和中性的原子团外,还有正电荷的原子团(C)配合物实际上是一种酸碱加合物(D)很多复盐如光卤石,实际上也是配合物6、有几何或旋光异构体的配合物是:(A)[Zn(OH)2(H2O)2](B)[Ni(CN)4]2–(C)[Ag(NH3)2]+(D)[Co(NH3)3Cl2Br]7、具有下列化学式的配合物有多少种几何异构体?1、MA4BC2、MA3B2C3、MA2B2C24、MA2BC(四面体)5、MA2BC(平面正方形)8、根据下列配离子的磁矩实验值,判断它们的空间构型和中心原子的成键轨道。
1、[Mn(NCS)6]4– 6.1 B.M.2、[Co(NO2)6]4– 1.8 B.M.3、[Ni(NH3)4]2+4、[CuCl4]2–9、利用价键理论解释下列实验事实:1、(NH4)3ZnCl5中不存在ZnCl53–配离子,它是NH4Cl和(NH4)2ZnCl4的复盐。
2、(NH4)2CuCl3的晶体中含有四面体的[CuCl4]3–配离子的无限长链。
配合物习题
有一些五边形碳环和七边形碳环,试问 (1)这些五、七边形碳环在碳纳米管的什么位置比较 多? (2)你认为碳纳米管可能具有超导特性吗?为什么?
[答案:]
(1)碳纳米管管身弯曲开叉部位,以及两端封闭部 分。 (2)可能。由于这种碳纳米管可以看成石墨结构卷 曲而成,所以在它的径向存在自由电子导电,所以可能 具有超导性(其它答案只要合理均可给分)
部结合O2,然后随血液输送到体内需氧部位,在那里,O2便
被H2O取代出来。通常在铁的配合物中结合有各种小分子,如 O2、H2O和CO等,它们结合力的强弱顺序为CO》O2≈H2O。 据此,请简要分析使用家用燃气热水器,为什么有时会出现伤 亡事故。 (1)若热水器的燃气主要成分为丙烷(C3H8),燃烧时的
• (1)写出形成A的化学反应方程式。 • (2)画出B和C的结构示意图。 • (3)在形成化合物A、B、C间涉及哪些化学平衡常数, 请用反应式表示它们间的关系。
解答
(13)
• 铂的配合物{Pt(CH3NH2)(NH3)[CH2(COO)2]}是一种抗癌新 药,药效高而毒副作用小,其合成路线如下:
+Cl-=AgCl↓+2NH4+ CO32-+2H+=CO2↑+H2O
[例题] [2001年江苏省高中学生化学奥林匹克竞赛(预赛)试题 ] 碳纳米管(CNTs—Carbon Nanotubes)的发现是材料科 学研究领域的一个新的突破,它又称巴基管(Buckytube) ,属富勒(F ullerene)碳系,是伴随着C60的研究不断深入 而出现的。碳纳米管是处于纳米级范围内,具有完整分 子结构的新型材料。典型的碳纳米管直径小于100nm, 长度为几μm。(注:lnm=10-9m,1μm=10-6m)CNTs 的基 本结构主要由六边形碳环组成,此外还
配合物

配合物习题1.下列关于叙述中,正确的是.()[Fe(CN)6]3-和[FeF6]3-的空间构型都为八面体形,但中心离子的轨道杂化方式不同。
[Fe(CN)6]3-是内轨型配合物,呈反磁性,磁矩为0; K3[FeF6]和K3[Fe(CN)6]都呈顺磁性;Fe2+的六配位配合物都是反磁性的;所有Fe3+的八面体配合物都属于外轨型配合物。
2.下列关于叙述中,错误的是.()Ni2+的四面体构型的配合物,必定是顺磁性的。
()Ni2+的平面四方形构型的配合物,必定是反磁性的。
.()所有Ni2+的八面体配合物都属于外轨型配合物。
()已知K2[Ni(CN)4]与Ni(CO)4均呈反磁性,所以这两种配合物的空间构型均为平面正方形。
3.已知下列配合物磁矩的测定值,按价键理论判断属于外轨型配合物的是()。
(A)[Fe(H2O)6]2+,5.3B.M.;(B)[Co(NH3)6]3+,0B.M.;(C)[Fe(CN)6]3-,1.7B.M.;(D)[Mn(CN)6]4-,1.8B.M.。
4.价键理论可以解释配合物的()。
(A)磁性和颜色;(B)空间构型和颜色;(C)颜色和氧化还原性;(D)磁性和空间构型。
5.下列叙述中错误的是.()。
(A)一般地说,内轨型配合物较外轨型配合物稳定;(B)ⅡB族元素所形成的四配位配合物,几乎都是四面体构型;(C)CN-和CO作配体时,趋于形成内轨型配合物;(D)金属原子不能作为配合物的形成体。
6.[AlF6]3-中,Al3+杂化轨道类型是()。
(A)sp3;(B)dsp2;(C)sp3d2;(D)d2sp3。
7.下列配合物中,属于内轨型配合物的是()。
(A)[V(H2O)6]3+,μ=2.8B.M.;(B)[Mn(CN)6]4-,μ=1.8B.M.;(C)[Zn(OH)4]2-,μ=0B.M.;(D)[Co(NH3)6]2+,μ=4.2B.M.。
8.下列叙述中错误的是.()。
(A)Ni2+形成六配位配合物时,只能采用sp3d2杂化轨道成键;(B)Ni2+形成四配位配合物时,可以采用dsp2或sp3杂化轨道成键;(C)中心离子采用sp3d2或d2sp3杂化轨道成键时,所形成的配合物都是八面体构型;(D)金属离子形成配合物后,其磁矩都要发生改变。
配合物思考与习题

配合物思考题与习题1.请写出下列各配合物的中心离子、配位体、中心离子氧化数、配位离子的电荷数及配合物名称:(1)K[AgI2];(2)[Cr(NH3)5Cl]SO4;(3)Na3[AlF6];(4)[Co(H2O)4(NH3)2]Cl2;(5)[Cr(NH3)4Cl2]Cl;(6)K4[Fe(CN)6];(7)[CoCl2(NH3)3(H2O)]Cl;(8)PtCl4(NH3)2;(9)[Co(NO2)3(NH3)3];(10)[Ag(NH3)2]Cl;(11)PtCl2(NH3)2;2.写出下列各物化学式:(1)四水二氰合铁(Ⅲ)离子;(2)四氨草酸合镍(Ⅱ)离子;(3)六氰合锰(Ⅲ)酸钾;(4)四氯合金(Ⅲ)离子;(5)二硫代硫酸合银(Ⅰ)离子。
3.写出下列配合物的分子结构:(1)顺-二氯·四氰合铬(Ⅲ);(2)面-三硝基·三水合钴(Ⅲ)。
4.写出平面型配合物Mabcd分子:[Pt(NH3)(NH2OH)Py(NO2)]+的可能的几何异构体(配体中的配位原子都是氮)。
5.已知[Ni(CO4)]和[Ni(CN)4]2-为反磁性的,试判断其中心体(原子和离子)的构型、杂化轨道和配合物空间构型,并指出它们属内轨型还是外轨型配合物。
6.Cr3+,Cr2+,Mn2+,Fe2+,Co3+,Co2+离子在强的和弱的正八面体晶体场中各有多少未成对电子,绘图说明t2g和e g电子数目。
7.为什么F—O—N—C电负性依次减小而CN-,CO在化学光谱序列中的配位能力远远强于卤素负离子?8.试讨论配合物中配位类型:σ型,π型。
9.配合物价键理论和晶体场理论的基本要点各是什么?后者比前者有何优点?晶体场理论如何解释配离子的颜色问题?10.命名下列配合物P(C3H7)3PtSCNPtNCS SCNNCS(C3H7)3 POHCoH3NH3NH3N OHONCo NH3NH3NH3O3+。
配合物练习题

8. (8 分) 朗伯-比耳定律可表示为 A=ε·b·c,即当入射光波长 λ 及光程 b 一定时,在一定浓 度范围内, 有色物质的吸光度 A[A=log(I0/I),其中 I0 和 I 分别为入射光强度和透射 光强度]与该物质的浓度 c 成正比。这是采用分光光度法进行定量分析的基础。 在一定的条件下,Fe2+(电子构型 3d6)与邻二氮菲(phen,结构式如后)生 成稳定的桔红色配合物[Fe(phen)n]2+。 实验表明该配合物在 516nm 附近产生最大 的 吸 收 。 固 定 Fe2+ 离 子 浓 度 为 c0 =8× 10-6mol· L-1 不 变 而 改 变 配 体 浓 度 c(phen)=k· c0,在 λ=516nm 的条件下测得的吸光度 A 随 k 变化的一组数据如下表 所示 k 0.1 0.5 0.02 6 1.0 0.04 8 2.0 0.09 6 3.0 0.14 5 4.0 0.14 5 5.0 0.14 5 6.0 0.14 5 8.0 0.14 5 10 0.14 6 100 0.14 7
POD 构象,上述分析的依据是 42、 cis-Pt(NH3)2Cl4和cis-PtCl2(en)等是目前临床上广泛使 用的抗癌药物,尤其对早期的睾丸癌具有很高的治愈率。实验测得它们都是反磁 性物质。(en为乙二胺) ① Pt2+ 和 Pt4+ 的价电子构型分别为 和 ,上述配合物都是
A
0.8 0.6 0.4 0.2
b/(a+b)
0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
11-3
该配合物中心离子的杂化轨道类型是____________,该配合物的理论磁距
是________,该配合物的晶体场稳定化能是____________________。 11-4 已知 Fe2+可与某配体 X 生成蓝色配合物 FeXn,对应的吸光波长在 590nm
配合物习题

1、[Ni(en)3]2+离子中镍的价态和配位数是(C)(A) +2,3 (B) +3,6 (C) +2,6 (D) +3,32、0.01mol氯化铬( CrCl3·6H2O )在水溶液中用过量AgNO3处理,产生0.02molAgCl沉淀,此氯化铬最可能为(B)(A) [Cr(H2O)6]Cl3(B) [Cr(H2O)5Cl]Cl2·H2O(C) [Cr(H2O)4Cl2]Cl·2H2O (D) [Cr(H2O)3Cl3]·3H2O3、在[Co(en)(C2O4)2]配离子中,中心离子的配位数为(D)(A) 3 (B) 4 (C) 5 (D) 64、假定下列配合物浓度相同,其中导电性(摩尔电导)最大的是(B)(A)[PtCl(NH3)5]Cl3(B)[Pt(NH3)6]Cl4(C)K2[PtCl6 ] (D) [PtCl4(NH3)2]5、下列八面体或正方形配合物中心原子的配位数有错误的是(B)(A) [PtNH2NO2(NH3)2] (B) [Co(NO2)2(en)2Cl2](C) K2[Fe(CN)5(NO)] (D) [PtCl(Br)(Py)(NH3)]6、Fe3+具有d5电子构型,在八面体场中要使配合物为高自旋态,则分裂能△和电子成对能P所要满足的条件是(C)(A) △和P越大越好(B) △>P (C) △<P (D) △=P7、根据晶体场理论,在八面体场中,由于场强的不同,有可能产生高自旋和低自旋的电子构型是(C)(A) d2(B) d3(C) d4(D) d88、已知[PdCl2(OH)2]2—有两种不同的结构,成键电子所占据的杂化轨道是(D)(A) sp3(B) d2s p3(C) sp3和dsp2(D) d s p29、已知某金属离子配合物的磁矩为4.90 B.M.,而同一氧化态的该金属离子形成的另一配合物,其磁矩为零,则此金属离子可能为(C)(A) Cr(Ⅲ) (B) Mn(Ⅱ) (C) Fe(Ⅱ) (D) Mn(Ⅲ)10、已知巯基(-SH)与某些重金属离子形成强配位键,预计是重金属离子的最好的螯合剂的物质为(D)(A) CH3-SH (B) H-SH (C) CH3-S-S-CH3(D) HS-CH2-CH-CH2-OH11、第一过渡系列二价金属离子的水合热对原子序数作图时有两个峰,这是由于(D)(A) 前半系列是6 配位,后半系列是4 配位(B) d电子有成对能(C) 气态离子半径大小也有类似变化规律(D) 由于晶体场稳定化能存在,使水合热呈现这样的规律12、[NiCl4]2-是顺磁性分子,则它的几何形状为(B)(A) 平面正方形(B) 四面体形(C) 正八面体形(D) 四方锥形13、[Fe(H2O)6]2+的晶体场稳定化能(CFSE)是(A)(A) -4 Dq (B) -12 Dq (C) -6 Dq (D) -8 Dq14、[Ni(CN)4]2-是平面四方形构型,中心离子的杂化轨道类型和d电子数分别是(D)(A) sp2,d7(B) sp3,d8(C) d2sp3,d6(D) dsp2,d815、如果下列配合物确实存在,预计配合物中有最大的10 Dq值的是(B)(A) Ni(NH3)62+(B) Rh(NH3) 62+(C) Co(NH3) 62+(D) Fe(NH3) 62+16、下列离子或化合物中,具有顺磁性的是(B)(A) Ni(CN)42-(B) CoCl42-(C) Co(NH3)63+(D) Fe(CO)517、Fe的原子序数为26,化合物K3[FeF6]的磁矩为5.9玻尔磁子,而K3[Fe(CN)6]的磁矩为2.4玻尔磁子,这种差别的原因是(B)(A) 铁在这两种配合物中有不同的氧化数(B) CN-比F-引起的晶体场分裂能更大(C) F比C或N具有更大的电负性(D) K3[FeF6]不是配位化合物18、下列离子具有最大晶体场稳定化能的是(B)(A) Fe(H2O)62+(B) Ni(H2O)62+(C) Co(H2O)62+(D) Mn(H2O)62+19、Mn(Ⅱ)的正八面体配合物有很微弱的颜色,其原因是(B)(A) Mn(Ⅱ)的高能d轨道都充满了电子(B) d-d跃迁是禁阻的(C) 分裂能太大,吸收不在可见光范围内(D) d5离子d能级不分裂20、不具有空间异构体的是(D)(A) [PtCl2(NH3)4]2+(B) [PtCl3(NH3)3]+(C) [PtCl(NO2)(NH3)4]2+(D) [PtCl(NH3)5]3+21、[Co(NO2)(NH3)5]Cl2和[Co(ONO)(NH3)5]Cl2属于(D)(A) 几何异构(B) 旋光异构(C) 电离异构(D) 键合异构22、已知M为配合物的中心原子(或离子),A,B,C为配位体,在具有下列化学式的配合物中,仅存在两种几何异构体的为(C)(A) MA5B (B) MA2B2C2(C) MA2BC(平面正方形) (D) MA2BC(四面体)23、中心原子以sp3杂化轨道形成配离子时,可能具有的几何异构体的数目是(D)(A) 4 (B) 3 (C) 2 (D) 024、以下两种配合物[PtBr(NH3)3]NO2和[Pt(NO2)(NH3)3]Br互为(B)(A) 几何异构(B) 电离异构(C) 旋光异构(D) 键合异构25、向[Cu(NH3)4]2+水溶液中通入氨气,则( )(A) K稳[Cu(NH3)4]2+增大(B) [Cu2+]增大(C) K稳[Cu(NH3)4]2+减小(D) [Cu2+]减小26、在0.20 mol·dm-3[Ag(NH3)2]Cl 溶液中,加入等体积的水稀释(忽略离子强度影响),则下列各物质的浓度为原来浓度的1/2的是(C)(A) c([Ag(NH3)2]Cl) (B) 离解达平衡时c(Ag+)(C) 离解达平衡时c(NH3·H2O) (D) c(Cl-)27、下列反应中配离子作为氧化剂的反应是(B)(A) [Ag(NH)2]Cl + KI AgI↓+ KCl + 2NH3(B) 2[Ag(NH 3)2]OH + CH3CHO CH3COOH + 2Ag↓+ 4NH3 + H2O(C) [Cu(NH 3)4]2+ + S2-CuS↓+ 4NH3]4-+ 4Fe3+Fe4[Fe(CN)6]3(D) 3[Fe(CN)28、下列配合物的稳定性,从大到小的顺序,正确的是(C)(A)[HgI4]2->[HgCl4]2->[Hg(CN)4]2-(B) [Co(NH3)6]3+>[Co(SCN)4]2->[Co(CN)6]3-(C)[Ni(en)3]2+>[Ni(NH3)6]2+>[Ni(H2O)6]2+ (D) [Fe(SCN)6]3->[Fe(CN)6]3->[Fe(CN)6]4-29、根据配离子的K稳值判断下列Eθ值最小的是(B)(A) Eθ(Ag+/Ag) (B) Eθ{[Ag(CN)2]-/Ag}(C) Eθ{[Ag(S2O3)2]3-/Ag} (D) Eθ{[Ag(NH3)2]+/Ag}30、AgI在下列相同浓度的溶液中,溶解度最大的是(A)(A) KCN (B) Na2S2O3(C) KSCN (D) NH3·H2O31、下列哪种离子在弱的八面体中具有最大的晶体场稳定化能(C)(A) d1(B) d2(C) d3(D) d432、在八面体场中,中心离子d轨道在配位体场的作用下分裂成(B)(A)能量不等的五组轨道(B)能量较高的d x2-y2,d z2和能量较低的dxy,dyz,dxz(C)能量较高的dxy,dyz,dxz和能量较低的d x2-y2,dz2(D)能量不等的四组轨道。
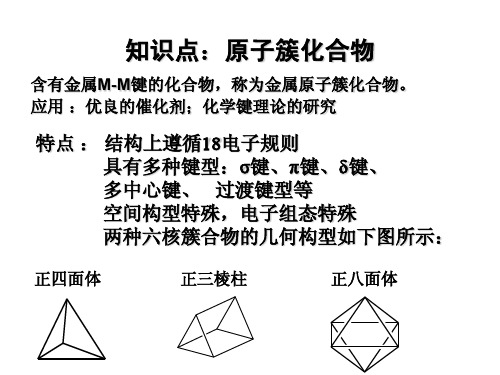
第十九章 配合物习题

D. 2.74× 10 )
26. 已知 AgI 的 K=K,〔Ag(CN)〕的 K 稳=K,则下列反应的平衡常数为( AgI(S)+2CN〔Ag(CN)〕+I A. K1· K B. K1/K C. K2/K ) B. 〔FeF〕 D. 〔Zn(NH)〕 ) B. 〔Mn(NCS)〕 D. 〔CuCl〕 D.K1+K
配合物,一氯· 硝基· 四氨合钴(Ⅲ)的化学式为(
A. 〔Co(NH)(NO)Cl〕 B. 〔Co(NH)(NO)〕Cl C. 〔Co(NH)(ONO)Cl〕 10. Na〔B(NO)〕的正确命名是( A. 硝酸合四硼酸(Ⅰ)钠 C. 四硝基硼酸钠 11. cis〔PtCl(phP)〕的正确命名是( ) B. 四硝酸合硼酸(Ⅲ)钠 D. 四硝酸根合硼(Ⅲ)酸钠 ) D. 〔Co(NH)(ONO)〕Cl
A. 配离子的稳定性依赖于螯环的大小,环越大越稳定 B. 配离子的稳定性依赖于螯环的大小,环越小越稳定 C. 一般情况下,五圆环最稳定 D. 由于配位原子间键张力的存在,四圆环的形成较容易 42. CoCl3· 4NH用硫酸溶液处理再结晶,SO42-可取代化合物中的 Cl-,但氨的摩尔质量不变. 用过量的 AgNO溶液处理该溶液,每摩尔钴可得 1molAgCl 沉淀,这种化合物应是 ( ) A. 〔Co(NH)〕Cl C. 〔Co(NH)Cl〕Cl B. Co(NH)· Cl D. 〔Co(NH)Cl〕Cl
A. 〔HgCl〕,HgI,〔HgI〕 C. HgCl,HgCl,〔HgI〕
45. 在 0.1mol· LK〔Ag(CN)〕溶液中,加入固体 KCl,使 Cl的浓度为 0.1mol· L,可发 生下列何种现象( )
(KAgCl=1.56× 10,K〔Ag(CN)〕=1× 10) A. 有沉淀生成 C. 有气体生成 二.填空题 1. 选择配位 (A) 中心原子 (B) 配位体 (C) 配位原子 (D) 配阴离子 (E) 外界 B. 无沉淀生成 D. 先有沉淀然后消失
张祖德《无机化学习题》及答案第十九章

第十九章 答案1. (1) 2FeCl 3 + H 2S 2 + S↓ + 2HCl (2) 2FeSO 4 + Br 2 + H 2SO 42(SO 4)3 +2HBr(3) FeCl 3+6NaF3FeF 6 + 3NaCl (4) 2FeCl 3 + 2KI2 + 2FeCl 2(5) Fe 3+ + K + + [Fe(CN)6]4—6↓ (6) Fe 2+ + K + + [Fe(CN)6]3—6↓ 2. (1) Co 2O 3 + 6HCl 2 + Cl 2 + 3H 2O (2) 2K 4[Co(CN)6O 3[Co(CN)6] + 2KOH (3)2Co(OH)2 + H 2O 3(4) Co(NO 3)22[Co(SCN)4] + 2KNO 3 (5) Ni + 4CO Ni(CO)4 (6) 2Ni(OH)2 + Br 2 + 2H 2O 3 + 2HBr3. 三角双锥型,dsp 3杂化,3d 8:4. 铁有+2、+3、+6氧化态,+3氧化态最稳定,因为Fe 3+ 3d 5半满,稳定;钴有+2、+3氧化态,+2氧化态最稳定,因为Co 一般失去4s 2电子,所以+2氧化态稳定; 镍有+2、+3、+4氧化态,Ni 一般也失去4s 2电子,所以+2氧化态稳定。
5.(1) 3Pt + 4HNO 3 + 18HCl 2PtCl 6 + 4NO + 8H 2O由于NOCl 的产生增加了氧化性,PtCl 62-的形成而增加了Pt 的还原性。
(2) H 2PtCl 6 (3) Pt(OH)4 + 2KOH 2[Pt(OH)6] (4) K 2PtCl 6 + SO 2 + 2H 2O 2PtCl 4 + H 2SO 4 + 2HCl(5) 铂溶于王水、盐酸—H 2O 2、盐酸—高氯酸的混合液中,热的浓硫酸也能缓慢地溶解铂生成Pt(OH)2·(HSO 4)2,熔化的苛性碱或过氧化钠对铂的腐蚀性很严重;硫或金属硫化物在加热时能与铂作用;硒和碲也容易与铂作用;磷或还原气氛中的磷化物和磷酸盐都容易与铂反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十七章配合物习题一.选择题1.对中心形成体的正确说法是()A.一般是金属阳离子B.一般是金属阳离子,中性原子,也可以是非金属阳离子或阴离子C.只能是金属阳离子D.以上几种说法都对2.对配位体的正确说法是()A.应该是带负电荷的阴离子B应该是中性分子C.可以是中性分子,也可以是阴离子D.应该是多电子原子(或离子)常见的是VAVIAAHIA等族原子3.下列不能做为配位体的物质是()A.C焚H鏈NH鑽B. CH炽NH鑽C. NH燎烟D. NH炽4.下列可以做为由陆酸配体的物质是()A.C炽H厦B.COC.D.C^H燮5.某配合物中心形成体半径大小适中,其氧化数朋3,若配体为中性分子,问其配位数应该为()A. 2B.3C.4D.66.当O.Olmol氯化珞(I I I)(CrC炽6H鎧O)在水溶液中用过量的硝酸银处理时,有0.02mol氯化银沉淀析岀,此样品的配离子的表示式为()A.(Cr(H鑼0)熒)烽B. (CrCl(H鐺0)鎳)祸C.(CrCl鐺(H鑼0)燎)烟D.(CrCl 炽(H 鑼0)炽)7.对中心原子的配位数下列说法不正确的是()A.能巫接与中心原子配位的原子数口称为配位数B.中心原子电荷越高,配位数就越大C.中性配体比阴离子配体的配位数大D.配位体的半径越尢配位数越大&在配位化合物中,一般作为中心形成体的元素是()A.非金属元素B.过渡金属元素C.金属元素D.IIIBIRVinB族元素9.配合物,一氯•硝基四氨合钻(III)的化学式为()A.〔Co(NH炽)燎(NOB)C1)烟B. (Co(NH炽凍(NO鑛))C1C. (Co(NH炽)燎(ONO)C1)烟D. (Co(NH炽)燎(ONO))C110.Na 燎)的正确命名是()A.硝酸合四硼酸(I )钠B.四硝酸合硼酸(III)钠C.四硝皋硼酸钠D.四硝酸根合硼(III)酸钠11.cis氓(PtCl鑼妙炽P)鑽)的正确命名是()A.顺琨氓二(三苯基麟)•二氯合钳(11)B.反琨琨二(三苯吗隣)•二氯合钳(II)C.反琨琨二氯二(三苯基麟)合钳(II)D.顺氓氓二氯•二(三苯基麟)合钳(II)12.在配位化合物的内界,若有多种无机配体和有机配体,其命名顺序为()A.阴离子氓氓阳离子氓氓中性分子氓氓有机配体B.阳离子氓琨中性分子氓琨阴离子氓氓有机配体C.中性分子氓氓阳离子氓琨阴离子氓氓有机配体D.阴离子氓氓中性分子氓氓阳离子氓氓有机配体13.(Co(NH炽)鎳H鑽O) C1炽的正确命名是()A.一水五氨基氯化钻B.三氯化一水•五氨合钻(II)C.三氯化五氨水合钻(III)D.三氯化水•五氨合钻(III)14. K燎(Fe(CN)燮)的错误名称是()A.铁氧化钾B.六貳合铁酸钾C.六氧合铁酸(4・)钾D.六氟合铁(II)酸钾E.黄血盐15. (NH燎)炽(CrCl鑽(SCN)燎)的命名是()A.四硫氤酸根•二氯合珞(III)酸钱B.二氯四個氧酸根)合做III)酸镀C.二氯四硫貳酸根合珞(III)酸饮D.四异硫氟酸根•二氯合锯(III)酸鞍16.(Cr(H鑽O)(en)(C鎮0燎)OH)的正确命名是( )A.一疑基一草酸根一水•一乙二胺合铮(III)B.一疑基•水草酸根乙二胺合珞(I【I)C.一水一轻基•草酸根•乙二胺合铠(111)D.乙二胺•一水一疑基一草酸根合珞(III)17.配合物氯化二(异硫鼠酸根)•四氨合珞(III)的化学式为()A.(Cr(NH炽)燎(SCN)鐺)C1B.(Cr(NH炽)燎(NCS)鑼)C1C.(Cr(NH 炽)燎(SCN)鎬C1)D.(Cr(NH 炽)燎(NCS)鑼C1)18.关于螯合物的泌不正确的是( )A.螯合物的配位体是多齿配体,与中心原子形成环状结构B.螯合物中环愈多愈稳定C.螯合剂中有空间位阻时,螯合物稳定性越小D.螯合剂中配位原子相隔越远形成的环越尢螯合物稳定性越大19.在下列正方形和八面休的几何构型中,以CO炽涸为螯合剂的是()A.(Co(NH炽)鎳CO炽)烟B.(Pt(en)CO 炽)C.(Pt(en)(NH 炽)CO 炽)D.(Pt(NH炽)燎(NO鑼)Cl)CO炽20.关于螯合物的正确叙述是()A.螯合物是一类很稳定的配合物,很少岀现分级配合的现象B.螯合剂均为有机物C.螯合剂的配位原子三面必须相隔2琨3个非配位原子以形成较稳定的环或六圆环螯合物.D.形成螯合物时,在配位原子附近必须有足够的空间使金属离子进入螯合剂结构的一定位置21.H坐能溶于王水,是因为()A.酸解B.氧化还原C.配合作用D.氧化还原和配合作用22.有一溶液含有O.lmol的NH炽,0.01mol的NH燎C1和0.15mol的[Cu(NH炽)燎)祸混和,此溶液中相互作用的结果是(体积变化略)()A.有Cu(OH)鑼沉淀生成B.无Cu(OH)鑼沉淀生成C.溶液形成缓冲体系D. (Cu(NH炽)燎)衲浓度增大23.配位酸或配位碱比相应的普通酸或普通碱的酸性或碱性强其原因是()A.配位酸,碱较稳定B.配位酸,碱较不稳定C.H烟或OH;蘋为配位酸或碱的外界D.配位后极性增强24.下列说法错误的是()A. 金属离子形成配离子后,它的标准电极电势值一般要低B. 配离子越稳定,它的标准电极电势越负C. 配离子越稳定,相应的金属离子越难得电子D. 配离子越稳定,它的标准电极电势越正25. 已知:Ni (NH 炽)燮)祸的逐级稳定常数的对数值为263,2.10,1.59,1.04,0.60,0.08,其 K 稳应为( )A. 1.10x10^B.8.04C. 43x10 濂D.2.74H0 裁AgI(S)+2CN 瀕怕珍(Ag(CN)^)渝I 瀕A.K f K 鑽 BK/K 鑽 CK/K 嬉 DK+K 鑽 27.下列配离子中,属于高自旋的是()(FeF 燮)勝(Zn (NH 炽)燎)祸A. (Co(NH 炽)燮)烽B.C. (Fe(CN)燮)腸D. 28. 下列配离子中,属于低自旋的是()A. (Co(CN)燮)勝B. (Mii(NCS)燮)勝C. (Fe(SCN)燮)勝D. (CuCl 燎)唠E. (Ni(H 鑼0)燮)29. 下列各配合物中,没有反馈邮键的是( )A. (Pt (C 鎮H 燎)C1炽)瀕B. (Fe(CN)燮)勝C. (Ni(CO)燎)D. (FeF 燮)勝30. 下列各组配离子中,几何构型相同的是( )A. (Cd (CN )燎门岡 (PtCl 燎)、阀B. (Ni (CN )燎)澗 (Cu (NH 炽)燎)祸 C. (Zn (CN )燎)涸 (PtCl 燎门岡D. (PtCl 燮)涸 (FcCl 燎)滿 26. 已知 Agl 的 (Ag(CN)鑼) 瀕的K 稳*鑛,则下列反应的平衡常数为(31.已知配离子(CuCl燎)涸的磁矩等于零,其空间构型和中心离子使用的杂化轨道分别是()A.四面体型和sp鋪杂化B.平面正方形和dsp腹杂化C.八面体型和d漫sp蹦杂化D.八面体型和sp蹦d藩杂化32.已知Cii为29号元素,试推测Cu( II)在与氨形成配合物时其配位数,杂化类型和空间构型为()A.4,sp鋪杂化正四而体B.4,dsp漫杂化,平面正方形C.6,sp鋪d裁杂化,八面体型D.4,sp漫d杂化,平面正方形33.配位键亦分为酹琨配键和由[(配键,下列配合物中,属于邮配键的有()A.F&CO)鎮B. (Ni(CN)燎)澗C.H鎮(PtCl燮)D. K (Pt(C鑼H燎)C1 炽)34.配合离子(CuCl鍾)勝的中心离子Cu祸的杂化形式为()A.印裁B.印鋪C.dsp裁D. dspB35.配合物的空间构型和配位数之间有着密切的关系,配位数为4的配合物空间立体构型是()A.正四面体B.正八面体C.直线型D.三角形E.平面正方形36.用H鑛O和C1作配体,写岀Ni祸的正八面体非电解质配合物()A.(Ni但鑼0)燎C1鑽)B.(Ni(H鐺0)炽Cl) C1C.(Ni(H鐺0)鎳C1)烟D.(Ni(H鐺0)炽C1)烟37.在(A1C1燎)瀕中A牌的杂化轨道是()A. sp杂化B. sp裁杂化C. sp銅杂化D. dsp漫杂化38.配离子(Ni(CN)燎)澗的磁矩等于O.OBM判断其空间构型和中心原子的杂化轨道为()A.四面体和sp鋪杂化B.平面正方形和dsp藩杂化C.八面体和sp蹦dj蔓杂化D.八面体和d裁sp绷杂化39.已知螯合物(Fe(C鐺O燎)炽)腸的磁矩等于5.75B.M,其空间构型及杂化轨道类型是()A.八面体型B.三角形C.三角双锥型D.sp蹦d裁杂化E. d裁sp蹦杂化40.比较配合物(Cu(NH炽)鑽)烟与Cu(CN)鑽)滿配离子的稳定性,并说明理由()A.稳定性(Cu(NH炽廣)烟>(Cu(CN)鑼)'瀬B.稳定性(Cu(NH炽)鐺)烟v〔Cu(CN)鑼)瀕C.稳定性无法比较D. CN瀕的碱性强于NH炽E.N原子的原子量大于C41.下列说法正确的是()A.配离子的稳定性依赖于螯环的大小,环越大越稳定B.配离子的稳定性依赖于螯环的大小,环越小越稳定C.一•般情况下,五圆环最稳定D.由于配位原子间键张力的存在,四圆环的形成较容易42.CoCly4NH炽用硫酸溶液处理再结晶,SO/可取代化合物中的CT,但氨的摩尔质量不变.用过量的AgNO炽溶液处理该溶液,每摩尔钻可得linolAgO沉淀,这种化合物应是()A. (Co(NH炽)燎)C1 炽B.Co(NH炽)燎C1 炽C. (Co(NH炽)燎Cl) ClD. (Co(NH炽)燎C1 鎮)C143.EDTA能与金属离子形成配合物拼且配合物极难转化成别种离子.这是因为EDTA与金属离子形成了( )A.简单配合物B.沉淀物C.螯合物D.聚合物44.在O.linol-L®的HgCl鑽溶液中,加入过量的C1:蘋离子,又加入适量的碘离子.问在以上过程中Hg祸离子的主要存在形式为( )A. (HgCl燎门岡Hgl鑽,(Hgl燎门岡B.HgCl鎮Jigl鎮C. HgCl鐺HgCl鐺,(Hgl燎)[岡D.Hg鐺C1 鑽,(Hgl燎)»45.在O.lmol L漩K (Ag(CN)^f)溶液中,加入固体KC1,使Cl瀕的浓度为O.lmol L酿可发生下列何种现象( )(K細AgCM.56xlO漩凜K (Ag(CN)鐺)瀕=1x10漫絢A.有沉淀生成B.无沉淀生成C.有气体生成D.先有沉淀然后消失二.填空题1.选择配位(A)中心原子(B)配位体(C)配位原子(D)配阴离子(E)外界请选择适当的答案填入下列各题:1). (Co(ONO)(NH炽)鎳)SO燎中ONO湧是_______ .2). (Cr(H鐺O)燎C1鎮)C12H鎮0中C烽是_.2.配碗择:(A)0 (B)+2 (C)+3 (D)+4 (E)-l请选择适当的答案填入下列各题:1)_________________________________________ .〔Co(NH炽)炽(NO鑼)炽)中Co的氧化数_________________________________________________ .2). (Fe(CN)B(CO))勝中Fe 的氧化数.3.[Fe(CN)燮]膀的中心离子采用的杂化轨道为,离子的空间构型为 ______________ .三.计算题1.当NH燎CNS和少量Fe烽共存于溶液中直到平衡时,加入NHK使F4(CNS)=lmol LM (问此溶液中FeF燮)腸与(Fe(CNS)炽)的浓度比为多少?(已知K 稳(FeF燮勝)=1310漪澗K 稳(Fe(CNS)炽)=2.0><10銅)2.浓度为0.300molL簾的氨水和0.300mol-的NaCN及0.03molL[簾的Z11C1鎖溶液等体积混和,试求:(Zn(NH3)4)M+4CN]蘋怕參(Zn(CN)4)2+4NH3的平衡常数及平衡时NH炽与CN湧的浓度比。
