电子教案与课件:《精细有机合成》(第三版) 第三章 卤化 第五节
精细有机合成ppt课件

名称由来:最初是从动植物等有机体中提炼出来的,
早期无法人工合成,但目前已经能够人工合成复杂 的有机化合物—有机合成化学。
物理有机化学
有机合成化学 天然产物化学
天然产物合成
有机化学发展领域
金属有机化学 不对称催化 绿色化学 有机材料化学 药物化学与药物设计 农药化学
化学生物学
天然产 物化学
chemistry of natural products
的天然有机物分子挑战的人
1965年, 伍德沃德(Robert Burns Woodward,1917—1979, 1965年诺贝尔得主) 美国人,人工合成固醇、叶绿素、维生 素B12和其他只存在于生物体中的物质。 (1)喹啉 (2)利血平(1956年) (7)叶绿素(1960年) (8)维生素B12(1973年,15 年, 一百多人参加) (3)胆甾醇(1951年) (9) 红霉素(262144个异构
结晶牛胰岛素的人工合成
中国科学院上海生物化学所、上海有机化学所、北京大学等单位的学者在王应睐、 邹承鲁、钮经义、汪猷、邢其毅等学科带头人的领导组织下,历经8年的艰苦努力, 终于攻克了胰岛素A及B链的拆合关、A链和B链的合成关等一道道难关,最终完成了 牛胰岛素的全合成。
R. B. Woodward--- 一位不断向最复杂
有机合成化学,是化学最中心的研究与生产任务之一, 是新中间体、新药、新材料、新催化剂等最主要的来源, 是化学学科中最活跃、最具创造性的领域,也是整个科学 界最活跃的方向。 现在,全世界化学工作者每年合成近百万种新化合物。 迄今人类已知的近2500万种物质中,绝大多数为有机化 合物(约90%以上),90%以上由人工合成。所以,有机 合成理所当然地成为合成化学最主要的内容。
《有机合成》教学设计 高中化学人教版(2019)选择性必修三第三章第五节

《有机合成》教学设计一、设计理念针对本节教材内容与学生学习能力起点、教学目标(终点)等进行任务分析,通过创设任务情境,复习再现各类有机物之间的转化关系,建构转化关系网络,运用逆合成法等策略,帮助学生建构有机合成的一般原理和策略。
在教学策略上采用学案预学导学,课堂上充分发挥小组合作探究的作用。
在选题和难度上根据学生基础比较薄弱的实际情况,降低难度和课堂容量,从而确保课堂的参与性和活跃性,确保教学的效果。
二、教材分析有机合成安排在人教版《有机化学基础》第三章第四节体现了设计者的匠心,因为在前面的学习中,学生已经学习了有机物的分类、结构、性质、转化等知识,但是缺乏对各物质之间演变关系的梳理,非常有必要进行及时的复习和融会贯通,而有机合成正是达到这个目标最好的方式。
本课承载的价值有以下两个方面:一方面,有机合成承载了整合有机反应的任务,通过有机合成的学习进一步建立起物质之间的转化关系。
另一方面,通过具体的事例让学生了解到有机合成在医药、化工、生产、生活中的广泛应用,开阔学生的视野。
三、学情分析经过半个学期的学习,学生已经掌握了高中常见有机物:脂肪烃、芳香烃、卤代烃、醇、酚、醛、羧酸和酯的性质,并对有机物官能团的性质有了全面的了解,学生已经具备了一定的基础知识和分析问题、解决问题的能力。
但是由于所学有机物种类繁多,学习时间还比较短,客观上造成了对官能团性质掌握不熟练,甚至混淆,各物质之间的转化途径不熟悉。
因此需要教师及时引导学生对所学知识此时进行归纳、梳理、整合。
并且设计上要适当降低难度,注意思维的递进性;在讲解上要讲究策略,要留足时间空间尽量让学生发挥自主合作探究的精神,避免教师的一言堂满堂灌才能达到启发学生思维的效果。
四、教学目标1 .复习再现烃和烃的衍生物之间的相互转化,构建转化关系网络。
2 .熟练掌握几条常见的合成线路。
3 .了解逆合成分析法的运用,并能应用知识网络分析简单的有机合成问题。
五、教学的重点、难点1 .教学重点:(1)建构各类有机物之间相互转化关系网络。
《精细有机合成》教学大纲

《精细有机合成》教学大纲一、课程的地位、性质和任务《精细有机合成》课程是精细化学品生产技术专业的一门主干课,是在学生具备了必要的无机化学、分析化学、物理化学、有机化学和化工原理等专业基础知识之后,必修的技术基础课。
《精细有机合成》的主要内容是讨论精细化工产品主要合成过程单元反应,着重介绍反应动力学、反应历程各种有关的化学理论及其生产工艺、并举出典型产品实例,从而培养学生理论联系实际、解决实际问题的能力。
二、学时分配:三、大纲本文第一章绪论基本内容:有机合成的任务、目的及内容;精细有机合成常见的单元反应基本要求:1.了解有机合成的任务、目的及内容2.掌握精细有机合成常见的单元反应及其特点第二章精细有机合成的理论与技术基础基本内容:精细有机合成中的电子效应和空间效应;有机反应试剂与溶剂;合成反应器;有机反应类型及其机理基本要求:1. 了解精细有机合成中的电子效应和空间效应2. 了解有机反应中常用的试剂与溶剂的种类3. 掌握五种类型反应的特点、反应历程第三章磺化与硫酸化基本内容:磺化方法;硫酸化方法;磺化剂和硫酸化剂;磺化及硫酸化影响因素;磺化产物的分离基本要求:1.掌握常用的磺化剂2.掌握磺化反应历程及主要影响因素3.掌握磺化方法及磺化产物的主要分离方法第四章硝化与亚硝化基本内容:硝化反应的特点、方法及影响因素;混酸硝化;亚硝化反应基本要求:1. 掌握各种类型硝化剂及其活泼质点2.熟悉硝化反应历程及动力学3.熟悉硝化反应主要影响因素4.掌握主要的硝化过程及混酸技术特性指标的计算第五章卤化基本内容:卤化糊弄及卤化剂;取代、加成和置换卤化基本要求:1.掌握芳环及其侧链氯化的反应历程2.熟悉氯化、溴化、碘化反应的特点3.熟悉置换几种已有取代基的氯化第六章烷基化基本内容:烷基化反应的糊弄及基本原理;相转移烷基化反应基本要求:1.掌握三类烷化反应的历程2.熟悉常用的烷基试剂3.熟悉烷化反应的生产过程第七章酰基化基本内容:酰化剂; N-酰化反应;C-酰化反应基本要求:1.掌握酰化反应的历程2.熟悉酰化反应影响因素及常用酰化剂乙酰化过程第八章还原基本内容:催化还原;化学还原;电解还原基本要求:1. 熟悉化学还原反应的历程、影响因素及主要应用2.掌握催化加氢的基本过程3.熟悉催化加氢的影响因素及催化剂的作用第九章氧化基本内容:氧化方法及其特点;空气催化氧化;化学氧化;电解氧化基本要求:1.掌握三类氧化反应的反应历程2.熟悉几种通过氧化制备化合物的生产过程第十章氨解基本内容:氨解剂;氨解的方法;氨解反应的基本原理基本要求:1.熟悉几类主要化合物氨解的过程及实际应用2.熟悉其反应机理及影响因素第十一章重氮化与重氮盐的转化基本内容:重氮化反应;反应的影响因素;重氮盐的应用基本要求:1. 掌握重氮化反应的反应历程和影响因素2. 掌握重氮盐的重要用途第十二章羟基化基本内容:羟基化的方法;芳磺酸盐的碱熔反应历程和影响因素;卤代烃和芳伯胺的水解;硝基化合物的水解;重氮盐和异丙苯过氧化氢的酸解等基本要求:1.熟悉各种主要的羟基化方法及实际应用2.了解三种基团置换成烷氧基的反应第十三章酯化基本内容:酯化反应的基本原理;酯化技术与反应装置;工业上制造羧酸酯的方法基本要求:1. 了解工业上制造羧酸酯的方法2. 了解酯化反应的基本原理3. 了解酯化反应的装置第十四章缩合基本内容:缩合反应的特征及分类方法;醛酮缩合;酯的缩合;烯烃参与的缩合;成环缩合基本要求 :1. 掌握缩合反应的特征及分类方法2. 了解醛酮缩合,醛酮与羟酸的缩合,醛酮与醇的缩合3. 了解酯的缩合4. 了解烯烃参与的缩合5. 了解成环缩合第十五章精细有机合成路线设计基本方法与评价基本内容:逆向合成法;逆向合成路线设计技巧;导向基与保护基;合成路线的评价标准基本要求:1. 掌握逆向合成法的概念和常用术语2. 了解逆向合成路线设计技巧3. 掌握导向基的应用及其基团的保护4. 熟悉合成路线的评价标准。
精细有机合成技术课件第三章

第二节 磺化及硫酸化反应基本原理
三、磺化及硫酸化影响因素 1. 有机化合物结构及性质 被磺化物的结构、性质,对磺化的难易程度有着很 大影响。通常,饱和烷烃的磺化较芳烃的磺化困难得多; 而芳烃磺化时,若其芳环上带有供电子基,则邻、对位 电子云密度高,有利于σ络合物的形成,磺化反应较易 进行;相反,若存在吸电子基,则反应速减慢,磺化困难。 在50~100℃用硫酸或发烟硫酸磺化时,含供电子基团 的磺化速度按以下顺序递增: H~Et<Me<Pr<< OEt<OMe<< OH 含吸电子基团的磺化速度按以下顺序递减: H>Cl>>Br~COMe~COOH>>SO3H~CHO~NO2
当采用气态三氧化硫进行醇类的硫酸化时,化学反应 几乎立刻发生,反应速度受气体的扩散控制,化学反应在 液相的界面上完成。由于硫原子存在空轨道,能与氧原子 结合形成络合物,而后转化为硫酸烷酯。
除脂肪醇以外,单甘油酯以及存在于蓖麻油中的羟基 硬脂酸酯,都可以进行硫酸化而制成表面活性剂。
第二节 磺化及硫酸化反应基本原理
第二节 磺化及硫酸化反应基本原理
第二节 磺化及硫酸化反应基本原理
2.硫酸与发烟硫酸 浓硫酸和发烟硫酸用作磺化剂适宜范围很广。为了 使用和运输上的便利,工业硫酸有两种规格,即92%~ 93%的硫酸(亦称绿矾油)和98%的硫酸。如果有过量的 SO3存在于硫酸中就成为发烟硫酸,它也有两种规格,即 含游离的SO3分别为20%~25%和60%~65%,这两种发 烟硫酸分别具有最低共熔点-11~-4℃和1.6~7.7℃, 在常温下均为液体。 烟酸的浓度可以用游离SO3的含量C(SO3)(质量分数, 下同)表示,也可以用H2SO4的含量C(H2SO4)表示。两种 浓度的换算公式如下:
精细有机合成化学和工艺学第3章 卤化

不计。
xD xA + xC +xD=1.00
2019/8/8
25
v k[C6H8
26
3.2 芳环上的取代卤化反应
3.2.1 芳环上的取代氯化反应
2019/8/8
27
假设氯气全部参加反应,没有损失,则可由一氯苯及二氯苯的生 成量再计算氯气消耗量,如转化率为50%时,氯气消耗量 =0.4811+2×0.0189=0.5189mol
NH2 Cl
NO2
NO2
分散染料用
2019/8/8
32
5、选择溶剂
氯化反应常常是在有 机物处于液相状态进 行的,若有机原料在 反应温度下已是液体 (如苯、甲苯、硝基苯 等),一般不需使用溶 剂;若有机原料为固 体,则需根据物料的 性质、反应的难易, 选择合适的溶剂。
2019/8/8
(A)水 例如对硝基苯胺的氯化。 (B)无机溶剂 常用的无机溶剂是硫酸,例如蒽醌在浓 硫酸介质中可直接氯化制1,4,5,8-四氯 蒽醌。 (C)有机溶剂 某些有机物的氯化是在有 机溶剂中进行的,所选用的有机溶剂应 是更难氯化的物质,例如萘的氯化可采 用氯苯作溶剂,水杨酸的氯化可采用乙 酸作溶剂。溶剂的极性变化对芳香化合 物氯化速度有一定的影响,如苯胺在 水—醋酸系统中氯化时,随着水含量的 增加,氯化速度增加。
2019/8/8
12
2、碳-卤键的稳定性和反应活性
(1)C-F键非常稳定,不易发生氟被其他基团所置换的反 应; (2)C-Cl键的键能稍弱,有机氯化物一般比较稳定,但在 一定条件下,可以发生-Cl被-F、-OH、-OCH3、-NH、-CN 等取代基所置换的反应; (3)用分子态碘的取代是吸热反应,会发生脱碘的反应。 用ICl的取代碘化是放热反应,不会发生脱碘的反应。
精细有机合成02精细有机合成的理论与技术基础课件

在酸性较强的位置上发生。
SE2和SEi
Y C
Y C
X
X
SE2(前面进攻) 构型保持
X CY
X CY
SE2(后面进攻) 构型转化
精细有机合成02精细有机合成的理 论与技术基础课件
SE1
R X慢
R-
+
+X
R- +Y+ 快 RY
取代反应的的动 力学是一级的, 包括两步:慢的 离解和快的结合
精细有机合成02精细有机合成的理 论与技术基础课件
由于该亲核取代反应中控制反应速度的一步是单分子,因此这 种反应称为单分子亲核取代反应。 SN1反应能量变化图 :
精细有机合成02精细有机合成的理 论与技术基础课件
➢双分子亲核取代反应(SN2)
溴甲烷在碱性水溶液中的水解反应:
C H 3 B r+ O H - C H 3 O H + B r -
溴甲烷在碱性水溶液中的水解反应速度取决于两个反应物的浓度, 该反应的反应历程可认为卤代烷和羟基离子都参与了限速步骤。
第二章 精细有机合成的 理论与技术基础
精细有机合成02精细有机合成的理 论与技术基础课件
复习: p轨道、C-H σ键、C-C π键、元素周期表和电负性概念
原子的电负性:指原子吸收电子的能力。鲍林指定氟原子的电负性为 4.0,其它原子与其比较计算得电负性值,是相对值,无单位。
精细有机合成02精细有机合成的理 论与技术基础课件
动态诱导效应 当进攻试剂接近底物时,因外界电场的影响也会
使共价键上电子云发生改变,键的极性发生变化,这种变化用Id表示。
Id:
-I>-Br>-Cl>-F -CR3>-NR2>-OR>-F
《精细有机合成化学及工艺学》第3章卤化

-X(-Cl)
亲核置换 -NH
2,-OH,-F,-OR,-OAr
OH
Cl
δ+
OH
OCH 3
OCH3 NH3
NH 2
7
三 卤化剂
按照反应类型分类
(1)氯化剂:Cl2、HCl+氧化剂、HCl+空气、HCl
分子态氯价格低廉、量大,氯化多 (2)溴化剂:Br2、HBr+氧化剂、N-溴代酰胺 分子态溴价格贵,用于含溴精细化学品 (3)碘化剂:I2、Icl
[Cl+ •FeCl4-]
FeCl3 + HCl
Cl++FeCl4-
14
(2) 以硫酸或碘为催化剂
H2SO4 H+ + Cl2 I2 + Cl2 ICl I+ + Cl2 H+ + HSO4HCl + Cl+ 2ICl (红棕色液体) I+ + ClICl + Cl+
备注:适应无水状态下 或在浓硫酸介质中用氯 气的氯化。
本节主要内容:
反应历程
反应动力学及氯化深度 芳环取代氯化反应的影响 因素 芳环取代氯化反应实例
13
一、反应历程和催化剂的选择
1、反应历程
Cl
+ Cl 2
Fe
慢
H Cl
+ HCl
+ + Cl
. .. + . . . .
快
Cl
+ H+
(1) 以FeCl3为催化剂 Cl2 + FeCl3
FeCl4- + H+
精细有机合成单元反应与合成设计全解PPT课件
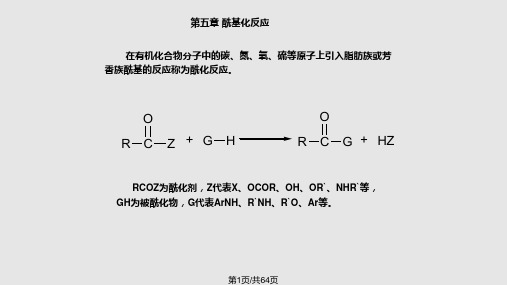
在有机化合物分子中的碳、氮、氧、硫等原子上引入脂肪族或芳 香族酰基的反应称为酰化反应。
O R C Z+G H
O R C G + HZ
RCOZ为酰化剂,Z代表X、OCOR、OH、OR`、NHR`等, GH为被酰化物,G代表ArNH、R`NH、R`O、Ar等。
第1页/共64页
5.1 N-酰化反应 N-酰化是胺类化合物与酰化剂反应,在氨基的氮原子上引入酰
第33页/共64页
5.2 C-酰化反应
C-酰化是在芳环上引入酰基,制备芳 酮或芳醛的反应过程,它是以酰卤或酸酐 为酰化剂,对芳环进行亲电取代的反应, 属于F-C反应中的重要一类。
第34页/共64页
5.2.1 C-酰化反应历程
+R C OAlCl3 +
Cl
+
-
R C O + AlCl4 +
O AlCl3 R C Cl H
OC2H5 NHCOCH3
OCH3
第14页/共64页
例:
2-羟基-3-萘甲酸(简称2,3-酸)和苯胺或其衍生物进行N-酰化 可得到一系列色酚,用于制备冰染染料。这类酰化反应的通式为:
OH + H2N Ar
COOH
- H2O
OH CONH Ar
第15页/共64页
反应中的2, 3-酸是很弱的酰化剂,它与芳胺的酰化过程是在三 氯化磷存在下进行的。按反应时2,3-酸的形态可分为酸式法及钠盐 法两种。
CH3 + HCl
第25页/共64页
(2)用芳羧酸酰氯及芳磺酰氯酰化
OC2H5 NH2 +
OC2H5
COCl
H2O, Na2CO3 85oC-90oC
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应器 ➢ 无铁、铝等金属离子 ➢ 搪瓷、搪玻璃、镀银、镀镍
4.反应实例
• 氯化苄的生产
Cl2, >100℃
Cl2, >100℃, hν
Cl2, >100℃, hν
• 饱和烃的取代卤化:CH(4-n)Cln、氯化石蜡
• 烯烃α-氢的取代卤化
小结
芳环侧链α-氢的取代卤化是自由基反应, 应注意反应体系中无铁、铝等金属离子, 以避免芳环上亲电取代反应的发生。
精细有机合成
第3章:卤化
3.5 芳环侧链α-氢的取代卤化
1
反应历程
2
反应动力学
3
反应的主要影响因素
4
反应实例
芳环侧链α-氢的取代卤化
1.反应历程
芳环侧链α-氢的取代卤化
自由基 反应
链引发 链增长 链终止来自反应历程链引发
化学键
加热、光照、引发剂
Cl2 均裂
2Cl •
键能 (kJ/mol) 热裂解温(℃) 光离解波 (nm)
C-C, C-H, H-H
Cl-Cl Br-Br, I-I O-O, N-N, C-N=N-C
325 ~ 430 240 < 200
≥ 600 50 ~ 150
400 ~ 500
过氧化苯甲酰(126kJ/mol)
偶氮二异丁腈(130kJ/mol)
反应历程
链增长 链终止
C6H5CH3 + Cl • C6H5CH2 • + Cl2 C6H5CH3 + Cl •
甲苯侧链氯化时氯化液组成与氯化深度的关系
k2 / k1 ≈10-1 k3 / k2 ≈10-1
3.反应的主要影响因素
反应物 ➢ 物料配比 ➢ 原料纯度
反应介质 ➢ 溶解反应物和产物 ➢ 溶剂化作用
催化剂(引发剂) 反应温度、压力 反应时间 反应器(搅拌形式及速度)
反应的主要影响因素
反应物 ➢ 物料配比:Cl2大大过量 ➢ 原料纯度:无铁(铝)、无水、无氧
反应的引发
➢ 光源:λ<478nm(E光=250kJ/mol)
➢ 引发剂 − 有机过氧化物、偶氮化合物 − 硫黄、红磷、三氯化磷、有机氯化物、 有机酰胺等
60~90℃
+ 2CO2↑
60~90℃
离解
PCl3 + Cl2
Cl • + • PCl4
反应的主要影响因素
反应温度:与引发方式和引发剂有关
➢ 反应温度高,有利于引发剂热离解生成自由基; 但温度太高,容易引发副反应
H • + Cl2
C6H5CH2 • + HCl↑ C6H5CH2Cl + Cl • C6H5CH2Cl + H • Cl • + HCl↑
Cl • + Cl • Cl • + O2
Cl2 ClOO •
2.反应动力学
+ Cl2, k1 - HCl
+ Cl2, k2 - HCl
+ Cl2, k3 - HCl
