实训水的总硬度测定
水中总硬度的测定
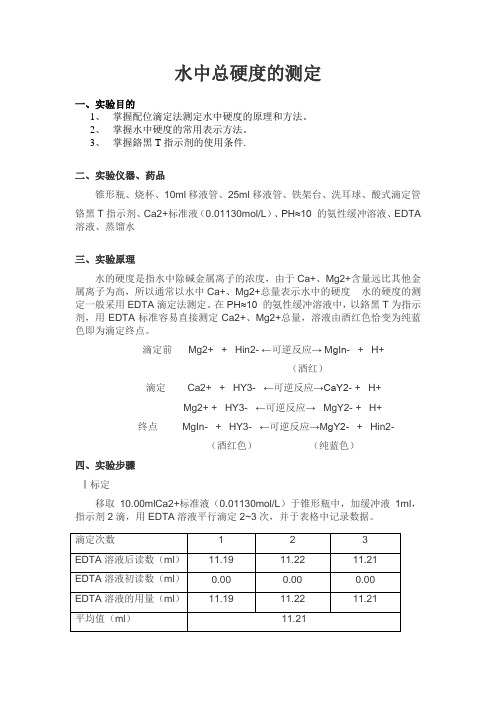
水中总硬度的测定一、实验目的1、掌握配位滴定法测定水中硬度的原理和方法。
2、掌握水中硬度的常用表示方法。
3、掌握鉻黑T指示剂的使用条件.二、实验仪器、药品锥形瓶、烧杯、10ml移液管、25ml移液管、铁架台、洗耳球、酸式滴定管铬黑T指示剂、Ca2+标准液(0.01130mol/L)、PH≈10 的氨性缓冲溶液、EDTA 溶液、蒸馏水三、实验原理水的硬度是指水中除碱金属离子的浓度,由于Ca+、Mg2+含量远比其他金属离子为高,所以通常以水中Ca+、Mg2+总量表示水中的硬度水的硬度的测定一般采用EDTA滴定法测定。
在PH≈10 的氨性缓冲溶液中,以鉻黑T为指示剂,用EDTA标准容易直接测定Ca2+、Mg2+总量,溶液由酒红色恰变为纯蓝色即为滴定终点。
滴定前Mg2+ + Hin2- ←可逆反应→ MgIn- + H+(酒红)滴定 Ca2+ + HY3- ←可逆反应→CaY2- + H+Mg2+ + HY3- ←可逆反应→MgY2- + H+终点MgIn- + HY3- ←可逆反应→MgY2- + Hin2-(酒红色)(纯蓝色)四、实验步骤Ⅰ标定移取10.00mlCa2+标准液(0.01130mol/L)于锥形瓶中,加缓冲液1ml,指示剂2滴,用EDTA溶液平行滴定2~3次,并于表格中记录数据。
Ⅱ测定移取25.00ml自来水于锥形瓶中,加缓冲液1ml,指示剂2滴,滴定至终点,平行滴定2~3次,并于表格中记录数据。
五、实验数据记录及处理实验数据已填于上述表格中实验数据计算:EDTA溶液浓度标定:由C(Ca2+)*V(Ca2+)=C(EDTA)*V(EDTA)得C(EDTA)= C(Ca2+)*V(Ca2+)/V(EDTA)= 0.01130mol/l*10.00ml/11.21ml =0.01008mol/l自来水硬度测定:由n(EDTA)=C(EDTA)V(EDTA)n(Caco3):n(EDTA)=1:1 n(Caco3)=m (Caco3)/ M(Caco3)自来水硬度ρ=m (Caco3)/ Vaq 所以计算可得ρ=0.135g/l=135mg/l六、注意事项:1.各个使用仪器用前需要润洗的注意润洗;2. 络合反应速度较慢,滴定时滴加速度不能太快,特别是临近终点时,要边滴边摇晃。
水的总硬度

实验目的
1、了解水的硬度测定意义和硬度的常用表 示方法; 2、掌握用配位滴定法测定水的硬度的原 理和方法; 3、熟悉金属指示剂的使用及其终点的判断。
实验原理
硬度的表示方法
我国以Ca2+、Mg2+离子总量折合成CaO来计 算水的硬度,以度(°)或mg/L表示。 1°表示十万份水中含有一份CaO,即1L水中 含有10mg CaO时为1°。
2、试剂
EDTA标准溶液( 0.01mol· -1 ) L pH=10的氨性缓冲溶液:将54gNH4Cl溶于少量 水中,加入350mL浓氨水,稀释至1000mL ;
三乙醇胺(1+2)
铬黑T指示剂(EBT):称1.0g铬黑T溶于1% 的三乙醇胺-无水乙醇溶液中;
实验步骤
1. 总硬度的测定(平行测定三次)
思考题解答:
1、为什么测定Ca2+、Mg2+总量时,要控制 PH=10,而滴定Ca2+则需PH=12~13? 答:因为稳定常数CaY2- > MgY2-,滴定Ca2+的最低 PH=8,滴定Mg2+的最低PH=10,指示剂铬黑T的最适 宜pH范围为9~10.5,所以溶液的pH值要控制为10。 测定Ca2+时,要将溶液的pH控制至12~13,主要是 让Mg2+完全生成Mg(OH)2沉淀,以保证准确测定Ca2+ 的含量。在pH为12~13间钙指示剂与Ca2+形成酒红色 配合物,指示剂本身呈纯蓝色,当滴至终点时溶液为 纯蓝色。但pH>13时,指示剂本身为酒红色,而无法 确定终点。
2O
1 0 0 0
10
5
思考题
1、为什么测定Ca2+、Mg2+总量时,要控 制PH=10,而滴定Ca2+则需PH=12~13?
实验五 水总硬度的测定

溶解
定量转移至250mL容量瓶中定容
C(EDTA)=
m(EDTA)
M (EDTA)×250
×1000
2. EDTA 的标定
准确称取 0.15~0.20 g 基准锌片于50 mL 烧杯中,加入约 5 mL (1+1)HCl 溶液,立即盖上表面皿,待锌片完全溶解后,以少量水
实验五 自来水总硬度的测定
(络合滴定法)
一、实验目的
1、学习EDTA标准溶液的配制方法及滴定终点的 判断; 2、学会用络合滴定法测定水的硬度。 3、了解水硬度的含义及其测定的实际意义。
二、仪器与试剂
电子天平;滴定管;移液管;锥形瓶等。
EDTA(0.02mol/L) ; NH3-NH4Cl缓冲溶液 ;
且形成的络合物应为无色或浅色,不影响重点的判断;
使用掩蔽剂应注意适用的pH范围。
反应如下:
滴定前:
Ca2++ Mg 2+ + In Ca 2+ +Mg 2+ + MgIn
酒红色
滴定中:
Ca2++Mg2++MgIn + Y
酒红色
CaY +MgY+Mg 2++MgIn 蓝色 CaY +MgY+Mg 2++MgIn
铬黑T(0.5%) ; 三乙醇胺(1:2) ; Na2S NaOH (40 g.L-1) 。
三、方法原理
水硬度一般是指水中钙、镁离子的含量。水 的总硬度是指水中Ca2+、Mg2+的总量。由Mg2+引 起的称镁硬度,由Ca2+引起的称钙硬度。 常用表示水硬度的方法是以水中Ca、Mg总量换 算为CaO、 CaCO3含量。单位为mmol/L、mg/L 和 (° )。 1°表示: 1 L 水中含10 mg CaO。
实训项目五 水总硬度的测定

襄樊职业技术学院实验报告系(部):生物工程学院专业:生物技术及应用班级:0901 2011年11月5日课程:生物产品分析姓名:曹龙刚学号:09229****实训项目五水总硬度的测定一、实验目的1.应用EDTA测定水中的钙硬度。
二、实验原理在pH=10时,水样中的钙镁离子与指示剂铬黑T形成紫红色配合物。
加EDTA时,钙镁离子与EDTA 形成更稳定的无色配合物。
滴定终点时游离出铬黑T,水样显蓝色。
三、实验试剂EDTA溶液(0.01mol•L-1);氨性缓冲溶液;铬黑T指示剂(5g/L);三乙醇胺溶液 NaOH(0.1mol/L)四、实验仪器量筒;移液管;锥形瓶;酸式滴定管五、实验步骤1.Mg2+标准溶液的配制:准确称取氧化镁基准试剂1.0~0.3g,置于100mL烧杯中,用少量水润湿,盖上表面皿,慢慢滴加1∶1 HC1使其溶解(约需3~4mL)。
加少量水将它稀释,定量地转移至200mL 容量瓶中,用水稀释至刻度,摇匀。
2.EDTA标准溶液的配制:称取1.0g乙二胺四乙酸二钠(Na2H2Y·2H2O)溶于250mL蒸馏水中,备用。
3.EDTA标准溶液浓度的标定:用20mL移液管移取Mg2+标准溶液于250mL锥形瓶中,加入10mL氨性缓冲溶液和3~4滴铬黑T指示剂,用0.01mol·L-1EDTA标准溶液滴定,至溶液由紫红色变为蓝色即为终点。
4.水的总硬度测定:用20mL移液管移取水样于250mL锥形瓶中,加氨性缓冲溶液6mL,1∶1三乙醇胺溶液3mL,EBT指示剂3~4滴,用EDTA标准溶液滴定,至溶液由紫红色变为蓝色即为终点。
六、数据记录与处理表-7 EDTA标准溶液的标定氧化镁质量氧化镁定容体积量取氧化镁体积消耗EDTA体积EDTA浓度1g 200ml 25ml 20.7ml 0.0151 mol/L表-8 水总硬度的测定水体积消耗EDTA体积EDTA浓度水硬度(CaO) 平均值100 ml 13.6ml 0.0151 mol/L 1.150㎎/L1.129㎎/L100 ml 13.1 ml 0.0151 mol/L 1.108㎎/L。
03实验3 水总硬度的测定(配位滴定法)

实验三水总硬度的测定(配位滴定法)实验日期:实验目的:1、学习EDTA标准溶液的配制方法及滴定终点的判断;2、掌握钙、镁测定的原理、方法和计算。
一、水硬度的表示法:一般所说的水硬度就是指水中钙、镁离子的含量。
最常用的表示水硬度的单位有:1、以度表示,1o=10 ppm CaO,相当10万份水中含1份CaO。
2、以水中CaCO3的浓度(ppm)计相当于每升水中含有CaCO3多少毫克。
MCaO—氧化钙的摩尔质量(56.08 g/mol),MCaCO3—碳酸钙的摩尔质量(100.09 g/mol)。
二、测定原理:测定水的总硬度,一般采用配位滴定法即在pH=10的氨性溶液中,以铬黑T作为指示剂,用EDTA标准溶液直接滴定水中的Ca2+、Mg2+,直至溶液由紫红色经紫蓝色转变为蓝色,即为终点。
反应如下:滴定前:EBT +Me(Ca2+、Mg2+)=Me-EBT(蓝色) pH=10 (紫红色)滴定开始至化学计量点前:H2Y2- + Ca2+= CaY2- + 2H+H2Y2- + Mg2+= MgY2- + 2H+计量点时:H2Y2- + Mg-EBT = MgY2- + EBT +2H+(紫蓝色)(蓝色)滴定时,Fe3+、Al3+等干扰离子用三乙醇胺掩蔽,Cu2+、Pb2+、Zn2+等重金属离子可用KCN、Na2S 或巯基乙酸掩蔽。
三、主要试剂1、0.02mol/LEDTA2、NH3-NH4Cl缓冲溶液 3、铬黑T:0.5%4、三乙醇胺(1:2)5、Na2S溶液 2% 6、HCl溶液 1:17、CaCO3固体A.R.四、测定过程1、EDTA溶液的标定准确称取在120度烘干的碳酸钙0.5~ 0. 55g 一份,置于250ml 的烧杯中,用少量蒸馏水润湿,盖上表面皿,缓慢加1:1HCl 10ml,加热溶解定量地转入250ml容量瓶中,定容后摇匀。
吸取25ml,注入锥形瓶中,加20ml NH3-NH4Cl缓冲溶液,铬黑T指示剂2~3滴,用欲标定的EDTA溶液滴定到由紫红色变为纯蓝色即为终点,计算EDTA溶液的准确浓度。
实验十八水的总硬度测定

实验十八水的总硬度测定答:因为铬黑T只能在pH=7~11使用,最适宜的酸度是pH=9~10.5,滴定过程颜色变化为酒红→紫→蓝,易于观察。
答:(1)lgKfCaY2->lgKfMgY2-CaY2-比MgY2-稳定。
(2)用EDTA先测出Ca、Mg总量,再测Ca量,计算出Mg量。
一、一、实验目的1、1、掌握配位滴定法测定水的总硬度的原理和方法。
2、2、学会EDTA标准溶液的配制和标定方法。
3、3、熟悉金属指示剂变色原理及滴定终点的判断。
二、二、实验原理含有较多钙盐和镁盐的H2O称为硬水。
水的硬度以H2O中Ca、Mg来计算,每升H2O中含10mgCaO为1度1的含量。
22测定水的硬度就是测定水中Ca折合成CaO2、Mg2一般把小于4的H2O称为很软的水,48称为软水,816称为中等硬水,1632称为硬水,大于32称为超硬水。
生活用水的总硬度一般不超过25各种工业水对硬度有不同的要求。
水的硬度是水质的一项重要指标,测定水的硬度有十分重要的意义。
在pH值为10的NH3NH4Cl缓冲溶液中,以铬黑T为指示剂,用EDTA 标准溶液滴定Ca、Mg,得出其总量。
铬黑T和EDTA都能与Ca、Mg定性顺序为:CaY2->MgY2>MgIn->CaIn-2222形成配合物,其稳因此,加入铬黑T后,它先与部分Mg标准溶液时,EDTA首先与游离的Ca22配合成MgIn而使溶液呈酒红色。
当滴加EDTA2配位,其次与游离的Mg2配位,生成无色的配合物。
化学计量点时,EDTA夺取MgIn中的Mg为纯蓝色,指点示达到终点。
滴定前:化学计量点前:,使铬黑T游离出来,溶液由酒红色变Mg2HIn2(纯蓝色)MgIn(酒红色)HCa2HY2CaY(无色)2H2化学计量点时:Mg2HY2MgY(无色)2H2根据消耗的EDTA标准溶液的体积及浓度,由下式计算出水的硬度: MgInHY2MgY2HIn2(纯蓝色)Hc(EDTA)V(EDTA)M(CaO)10V水样()水的硬度三、三、实验用品1、1、仪器酸式滴定管(50ml);烧杯(100ml,250ml);表面皿;锥形瓶;移液管(25ml,50ml);容量瓶(250ml);量筒(10ml,50ml);台天平;聚乙烯塑料瓶(500ml)。
实验五水总硬度测定

b.不能太低。否则未到终点时就游离出来,使滴 定终点提前到达。
3. 指示剂与金属离子生成的配合物应有易溶于水,配 位反应必须灵敏、迅速、有良好的可逆性。
4.掩蔽剂
配位滴定法广泛应用于金属离子的测定。 最常用的是以乙二胺四乙酸二钠(EDTA) 为滴定剂,滴定金属离子的方法。
乙二胺四乙酸二钠盐(C10H14N2Na2O8·2H2O )
白色粉末,水溶性好,难溶于乙醇、乙醚等 有机溶剂
标定EDTA的基准物有Zn、ZnO、CaCO3、 Bi、Cu、MgSO47H2O等
EDTA配位反应具有以下特点: ① EDTA能与大多数不同价态的金属离子形成配位比为
1:1的、溶于水(使滴定反应能够在水溶液中进行) 的稳定配合物,并且容易找到合适指示剂。
② 与大多数金属离子配位反应速率快,反应几乎是一 步形成,所以配位反应很完全。
③ EDTA与金属离子的配位能力与溶液酸度有关,控制 溶液酸度可提高滴定的选择性。
学科名词
❖ 硬水:含有较多可溶性钙、镁化合物的水。
❖ 硬水中含盐量一般以硬度表示。硬度单位是度,1度相当 于每升水中含10mg的CaO。
❖ 硬度在8以上者通常称为硬水,地下水(如井水、泉水) 的含盐量较多,属于硬水。在硬水中,钙盐和镁盐以碳 酸氢盐、碳酸盐、硫酸盐、氯化物和硝酸盐的形式存在。
❖ 硬度又分为暂时性硬度和永久性硬度。由于水中含有碳 酸氢钙与碳酸氢镁而形成的硬度,经煮沸后可把硬度去 掉,这种硬度称为暂时性硬度。水中含硫酸钙和硫酸镁 等盐类物质而形成的硬度,经煮沸后不能去除的硬度, 称为永久性硬度。
实验二 自来水总硬度的测定

实验二自来水总硬度的测定一、实验原理1.总硬度水的总硬度是指水中所含的钙和镁离子的总和,一般以CaCO3的形式表示。
在工业生产和日常生活中,硬度会对水质和水处理产生一定的影响。
硬水中所含的钙和镁离子与硬质水垢形成的速度成正比,影响了生产的效率和设备的使用寿命。
此外,硬水还会影响某些化学反应的结果,如肥料和洗涤剂的效果。
2.测定方法2.1 EDTA滴定法本实验采用的是EDTA(乙二胺四乙酸)滴定法。
EDTA是一种螯合剂,可以与钙、镁离子反应,形成不溶性化合物,使水中的钙、镁离子测定,从而得到水的总硬度值。
2.2 螯合剂螯合剂是一种能够与金属离子形成稳定的络合物的化学物质,也称为配位剂。
EDTA是最常用的螯合剂之一。
2.3 指示剂指示剂是用来指示滴定反应的终点。
本实验中采用的指示剂是锯末萘酚,它在不同pH 值下的颜色变化是由橙色到蓝色。
3.反应方程当EDTA与钙、镁离子反应时,生成的络合物为:Ca2+ + EDTA4- → CaEDTA2-四、实验步骤实验装置:滴定管,容量瓶,磁力搅拌器,滴定管架,洗瓶,清洗钳。
实验物品:样品自来水(初步测试自来水PH值为7.8),EDTA滴定液,NH3-NH4Cl缓冲液,锯末萘酚指示剂,烧杯和滴定管。
1. 取自来水样品20mL,加入烧杯中,并加入1mL的NH3-NH4Cl缓冲液,再滴入2滴锯末萘酚指示剂。
2. 在磁力搅拌器上将样品转动,并用EDTA滴定液进行滴定。
滴定过程中,必须反复试验,以确保所得结果的正确性。
3. 当水样中的钙和镁离子全部被螯合之后,所得溶液颜色由橙色变为蓝色。
4. 记录滴定量V,计算出进入水中的EDTA滴定液的体积,计算出水样中的钙和镁的总硬度。
五、实验结果分析1.实验数据样品自来水总用量:20mLNH3-NH4Cl缓冲液用量:1mL锯末萘酚指示剂用量:2滴滴定液用量:23.1mL2.结果计算样品自来水总硬度(以CaCO3计)=(滴定液用量-滴定液空白用量)× 0.01 × 1000× 1000 ÷ 样品自来水用量= (23.1-0)× 0.01 × 1000 × 1000 ÷ 20= 1155mg/L三、实验注意事项1.样品自来水必须预先过滤,以去除其中的杂质,保证测量的准确性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
终点时: EDTA + Mg-EDT(酒红色)== Mg-EDTA + EDT( 蓝色)
3、计算公式:
二、仪器与试剂
仪器:酸式滴定管、移液管(50mL)、洗耳球、锥形瓶(250mL)、量筒、烧杯(500mL)。
试剂:EDTA标准溶液(0.0100mol.L-1)、NH3-NH4Cl缓冲液(pH=10)、铬黑T指示剂。
平均偏差
相对平均偏差/%
其中,硬度计算公式:
五、实验指导
1.实验前预习电子天平和滴定分析仪器(包括容量瓶、移液管和滴定管)的相关任务模块。
2.本次实验要注意滴定终点的判断,颜色刚刚变为蓝色的那一点即为终点。
六、思考题
1.用移液管取水样时,应用什么来润洗移液管?自来水还是蒸馏水?
2.配位滴定为什么要用缓冲溶液?
重点
EDTA为滴定剂测定水的硬度的原理。
难点
掌握金属指示剂EBT滴定终点的判断。
能力培养
通过实验使学生掌握配位滴定法的基本操作,进一步巩固滴定仪器的使用方法,并能准准确地判断滴定终点,运用有效数字进行结果计算。
课堂类型
实验课
教具
酸式滴定管、锥形瓶、移液管等实验器材
作业
思考题1、2、3
***职业学院备课纸
3.实验所用的锥形瓶待仪器,是否需用待测水样润洗?为什么?
三、实验步骤
1、自来水水样采集
打开自来水龙头,先放水数分钟,接着用水样洗涤干净的取样瓶及塞子2-3次。取样装满,盖好塞子。
2、硬度滴定
用50ml移液管移取水样100ml于锥形瓶中,再加入10mlNH3.H20-NH4Cl缓冲液和少量铬黑T指示剂.摇匀,用EDTA标准溶液滴定至溶液由酒红色变为纯蓝色即为终点。
平行滴定3次,记录滴定消耗的EDTA体积。
Байду номын сангаас3、计算自来水的硬度
根据记录体积计算自来水的硬度,并判断是否符合生活饮用水标准。
四、数据记录与结果处理
将实验数据及处理结果分别填入表1中
表1
项 目
1
2
3
水样体积/ml
EDTA浓度/mol.L-1
消耗EDTA溶液体积/mL
总硬度/CaCO3mg.L-1
平均值/CaCO3mg.L-1
2、水的硬度测定原理
按国际标准方法测定水的总硬度:在pH=10的NH3.H20-NH4Cl缓冲液中,以铬黑T为指示剂,用EDTA标准溶液滴定至待测溶液由酒红色变为纯蓝色即为终点。滴定反应如下:
滴定前: (蓝色) EBT + Mg2+ == Mg-EBT(酒红色)
滴定时: DTA+ Ca2+ == Ca-EDTA(无色)
***职业学院备课纸
授课班级
**专业**班
第*
课
教
案
授课时间
*月*日(5-6节)
星期
星期一
授课地点
**楼**室
课题内容
实训项目六 自来水的总硬度测定
教学目的
1.掌握配位滴定法中以EDTA为滴定剂测定水的硬度的原理。
2.掌握金属指示剂EBT滴定终点的判断。
3.练习移液管和酸式滴定管的使用
教学方法
实验法、练习法
一、原理
1、水的总硬度
水中Ca2+,Mg2+离子的总量称为水的硬度,是衡量水质好坏的重要指标之一。
硬度的表示方法有两种:(1)1L水中含有10mg CaO为1度;
(2)以每升水中所含CaCO3的质量(mg)表示(mg.L-1)。
我国生活饮用水卫生标准中规定硬度(以CaCO3计)不得超过450mg.L-1。
