出厂检验明细表
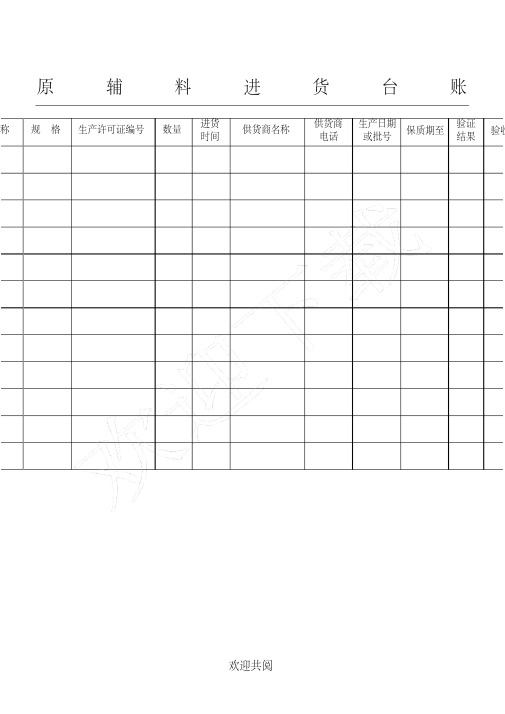
食品企业台账、卫生、生产等记录表格模板格
符合规定 ( ) 不符合规定( )
符合规定 ( ) 不符合规定( )
符合规定 ( ) 不符合规定( )
符合规定 ( ) 不符合规定( )
符合规定 ( ) 不符合规定( )
符合规定 ( ) 不符合规定( )
符合规定 ( ) 不符合规定( )
符合规定 ( ) 不符合规定( )
登记 12.
投诉质量问题
12. 及处理
企业采取的处理措施
12.
处理结果
收集风
险监测 13. 收集与企业相关的风险监测与
及评估
信息的 13.
企业做出的反应
企记业录处 置食品 安全事 故的
14. 14.
企企业业制定定期的检食查品各安项全食事品故安处全置防 范措施的落实情况
情况 14. 企业处置的食品安全事故处置
生产日 期或批号
出库日期
出库
出库数量
使用日期
使用情况
库存
存放地点 累计库存
欢迎共阅
控制点名称
关键控制点控制记录
规定控制参数
序号 日期
时间(时 分) 实际控制参数 操作人员签字
备注 (纠正措施)
欢迎共阅
环境监测记录表
日期
温度
湿度
记录人
备注
欢迎共阅
设备名称 设备编号 设备故障描述
设备维修保养记录
规格 / 型号
欢迎共阅
序 号
食品名称
规格型号 数量 生产日期或批号 检验合格证明 销售日期
购货者名称
购货者联系电话
欢迎共阅
欢迎共阅
食品安全自查表
企业名称
产品名称
生产地址
产品成品检验记录表格

产品成品检验记录表格
产品成品检验记录表格通常用于记录产品在生产过程中的各项检验数据,以确保产品质量和符合相关标准。
以下是一个简单的产品成品检验记录表格的模板:
序号检验项目检验标准或要求检验方法检验结果检验人员检验日期1
2
3
4
5
具体内容可以根据实际需要进行调整。
在填写检验记录时,请确保各项内容准确无误,以便于追踪和分析产品的质量情况。
如有需要,可以添加或删除检验项目,以满足不同产品的检验需求。
药包材生产现场检查考核评分明细表

药包材生产现场检查考核评分明细表
说明:
一、本评分明细表按照国家食品药品监督管理局《药包材生产现场考核通则》制定。
二、本评分明细表内容共7大项60条,共600分。
各项基本分分布见下表:
三、实际评分达总分的70%(含70%)为合格,出现下列情况之一者实行否决:
1、评分明细表中有一大项达不到本大项总分的70%。
2、没有独立质量管理部门或质量管理专职人员,(即企业和部门质量负责人与生产负
责人相互兼任或由非在编人员担任)不具备对产品进行检验条件。
3、按《通则》规定需洁净要求的而不具备洁净要求的。
4、生产不洗即用药包材产品的车间没有空气净化调节系统,不符合《通则》规定的
洁净级别。
5、产品一次抽样3批检验不合格。
四、对考核项目逐条评定,评审采用系数评定法,共分为5个档次,即:
1、满意:按标准分乘以系数1.0。
2、执行情况较好,尚需改进,按标准分乘以系数0.8。
3、基本达到要求,按标准分乘以系数0.7。
4、部分达到要求,按标准分乘以系数0.4。
5、尚未执行,按标准分乘以系数0。
五、检查中不涉及的条款,计算得分率时应在分子、分母同时扣除不涉及条款的基本分。
食品QS果冻加工过程和检验等记录表1
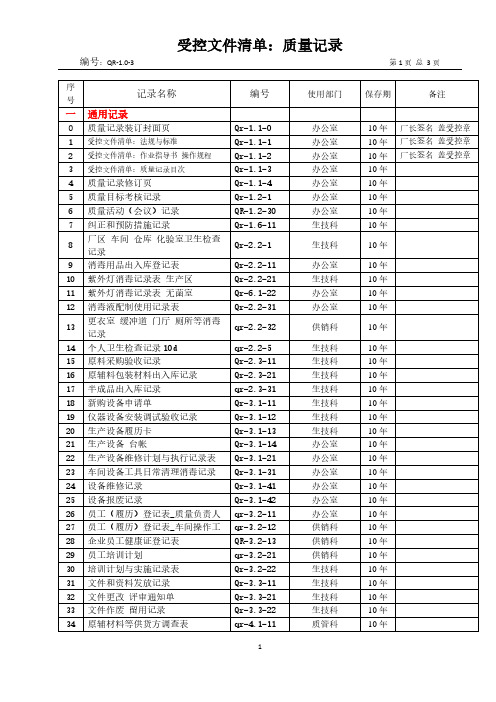
序号记录名称编号使用部门保存期备注一通用记录0 质量记录装订封面页Qr-1.1-0 办公室10年厂长签名盖受控章1 受控文件清单:法规与标准Qr-1.1-1 办公室10年厂长签名盖受控章2 受控文件清单:作业指导书操作规程Qr-1.1-2 办公室10年厂长签名盖受控章3 受控文件清单:质量记录目次Qr-1.1-3 办公室10年4 质量记录修订页Qr-1.1-4 办公室10年5 质量目标考核记录Qr-1.2-1 办公室10年6 质量活动(会议)记录QR-1.2-30 办公室10年7 纠正和预防措施记录Qr-1.6-11 生技科10年8 厂区车间仓库化验室卫生检查记录Qr-2.2-1 生技科10年9 消毒用品出入库登记表Qr-2.2-11 办公室10年10 紫外灯消毒记录表生产区Qr-2.2-21 生技科10年11 紫外灯消毒记录表无菌室Qr-6.1-22 办公室10年12 消毒液配制使用记录表Qr-2.2-31 办公室10年13 更衣室缓冲道门厅厕所等消毒记录qr-2.2-32 供销科10年14 个人卫生检查记录10d qr-2.2-5 生技科10年15 原料采购验收记录Qr-2.3-11 生技科10年16 原辅料包装材料出入库记录Qr-2.3-21 生技科10年17 半成品出入库记录qr-2.3-31 生技科10年18 新购设备申请单Qr-3.1-11 生技科10年19 仪器设备安装调试验收记录Qr-3.1-12 生技科10年20 生产设备履历卡Qr-3.1-13 生技科10年21 生产设备台帐Qr-3.1-14 办公室10年22 生产设备维修计划与执行记录表Qr-3.1-21 办公室10年23 车间设备工具日常清理消毒记录Qr-3.1-31 办公室10年24 设备维修记录Qr-3.1-41 办公室10年25 设备报废记录Qr-3.1-42 办公室10年26 员工(履历)登记表_质量负责人qr-3.2-11 办公室10年27 员工(履历)登记表_车间操作工qr-3.2-12 供销科10年28 企业员工健康证登记表QR-3.2-13 供销科10年29 员工培训计划qr-3.2-21 供销科10年30 培训计划与实施记录表Qr-3.2-22 生技科10年31 文件和资料发放记录Qr-3.3-11 生技科10年32 文件更改评审通知单Qr-3.3-21 生技科10年33 文件作废留用记录Qr-3.3-22 生技科10年34 原辅材料等供货方调查表qr-4.1-11 质管科10年序号记录名称编号使用部门保存期备注35 合格供货方名单汇总qr-4.1-12 质管科10年36 采购计划表qr-4.1-21 质管科10年37 采购合同QR-4.1-22 质管科10年38 生产计划表qr-5.1-41 质管科10年39 领料单qr-5.1-42 质管科10年40 成品发货通知单qr-5.1-51 质管科10年41 成品出入库记录qr-6.3-52 质管科10年42 产品销售明细表qr-6.3-53 质管科10年43 台帐检测设备化验器具qr-6.1-12 质管科10年44 检测设备化验器具履历卡qr-6.1-21 办公室10年45 计量器具计量检定计划与执行记录化验室qr-3.1-31 质管科10年46 计量器具计量检定计划与执行记录车间qr-3.1-3247 化验室试剂出入库记录qr-6.1-4148 无菌室与超净工作台无菌程度测试记录qr-6.1-51 质管科办公室10年49 无菌室与超净工作台消毒灭菌记录qr-6.1-5250 不合格(品)评审处置记录直式qr-6.4-1151 紧急放行申请处置单qr-6.4-2152 顾客投诉受理处置记录qr-6.4-4553 顾客满意度调查表a QR-6.4-4654 食品生产加工企业食品添加物质使用备案表Qr-6.3-4555 产品委托检验计划与执行记录Qr-6.3-456 产品召回处置记录表QR-7.2-157 产品回收通知(函)Qr-7.2-258 不安全食品销毁台帐QR-7.2-359 风险监测及评估信息收集和处置记录bQR-8.4-160 食品安全事故处置记录Qr-7.2-261 食品生产加工企业落实质量安全主体责任情况自查表QR-8.5-162 食品添加剂使用合规性自评表QR-8.6-163 工艺文件汇编目次QR-9.164 检验文件汇编目次QR-9.2序记录名称编号使用部门保存期备注号二专用记录(工艺)CIP清洗记录表QR-3.1-452水纯化监控记录QR-5.1-112化糖监控记录QR-5.1-113煮料操作监控记录QR-5.1-114调味调色料配制记录果冻QR-5.1-105充填封口岗位操作记录QR-5.1-117杀菌岗位生产记录QR-5.1-118二专用记录(检验)过程(工序)检验记录果冻QR-5.1-432产品出厂检验原始记录(合并)果冻QR-6.3-443产品出厂检验报告果冻QR-6.3-451工艺文件汇编目次1 果冻加工作业指导书 (1)2 果冻加工工艺流程图……………………………………3 调味调色料配制作业指导书 ……………………………4 车间加工设备操作规程………………………………5 果冻充填封口机使用规范………………………………6 标签贮运作业指导书 …………………………………化验室(检验)文件汇编目次1 化验室操作规程 (1)2 原辅材料、包装材料采购质量验收操作规程…………3 感官检验实施细则 ……………………………………4 净含量检验实施细则…………………………………5 产品出厂检验操作规程 ………………………………6 化验室仪器操作规程 …………………………………7 过程(工序)检验操作规程 ……………………………8 委托检验计划 …………………………………………9 罐头食品中可溶性固形物含量的测定(GB/T10788)…10 食品微生物学检验总则(GB/T4789.1)………………11 菌落总数的测定方法(GB/T4789.2)……………………12 大肠菌群的测定方法(GB/T4789.2)……………………水处理监控记录表审核/日期:CIP清洗操作记录表审核/日期:原辅材料、包装材料的验收记录编号:QR-6.3-4.2.2 №:材料名称牌号规格进货日期供方名称总数量抽样数量检验内容项目检验结果与评定项目检验结果与评定包装状况净含量标签感官检验形态色泽气味与滋味杂质供方质量资质证明验证:检验员:日期:不合格的处理措施:质检科:质量负责人:日期:[键入文字]产品委托检验计划与执行记录[键入文字] 编号:QR-6.3-43 委托检验机构:****食品质量监督检验中心№:1序号产品名称委托检验项目计划时间执行时间检验结果执行人备注1 果冻一、理化:总砷苯甲酸铅山梨酸铜甜蜜素蛋白质糖精钠二氧化硫残留量安赛蜜着色剂(根据色泽选择测定)二、微生物:霉菌、酵母、致病菌(沙门氏菌、志贺氏菌、金黄色葡萄球菌) 2006-06-15 2006-07-05 合格***2 果冻2006-11-30 审核/日期:食品生产加工企业食品添加物质使用备案表生产者名称(盖章): 注册地址:实际生产地址: 联系电话: 填报日期:食品名称食品类别食品生产许可证号食品执行标准号添加物质名称添加剂类别用途是否进口添加剂生产企业添加剂生产许可证号实际最大使用量添加剂来源添加剂来源详细信息备案机构(盖章):备案日期:调味料配制记录表编号:QR-5.1-105 №:日期批号花生仁食盐白砂糖辣椒粉香兰素工序检验责任人(签名)形态色泽口感编号:QR-6.3-443№:产品名称批号20**060801 抽样基数78箱抽样量13箱规格5kg/箱检验日期20**.06.10 检验依据GB 19883-2005,GB 19299-2003,GB/T 10788-1989,GB/T 4789.2-2003,GB/T 4789.3-2003 检验结果备注感官样品状态形态色泽气味与滋味杂质合格正常,内外包装封装良好,标签标注符合要求符合要求符合要求符合要求无可溶固形物/% 样品温度:℃测定结果(1)(2)(3)净含量/g 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 平均净含量:5.02 k g超出最大允许负偏差件数:无净重 5.01 5.02 4.95 4.98 5.03 5.00 5.03 5.04 5.06 4.97 4.99 5.03 5.18标重60 60 60 60 60 60 60 60 60 60 60 60 60偏差0.01 0.02 -0.05 -0.02 0.03 0.00 0.03 0.04 0.06 -0.03 -0.01 0.03 0.18菌落总数/cfu/g不同稀释度菌落总数-0.1g×2 平均数0.01 g×2 平均数0.001 g×2 平均数空白大肠菌群/MPN/100g不同稀释度发酵管数复发酵阳性管数<30 1g×3 0.1g×3 0.01g×3 1g×3 0.1g×3 0.01g×30 0 0编号:QR-6.3-443№:产品名称批号20**060801 抽样基数78箱抽样量13箱规格5kg/箱检验日期20**.06.10 检验依据GB 19883-2005,GB 19299-2003,GB/T 10788-1989,GB/T 4789.2-2003,GB/T 4789.3-2003 检验结果备注感官样品状态形态色泽气味与滋味杂质合格正常,内外包装封装良好,标签标注符合要求符合要求符合要求符合要求无可溶固形物/% 样品温度:℃测定结果(1)(2)(3)净含量/g 毛重 5.41 5.42 5.35 5.38 5.43 5.39 5.42 5.43 5.45 5.36 5.41 5.45 5.60 平均净含量:5.02 k g超出最大允许负偏差件数:无皮重0.40 0.40 0.40 0.40 0.40 0.39 0.39 0.39 0.39 0.39 0.42 0.42 0.42净重 5.01 5.02 4.95 4.98 5.03 5.00 5.03 5.04 5.06 4.97 4.99 5.03 5.18偏差0.01 0.02 -0.05 -0.02 0.03 0.00 0.03 0.04 0.06 -0.03 -0.01 0.03 0.18菌落总数/cfu/g不同稀释度菌落总数-0.1g×2 平均数0.01 g×2 平均数0.001 g×2 平均数空白大肠菌群/MPN/100g不同稀释度发酵管数复发酵阳性管数<30 1g×3 0.1g×3 0.01g×3 1g×3 0.1g×3 0.01g×30 0 0产品出厂检验报告编号:QR-6.3-451№:产品名称规格60g/个抽样日期20**.10.11 批号20**101101 总数量98瓶抽样数量 2 kg 抽样人*××项目标准要求检验结果评定包装状况要求内、外包装及封装完好,有产品合格证完好合格标签符合GB 7718要求:①品名、②配料表、③净含量及字符高度、④厂名、⑤厂址、⑥生产日期和⑦保质期清晰、⑧产品标准号、⑨符合要求合格规格杯形的杯口内径或杯口内侧最大长度(cm):≥3.5 3.5合格感官检验形态和质地凝胶果冻呈凝胶状,脱离包装容器后,能基本保持原有的形态,组织柔软适中符合要求合格色泽具有该品种应有色泽,着色基本均匀符合要求合格气味与滋味具本品固有的口感风味,味纯正,酸甜适中,无异味。
市政工程质检表及具体填写方法(全)

3、质检表3.1 质检表1的填写质检表1是一张查验合格证、出厂检试验报告的汇总表,要求必须有产品名称、规格、数量。
检查量与产品数量(这里是指单据上的数量而不是实际用量)要相对应,主要检测项目应齐全,一般均应有明确结论。
合格证书、检(试)验报告一般应为原件,如为复印件的必须加盖供货单位印章方为有效,并注明使用工程名称、规格、数量、进场日期、经办人签名及原件存放地点.除一般常用的材料外,市政工程常用的三渣及沥青混合料有如下规定:水泥、石灰、粉煤灰混合料,生产单位应按规定,提供产品出厂质量合格证书。
连续供料时,生产单位出具合格证书的有效期最长不得超过7天。
沥青混合料生产单位应按同类型、同配比、每批次至少向施工单位提供一份产品质量合格证书。
连续生产时,每2000t提供一次。
凡使用新技术、新工艺、新材料、新设备的,应有法定单位鉴定证明和生产许可证。
产品要有质量标准、使用说明和工艺要求。
使用前应按其质量标准进行检(试)验。
3。
2 质检表2的填写质检表2是一张开箱检查记录,应按栏目内容填写.填表示例见后。
3.3 质检表3的填写下列内容应填写预检记录:(1)主要结构的模板预检记录,包括几何尺寸、轴线、标高、预埋件和预留孔位置、模板牢固性和模内清理、清理口留置、脱模剂涂刷等检查情况。
(2)大型构件和设备安装前的预检记录应有预埋件、预留孔位置、高程、规格等检查情况.(3)设备安装的位置检查情况.(4)非隐蔽管道工程的安装检查情况.(5)补偿器预拉情况、补偿器的安装情况.(6)支(吊)架的位置、各部位的连接方式等检查情况。
(7)油漆工程。
3。
4 质检表4的填写凡被下道工序、部位所隐蔽的,在隐蔽前必须进行质量检查,并填写隐蔽工程检查验收记录.隐蔽检查的内容应具体,结论应明确。
验收手续应及时办理,不得后补.需复验的要办理复验手续。
隐检内容及检查情况、验收意见,一般应按监理单位或其他第三方检查意见填写。
处理情况及结论栏,预检中提出过处理意见的,必须填写处理情况和处理后的结论。
船舶出厂检验表格形式

船舶出厂检验表格形式
船舶建造检验技术资料
船为质船, 按照经审查批准、审图号为的图纸施工建造。
全船结构、机械零部件、机电设备的材料和制造安装质量均符合图纸和现行法规要求,经系泊和航行试验,各系统的运行情况良好,船舶性能符合设计要求,准予出厂。
质检部门(签章)
年月日
目录
船体材料性能报告
附:质量证明文件
船体材料使用部位
船体焊接材料质量证明
附:质量证明文件
焊条、焊丝、焊剂施焊的船体部位
主要机电设备明细表
附:质量证明文件
船体舱室密闭性试验报告
肋位中剖面构件尺寸测量记录
船体主尺度测量
载重线标志及水尺检验报告
锚机/绞盘系泊试验记录
锚机/绞盘航行试验记录
起双
起
舵装置及舵机系泊试验记录
操舵试验报告
起货设备试验报告
固定水消防系统检验记录
固定压力水雾灭火系统检验记录
固定CO2灭火系统检验记录
固定甲板泡沫灭火系统检验记录
消防用品、救生设备检验记录
船舶性能试验报告
艉轴与轴承间隙测量单位:mm
主机臂距差测量单位: mm
柴油机起动性能试验
换向试验记录
柴油机系泊/航行试验记录。
生产许可证检查明细
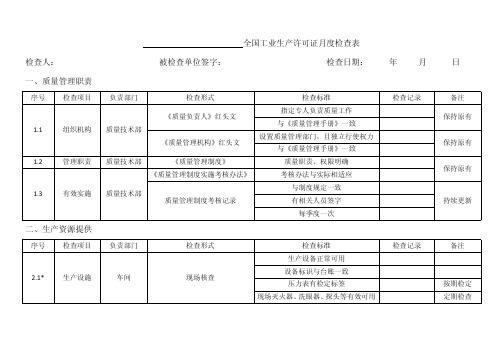
序号 5.2.3 5.3.1 5.3.2 5.4
5.5
5.6
检查项目 工艺管理
质量控制
负责部门 车间
车间
质量控制
车间
产品标识
车间
不合格产品
车间
质量技术部
产品销售 市场营销部
检查形式 岗位操作记录 关键质量控制图 工艺操作规程 关键质量控制程序
关键参数抽查表
《产品包装、标识管理规定》 现场核查 合格证书
工艺、设备、安全、检验 技术操作规程
4.2.2
车间化验室 技术文件
车间
检验技术规程 工艺技术操作规程
检查标准 熟知产品出厂指标 能熟练按规定检验
熟悉岗位职责 能讲清关键控制流程 有签字、考卷,每季度一次 有签字、考卷,每季度一次
至少 2 本 与岗位人员对应
检查标准 与细则中一致 现行、有效且受控 审批、更改手续齐全
检查记录
备注 持续更新 持续更新 持续更新
出厂检验
车间
现场核查
市场营销部
6.4
委托检验 质量技术部
包装袋生产厂家资质 委托单位资质 委托检验合同
委托检验报告
6.5
型式检验 车间化验室
七、安全防护
型式检验报告 型式检验原始记录
序号 7.1
检查项目 安全生产
负责部门 质量技术部
检查形式 危险化学品储罐定期检查规定
检查标准 检验结果均合格 对产品检验做出明确规定 检验状态有明确标识 与标准中要求一致 明确产品包装细则 备有专用包装袋 有安全技术说明书 有合格证标签(包含批号)
7.1
安全生产
车间
7.2
劳动防护
车间
检查形式 危险化学品储罐检查记录
工厂检验报告样本CIG023

CIG 023Factory InspectionReport ChineseUL does not endorse any vendors or products referenced herein.UNDERWRITERS LABORATORIES INC. ASSUMES NO RESPONSIBILITY FOR ANY OMISSIONS OR ERRORS ORINACCURACIES WITH RESPECT TO THIS INFORMATION. UL MAKES NO REPRESENTATION OR WARRANTY OF ANY KIND WHATSOEVER, WHETHER EXPRESS OR IMPLIED, WITH RESPECT TO THE ACCURACY, CONDITION, QUALITY, DESCRIPTION, OR SUITABILITY OF THIS INFORMATION, INCLUDING ANY WARRANTY OF MERCHANTABILITY OR FITNESS FOR A PARTICULAR PURPOSE AND EXPRESSLY DISCLAIMS THE SAME.Copyright Underwriters Laboratories Inc. All rights reserved. May not be reproduced without permission. This document isWARNING:THIS DOCUMENT IS ONLY VALID IF USED BY ECS MEMBERSAND THEIR AUTHORISED AGENTSPERMANENT DOCUMENT 永久性文件CIG 023Factory Inspection Report 工厂检验报告WARNING:THIS DOCUMENT IS ONLY VALID IF USED BY ECS MEMBERSAND THEIR AUTHORISED AGENTS警告:本文件仅在为欧洲认证体系(ECS)成员及其授权代理人所用时生效Approved by: ECS General Meeting, 22/23-04-2009 Nr of pages: 19 Date of issue: May 2009Supersedes: PD CIG 023 - June 2004 Page 1 of 19 PD CIG 023 reports shall not contain any unauthorised modifications which change the originalmeaning or the requirements.Any additions created to any document in the series shall be shown in an Appendix.未经批准,不得对 PD CIG 023 报告进行任何改变其原有含意或要求的修改。
