凝固点-物化实验报告
凝固点下降法测定物质分子

凝固点下降法测定物质分子量一.实验目的1.利用凝固点降低法测定稀溶液中溶质萘的分子量。
2.掌握溶液凝固点的测定技术。
3.通过实验加深对稀溶液依数性的理解。
二.实验原理1.凝固点降低法测分子量的原理当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯溶剂的凝固点,其降低值与溶液的质量摩尔浓度成正比。
即ΔT=T f* - T f = K f .b B(1) 式中,T f*为纯溶剂的凝固点,T f为溶液的凝固点,b B为溶液中溶质B的质量摩尔浓度,K f为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的性质有关。
若称取一定量的溶质m B(g)和溶剂m A (g),配成稀溶液,则此溶液的质量摩尔浓度为 b B=1000m B/M B.m A,式中,M B为溶质的分子量。
将该式代入(1)式,整理得: M B = 1000 K f m B /ΔT. m A(g/mol) (2)若已知某溶剂的凝固点降低常数K f值,通过实验测定此溶液的凝固点降低值ΔT,即可计算溶质的分子量M B。
2.凝固点测量原理通常测凝固点的方法是将溶液逐渐冷却,但冷却到凝固点,并不析出晶体,往往成为过冷溶液。
然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升,当放热与散热达到平衡时,温度不再改变。
此固液两相共存的平衡温度即为溶液的凝固点。
但过冷太厉害或寒剂温度过低,则凝固热抵偿不了散热,此时温度不能回升到凝固点,在温度低于凝固点时完全凝固,就得不到正确的凝固点。
溶剂与溶液的冷却曲线形状不同。
对纯溶剂两相共存时,冷却曲线出现水平线段,其形状如图(a)所示。
对溶液两相共存时,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,但回升到最高点又开始下降,所以冷却曲线不出现水平线段,而斜率发生变化,如图(b)所示。
由于溶剂析出后,剩余溶液浓度变大,显然回升的最高温度不是原浓度溶液的凝固点,严格的做法应作冷却曲线,并按图(b)中所示方法加以校正。
凝固点测定摩尔质量的实验报告

凝固点测定摩尔质量的实验报告实验目的:通过测定不同溶液的凝固点,确定溶质的摩尔质量。
实验原理:根据Raoult定律,溶液的凝固点降低与溶质的摩尔浓度成正比。
凝固点下降(ΔT)与溶质的摩尔浓度(mol/kg)之间的关系可以用以下公式表示:ΔT = K × m其中,ΔT为凝固点下降,K为凝固点常数,m为溶质的摩尔浓度。
由于m = n/V,其中n为溶质的物质量,V为溶液的体积,因此,m可以表示为m = (n/M)/V,其中M为溶质的摩尔质量。
实验步骤:1. 准备不同浓度溶液:根据需求,准备不同摩尔质量的溶质,称取适量的溶质并加入适量的溶剂,搅拌溶解均匀,得到不同浓度的溶液。
2. 测定溶液的凝固点:将准备好的溶液分别放入凝固点测定仪器中,测定其凝固点。
注意记录溶液的凝固点和浓度。
3. 绘制凝固点与浓度的关系曲线:根据测定得到的凝固点和浓度数据,绘制凝固点与浓度的关系曲线。
4. 根据曲线确定溶质的摩尔质量:通过曲线确定不同浓度溶液的凝固点下降(ΔT),然后利用ΔT = K × m,计算得到不同浓度溶液的摩尔浓度(m)。
由于所用的溶质量和溶液体积都是已知的,因此可以通过计算得到不同浓度溶液的摩尔质量(M)。
实验结果:根据测定得到的凝固点和浓度数据,绘制凝固点与浓度的关系曲线,如下图所示。
[插入图片]根据曲线确定不同浓度溶液的凝固点下降(ΔT),如下表所示:浓度(mol/L)凝固点下降(ΔT)(℃)------------------------------------0.1 1.20.2 2.50.3 3.80.4 5.10.5 6.4根据ΔT = K × m,计算得到不同浓度溶液的摩尔浓度(m)如下表所示:浓度(mol/L)摩尔浓度(mol/kg)------------------------------------0.1 0.50.2 1.00.3 1.50.4 2.00.5 2.5由于所用的溶质量和溶液体积都是已知的,根据公式m =(n/M)/V,即可计算得到不同浓度溶液的摩尔质量(M),如下表所示:浓度(mol/L)摩尔浓度(mol/kg)摩尔质量(g/mol)----------------------------------------------0.1 0.5 1000.2 1.0 1000.3 1.5 1000.4 2.0 1000.5 2.5 100实验结论:根据实验结果可知,不同浓度溶液的摩尔浓度与溶质摩尔质量呈正比关系,并且摩尔质量均为100g/mol。
物理化学实验报告-凝固点法

物理化学实验报告凝固点降低法测定摩尔质量1.实验目的(1)用凝固点降低法测定萘的摩尔质量。
(2)掌握精密电子温差仪的使用方法。
2.实验原理非挥发性的二组分溶液,其稀溶液具有依数性,凝固点降低就是依数性的一种表现。
根据凝固点降低的数值,可以求溶质的摩尔质量。
对于稀溶液,如果溶质和溶液不生成固溶体,固体是纯的溶剂,在一定压力下,固体溶剂与溶液成平衡的温度叫做溶液的凝固点。
溶剂中加入溶质后,溶液的凝固点比纯溶剂的凝固点要低,其凝固点降低值∆T f与溶质质量摩尔浓度b成正比。
∆T f=T f0−T f=K f b式中T f0为纯溶剂的凝固点;T f为浓度为b的溶液的凝固点;K f为溶剂凝固点降低常数。
若已知某种溶剂的凝固点降低常数K f,并测得溶剂和溶质的质量分别为m a,m b的稀溶液的凝固点降低值∆T f,则可通过下式计算溶质的摩尔质量M BM B=K f m b ∆T f m A式中,K f的单位是K*kg*mol−1。
凝固点降低值得大小,直接反映了溶液中溶质有效质点的数目。
如果溶质在溶液中有离解,缔合,溶剂化和配合物生成等情况,这些均影响溶质在溶剂中的表观相对分子量。
因此凝固点降低法也可用来研究溶液的一些性质,例如电解质的电离度,溶质的缔合度,活度和活度系数等。
纯溶剂的凝固点为其液相和固相共存的平衡温度。
若将液态的纯溶剂逐步冷却,在未凝固前温度将随时间均匀下降,开始凝固后因放出凝固热而补偿了热损失,体系将保持液固两相共存的平衡温度不变,直至全部凝固,温度再继续下降。
但在实际过程中,当液体达到或稍低于凝固点时,晶体并不析出,这就是所谓的过冷现象。
此时加入搅拌或加入晶种,促使晶格形成,则大量晶体会迅速形成,并释放出凝固热,使体系温度回升到稳定的平衡温度;待液体全部凝固后温度再逐步下降。
溶液的凝固点是该溶液与溶剂共存的平衡温度,其冷却曲线与纯溶剂不同。
当有溶剂凝固析出时,剩余溶液的浓度逐渐增大,因而溶液的凝固点也逐渐下降。
凝固点-物化实验报告

实验7 凝固点降低法测定摩尔质量:憨家豪;学号:2012012026;班级:材23班;同组实验人员:晓慧 实验日期:2014-3-8;提交报告日期:2014-3-15 带实验的助教:袁斌 1. 引言 1.1 实验目的1.用凝固点降低法测定尿素的摩尔质量。
2.学会用步冷曲线对溶液凝固点进行校正。
3.通过本实验加深对稀溶液依数性的认识。
1.2 实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为:*×f f f f BT T T K b ∆=-=式中:f T ∆为凝固点降低值,*f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。
如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为:1000××Bf f A m T K M m ∆=即310Bff Am M K T m =∆ 式中: f K 为溶剂的凝固点降低常数(单位为K ·kg ·mol -1);M 为溶质的摩尔质量(单位为g ·mol -1)。
如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ∆,利用上式即可求出溶质的摩尔质量。
常用溶剂的f K 值见下表1。
表1 常用溶剂的f K 值实验中,要测量溶剂和溶液的凝固点之差。
对于纯溶剂如图1所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。
对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。
相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。
当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。
因此,凝固点不是一个恒定的值。
物化实验报告_凝固点降低法测定摩尔质量

图1
溶剂和溶液的步冷曲线
2
实验操作 2.1 实验药品、仪器型号及测试装置示意图
1.仪器 TSW-3 型 精密数字温度计(-12-12℃,0.002℃) CJ-2 型 磁力搅拌器 (北京林元佳业科技有限公司) HS-4 型 精密恒温浴槽(可制冷,-20-100℃) 冷阱 大试管 移液管(25ml)分析天平(公用) 秒表(E7-1,上海手表五厂) 2.药品 环己烷(分析纯,密度 0.778g/ml) ,萘(分析纯,摩尔质量:128.17) 3.测试装置示意图(见下图)
第 3,4,5 次平均值 6.388
在实验中,一共进行六次凝固点测定,取其中差距最小的三次,取平均值后作为溶剂的凝固点, 即溶剂凝固点 Tf*=6.388℃。 (b)溶液凝固点测量原始数据 表 5 溶液凝固点测量原始数据记录表
时间(s)
温度(℃) 时间(s) 温度(℃) 时间(s) 温度(℃)
0 6.000 240 5.091 420 5.091
Time (Sec.)
图 3 测定所得的溶液步冷曲线。测定体系由 0.1525g 萘与 25.0mL 环 己烷组成,当系统温度降至 6.000℃时开始记录,横坐标为时间,纵坐 标为所测得的溶液温度,从而得到溶液的步冷曲线。 为得到准确的溶液凝固点,将溶液凝固后温度回升又下降的部分做反向延长线,与开始的温度 下降线相交,分别选取线性程度较好的有效数据区进行线性拟合,所得到两条直线的交点即为溶 液的凝固点 Tf。结果如下图 4 所示:
210 5.192 390 5.108
3.2 计算的数据、结果
利用冷却曲线计算溶液凝固点 Tf 利用 Origin Pro 软件将表 5 中的数据用作图法表示出来,可得到实验中溶液的冷却曲线。结果 如下图 3 所示: a)
物化实验-凝固点降低法测定摩尔质量 实验报告
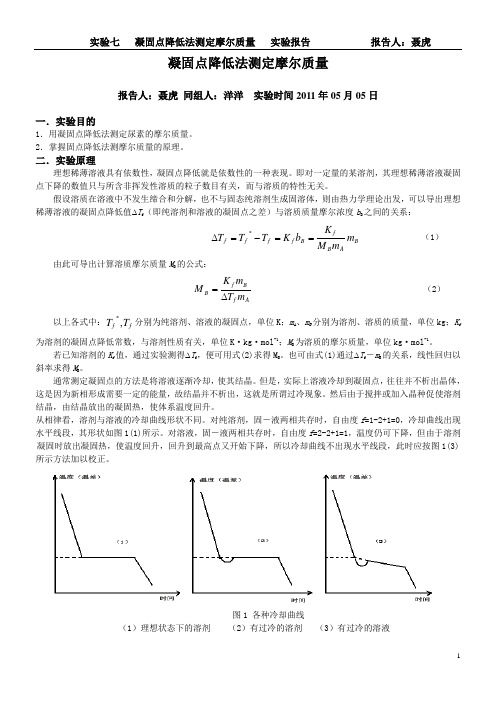
凝固点降低法测定摩尔质量报告人:聂虎 同组人:洋洋 实验时间2011年05月05日一.实验目的1.用凝固点降低法测定尿素的摩尔质量。
2.掌握固点降低法测摩尔质量的原理。
二.实验原理理想稀薄溶液具有依数性,凝固点降低就是依数性的一种表现。
即对一定量的某溶剂,其理想稀薄溶液凝固点下降的数值只与所含非挥发性溶质的粒子数目有关,而与溶质的特性无关。
假设溶质在溶液中不发生缔合和分解,也不与固态纯溶剂生成固溶体,则由热力学理论出发,可以导出理想稀薄溶液的凝固点降低值∆T f (即纯溶剂和溶液的凝固点之差)与溶质质量摩尔浓度b B 之间的关系:B AB fB f f f f m m M Kb K T T T ==-=∆*(1)由此可导出计算溶质摩尔质量M B 的公式:Af B f Bm T m K M∆=(2)以上各式中:f f T T ,*分别为纯溶剂、溶液的凝固点,单位K ;m A 、m B 分别为溶剂、溶质的质量,单位kg ;K f为溶剂的凝固点降低常数,与溶剂性质有关,单位K·kg·mol -1;M B 为溶质的摩尔质量,单位kg·mol -1。
若已知溶剂的K f 值,通过实验测得∆T f ,便可用式(2)求得M B 。
也可由式(1)通过∆T f -m B 的关系,线性回归以斜率求得M B 。
通常测定凝固点的方法是将溶液逐渐冷却,使其结晶。
但是,实际上溶液冷却到凝固点,往往并不析出晶体,这是因为新相形成需要一定的能量,故结晶并不析出,这就是所谓过冷现象。
然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升。
从相律看,溶剂与溶液的冷却曲线形状不同。
对纯溶剂,固-液两相共存时,自由度f =1-2+1=0,冷却曲线出现水平线段,其形状如图1(1)所示。
对溶液,固-液两相共存时,自由度f =2-2+1=1,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,回升到最高点又开始下降,所以冷却曲线不出现水平线段,此时应按图1(3) 所示方法加以校正。
物化实验报告-凝固点降低法测定摩尔质量
物理化学实验报告武汉大学凝固点降低法测定摩尔质量一、实验目的1. 用凝固点降低法测定某未知物的摩尔质量 2. 学会用步冷曲线对溶液凝固点进行校正3. 通过本实验了解掌握凝固点降低法测定摩尔质量的原理,加深对稀溶液依数性的理解。
二、实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为:*×f f f f B T T T K b ∆=-=其中,f T ∆为凝固点降低值,*f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。
如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为:1000××B f f Am T K M m ∆=即310Bff Am M K T m =∆ (*) 式中: f K ——溶剂的凝固点降低常数(单位为K·kg·mol -1)M ——溶质的摩尔质量(单位为g/mol )。
如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ∆,利用上式即可求出溶质的摩尔质量。
实验中,要测量溶剂和溶液的凝固点之差。
对于纯溶剂如图1(a )所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。
对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。
相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。
当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。
因此,凝固点不是一个恒定的值。
如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。
要精确测量,应测出步冷曲线,按下一页图1(b )所示方法,外推至f T 校正。
物理化学实验报告讲义凝固点降低法测定非挥发性溶质的摩尔质量
实验28 凝固点降低法测定非挥发性溶质的摩尔质量预习要求1. 理解稀溶液的“依数性”的含义。
2. 理解纯溶剂和稀溶液的冷却曲线的差别。
3. 凝固点降低法测定溶质的摩尔质量的适用条件。
4. 明确本实验的技术关键。
实验目的1. 用凝固点降低法测定萘的摩尔质量,加深对稀溶液依数性的理解。
2. 了解液体过冷的原理及实现的方法。
3. 掌握贝克曼温度计的特点及使用方法。
实验原理稀溶液具有依数性,包括蒸气压下降、沸点升高、凝固点降低和渗透压等四种性质。
当稀溶液凝固结晶析出的只是纯溶剂时,则溶液的凝固点比纯溶剂的凝固点低,凝固点降低的数值与溶质的质量摩尔浓度成正比。
即B f B AA f f f f Δ)(Δ2b k b H M T R T T T ***==-= (3-16) 式中,T f *、T f ——分别为纯溶剂和稀溶液的凝固点;ΔT f ——溶液的凝固点降低值;M A 、ΔH A *—— 分别为纯溶剂的摩尔质量和摩尔凝固焓;k f ——为凝固点降低常量,仅与溶剂的性质有关;b B ——溶质的质量摩尔浓度。
若溶质和溶剂的质量分别为m B 和m A ,溶质的摩尔质量为M B ,则 b B =m M m B AB (3-17) 将式(3-17)代入式(3-16)得M B =k f m B /(ΔT f m A ) (3-18) 式(3-18)中,m B 可以用分析天平精确称量,k f 可以从有关手册中查到(也可以用已知摩尔质量的标准物质测定)。
常用溶剂的凝固点降低常量列于表3-2。
实验中只要测出溶液的凝固点降低ΔT f ,就可以计算出溶质的摩尔质量M B 。
因此,本实验的关键是测定纯溶剂和溶液的凝固点。
实验采用过冷法测定凝固点。
即把待测液体逐渐降温成为过冷液体,然后在几乎绝热的情况下突然搅拌待测液体,促使固体析出,放出的凝固热使系统温度逐渐回升,当放热与散热达到平衡时,即为待测液体的凝固点。
对纯液体,此时温度不再变化,此温度即为纯液体的凝固点,见图3-9(a)。
物化实验报告_凝固点降低法测定摩尔质量
凝固点降低法测定摩尔质量丛乐 2005011007 生 51实验日期: 2007年10月13日星期六 提交报告日期: 2007年 10月 27日星期六助教老师:马林1 引言1.1 实验目的1. 用凝固点降低法测定萘的摩尔质量 2. 学会用步冷曲线对溶液凝固点进行校正 3. 通过本实验加深对稀溶液依数性的认识1.2 实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为:T f T f * T f K f ×b B其中, T f 为凝固点降低值, T f *、 T f 分别为纯溶剂、溶液的凝固点, b B 为溶液质量摩尔浓度, K f 为凝固点降低常数, 它只与所用溶剂的特性有关。
如果稀溶液是由质量为 构成,则上式可写为:即103m BM K f B (*) T f m A1式中: K f ——溶剂的凝固点降低常数(单位为 K gkggmol 1); M ——溶质的摩尔质量(单位为 ggmol 1)。
如果已知溶液的 K f 值,则可通过实验测出溶液的凝固点降低值 质量。
常用溶剂的 K f 值见下表。
表 1 常用溶剂的 K f 值实验中,要测量溶剂和溶液的凝固点之差。
对于纯溶剂如图 1( a )所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出) ,温度降低至一定值时出现结晶,当晶体生成时,放出的 热量使体系温度回升,而后温度保持相对恒定。
对于纯溶剂来说,在一定压力下,凝固点是固定不变的, 直到全部液体凝固成固体后才会下降。
相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。
当溶液温度回升后,由于不断析出溶剂晶体,所以溶 液的浓度逐渐增大,凝固点会逐渐降低。
因此,凝固点不是一个恒定的值。
如把回升的最高点温度作为凝 固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是 原浓度溶液的凝固点。
物化实验报告-凝固点降低法测定摩尔质量
物理化学实验报告武汉大学凝固点降低法测定摩尔质量一、实验目的1. 用凝固点降低法测定某未知物的摩尔质量 2. 学会用步冷曲线对溶液凝固点进行校正3. 通过本实验了解掌握凝固点降低法测定摩尔质量的原理,加深对稀溶液依数性的理解。
二、实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为:*×f f f f B T T T K b ∆=-=其中,f T ∆为凝固点降低值,*f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。
如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为:1000××B f f Am T K M m ∆=即310Bff Am M K T m =∆ (*) 式中: f K ——溶剂的凝固点降低常数(单位为K ·kg ·mol -1)M ——溶质的摩尔质量(单位为g/mol )。
如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ∆,利用上式即可求出溶质的摩尔质量。
实验中,要测量溶剂和溶液的凝固点之差。
对于纯溶剂如图1(a )所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。
对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。
相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。
当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。
因此,凝固点不是一个恒定的值。
如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。
要精确测量,应测出步冷曲线,按下一页图1(b )所示方法,外推至f T 校正。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验7 凝固点降低法测定摩尔质量姓名:憨家豪;学号:2012012026;班级:材23班;同组实验人员:赵晓慧 实验日期:2014-3-8;提交报告日期:2014-3-15 带实验的助教姓名:袁斌1. 引言1.1 实验目的1.用凝固点降低法测定尿素的摩尔质量。
2.学会用步冷曲线对溶液凝固点进行校正。
3.通过本实验加深对稀溶液依数性的认识。
1.2 实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为:*×f f f f BT T T K b ∆=-=式中:f T ∆为凝固点降低值,*f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。
如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为:1000××Bf f A m T K M m ∆=即310Bff Am M K T m =∆ 式中: f K 为溶剂的凝固点降低常数(单位为K ·kg ·mol -1);M 为溶质的摩尔质量(单位为g ·mol -1)。
如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ∆,利用上式即可求出溶质的摩尔质量。
常用溶剂的f K 值见下表1。
表1 常用溶剂的f K 值实验中,要测量溶剂和溶液的凝固点之差。
对于纯溶剂如图1所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。
对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。
相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。
当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。
因此,凝固点不是一个恒定的值。
如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。
要精确测量,应测出步冷曲线,按图1(b )所示方法,外推至f T 校正。
图1 溶剂和溶液的步冷曲线2. 实验操作2.1 实验用品、仪器型号及测试装置示意图SWC-IID 精密数字温度温差仪、冷阱、大试管、移液管(25 mL )、85-2型恒温磁力搅拌器、DC-2010节能型智能恒温槽、分析天平。
去离子水,尿素(分析纯)。
测试装置示意图(如下)图2 凝固点降低实验装置图2.2 实验条件实验温度14.0℃,大气压102.1 kPa,相对湿度28.0%。
2.3实验步骤1. 仪器装置如图2—7—2所示,将恒温槽温度调至-6℃左右,通入冷阱。
在室温下,用移液管移取25 mL去离子水,加入大试管。
调整数字温度计的测温探头,使探头顶端处于液体的中下部。
调整磁力搅拌器转速旋钮至适当转速,保持恒定。
2. 溶剂凝固点的测定观察温度计的变化,当温度降至1℃时,打开秒表,每半分钟记录一次温度。
当温度降低到最低点后,温度开始回升,此时将记录时间改为10s一次,直到升至最高,在一段时间内恒定不变,此时温度即为溶剂的凝固点,记下温度值。
取出大试管,不要使溶液溅到橡皮塞上。
通过自然降温法(不用手温加热)晶体全部融化(注意不要使温度升高过多,避免以后实验的降温时间过长)。
将大试管放回冷阱,重复上述操作。
如此再重复两次,直到取得两个偏差不超过±0.01℃的值。
取其平均值作为水的凝固点。
3. 溶液的凝固点测定取出大试管,在管中加入0.4 g左右(准确到0.0002 g)的尿素,注意不要粘于管壁上(可先将尿素压成片)。
拿掉磁力搅拌器上的冷阱,将大试管直接放在磁力搅拌器上搅拌至全部溶解,然后按装置图将一起装好。
观察数字温度计,当温度计降至1℃时,设定温差计,半分钟记录一次温度值,当温度降至最低开始回升后(晶体析出),10s 记录一个点,注意观察,将最高点温度记录下来(用此点估算尿素的摩尔质量)。
此后再记录6~7个点,实验结束。
3. 结果与讨论3.1 数据记录尿素质量0.4073 g,去离子水体积25 mL表1、去离子水凝固点测量(第一次)t/s 0 30 60 90 120 150T/℃0.556 0.31 0.079 -0.151 -0.38 -0.591t/s 180 210 230 240 250 260T/℃-0.804 -1.008 0.119 0.189 0.212 0.224t/s 270 280 290 300 310 320T/℃0.234 0.237 0.236 0.243 0.251 0.258t/s 330 340 350 360 370 380T/℃0.262 0.274 0.278 0.282 0.282 0.281t/s 390 400 410 420 430 440T/℃0.285 0.285 0.284 0.286 0.283 0.283去离子水凝固点取第390~440s的平均值,为T1=0.284 ℃。
表2、去离子水凝固点测量(第二次)t/s 0 30 60 90 120 150T/℃0.403 0.255 0.108 -0.033 -0.176 -0.32t/s 180 210 240 270 290 300T/℃-0.514 -0.714 -0.914 -1.085 0.137 0.19t/s 310 320 330 340 350 360T/℃0.208 0.221 0.229 0.238 0.243 0.245t/s 370 380 390 400 410 420T/℃0.248 0.253 0.251 0.257 0.269 0.267t/s 430 440 450 460 470 480T/℃0.27 0.277 0.275 0.276 0.277 0.278去离子水凝固点取第440~480s的平均值,为T2=0.277 ℃。
两次测量的去离子水凝固点相差不到0.01℃,符合要求。
去离子水凝固点的值取二者平均,为T f*=0.281℃。
表3、尿素水溶液凝固点测量t/s 0 30 60 90 120 150 180 210 T/℃0.573 0.402 0.231 0.065 -0.1 -0.259 -0.419 -0.576 t/s 240 270 300 330 360 390 420 450 T/℃-0.728 -0.878 -1.024 -1.176 -1.317 -1.46 -1.6 -1.739 t/s 480 510 540 560 570 580 590 600 T/℃-1.873 -2.006 -2.137 -0.449 -0.342 -0.315 -0.305 -0.301 t/s 610 620 630 640 650 660 670T/℃-0.298 -0.297 -0.297 -0.296 -0.295 -0.294 -0.2943.2 数据处理根据表3,做出尿素溶液的步冷曲线,并用外推法求出T f 值。
T ( 0C )t (s)图3 尿素水溶液的步冷曲线红色直线方程y= -0.0001x - 0.227, R²= 0.9999。
从图中读出 T f = -0.232℃。
K f =1.853 Kkg/mol , m B =0.4073 g , m A =25 g ,计算得到M B =58.85 g/mol 。
根据相对原子质量计算得到的尿素(CO(NH 2)2)的分子量为: M 0 =60g/mol ,绝对误差为 △M = M B - M 0=-1.15g ,相对误差为 ( | M B - M 0 | ) / M 0 =1.9 %。
3.3 讨论分析1. 本实验最终算出尿素的分子质量为58.85g/mol ,与准确值相比偏小相对误差约为1.9 %,误差是比较小的;2. 除系统误差外,在操作中还可能出现误差的地方有:尿素称量误差、去离子水量取误差,大试管中磁子搅拌不均匀使得液体冷凝不匀,冷阱壁对试管冷凝产生的影响以及数据记录时产生的误差。
另外,水和溶液的升温过程很迅速,计时(30s 一次换成10s 一次)不准,绘制的步冷线对凝固点的判断产生误差;3. 在降温过程中任何轻微扰动都会对体系产生影响,所以在试验当中应不免接触或靠近反应器,冷阱壁不能与大试管管壁接触,避免测温不准;4. 磁力搅拌器的磁子旋转速度对温度变化也有影响,转速越快,热传导越快,所以温度下降的也越快,应使转速适当。
电偶应位于溶液中间,磁子在底部中心稳定运动;4. 达到温度最低点后一定要耐心等待温度稳定,避免在温度尚未达到凝固点时就记录错误数据,有时候数据会有上下波动不能误以为此时就达到了最低点。
四、实验结论实验得到尿素分子量为58.85 g/mol ,相对误差为1.9 %。
五、参考文献[1] 张连庆,步冷曲线法——对凝固点降低测定摩尔质量的改进,大学化学,2006,12(2):54-56.[2] 清华大学化学系物理化学实验编写组. 物理化学实验. 北京:清华大学出版社,1991:45-53.[3] 朱文涛. 物理化学,上册. 北京:清华大学出版社,1995:190-192.六、思考题1.实验中所配溶液浓度,太浓或太稀都会使实验结果产生较大的误差,为什么?答:因为溶液凝固点的降低与溶质的浓度成正比这种性质只适用于非电解质稀溶液,浓溶液不具有这种依数性,所以不能采用浓度很大的溶液。
但若浓度很低,则凝固点降低值也很小,导致相对误差很大,所以也不能选择浓度很小的溶液。
2.测凝固点时,纯溶剂温度回升后能有一相对恒定阶段,而溶液则没有,为什么?答:纯溶液凝固过程中产生晶体,这一凝固过程中温度保持不变,直到全部液体全部转变为晶体后温度才会变化。
而溶液凝固过程中,溶剂不断结晶导致溶质析出,溶液的浓度不断变化,导致溶液凝固点不同,所以这个过程中温度是不断变化的,没有一个稳定的温度。
3.为什么会产生过冷现象?答:凝固点相变需要一定的能量,所以在温度达到凝固点之后需要进一步减低温度,为相变提供能量,所以产生了过冷现象。
另外凝固需要一定量的凝结核,液体过于纯净也是产生过冷现象的一种原因。
4.原理中计算公式的导出作了哪些近似处理,如何判断本实验中这些假设的合理性?答:把尿素的水溶液看做理想的稀溶液,认为溶液完全符合依数性,是在原理上的近似。
本实验配制的溶液质量浓度为b=0.27 mol/kg,与稀薄溶液符合很好,由此带来的实验误差远比拟合、测温等带来的误差小,是合理的。
另外,计算中认为水的密度不随温度变化(实际变化也很小),也是做了一定的近似处理。
