2016届高考化学(全国通用)总复习 高效演练·跟踪检测区 3.3 铁及其重要化合物
《全程复习方略》2016届高考化学(全国通用)总复习高效演练跟踪

《全程复习方略》2016届高考化学(全国通用)总复习高效演练跟踪高效运动和跟踪检测区1。
下列试剂是空气中变质反应的氧化剂和还原剂()A。
过氧化钠b .硫化钠c .硫酸亚铁d .氢氧化钠[分辨率]选项a过氧化钠可以通过氧化和还原与水或二氧化碳反应,过氧化钠既是氧化剂又是还原剂。
硫化钠很容易被氧氧化成元素硫,元素硫是一种还原剂。
硫酸亚铁中的Fe2+容易被氧作为还原剂氧化成Fe3+;氢氧化钠在空气中的变质主要是与二氧化碳的反应,而不是氧化还原反应。
2.(2015年莱芜模拟)在以下反应中,氧化剂与还原剂的比例为()a . 3s+6 NaOH = = = 2na2s+na2so 3+3h2ob . 2ch 3cooh+ca(clo)2 = = = 2hclo+(ch3co 0),比例为1: 2 2Cac。
I2+2NaClO 3 = = = 2Na2O 3+Cl2 56+d . 4盐酸(浓缩)+二氧化锰高温二氯化锰+Cl2↓+2H2O[分辨率]选择D第一项,氧化剂和还原剂均为硫,物质的量之比为2∶1;乙项是非氧化还原反应;丙项、氯化钠和碘分别为氧化剂和还原剂,物质量之比为2∶1;D项中,二氧化锰和盐酸分别为氧化剂和还原剂,2摩尔4摩尔盐酸为还原性,另2摩尔为酸性,即氧化剂和还原剂的比例为1∶23.一个未修正的离子方程式是_ _ _ _ _ _ _ _+x+6h+-3 x2+3h2o。
在此基础上,判断- 1-,并选择氧化产物和还原产物的物质的量之比(a . 1:1b . 3:1c . 5:1d . 7:1[分辨率)作为C根据质量和电荷守恒,离子方程式是5X-+X5: 1。
4。
(2015许昌模拟)据了解,以下三个实验都可以产生化学反应①②③+6H+= = = 3X 2+3H2O,则氧化产物与还原产物的质量比为。
将铁钉放入硫酸亚铁中,将铜线放入硫酸铜溶液中,并将其滴入氯化铁溶液中。
以下判断是正确的()A。
上述实验证明氧化:Fe3+> Fe2+ > Cu2+b。
2016届高考化学(全国通用)总复习 高效演练·跟踪检测区 11.3 物质的制备
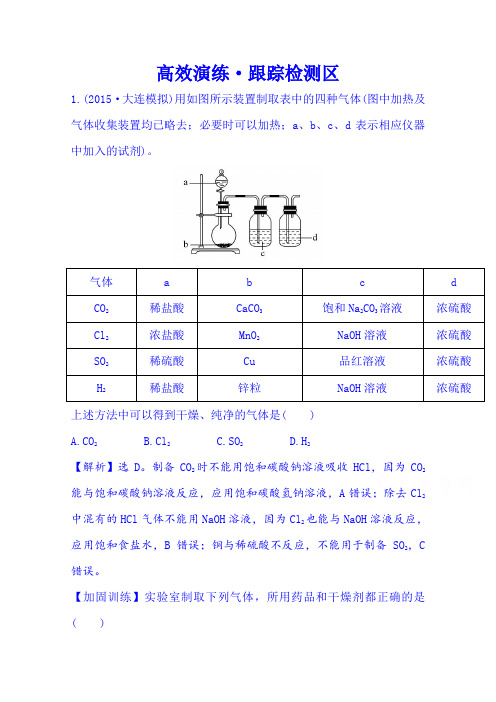
高效演练·跟踪检测区1.(2015·大连模拟)用如图所示装置制取表中的四种气体(图中加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
上述方法中可以得到干燥、纯净的气体是( )A.CO2B.Cl2C.SO2D.H2【解析】选D。
制备CO2时不能用饱和碳酸钠溶液吸收HCl,因为CO2能与饱和碳酸钠溶液反应,应用饱和碳酸氢钠溶液,A错误;除去Cl2中混有的HCl气体不能用NaOH溶液,因为Cl2也能与NaOH溶液反应,应用饱和食盐水,B错误;铜与稀硫酸不反应,不能用于制备SO2,C 错误。
【加固训练】实验室制取下列气体,所用药品和干燥剂都正确的是( )【解析】选A。
A项中制取H2的药品及干燥剂的选择均正确;B项中干燥剂选择错误,因为Cl2能与碱石灰发生反应,应选浓硫酸为干燥剂;C项中药品与干燥剂选择均错误,应用浓硫酸作药品,P2O5或CaCl2为干燥剂;D项中的干燥剂选择错误,应用碱石灰作干燥剂。
2.(2015·赤峰模拟)实验室某些物质的制备装置如图所示(省略夹持装置和净化装置),仅用此装置和表中提供的物质完成相关实验,最合理的是( )【解析】选A。
ab中的物质反应生成SO2,ed中的物质反应生成NH3,SO2和NH3在c中生成(NH4)2SO3,故A正确;ed中生成的H2S会溶解在稀盐酸中,故B错误;两装置中分别生成的氢气和氯气在常温下不反应,不能得到HCl,故C错误;浓硫酸和乙醇在常温下不反应,故D错误。
【加固训练】下列选项正确的是( )【解析】选B。
收集氧气时试管不能加橡皮塞,A项错误;反应装置无加热仪器,C项错误;收集乙酸乙酯的导管末端不应伸到液面以下,D 项错误。
3.下列关于实验的叙述正确的是( )A.向一定量的稀硫酸中加入除去油污的废铁屑,是制备硫酸亚铁溶液的可行方案B.向煮沸的1 mol·L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体C.向铝屑与硫酸反应后的溶液中加入氢氧化钠溶液反应,是制备氢氧化铝的最佳方案D.向某溶液中,依次加入氯水和硫氰化钾溶液,溶液变红,说明溶液中含有Fe2+【解析】选A。
高考化学一轮复习(高效演练跟踪检测)第三章金属及其化合物3铁及其重要化合物

铁及其重要化合物高效演练·跟踪检测【教材母题拓展练】1.(RJ必修1·P63改编题)为了检验某FeCl2溶液是否变质,可向溶液中加入( )A.NaOH溶液B.KSCN溶液C.先通入氯气,再加入KSCN溶液D.先加入足量铁粉,再加入KSCN溶液【解析】选B。
Fe2+易被氧化为Fe3+,检验溶液中有没有Fe3+即可。
2.(RJ必修1·P63改编题)要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时,最佳顺序是( )①加足量氯水②加足量KMnO4溶液③加少量KSCN溶液A.①②B.③②C.③①D.①②③【解析】选C。
本题检验方法的关键是Fe3+遇SCN-显红色,而Fe2+遇SCN-不显红色。
加入KSCN溶液不显红色证明无Fe3+,再加氯水,如有Fe2+则可被氧化为Fe3+,溶液显红色。
KMnO4溶液也能氧化Fe2+,但因其本身呈紫色,使Fe3+遇SCN-显红色不易观察。
3.(RJ必修1·P70改编题)铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )A.Fe(OH)3Fe2O3B.Fe(OH)2Fe2O3C.Fe(OH)2Fe(OH)3D.Fe(OH)2FeO【解析】选B。
铁与稀硫酸反应生成FeSO4,再与过量氨水反应生成白色沉淀Fe(OH)2,在空气中加热Fe(OH)2,铁元素被氧化为+3价,最后所得红棕色残渣为Fe2O3。
【模拟预测强化练】1.(2016·石家庄模拟)把铁片分别放入下列物质的溶液中,充分反应后,溶液质量比反应前减轻的是( )A.CuSO4B.Fe2(SO4)3C.HClD.FeSO4【解析】选A。
铁与CuSO4反应后,生成FeSO4溶液,溶液质量减轻,故A正确;铁与Fe2(SO4)3反应后,生成FeSO4溶液,溶液质量增加,故B错误;铁与HCl反应后,生成FeCl2溶液,溶液质量增加,故C错误;铁与FeSO4溶液不反应,溶液质量不变,故D错误。
2016届高考化学高效跟踪检测题20

高效演练·跟踪检测区1.(2015·泉州模拟)将0.1 mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )A.CH3COOH电离程度变大B.溶液pH减小C.溶液的导电能力减弱D.溶液中c(H+)减小【解析】选D。
CH 3COOH CH3COO-+H+,当加水稀释时,c(CH3COOH)、c(CH3COO-)、c(H+)都减小,平衡右移,pH增大,导电能力减弱,电离程度增大;当加入少量CH3COONa晶体时,使c(CH3COO-)增大,平衡左移,电离程度减小,c(H+)减小,pH增大,导电能力增强。
【加固训练】25℃时,0.1 mol·L-1稀醋酸加水稀释,下图中的纵坐标y可以是( )A.溶液的pHB.醋酸的电离平衡常数C.溶液的导电能力D.醋酸的电离程度【解析】选C。
0.1 mol·L-1稀醋酸加水稀释,电离程度增大,n(H+)增大,但c(H+)减小,因此pH增大,A错、D错;电离平衡常数只与温度有关,因此稀释时电离平衡常数不变,B错;加水稀释时溶液中离子浓度减小,溶液的导电能力降低,C对。
2.稀氨水中存在着下列平衡:NH 3·H2O N+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )①NH4Cl固体②硫酸③NaOH固体④水⑤加热A.①②③⑤B.②③C.③D.③⑤【解析】选C。
若在氨水中加入NH 4Cl固体,c(N)增大,平衡向逆反应方向移动,c(OH-)减小,①不合题意;硫酸中的H+与OH-反应,使c(OH-)减小,平衡向正反应方向移动,②不合题意;当在氨水中加入NaOH固体后,c(OH-)增大,平衡向逆反应方向移动,符合题意,③正确;若在氨水中加入水,稀释溶液,平衡向正反应方向移动,但c(OH-)减小,④不合题意;电离属吸热过程,加热平衡向正反应方向移动,c(OH-)增大,⑤错。
2016届高考化学高效跟踪检测题36

高效操练·追踪检测区1.已知周期表中,元素 Q、R、W、Y 与元素 X 相邻。
Y 的最高化合价氧化物的水化物是强酸。
回答以下问题:(1)W 与 Q能够形成一种高温构造陶瓷资料。
W的氯化物分子呈正四周体构造, W的氧化物的晶体种类是 ________。
(2)Q 的拥有同样化合价且能够互相转变的氧化物是________。
(3)R 和 Y 形成的二元化合物中, R体现最高化合价的化合物的化学式是________。
(4)这 5 种元素的氢化物分子中:①立体构造种类同样的氢化物的沸点从高到低摆列序次是 ( 填化学式)_______,其原由是;②电子总数同样的氢化物的化学式和立体构造分别是 _____________________。
(5)W 和Q所形成的构造陶瓷资料的一种合成方法以下:W的氯化物与Q 的氢化物加热反响,生成化合物 W(QH2) 4和 HCl 气体; W(QH2) 4在高温下分解生成Q的氢化物和该陶瓷资料。
上述有关反响的化学方程式( 各物质用化学式表示 ) 是_______________________。
【分析】此题可联合问题作答。
W的氯化物为正四周体构造,则应为SiCl或 CCl ,又 W与 Q 形成高温陶瓷,故可推测W为 Si 。
(1)SiO 442为原子晶体。
(2) 高温陶瓷可联想到Si 3N4,Q为 N,则有 NO2与 N2O4之间的互相转变关系。
(3)Y的最高价氧化物对应的水化物为强酸,且和 Si 、N等与同一元素相邻,则只好是 S。
R为 As,所以 R 的最高价化合物应为 As2S5。
(4) 明显 X 为磷元素。
①氢化物沸点次序为NH3>AsH3>PH3,因为前者中含有氢键,后二者构型同样,分子间作用力不一样。
②S iH4、PH3和 H2S 的电子数均为 18,构造分别为正四周体形、三角锥形和 V 形。
(5) 由题中所给出的含字母表示的化学式能够写出详细的物质,而后配平即可。
2016届高考(人教版全国通用)化学一轮复习高效演练36含答案

高效操练 361.(2015 ·湛江模拟 ) 以下各项有机化合物的命名或分类正确的选项是()A.2 ,3- 二甲基 -2- 乙基己烷B.CH3CH2CH2Cl 氯丙烷C.属于芬芳化合物D.属于羧酸【分析】选 D。
A 项,该物质的名称为 3,3,4- 三甲基庚烷,故 A 错误;B 项,该物质的名称为1- 氯丙烷,故 B 错误; C项,芬芳族化合物一定含有苯环,故C错误; D项,— COOH为羧酸的官能团,故D正确。
2.以下说法错误的选项是 ()A. 三硝基甲苯的分子式为C7H3N3O6B. 等质量的甲烷、乙烯、1,3- 丁二烯分别充足焚烧,所耗用氧气的量挨次减少C.在核磁共振氢谱中能出现两个峰,且其峰面积之比为3∶1D.2,3- 二甲基丁烷的核磁共振氢谱中会出现两个峰【分析】选。
A 项,三硝基甲苯的分子式为7 H5N3O6,错误;B项,A C等质量的 C x H y焚烧耗氧量多少是比较y/x 的值, y/x 的值越大,耗氧量越多,正确; C项,该物质的分子中有两种环境的氢原子,个数之比为 1∶3,正确; D项,2,3- 二甲基丁烷的核磁共振氢谱中会出现两个峰,且面积之比为6∶1,正确。
3.( 2015 ·宁波模拟 ) 以下说法不正确的选项是 ()A. 均三甲苯在核磁共振氢谱中能出现两组峰,且其峰面积之比为3∶1B. 按系统命名法,化合物的名称是2,2,4,5- 四甲基 -3 ,3-二乙基己烷C.乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴识二者D.肌醇与葡萄糖的元素构成同样,化学式均为 C6 H12O6,知足 C m(H2O)n,所以,均属于糖类化合物【分析】选 D。
肌醇为环己六醇,属于环醇类,葡萄糖是多羟基醛,D错误。
【方法例律】键线式表示的有机物分子式的推导(1)图中的端点、折点、交错点上都表示碳原子,由此确立碳原子数。
(2)确立含有的官能团个数。
(3)由碳四价、氧二价、氮三价等来确立分子中的氢原子数。
2016届高考(人教版全国通用)化学一轮复习高效演练02Word版含答案

高效演练021.(2015·茂名模拟)设N A表示阿伏加德罗常数的值,下列关于0.2 mol·L-1Ba(NO3)2溶液的叙述不正确的是( )A.2 L溶液中阴阳离子总数为1.2N AB.500 mL溶液中N浓度为0.2 mol·L-1C.500 mL溶液中Ba2+浓度为0.2 mol·L-1D.500 mL溶液中N物质的量为0.2 mol【解析】选B。
2 L溶液中阴阳离子的物质的量为2 L×0.2 mol·L-1×3=1.2 mol,A正确;溶液具有均一性,根据Ba(NO3)2Ba2++ 2N,0.2 mol·L-1Ba(NO3)2溶液中Ba2+浓度为0.2 mol·L-1、N浓度为0.4 mol·L-1,B错误,C、D正确。
2.(2015·益阳模拟)下列溶液中的Cl-物质的量与100 mL 1 mol·L-1AlCl3溶液中Cl-物质的量相等的是( )A.150 mL 1 mol·L-1NaCl溶液B.100 mL 3 mol·L-1KClO3溶液C.75 mL 2 mol·L-1MgCl2溶液D.50 mL 1 mol·L-1FeCl3溶液【解析】选C。
100 mL 1 mol·L-1AlCl3溶液中Cl-物质的量浓度是 3 mol·L-1,Cl-物质的量为3 mol·L-1×0.1 L=0.3 mol。
A项,150 mL 1 mol·L-1NaCl溶液中c(Cl-)=1 mol·L-1×1=1 mol·L-1,Cl-物质的量为1 mol·L-1×0.15 L=0.15 mol;B项,100 mL 3 mol·L-1KClO3溶液中不含有Cl-,错误;C项,75 mL 2 mol·L-1MgCl2溶液中c(Cl-)=2 mol·L-1×2=4 mol·L-1,Cl-物质的量为4 mol·L-1×0.075 L=0.3 mol;D项,50 mL 1 mol·L-1FeCl3溶液中c(Cl-)=1 mol·L-1×3=3 mol·L-1,Cl-物质的量为3 mol·L-1×0.05 L=0.15 mol。
2016届高考一轮复习化学人教版课时跟踪检测3铁及其化合物

课时跟踪检测(三)铁及其化合物1.下列试剂中,不能使Fe2+转化为Fe3+的是()①氯气②NaCl溶液③KMnO4溶液④稀硝酸⑤盐酸⑥NaNO3溶液A.①②③B.①③④C.②④⑤D.②⑤⑥2.(2015·成都模拟)某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是() A.一定有Fe2+,一定没有Fe3+、Mg2+B.一定有Fe3+,一定没有Fe2+、Mg2+C.一定有Fe3+,可能有Fe2+,一定没有Mg2+D.一定有Fe2+,可能有Mg2+,一定没有Fe3+3.在FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是()A.加入KSCN溶液一定不变红色B.溶液中一定含Fe2+C.溶液中一定含Cu2+D.剩余固体中一定含铜4.把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。
则已反应的Fe3+和未反应的Fe3+的物质的量之比为()A.1∶1B.1∶2C.2∶3 D.3∶25.为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是()A.④B.③C.③④D.①②③④⑤6.下列中学常见实验的现象或表述正确的是()A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显血红色B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可D.FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液7.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是()8.把20.2 mol NO,下列说法正确的是()A.反应后生成的盐只为Fe(NO3)3B.反应后生成的盐只为Fe(NO3)2C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶19.某研究小组开展课外研究发现,将适量Zn与一定浓度氯化铁溶液反应,开始可以观察到大量气泡产生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高效演练·跟踪检测区
1.(2015·沈阳模拟)铁是一种应用广泛的金属。
下列有关铁的说法正确的是
( )
A.铁与盐酸反应生成氯化铁和氢气
B.常温下铁在浓硫酸中钝化
C.铁在氧气中燃烧生成物为三氧化二铁
D.纯铁(块状)是黑色金属
【解析】选B。
A项,铁与盐酸反应生成氯化亚铁和氢气,错误;B项,在常温下铁遇浓硫酸表面被氧化产生一层致密的氧化物保护膜,故在浓硫酸中钝化,正确;C项,铁在氧气中燃烧生成物为四氧化三铁,错误;D项,纯铁 (块状)是银白色金属,错误。
2.下列物质能用化合反应直接制得的是( )
①FeCl2②Fe(OH) 3③NaHSO3④Fe(OH)2
A.②
B.②③
C.①②③
D.①②③④
【解析】选C。
2FeCl3+Fe3FeCl2;
4Fe(OH)2+O2+2H2O4Fe(OH)3,
Na2SO3+H2O+SO22NaHSO3,
以上反应均为化合反应。
Fe(OH)2不能用化合反应制得。
【方法规律】不能通过化合反应得到的物质
(1)常见不能通过单质之间化合得到的物质有FeCl2、Fe2S3、Fe2I3、SO3、NO2等;
(2)常见不能通过单质之间化合得到,但可以通过化合反应得到的物质有FeCl2、SO3、NO2等;
(3)常见不能通过氧化物与水化合得到的酸、碱有H2SiO3、Fe(OH)3、Fe(OH)2、Al(OH)3、Cu(OH)2等;
(4)常见不能通过氧化物与水化合得到,但可以通过化合反应得到的物质有Fe(OH)3等。
3.有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸
B.烧碱溶液
C.氨水
D.KSCN溶液
【解析】选B。
【加固训练】将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
A.Fe2O3
B.FeCl3
C.Fe2(SO4)3
D.FeO
【解析】选D。
由题意可知所得溶液中含有Fe2+而不含Fe3+,溶解在盐酸中能得到Fe2+,只有D项。
4.(2015·蚌埠模拟)下列反应的离子方程式表示正确的是( )
A.澄清石灰水中通入过量二氧化碳:OH-+CO2HC错误!未找到引用源。
B.铜片跟三氯化铁溶液反应:2Fe3++3Cu3Cu2++2Fe
C.漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O CaSO3↓+2HClO
D.Fe3O4与稀硝酸反应:Fe3O4+8H+Fe2++2Fe3++4H2O
【解析】选A。
铜的金属活动性比铁弱,不能置换出铁,B项应为2Fe3++Cu2Fe2++Cu2+;ClO-具有强氧化性,可将SO2氧化为S错误!未找到引用源。
,C应为Ca2++ClO-+SO2+H2O CaSO4↓+Cl-+2H+;HNO3具有强氧化性,可将Fe2+氧化为Fe3+,D项反应为3Fe3O4+28H++N错误!未找到引用源。
9Fe3++NO↑+14H2O。
5.(2015·温州模拟)(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。
其中一个反应为3FeS2+8O26SO2+Fe3O4,氧化产物为________,若有3 mol FeS2参加反应,转移________mol电子。
(2)与明矾相似,硫酸铁也可用作净水剂,其原理为______________________
____________________(用离子方程式表示)。
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________。
(4)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶
液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请写出相应的离子方程式:_____
____________________________________________________________ ______。
(5)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24 L(标准状况)H2,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为________g。
【解析】(1)反应3FeS2+8O2Fe3O4+6SO2,反应前后各元素化合价的变化情况如下:
Fe:+2→+3,化合价升高;S:-1→+4,化合价升高;
O:0→-2,化合价降低;
因此,在反应中FeS2为还原剂,O2是氧化剂,Fe3O4既是氧化产物也是还原产物, SO2既是氧化产物也是还原产物;在上述反应中共转移32个电子,有3 mol FeS2参加反应时,转移电子的物质的量为32 mol。
(2)Fe3+水解生成Fe(OH)3胶体可以净水,Fe3++3H2O Fe(OH)3+3H+。
(3)氯化铁具有氧化性,碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质。
(4)FeSO4中铁的化合价由+2价升高为+3价,变化1,KNO3中氮的化合价由+5价降低为+2价,变化3,通过化合价升降总数相等和质量守恒来配平方程式:
6FeSO4+2KNO3+4H2SO4K2SO4+3Fe2(SO4)3+2NO↑+4H2O
反应的离子方程式为3Fe2++N错误!未找到引用源。
+4H+3Fe3++NO↑+2H2O
(5)氢气的物质的量为0.1 mol,由关系式
Fe ~ 2HCl ~ H2
0.1 mol 0.2 mol 0.1 mol
根据氯原子守恒,所以氯化铁的物质的量为
1/3×(0.16 L×5 mol·L-1-0.2 mol)=0.2 mol,
Fe ~2FeCl3
0.1 mol 0.2 mol
所以参加反应的铁粉的质量为(0.1 mol+0.1 mol)×56 g·mol-1=11.2 g
答案:(1)SO2和Fe3O432
(2)Fe3++3H 2O Fe(OH)3+3H+
(3)2Fe3++2I-2Fe2++I2
(4)3Fe2++N错误!未找到引用源。
+4H+3Fe3++NO↑+2H2O
(5)11.2
【加固训练】(2015·冀州模拟)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:
将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。
请你填出该同学实验中出现以下现象时应得出的结论:
(1)若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,结论是
____________________________________________________________ ______。
(2)若滴入酸性高锰酸钾溶液后不褪色,滴入KSCN溶液变红,结论是
____________________________________________________________ _____。
(3)若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液变红,结论是
____________________________________________________________ ______。
(4)能不能将KMnO4和KSCN滴入同一试管中进行验证,为什么?试进行解释:
____________________________________________________________ _____。
【解析】加KMnO4溶液只要褪色就说明含有Fe2+,而加入KSCN溶液变红则说明含有Fe3+,所以前三问的答案很容易得出,而第(4)问中的原因可归结为两条,一是KMnO4溶液呈紫红色,影响观察Fe(SCN)3的红色,二是KSCN具有较强的还原性,可以被KMnO4氧化,影响Fe2+的检验。
答案:(1)没有被氧化(2)完全被氧化
(3)部分被氧化
(4)不能,原因是KMnO4溶液呈紫红色,影响Fe3+的检验;KSCN具有还原性,影响Fe2+的检验
关闭Word文档返回原板块。
