物质在空气和氧气中反应的现象
各种常见物质反应现象

各种常见物质反应现象1.镁条在空气中燃烧:发出耀眼强光,放出大量的热,生成白烟同时生成一种白色物质。
2.木炭在氧气中燃烧:发出白光,放出热量。
3.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体。
4.铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质。
5.加热试管中碳酸氢铵:有刺激性气味气体生成,试管上有液滴生成。
6.氢气在空气中燃烧:火焰呈现淡蓝色。
7.氢气在氯气中燃烧:发出苍白色火焰,产生大量的热。
8.在试管中用氢气还原氧化铜:黑色氧化铜变为红色物质,试管口有液滴生成。
9.用木炭粉还原氧化铜粉末,使生成气体通入澄清石灰水,黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊。
10.一氧化碳在空气中燃烧:发出蓝色的火焰,放出热量。
11. 向盛有少量碳酸钾固体的试管中滴加盐酸:有气体生成。
12.加热试管中的硫酸铜晶体:蓝色晶体逐渐变为白色粉末,且试管口有液滴生成。
13.钠在氯气中燃烧:剧烈燃烧,生成白色固体。
14.点燃纯净的氯气,用干冷烧杯罩在火焰上:发出淡蓝色火焰,烧杯内壁有液滴生成。
15.向含有C1-的溶液中滴加用硝酸酸化的硝酸银溶液,有白色沉淀生成。
16.向含有SO42-的溶液中滴加用硝酸酸化的氯化钡溶液,有白色沉淀生成。
17.一带锈铁钉投入盛稀硫酸的试管中并加热:铁锈逐渐溶解,溶液呈浅黄色,并有气体生成。
18.在硫酸铜溶液中滴加氢氧化钠溶液:有蓝色絮状沉淀生成。
19.将Cl2通入无色KI溶液中,溶液中有褐色的物质产生。
20.在三氯化铁溶液中滴加氢氧化钠溶液:有红褐色沉淀生成。
21.盛有生石灰的试管里加少量水:反应剧烈,发出大量热。
22.将一洁净铁钉浸入硫酸铜溶液中:铁钉表面有红色物质附着,溶液颜色逐渐变浅。
23.将铜片插入硝酸汞溶液中:铜片表面有银白色物质附着。
24.向盛有石灰水的试管里,注入浓的碳酸钠溶液:有白色沉淀生成。
25.细铜丝在氯气中燃烧后加入水:有棕色的烟生成,加水后生成绿色的溶液。
铁丝在空气和氧气中燃烧的实验现象

铁丝在空气和氧气中燃烧的实验现象以铁丝在空气和氧气中燃烧的实验现象为标题,我们将探讨铁丝在两种气体环境下的燃烧行为,并分析其原因。
1. 实验背景铁是一种常见的金属元素,其具有较高的熔点和燃点。
在正常情况下,铁丝并不会自燃,但当铁丝接触到氧气时,会发生燃烧反应。
为了进一步研究铁丝在空气和氧气中燃烧的实验现象,我们进行了以下实验。
2. 实验设备和方法我们准备了一段铁丝和两个实验室瓶子,一个用于放置空气,另一个用于放置氧气。
首先,我们将一小段铁丝放入空气瓶中,并点燃铁丝的一端。
我们观察到铁丝在空气中燃烧,并产生明亮的火焰。
然后,我们使用同样的方法在氧气瓶中进行实验。
在氧气中,铁丝燃烧得更加剧烈,并产生了更亮的火焰。
3. 实验现象和观察结果在空气中,铁丝燃烧时产生明亮的火焰,火焰呈现出橙色。
然而,在氧气中,铁丝燃烧得更加剧烈,火焰呈现出明亮的白色。
4. 实验结果分析铁丝在空气和氧气中燃烧的实验现象可以通过以下反应方程式来描述:2Fe + 3O2 -> 2Fe2O3在空气中,铁丝与氧气发生反应生成氧化铁(III),即铁丝燃烧的产物为三氧化二铁(Fe2O3)。
这种物质是一种常见的红色粉末,也被称为铁锈。
因此,我们观察到的橙色火焰是由铁丝燃烧产生的氧化铁颗粒所发出的光线。
而在氧气中,由于氧气的浓度更高,铁丝燃烧的速度更快,火焰更加明亮。
这是因为氧气提供了更多的氧供给燃烧反应,使得铁丝燃烧更加充分。
5. 实验结论通过本次实验,我们可以得出以下结论:- 铁丝在空气中燃烧产生的火焰颜色为橙色,燃烧产物为三氧化二铁(Fe2O3),即铁锈。
- 铁丝在氧气中燃烧产生的火焰颜色更亮,燃烧更剧烈,燃烧产物仍为三氧化二铁(Fe2O3)。
6. 实验意义和应用铁丝在空气和氧气中燃烧的实验现象具有重要的科学意义和应用价值。
首先,通过研究铁丝燃烧的机制,我们可以更好地理解金属燃烧的过程和规律。
其次,对于工业中的燃烧过程,如铁制品的焊接、切割等,我们可以利用氧气的高浓度来提高燃烧的效率和速度。
人教版九年级上册12单元化学反应文字表达式及现象

1-2单元化学反应文字表达式及现象1、镁在空气中燃烧:文字表达式 :镁 + 氧气 氧化镁Mg O 2 MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末 2、铁在氧气中燃烧:文字表达式 :铁 + 氧气 四氧化三铁Fe O 2 Fe 3O 4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体 注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
3、铜在空气中受热:文字表达式 :铜 + 氧气 氧化铜Cu O 2 CuO现象:铜丝变黑。
4、铝在空气中燃烧:文字表达式 :铝 + 氧气 三氧化二铝(氧化铝)Al O 2 Al 2O 3现象:发出耀眼的白光,放热,有白色固体生成。
5、红(白)磷在空气中燃烧:文字表达式 :红磷 + 氧气 五氧化二磷P O 2 P 2O 5现象:(1)发出白光(2)放出热量(3)生成大量白烟。
6、硫粉在空气中燃烧:文字表达式 :硫 + 氧气 二氧化硫S O 2 SO 2现象:A 、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B 、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
7、碳在氧气中充分燃烧:点燃点燃加热加热点燃点燃文字表达式 :碳 + 氧气 二氧化碳 C O 2 CO 2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊8、蜡烛在空气中燃烧文字表达式 :石蜡 + 氧气 水 + 二氧化碳O 2 H 2O CO 2现象:在氧气中燃烧发出白光,在空气中燃烧发黄光,集气瓶的内壁有水珠出现,并生成能使澄清的石灰水变浑浊的气体。
9、实验室制氧气:① 过氧化氢 水 + 氧气 H 2O 2 H 2O O 2② 高锰酸钾 锰酸钾 + 二氧化锰 + 氧气KMnO 4 K 2MnO 4 MnO 2 O 2 ③ 氯酸钾 氯化钾 + 氧气KClO 3 KCl O 2 点燃2MnO 加热−−−−→二氧化锰加热点燃。
镁在空气中燃烧的现象和化学方程式

镁条在空气中燃烧的现象和表达式一1、镁条在空气中燃烧的文字表达式为:镁条+氧气→氧化镁,反应条件为点燃;现象:镁条在空气中燃烧的现象是发出耀眼白光,释放大量的热,生成一种白色固体(氧化镁)。
镁在空气(氧气)中燃烧:2Mg+O2==2MgO。
2、镁在氯气中燃烧:Mg+Cl2==MgCl2;现象:产生白烟。
3、镁在氮气中燃烧:3Mg+N2==Mg3N2;现象:产生灰黄色烟。
4、镁在CO2中燃烧:2Mg+CO2==2MgO+C;现象:产生白烟,瓶壁上有少许黑色物质。
二镁在氧气中燃烧的化学方程式2Mg+O=点燃=2MgO,所出现的现象是燃烧,发出耀眼白光、释放热量、生成白色粉末。
当然,镁也可以在空气中反应,发生燃烧的现象,因为空气中也存有氧气。
镁可以与哪些物质发生反应镁和一些活泼的非金属单质化合,如非金属单质Cl2,S,O2。
比如镁在空气中燃烧,主要是和氧气反应,部分镁和空气中的氮气反应:2Mg+O2=点燃=2MgO3Mg+N2=点燃=Mg3N2。
只要溶液中能够提供H+,镁就能发生上述反应。
强酸弱碱盐由于水解作用,在水溶液中也会供给出H+,水溶液显酸性。
如果在强酸弱碱盐溶液中投入镁,由于镁会消耗H+,使强酸弱碱盐的水解正向进行,几乎水解达到彻底。
如向氯化铵的溶液中投入金属镁,反应如下:Mg+2NH4Cl+2H2O=MgCl2+2NH3*H2O+H2↑。
镁的应用有哪些镁常用作还原剂,去置换钛、锆、铀、铍等金属。
主要用于制造轻金属合金、球墨铸铁、科学仪器和格氏试剂等。
也能用于制烟火、闪光粉、镁盐、吸气器、照明弹等。
结构特性类似于铝,具有轻金属的各种用途,可作为飞机、导弹的合金材料。
但是镁在汽油燃点可燃,这限制了它的应用。
物质与氧气反应实验现象的总结
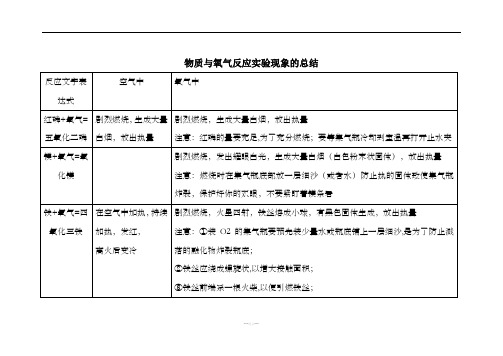
在空气中加热,持续加热ห้องสมุดไป่ตู้发红,
离火后变冷
剧烈燃烧,火星四射,铁丝熔成小球,有黑色固体生成,放出热量
注意:①装O2的集气瓶要预先装少量水或瓶底铺上一层细沙,是为了防止溅落的融化物炸裂瓶底;
②铁丝应绕成螺旋状,以增大接触面积;
③铁丝前端系一根火柴,以便引燃铁丝;
④待火柴将要燃尽时,才能将铁丝由上向下缓慢伸入瓶中;
物质与氧气反应实验现象的总结
反应文字表达式
空气中
氧气中
红磷+氧气=五氧化二磷
剧烈燃烧,生成大量白烟,放出热量
剧烈燃烧,生成大量白烟,放出热量
注意:红磷的量要充足,为了充分燃烧;要等集气瓶冷却到室温再打开止水夹
镁+氧气=氧化镁
剧烈燃烧,发出耀眼白光,生成大量白烟(白色粉末状固体),放出热量
注意:燃烧时在集气瓶底部放一层细沙(或者水)防止热的固体致使集气瓶炸裂,保护好你的双眼,不要紧盯着镁条看
⑤铁丝上不能有漆或有锈,使用前先用砂纸打磨干净.
铁锈是Fe2O3,不会跟O2反应,所以,要除去铁丝表面的锈
碳+氧气=二氧化碳
木炭红热,无烟无焰,生成无色无味的能使澄清石灰水变浑浊的气体,放出热量
剧烈燃烧,发出白光,生成无色无味的,能使澄清石灰水变浑浊的气体,放出热量
注意事项:先将木炭在空气中烧至红热,然后由上到下缓缓伸入充满氧气的集气瓶.这是为了防止因受热膨胀的氧气溢出集气瓶,也可以使木炭充分与氧气接触.
硫+氧气 =二氧化硫
剧烈燃烧,发出淡蓝色火焰,生成有刺激性气味的气体,放出热量
剧烈燃烧,发出蓝紫色火焰,生成有刺激性气味的气体,放出热量
注意:需要给集气瓶内装上少量水,因为硫在氧气中点燃生成二氧化硫,是有毒气体,它溶于水.
(完整版)物质在氧气中燃烧现象归纳
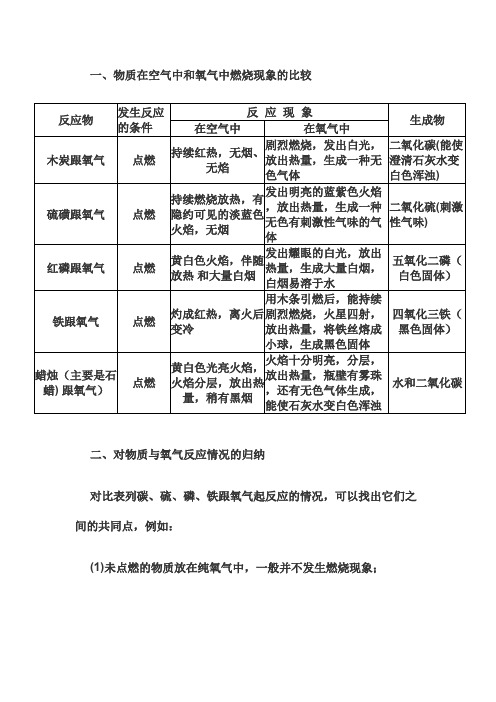
一、物质在空气中和氧气中燃烧现象的比较
二、对物质与氧气反应情况的归纳
对比表列碳、硫、磷、铁跟氧气起反应的情况,可以找出它们之间的共同点,例如:
(1)未点燃的物质放在纯氧气中,一般并不发生燃烧现象;
反 应 现 象
反应物发生反应的条件在空气中在氧气中
生成物木炭跟氧气
点燃
持续红热,无烟、
无焰
剧烈燃烧,发出白光,
放出热量,生成一种无
色气体
二氧化碳(能使澄清石灰水变白色浑浊)硫磺跟氧气点燃
持续燃烧放热,有
隐约可见的淡蓝色
火焰,无烟
发出明亮的蓝紫色火焰
,放出热量,生成一种
无色有刺激性气味的气
体
二氧化硫(刺激性气味)红磷跟氧气点燃
黄白色火焰,伴随
放热 和大量白烟
发出耀眼的白光,放出
热量,生成大量白烟,
白烟易溶于水
五氧化二磷(白色固体)铁跟氧气点燃
灼成红热,离火后变冷用木条引燃后,能持续
剧烈燃烧,火星四射,放出热量,将铁丝熔成
小球,生成黑色固体四氧化三铁(黑色固体)
蜡烛(主要是石蜡) 跟氧气)
点燃黄白色光亮火焰,
火焰分层,放出热
量,稍有黑烟
火焰十分明亮,分层,
放出热量,瓶壁有雾珠
,还有无色气体生成,
能使石灰水变白色浑浊
水和二氧化碳
(2)物质在燃烧时有的有火焰、有的无火焰,有的冒烟、有的不冒烟,烟和焰色也各有不同;
(3)在空气中原来不能燃烧(或不能持续燃烧)的物质,在纯氧气中却能燃烧起来,且燃烧得十分剧烈;
(4)前四个实验都是某物质跟氧气相互起化学反应,产生了一种新物质,属于化合反应;
(5)这五种物质都是与氧发生了化学反应,故都属于氧化反应。
铝在空气中氧化的现象

铝在空气中氧化的现象铝是一种常见的金属材料,具有轻巧、耐腐蚀等优点,因此广泛应用于工业和生活中。
然而,铝在空气中会发生氧化的现象,这一过程也被称为铝的氧化反应。
本文将围绕这一现象展开讨论。
一、铝的氧化反应过程铝的氧化是指铝与空气中的氧气发生化学反应,生成氧化铝的过程。
一般情况下,铝表面会形成一层薄薄的氧化铝膜,这是由于铝与氧气反应生成的产物。
这层膜具有一定的稳定性,可以阻止进一步的氧化反应进行。
当铝与氧气发生反应时,氧气中的氧分子会与铝表面的金属铝原子发生作用,形成氧化铝分子。
这个反应可以用化学方程式表示如下:4Al + 3O2 → 2Al2O3在这个化学方程式中,左边的4个铝原子与3个氧气分子反应,生成了2个氧化铝分子。
二、氧化铝膜的特性氧化铝膜是由氧化铝分子组成的,它具有一定的稳定性和附着力。
这层膜能够有效地保护铝材料不受进一步的氧化侵蚀。
同时,氧化铝膜还具有一定的耐腐蚀性,可以抵御酸、碱等化学物质的侵蚀。
氧化铝膜的形成是一个自发的过程,当铝暴露在空气中时,铝表面的金属铝原子会与氧气反应形成氧化铝分子,逐渐形成氧化铝膜。
这个过程是一个动态平衡,即氧化铝分子不断地与铝原子发生反应生成新的氧化铝分子,同时也会有氧化铝分子分解为氧气和金属铝原子。
三、氧化铝的应用氧化铝是一种重要的工业原料,广泛应用于陶瓷、电子、化工等领域。
由于氧化铝具有良好的绝缘性能和热稳定性,因此常用于制作陶瓷材料和电子元件的绝缘层。
此外,氧化铝还可以作为催化剂、填料等用途。
四、影响铝氧化反应的因素铝的氧化反应受多种因素的影响,其中最主要的影响因素是温度和湿度。
较高的温度和湿度有利于铝与氧气反应生成氧化铝,加速氧化反应的进行。
此外,铝表面的污染物、气氛中的杂质等也会影响铝的氧化反应。
五、预防铝氧化的措施为了减缓铝的氧化反应,可以采取一些预防措施。
首先,可以通过表面处理的方法,如阳极氧化等,增加氧化铝膜的厚度,提高其稳定性和附着力。
九年级上册化学方程式及现象汇总

九年级上册化学方程式及现象汇总一、化合反应:1、镁在空气中燃烧:2Mg + O2点燃2MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末2、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
3、铜在空气中受热:2Cu + O2△2CuO 现象:铜丝变黑。
4、铝在氧气中燃烧:4Al + 3O2点燃2Al2O3现象:发出耀眼的白光,放热,有白色固体生成。
5、氢气中空气中燃烧或爆炸:2H2 + O2点燃2H2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
6、红(白)磷在空气中燃烧:4P + 5O2点燃2P2O5现象:(1)发出白光(2)放出热量(3)生成大量白烟。
7、硫粉在空气中燃烧:S + O2点燃SO2 现象:(注意两种现象有差异)A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
8、碳在氧气中充分燃烧:C + O2点燃CO2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊9、碳在氧气中不充分燃烧:2C + O2点燃2CO10、二氧化碳通过灼热碳层:C + CO2高温2CO(吸热反应)11、一氧化碳在氧气中燃烧:2CO + O2点燃2CO2现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。
12、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O == H2CO3现象:石蕊试液由紫色变成红色。
注意:某些非金属氧化物+水→酸如:SO2 + H2O == H2SO3(亚硫酸)SO3 + H2O == H2SO4(硫酸)13、生石灰溶于水:CaO + H2O == Ca(OH)2(此反应放出热量)14、用无水硫酸铜鉴定水的存在:(化学方程式不用特别记忆,但要记得这种方法及现象CuSO4 + 5H2O = CuSO4·5H2O(五水硫酸铜,胆矾)现象:白色粉末变成蓝色二、分解反应:15、水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑现象:(1)电极上有气泡产生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
点燃
黄白色光亮火焰,火焰分层,放出热量,稍有黑烟
火焰十分明亮,分层,放出热量,瓶壁有雾珠,还有无色气体生成,能使石灰水变白色浑浊
水和二氧化碳
铁跟氧气
点燃
灼成红热,离火后变冷
用木条引燃后,能持续剧烈燃烧,火星四射,放出热量,将铁丝熔成小球,生成黑色固体
四氧化三铁(黑色固体)
红磷跟氧气
氧化镁(白色固体)
氢气跟氧气
点燃
淡蓝色的火焰
水(无色液体)
水和二氧化碳
铁跟氧气
点燃
灼成红热,离火后变冷
用木条引燃后,能持续剧烈燃烧,火星四射,放出热量,将铁丝熔成小球,生成黑色固体
四氧化三铁(黑色固体)
红磷跟氧气
点燃
黄白色火焰,伴随放热和大量白烟
发出耀眼的白光,放出热量,生成大量白烟,白烟易溶于水
五氧化二磷(白色固体)
镁跟氧气
点燃
燃烧、放出大量的热、同时放出耀眼的白光
剧烈燃烧,发出白光,放出热量,生成一种无色气体
二氧化碳(能使澄清石灰水变白色浑浊)
硫磺跟氧气
点燃
持续燃烧放热,有隐约可见的淡蓝色火焰,无烟
发出明亮的蓝紫色火焰,放出热量,生成一种无色有刺激性气味的气体
二氧化硫(刺激性气味)
蜡烛(主要是石蜡)跟氧气)
点燃
黄白色光亮火焰,火焰分层,放出热量,稍有黑烟
火焰十分明亮,分层,放出热量,瓶壁有雾珠,还有无色气体生成,能使石灰水变白色浑浊
反应物
发生反应的条件
反应现象
生成物在空Βιβλιοθήκη 中在氧气中木炭跟氧气
点燃
持续红热,无烟、无焰
剧烈燃烧,发出白光,放出热量,生成一种无色气体
二氧化碳(能使澄清石灰水变白色浑浊)
硫磺跟氧气
点燃
持续燃烧放热,有隐约可见的淡蓝色火焰,无烟
发出明亮的蓝紫色火焰,放出热量,生成一种无色有刺激性气味的气体
二氧化硫(刺激性气味)
点燃
黄白色火焰,伴随放热和大量白烟
发出耀眼的白光,放出热量,生成大量白烟,白烟易溶于水
五氧化二磷(白色固体)
镁跟氧气
点燃
燃烧、放出大量的热、同时放出耀眼的白光
氧化镁(白色固体)
氢气跟氧气
点燃
淡蓝色的火焰
水(无色液体)
反应物
发生反应的条件
反应现象
生成物
在空气中
在氧气中
木炭跟氧气
点燃
持续红热,无烟、无焰
