精馏原理 精馏原理.ppt
合集下载
化工原理课件 9.4 精馏

q [rF cP (tb tF )] rF
b. 饱和液体进料(泡点进料) 饱和液体温度等于泡点
iF i
q 1
V V
0 q 1
L LF
c.汽液混合物进料 汽液混合物的温度介于泡点和露点之间
i iF I
V V
LL
q=x(液相分率) 已知进料中汽相与液相的摩尔数之比为2:1,轻组分的摩尔分 数为0.55,则q=_____. A. 1/3 B. 0.55 C.不能确定
传质单元高度
精 馏
实 际 塔 板 数
理论板数
反映分离任务的难易, 与设备型式无关
反映设备效能的高低
全塔效率
④塔板物料、热量衡算及传递速率的最终简化 引入理论板的概念及恒摩尔流假设使塔板过程的物料衡 算、热量衡算及传递速率最终简化为 物料衡算式
Vy n1 Lxn1 Vy n Lxn
相平衡方程
LL q F 以1kmol/h进料为基准,提馏段中的液体流量较精馏段的液 体流量增大的kmol/h数即为q值
L L qF
V V (1 q)F
I iF q I i
iF i I
q 1
L L qF
V V, L L
V V (1 q)F
a. 过冷液体进料 过冷液体温度低于泡点
I iF q I i
L L qF
V V (1 q)F
d.饱和蒸汽进料(露点进料) 饱和蒸汽的温度等于露点
iF I
q0
V V F
LL
e.过热蒸汽进料(过热蒸汽的温度高于露点)
iF I
q0
V V, L L
q cP (tF td ) rF
(化工原理)精馏原理

通过重复加热和冷凝的过程,可以逐步将液体混合 物中的不同组分分离出来。
精馏的原理和过程
原理
基于物质的沸点不同,通过加热和冷凝的方法,将不同沸点的物 质分离出来。
过程
将液体混合物加热至沸腾,产生的蒸汽在冷凝器中冷凝,再通过 回流装置将冷凝液返回精馏塔中,重复进行加热和冷凝的过程, 直至达到分离目的。
操作温度应根据进料组成 和产品要求进行选择,以
实现最佳分离效果。
操作压力应根据进料组成 和产品要求进行选择,以
实现最佳分离效果。
操作条件的优化
实验法
通过实验方法测定不同操作条件下的分离效果,找 出最优的操作条件。
模拟法
利用计算机模拟软件对精馏过程进行模拟,通过优 化算法找出最优的操作条件。
经济分析法
石油化工原料的制备
通过精馏技术可以制备石油化 工原料,如乙烯、丙烯等,这 些原料是生产塑料、合成橡胶 等材料的重要基础。
精馏在其他领域的应用
01
02
03
食品工业
精馏技术可用于食品工业 中,如分离果汁中的果糖 和乙醇饮料中的酒精等。
制药工业
精馏技术可用于药品的生 产和提纯,如分离抗生素、 维生素等。
精馏的分类
02
01
03
根据操作方式的不同,精馏可以分为连续精馏和间歇 精馏。
根据进料位置的不同,精馏可以分为侧线精馏、塔顶 精馏和塔底精馏。
根据操作压力的不同,精馏可以分为常压精馏、加压 精馏和减压精馏。
02
精馏塔的构造和工作原理
精馏塔的结构
塔体
进料板
塔板
溢流管
冷凝器
精馏塔的主要部分,用于 容纳待分离的液体混合物 和进行传热传质过程。
精馏的原理和过程
原理
基于物质的沸点不同,通过加热和冷凝的方法,将不同沸点的物 质分离出来。
过程
将液体混合物加热至沸腾,产生的蒸汽在冷凝器中冷凝,再通过 回流装置将冷凝液返回精馏塔中,重复进行加热和冷凝的过程, 直至达到分离目的。
操作温度应根据进料组成 和产品要求进行选择,以
实现最佳分离效果。
操作压力应根据进料组成 和产品要求进行选择,以
实现最佳分离效果。
操作条件的优化
实验法
通过实验方法测定不同操作条件下的分离效果,找 出最优的操作条件。
模拟法
利用计算机模拟软件对精馏过程进行模拟,通过优 化算法找出最优的操作条件。
经济分析法
石油化工原料的制备
通过精馏技术可以制备石油化 工原料,如乙烯、丙烯等,这 些原料是生产塑料、合成橡胶 等材料的重要基础。
精馏在其他领域的应用
01
02
03
食品工业
精馏技术可用于食品工业 中,如分离果汁中的果糖 和乙醇饮料中的酒精等。
制药工业
精馏技术可用于药品的生 产和提纯,如分离抗生素、 维生素等。
精馏的分类
02
01
03
根据操作方式的不同,精馏可以分为连续精馏和间歇 精馏。
根据进料位置的不同,精馏可以分为侧线精馏、塔顶 精馏和塔底精馏。
根据操作压力的不同,精馏可以分为常压精馏、加压 精馏和减压精馏。
02
精馏塔的构造和工作原理
精馏塔的结构
塔体
进料板
塔板
溢流管
冷凝器
精馏塔的主要部分,用于 容纳待分离的液体混合物 和进行传热传质过程。
精馏原理.ppt
V'---提馏段中上升蒸汽摩尔流量(kmol/h)。
②恒摩尔液流: 精馏操作时,在塔的精馏段内, 每层板下降的液体摩尔流量都是相等,在提馏段 内也是如此,但两段液体的摩尔流量却不一定相 等,即:
L1 = L2 =...= Ln =L L1'= L2' =...=Ln' =L' 式中 L----精馏段中下降液体摩尔流量(kmol/h)
• •
2、精馏塔
板式塔
•分类 填料塔
x ,t n-1 n-1
yn,tn
工作原理:
理论板: 精馏段: 提馏段: 进料板(加料板):
y ,t n+1 n+1
xn,tn
如何确定加料 板位置?
第四节 精馏塔的物料衡算和操作线方程
一、全塔物料衡算
V,y1
以全塔为衡算范围,以单位时
间为基准,则有
F,xF
总物料: F = D + W
操作关系:精馏塔内自任意第n层塔板下降 的液相组成与其相邻的下一层塔板上升的气 相组成之间的关系。
精馏段操作线方程 的推导图
V,y1
1 2 n
n+1
y1 L,xD
x2
y2
yn
xn yn+1
F,xF
D,xD
易挥发组分:
L,xD
D,x
V´
F ·xF= D·xD + W·xw
L´
W,
回收率:
易挥发组分回收率 = DxD
FxF
×100℅
难挥发组分的回收率 =
W (1 xw ) F (1 xF )
×100℅
[例题] 某连续精馏塔操作压力为700kPa,用来
②恒摩尔液流: 精馏操作时,在塔的精馏段内, 每层板下降的液体摩尔流量都是相等,在提馏段 内也是如此,但两段液体的摩尔流量却不一定相 等,即:
L1 = L2 =...= Ln =L L1'= L2' =...=Ln' =L' 式中 L----精馏段中下降液体摩尔流量(kmol/h)
• •
2、精馏塔
板式塔
•分类 填料塔
x ,t n-1 n-1
yn,tn
工作原理:
理论板: 精馏段: 提馏段: 进料板(加料板):
y ,t n+1 n+1
xn,tn
如何确定加料 板位置?
第四节 精馏塔的物料衡算和操作线方程
一、全塔物料衡算
V,y1
以全塔为衡算范围,以单位时
间为基准,则有
F,xF
总物料: F = D + W
操作关系:精馏塔内自任意第n层塔板下降 的液相组成与其相邻的下一层塔板上升的气 相组成之间的关系。
精馏段操作线方程 的推导图
V,y1
1 2 n
n+1
y1 L,xD
x2
y2
yn
xn yn+1
F,xF
D,xD
易挥发组分:
L,xD
D,x
V´
F ·xF= D·xD + W·xw
L´
W,
回收率:
易挥发组分回收率 = DxD
FxF
×100℅
难挥发组分的回收率 =
W (1 xw ) F (1 xF )
×100℅
[例题] 某连续精馏塔操作压力为700kPa,用来
化工原理精馏PPT课件

D,xD
•
(xD,xD)
3
(二) 提馏段操作线方程
总物料衡算:L=V+W
m Lxm V ym+1
m+1
易挥发组分衡算 :Lxm= Vym+1+ WxW
yN
ym 1LL Wxm LW WxW 或 ym 1V Lxm V WxW
N xN
V
LxN
W,xw
提馏段操作 线方程
•(xW,xW)
4
【例1】在连续精馏塔中分离某理想二元混合物。已知原料液流量 为100kmol/h,组成为0.5(易挥发组分的摩尔分率,下同),提馏 段下降液体量与精馏段相等,馏出液组成为0.98,回流比为2.6。若 要求易挥发组分回收率为96%,试计算: (1) 釜残液的摩尔流量; (2) 提馏段操作线方程。
IV IL
(1)饱和液体进料——泡点进料
LV F
此时,IF=IL
q=1
原料液全部与精馏段下降液体汇合进入 提馏段。
L V
饱和液体
L =L+F
V =V
11
(2)饱和蒸汽进料
IF=IV
q=0
q IV IF IV IL
原料全部与提馏段上升气体汇合进入 精馏段。
L =L V=V +F
(3)冷液进料
内容回顾
一、精馏原理
(1)无中间加热及冷凝器的多次部分气化和多次部分冷凝 (2)顶部回流及底部气化是保证精馏过程稳定操作的必不可 缺少的条件。 (3)精馏操作流程 (4)相邻塔板温度及浓度的关系
tn1tntn1 xn1xnxn1 yn1ynyn1
1
二、理论塔板
三、恒摩尔流假定 四、全塔物料衡算
化工原理精馏PPT课件全

用饱和蒸气压表示的气液平衡关系
2)用相对挥发度表示 ☆挥发度定义
某组分在气相中的平衡分压与该组分在液相中
的摩尔分率之比
挥发度意义
vi
pi xi
某组分由液相挥发到气相中的趋势,是该组分 挥发性大小的标志
双组分理想溶液
vA
pA xA
pAo xA xA
pAo
vB
pB xB
pBo xB xB
pBo
☆相对挥发度定义
pA pyA
pB pyB p(1 yA )
p
o A
xA
pyA
yA
p
o A
xA
p
pBo xB pyB
yB
pBo xB p
yA
p
o A
x
A
p
xA
p pBo pAo pBo
yA
pAo p
p pBo pAo pBo
xA
p pBo pAo pBo
,
yA
pAo p
p pBo pAo pBo
解 (1)利用拉乌尔定律计算气液平衡数据
xA
p pBo pAo pBo
yA
p
o A
x
A
p
t/℃ x y
80.1 84 88 92 96 100 104 108 110.8 1.000 0.822 0.639 0.508 0.376 0.256 0.155 0.058 0.000 1.000 0.922 0.819 0.720 0.595 0.453 0.305 0.127 0.000
xF,y,x---原料液、气相、液相产品的组成,摩尔分数
y
1
F D
x
《化工原理精馏》课件

精馏流程图
• 流程图:精馏流程图展示了精馏 操作的全过程,包括原料的预处 理、加热、蒸发、冷凝、回流等 步骤。通过流程图可以直观地了 解精馏操作的过程和原理,有助 于更好地理解和掌握精馏技术。
02 精馏塔设备
精馏塔类型
板式塔
塔内装有多层塔板,液体在塔板上完成汽化与回流,实现分 离。
填料塔
塔内装有填料,液体沿填料表面流下,与上升气体进行接触 传质。
低温余热利用
利用低温余热驱动精馏过程,减少对新鲜能源的依赖 。
废气处理技术
采用吸附、吸收、催化燃烧等方法处理废气,降低污 染物排放。
新型精馏技术
分子蒸馏
利用高蒸气压下分子间的平均自由程大于蒸馏 器结构尺寸的特点,实现高效分离。
反应精馏
在精馏过程中进行化学反应,实现产物的高效 分离和转化。
膜分离技术
据具体工艺要求进行选择和控制。
苯精馏案例
总结词
苯精馏是石油化工中重要的分离过程,其工 艺流程和操作条件较为复杂。
详细描述
苯精馏的目的是从石油裂解气中分离高纯度 的苯产品。原料经过预处理后进入精馏塔, 在塔内通过多次汽化和冷凝操作,将苯与其 他组分分离。操作过程中需严格控制温度、 压力、进料位置和回流比等参数,以保证苯 产品的质量和收率。
精馏操作优化
04
操作参数优化
01
塔板数优化
根据物料性质和分离要求,合理选择塔板数,以提高分 离效率和产品质量。
02
进料位置优化
通过调整进料位置,改善物料在塔内的分布,提高传热 和传质效率。
03
回流比优化
根据操作条件和分离要求,合理调整回流比,以平衡能 耗和分离效果。
节能减排技术
热集成精馏
本章主要介绍蒸馏的基本原理(共49张PPT)

由其泡点或露点计算确定。对液相则由泡点计算确定其
平衡常数 、泡点 及与之平衡气相组成 ,并
有
。对气相混合物,则由露点计算来确定
其 、 及。
第七页,共四十九页。
二元混合物相平衡关系
对于理想的二元混合物的相平衡(pínghéng)关系,由平衡 常 (pínghéng) 数表示,则有:
YA=KA.xA, KA =pA/P, yB=KB.xB, KB =pB/P
(10.27)
式( 10.27 )为提馏段操作方程常用表达式,亦为线性方 程,关联提馏段任意塔截面(jiémiàn)上,上升蒸气与流下液相组 成xn,yn+1 的关系。已知流下液相组成 ,即可由式 ( 10.27 )得来自n+1板上的蒸气组成 。
第二十五页,共四十九页。
若将精馏段及提馏段两操作线与平 衡曲线(y~x)同时(tóngshí)绘于同一 直角坐标中,如图10-7所示。精馏 段操作线如DC所示,提馏段操作线 如QW所示。
第三节 二元连续(liánxù)精馏的分析和计算
10-8 全塔物料(wùliào)衡算
应用全塔物料衡算可以找出经历塔顶、底 的产量与进料量及各组成之间的关系。如 图10-5所示。令:
F为料液流量;D为塔顶产品(馏出液) 流量;W为塔底产品(釜液)流量;ZF 为料液组成;xD、xW为塔顶、底产品的组成。
本章重点:
·连续精馏过程的基本原理及过程描述的基本方法 ·二元精馏过程的设计以及精馏过程的操作分析与诊断 ·精馏过程的塔设备
第三页,共四十九页。
第一节 二元物系的气液平衡(pínghéng)
a. 气液相平衡
b. 在一封闭容器中,如图6.1.1所示。在一 定条件下,液相中各组分均有部分(bùfen)分 子从界面逸出进入液面上方气相空间, 而气相也有部分(bùfen)分子返回液面进入液 相内。经长时间接触,当每个组分的分 子从液相逸出与气相返回的速度相同, 或达到动态平衡时,即该过程达到了相 平衡。平衡时气液两相的组成之间的关 系称为相平衡关系。它取决于体系的热 力学性质,是蒸馏过程的热力学基础和 基本依据。
《精馏基础知识》课件

塔板或填料
提供气液接触面,促进气液传质 和传热。
进料口
将原料引入塔内的装置,位置根 据工艺要求而定。
塔底再沸器
加热塔底液体,使其部分汽化后 返回塔内,提供上升蒸汽。
塔顶冷凝器
将塔顶上升蒸汽冷凝成液体的装 置,以便进行液相收集和回流。
回流口
将部分塔顶冷凝液返回塔内的装 置,用于提供液相回流。
精馏塔操作参数设置
03
精馏塔结构与操作
精馏塔类型及特点
1 2
3
板式塔
气液接触良好,操作弹性大,塔板效率高,但结构复杂,造 价高。
填料塔
结构简单,造价低,压降小,但操作弹性小,效率相对较低 。
复合塔
结合板式塔和填料塔的优点,具有高效、低压降、大操作弹 性等特点。
精馏塔内部构件介绍
塔体
提供气液传质和传热的场所,通 常由钢板焊接而成。
精馏原理
基于溶液中不同组分相对挥发度的差异,通过加热使溶液部分汽化,然后使汽液两相进行充分接触,进行相际传 质,使易挥发组分不断从液相往气相中转移,而难挥发组分则从气相往液相中转移,从而在塔顶得到易挥发组分 的浓度较高的产品,在塔底得到难挥发组分的浓度较高的产品。
精馏分类及应用领域
精馏分类
根据操作方式的不同,精馏可分为连 续精馏和间歇精馏;根据压力的不同 ,可分为常压精馏、加压精馏和减压 精馏。
随着新能源和环保领域的快速发展,精馏 技术将在这些领域发挥重要作用,如用于 锂电池电解液的提纯、废气处理等。
THANKS
实验结果讨论与误差分析
实验结果展示
将实验结果以图表形式展示,便于直观比较和分析。
结果讨论
根据实验结果,讨论精馏过程的效率、产品质量等关键指标,以及 与理论预测的差异。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对于一般正、负偏差的情况,对于易挥发组分始 终有气相组成大于液相中的组成,但存在最大正、负 偏差时不成立。
[例] 在50℃时两种液体A与B的饱和蒸汽压分 别为255与470mmHg,当A与B形成完全互 溶的溶液时,xA=0.3,A与B的平衡分压分 别是182mmHg与433mmHg,则此二元溶液 在常压下的T-x图应该是
§5-11 二组分真实液态混合 物的气-液平衡相图
掌握
二组分系统液态互溶情况
二组分液态完全互溶 二组分液态完全不互溶 二组分液态部分互溶
(a)完全互溶
(b)完全不互溶 (c)部分互溶
二组分系统互溶情况示意图
非理想的完全互溶双液系
(1) 对拉乌尔定律发生一般正偏差 由于某一组分本身发生分子缔合或A、B组分
精馏原理
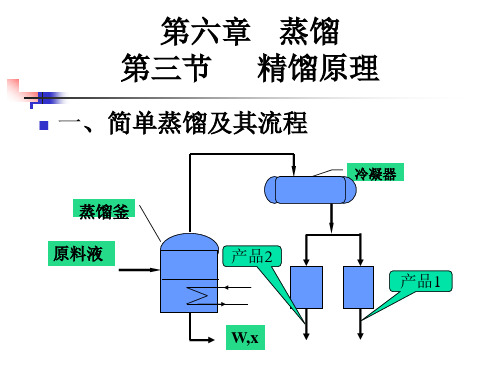
实际生产中, 在精馏柱及精馏 塔中精馏时,上 述部分气化和部 分冷凝是同时进 行的。对理想液 态混合物精馏时, 最后得到的馏液 (气相冷却而成)是 沸点低的B物质, 而残液是沸点高 的A物质。
精馏
实际生产中,在精 馏柱及精馏塔中精馏时, 上述部分气化和部分冷 凝是同时进行的。
精馏是多次简单蒸馏的组 合。精馏塔底部是加热区, 温度最高;塔顶温度最低。 精馏结果,塔顶冷凝收集 的是纯低沸点组分,纯高 沸点组分则留在塔底。精 馏塔有多种类型,如图所 示是泡罩式塔板状精馏塔 的示意图。
对于 H2O - C2H5OH 体系,若乙醇的含量小于 95.57,无论如何精馏,都得不到无水乙醇。只有 加入 CaCl 2 ,分子筛等吸水剂,使乙醇含量超过 95.57,再精馏可得无水乙醇。
非理想的完全互溶双液系
(3) 对拉乌尔定律发生负偏差
CHCl3 (A)- (CH3)2O (B)系统
pl
t=const.
t
p=const. g
g
l
0
xB
1
0
xB
1
A
B
A
B
非理想的完全互溶双液系
(4) 负偏差在p-x图上有最低点
由于A,B二组分对拉乌尔 定律的负偏差很大,在p-x图上 形成最低点,如图(a)所示。
存在 p pA* p pA* xA pB* xB
在p-x图上有最低点,在T-x图上就有最高点,这 最高点称为最高恒沸点(maximum azeotropic point)
非理想的完全互溶双液系
最低恒沸混合物
在T-x(y)图上,处在最 低恒沸点时的混合物称为最低 恒沸混合物(Low-boiling azeotrope)。它是混合物而不 是化合物,它的组成在定压下 有定值。改变压力,最低恒沸 点的温度也改变,它的组成也 随之改变。
属于此类的体系有:H2O-C2H5OH, CH3OH-C6H6 , C2H5OH - C6H6 等。在标准压力下,H2O - C2H5OH 的最低恒 沸点温度为351.28K,含乙醇95.57 。
会溶温度的高低反映了一对液体间的互溶能力, 可以用来选择合适的萃取剂。
(2) 具有最低 会溶温度
(3)同时具有最高 、最低会溶温度
水和烟碱
(4)不具有 会溶温度
乙醚与水
2. 部分互溶系统气-液平衡的 T-x 相图
§5-12 二组分液态部分互溶系统的气-液 掌握 平衡相图(温度-组成图)
二组分系统液态互溶情况
二组分液态完全互溶(前已讨论) 二组分液态完全不互溶 二组分液态部分互溶
(a)完全互溶
(b)完全不互溶 (c)部分互溶
二组分系统互溶情况示意图
1. 液相的相互溶解度
(1)具有最高会溶温度
(a) 现象 H2O - C6H5NH 2 体系在常温下
始终有 pA* p pB* p pA* xA pB* xB
非理想的完全互溶双液系
(2) 正偏差在p-x图上有最高点
由于A,B二组分对 拉乌尔定律的正偏差很大, 在p-x图上形成最高点。
存在 p pB* p pA* xA pB* xB
在p-x图上有最高点者,在T-x图上就有最低点,这 最低点称为最低恒沸点(minimum azeotropic point)
非理想的完全互溶双液系
最高恒沸点混合物 在T-x(y)图上,处在最
高恒沸点时的混合物称为最 高恒沸混合物(high-boiling azeotrope)。
它是混合物而不是化合物,它的组成在定压下有 定值。改变压力,最高恒沸点的温度会改变,其组成 也随之改变。 属于此类的体系有:H2O - HNO3,H2O - HCl 等。在标准 压力下,H2O - HCl 的最高恒沸点温度为381.65 K,含 HCl 20.24,分析上常用来作为标准溶液。
混合时有相互作用,使体积改变或相互作用力改变, 都会造成某一组分对拉乌尔定律发生偏差,这种偏 差可正可负。
如图所示,是对拉乌 尔定律发生正偏差的情况, 虚线为理论值,实线为实 验值。真实的蒸气压大于 理论计算值。
非理想的完全互溶双液系
如果把它对应的气相组 成线也画出来,分别得到对 应的p-x(y)图和T-x(y)图,这时 液相线已不再是直线。
对具有最高、低 恒沸点的实际溶 液精馏时,因在 恒沸点液、气相 组成相同,沸点 不变,故不能将 两组分完全分离, 其精馏结果之一
精馏
非理想的完全互溶双液系具有最恒沸点的相图可以看作由两个简单的T-x(y)
图的组合。在组成处于恒沸点 之左,精馏结果只能得到纯B 和恒沸混合物。组成处于恒沸 点之右,精馏结果只能得到恒 沸混合物和纯A 。
(c) 相图分析
帽形区外,溶液为单一液相; 帽形区内,溶液分为两相。
在373 K时,两层的组成分别 为A’和A”,称为共轭层(conjugate layers),A’和A”称为共轭配对点。
是共A轭n层组成的平均值。
共轭溶液的组成可由与之 对应的两个相点(A’,A”)读出。 相点间的联线称为结线(A’ A”), 在结线上可用杠杆规则计算两相 的相对量。
只能部分互溶,分为两层。 下层是水中饱和了苯胺,溶
解度情况如图中左半支所示;上 层是苯胺中饱和了水,溶解度如 图中右半支所示。升高温度,彼 此的溶解度都增加。到达B点, 界面消失,成为单一液相。 (b) B点温度称为最高临界会溶温度(critical
consolute temperature)TB 。温度高于 TB ,水和 苯胺可无限混溶。
