常见离子的分离与鉴别
常见阴离子的分离与鉴定实验报告

常见阴离子的分离与鉴定实验报告实验报告:常见阴离子的分离与鉴定摘要:通过本实验能够掌握离子交换法分离阴离子、荧光试剂法鉴定阴离子和近红外光谱法鉴定阴离子的方法,成功分离和鉴定了常见的硫酸根、硝酸根和氯根离子。
一、实验目的:1.掌握离子交换法分离阴离子的方法,并分离出常见的硫酸根、硝酸根和氯根离子。
2.掌握荧光试剂法鉴定阴离子的方法,并鉴定分离得到的硫酸根、硝酸根和氯根离子。
3.掌握近红外光谱法鉴定阴离子的方法,并鉴定分离得到的硫酸根、硝酸根和氯根离子。
二、实验原理:1.离子交换法分离阴离子:通过阳离子交换树脂,将不同离子与树脂中的Na+交换,使阴离子被树脂吸附并分离出来。
2.荧光试剂法鉴定阴离子:荧光试剂与阴离子反应产生荧光物质,根据荧光的强度或颜色判断阴离子种类。
3.近红外光谱法鉴定阴离子:近红外光谱区域中阴离子所产生的吸收峰可用于鉴定阴离子种类。
三、实验步骤:1.离子交换法分离阴离子:分别取三个含阴离子的样品,加入少量0.005mol/L NaCl溶液。
将三个样品分别加入三个干燥的阳离子交换树脂柱中,收集通过的溶液,收集得到三个样品的阴离子分离物。
2.荧光试剂法鉴定阴离子:将阴离子分离物溶于少量水中,并加入不同的荧光试剂,观察荧光变化并判断阴离子种类。
3.近红外光谱法鉴定阴离子:将不同的阴离子样品固定在固体基底上,并进行近红外光谱扫描,根据吸收峰判断阴离子种类。
四、实验结果:通过离子交换法成功分离得到三个样品的阴离子分离物,经荧光试剂鉴定与近红外光谱鉴定,确定分离得到的三种阴离子分别为硫酸根、硝酸根和氯根离子。
五、结论:离子交换法分离阴离子是一种可行的方法,能够分离常见的阴离子;荧光试剂法与近红外光谱法鉴定阴离子的方法也能够准确判断阴离子种类,三种方法结合使用,能够充分确认阴离子的种类。
实验常见阳离子的分离与鉴定-V1

实验常见阳离子的分离与鉴定-V1实验常见阳离子的分离与鉴定阳离子是指带正电荷的离子,常见的有盐酸中的K+、Na+、Mg2+、Ca2+等。
在实验室中对这些阳离子的分离和鉴定是一项比较常见的实验操作,下面将对此进行重新整理。
一、分离NH4+和Fe3+实验操作步骤:1.将NH4+和Fe3+混合,并加入NaOH,出现棕色沉淀;2.将沉淀过滤,并加入HCl,沉淀消失;3.将所得溶液加入HgCl2,出现白色沉淀。
实验操作目的:该实验可用于检测食品和饲料中的氨盐等。
二、分离Ba2+和Fe3+实验操作步骤:1.将Ba2+和Fe3+混合,并加入NaOH,出现棕色沉淀;2.将沉淀过滤,得到沉淀和过滤液;3.将所得沉淀加入Na2CO3,在锅炉中加热,轻轻搅拌,直到溶解;4.将溶液冷却,加入硫酸钠,出现白色沉淀。
实验操作目的:该实验可用于检测水中钙、铁的含量。
三、分离Mg2+和Fe2+实验操作步骤:1.将Mg2+和Fe2+混合,加入氨水,pH值达到9.5~10.2;2.将所得溶液加入EDTA,出现蓝色沉淀。
实验操作目的:该实验可用于检测水或者土壤中的镁和铁的含量。
四、分离Ca2+和Ba2+实验操作步骤:1.将Ca2+和Ba2+混合,加入Na2SO4;2.出现白色沉淀。
实验操作目的:该实验可用于检测食品和饲料中的钙盐。
五、分离Na+和K+实验操作步骤:1.将Na+和K+混合,并加入Na2CO3;2.加热,溶解后冷却,加入二甲基黄。
3.观察产生的沉淀,小型重沉。
实验操作目的:该实验可用于检测水中钠、钾的含量。
实验十常见无机阳离子的分离与鉴

2、物质检验的方法
物质的检验一般包括取样、操作、现象、结论四个部分:
①“先取样,后操作”。如果样品是固体,一般先用水 溶解,配成溶液后再检验;
②要“各取少量溶液分别加入几支试管中”进行检验, 不得在原试剂瓶中进行检验;
③要“先现象,后结论”,如向Na2CO3溶液中滴加盐酸, 所观察到的现象应记录为“有气泡产生”或“有无色气体放 出”,不能说成“碳酸钠和盐酸反应,放出二氧化碳”,或 “有无色二氧化碳气体放出”。
.
3. 银与亚汞的分离及亚汞的鉴定
分出PbCl2后的沉淀应以热水洗涤干净,然后 加入氨水,此时AgCl溶解,生成Ag(NH3)2+,分出后 另行鉴定。Hg2Cl2与氨水作用,生成HgNH2Cl+Hg, 残渣变黑,表示汞的存在。
4. 银的鉴定
在分出的Ag(NH3)2+溶液中加入HNO3酸化,可 以重新得到AgCl白色沉淀:
此种情况在溶液的酸度低于1.2—1.5mol/L时发生。 为防止它们水解,应使上述平衡向左移。为此,要 保 证 溶 液 有 足 够 的 H+ 浓 度 。 本 组 组 试 剂 所 以 采 用 HCl,就是考虑到它既含有C1-,又含有防止水解所 需要的H+。
.
3. 防止生成胶性沉淀
本组氯化银沉淀很容易生成难以分离的胶性沉淀。为 防止此种现象发生,加入适当过量的沉淀剂,以便提供使胶 体凝聚的电解质。
进 行消去实验 (4)对未消去的离子选择合适的方法加以确证。
.
阳离子分析
一、 常见阳离子的分组
常见的阳离子有二十几种,我们讨论的是下列24 种 : Ag+ 、 Hg22+ 、 Hg2+ 、 Pb2+ 、 Bi3+ 、 Cu2+ 、 Cd2+ 、 As(Ⅲ,Ⅴ) 、 Sb(Ⅲ,Ⅴ) 、 Sn(Ⅱ,Ⅳ) 、 Al3+ 、 Cr3+ 、 Fe3+、Fe2+、Mn2+、Zn2+、Co2+、Ni2+、Ba2+、Ca2+、 Mg2+、K+、Na+、NH4+ 。
常见化合物的鉴别与分离方法

常见化合物的鉴别与分离方法化学是一门研究物质组成、性质和变化的科学。
在化学实验中,我们经常需要对不同的化合物进行鉴别和分离。
本文将介绍常见化合物的鉴别与分离方法。
I. 鉴别常见离子的方法1. 鉴别阳离子(1)阳离子铁(Fe3+):加入氨水后溶液呈深红色。
(2)阳离子铜(Cu2+):加入氢氧化钠后溶液呈深蓝色。
(3)阳离子银(Ag+):加入氯化物溶液后,产生白色沉淀。
2. 鉴别阴离子(1)阴离子碳酸根离子(CO3^2-):加入酸后产生气泡。
(2)阴离子硫酸根离子(SO4^2-):加入氯化钡溶液后产生白色沉淀。
(3)阴离子氯离子(Cl^-):加入硝酸银溶液后产生白色沉淀。
II. 分离常见化合物的方法1. 晶体分离法(1)卤素的分离:将混合物加入水中,使其溶解。
然后加入氯化钾,卤素溶解度较小,会生成沉淀而分离出来。
2. 蒸馏法(1)液体蒸馏:利用液体的沸点差异,将两种沸点相差较大的液体分离。
(2)汽包分离法:利用汽包的作用,将气化液体与非气化液体分离。
3. 结晶法(1)溶液结晶:将溶液浓缩至饱和,冷却后结晶分离。
(2)蒸发结晶:将溶液加热蒸发,溶质浓缩至饱和后冷却结晶。
4. 离心法(1)离心过滤:利用不同化合物粒子的沉降速度差异,通过离心作用将固体与液体分离。
(2)离心离析:利用不同化合物的密度差异,通过离心分离混合物中的不同组分。
5. 萃取法(1)液液萃取:通过两种不相溶的液体之间的分配行为,将化合物从一个相中转移到另一个相中,实现分离。
6. 色谱法(1)气相色谱法:根据化合物在固定相和流动相之间吸附的差异,进行分离。
以上介绍了常见化合物的鉴别与分离方法。
通过对离子的鉴别和化合物的分离,我们可以更好地理解不同化合物的性质和特点,为化学实验和研究提供有力支持。
在实践中,我们还可以根据具体情况选择合适的方法,进行化合物的鉴别和分离。
常见阳、阴离子的分离与鉴定
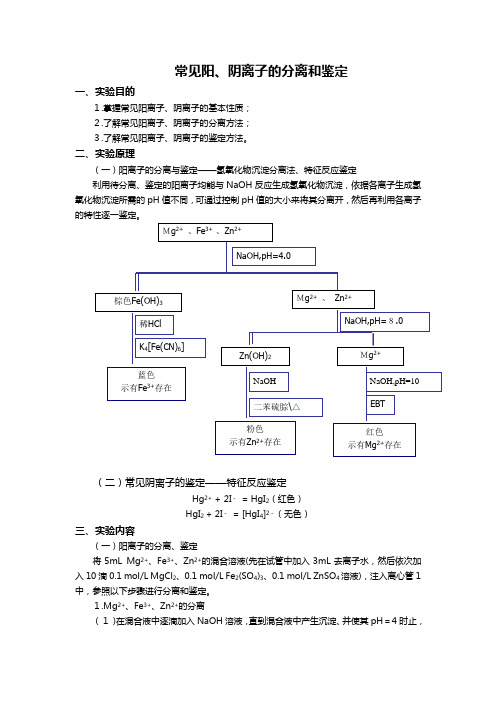
常见阳、阴离子的分离和鉴定一、实验目的1.掌握常见阳离子、阴离子的基本性质; 2.了解常见阳离子、阴离子的分离方法; 3.了解常见阳离子、阴离子的鉴定方法。
二、实验原理(一)阳离子的分离与鉴定——氢氧化物沉淀分离法、特征反应鉴定利用待分离、鉴定的阳离子均能与NaOH 反应生成氢氧化物沉淀,依据各离子生成氢氧化物沉淀所需的pH 值不同,可通过控制pH 值的大小来将其分离开,然后再利用各离子的特性逐一鉴定。
(二)常见阴离子的鉴定——特征反应鉴定Hg 2+ + 2I - = HgI 2(红色) HgI 2 + 2I - = [HgI 4]2-(无色)三、实验内容(一)阳离子的分离、鉴定将5mL Mg 2+、Fe 3+、Zn 2+的混合溶液(先在试管中加入3mL 去离子水,然后依次加入10滴0.1 mol/L MgCl 2、0.1 mol/L Fe 2(SO 4)3、0.1 mol/L ZnSO 4溶液),注入离心管1中,参照以下步骤进行分离和鉴定。
1.Mg 2+、Fe 3+、Zn 2+的分离(1)在混合液中逐滴加入NaOH 溶液,直到混合液中产生沉淀、并使其pH =4时止,Mg 2+ 、Fe 3+ 、Zn 2+Mg 2+ 、 Zn 2+棕色Fe(OH)3稀HCl NaOH,pH=4.0蓝色 示有Fe 3+存在K 4[Fe(CN)6] NaOH,pH=8.0 Zn(OH)2Mg 2+NaOH 粉色示有Zn 2+存在二苯硫腙\△ NaOH,pH=10 红色示有Mg 2+存在EBT然后离心分离。
把上清液移到另一离心管2中;沉淀用去离子水洗涤二遍后,记为沉淀1,留待下面分析。
(2)往离心管2的上层清液中继续逐滴加入NaOH溶液,直到溶液中产生沉淀、并使其pH=8时止,把上清液移到另一离心管3中;沉淀用去离子水洗涤二遍后,记为沉淀2,留待下面分析。
2.Mg2+、Fe3+、Zn2+的鉴定(1)Fe3+的鉴定取沉淀1加入去离子水及几滴盐酸,振荡试管使沉淀溶解。
常见非金属阴离子的分离与鉴定

常见非金属阴离子的分离与鉴定非金属阴离子是指没有金属离子的离子,它们在化学实验中是非常重要的。
分离和鉴定非金属阴离子是化学分析的一个重要方面,因为它们在水质分析、环境分析、生物化学和食品化学等方面都是重要的组成部分。
1. 氯离子(Cl-)氯离子是被发现最早和最广泛使用的离子之一。
它通常存在于自然水体中,例如河流、湖泊和海洋。
氯离子的分离方法包括溶液酸化、加入银盐等试剂,形成氯化银沉淀进行检测。
鉴定方法包括氯化银沉淀颜色变化、AgNO3溶液滴定等。
2. 硝酸盐离子(NO3-)硝酸盐离子在自然界中广泛存在,尤其是在土壤和植物中。
硝酸盐离子的分离方法包括反应试样与五氧化二钒的反应,有钒氧化物形成。
鉴定方法包括金属离子还原法和碳酸气体的检测。
硫酸盐离子在自然界中存在于地下水中、矿物中和硫酸盐矿物中。
分离硫酸盐离子通常使用钡离子或钙离子沉淀,检测沉淀的颜色变化或灼烧残渣化学元素分析。
鉴定方法包括加入水溶性盐类,如盐酸、氯化钡等,然后通过色谱法、气相色谱法、电导法等进行检测。
4. 氢氧化物离子(OH-)氢氧化物离子在水中存在,它是酸碱反应的碱性部分。
分离氢氧化物离子的方法包括通过加酸滴定进行酸碱反应,以及通过加盐酸加热蒸发测定沉淀重量等。
鉴定方法包括使用电极电势寻找中和点、用指示剂观察颜色变化、用漏斗检测氢氧根离子的滤液沉淀等。
磷酸盐离子在自然界中广泛存在,通常被认为是主要的污染因素之一。
分离磷酸盐离子的方法包括加入酒石酸钾等化合物,形成分离的沉淀检测。
鉴定方法包括吸附光谱法、原子荧光光谱法等物理和化学方法。
以上列举的几种方法只是分离和鉴定非金属离子的一小部分。
在实际分析中,需要选择适当的方法,以保证结果的准确性和可靠性。
常见非金属阴离子的分离与鉴定实验报告
常见非金属阴离子的分离与鉴定实验报告常见非金属阴离子的分离与鉴定实验报告实验目的:通过实验,了解常见非金属阴离子的分离与鉴定方法,掌握实验操作技巧,并能正确判断不同阴离子的存在与否。
实验原理:常见非金属阴离子包括氯离子、溴离子、碘离子、硫酸根离子、硝酸根离子、碳酸根离子等。
本实验通过一系列化学反应,利用各个阴离子的特性进行分离与鉴定。
实验器材与试剂:实验器材:试管、滴管、烧杯、玻璃棒等。
试剂:氯化银溶液、溴化银溶液、碘化银溶液、硫酸银溶液、硝酸银溶液、盐酸、硫酸、硝酸、碳酸钠溶液等。
实验步骤:1. 氯离子的鉴定取一小部分待测溶液,加入少量氯化银溶液。
若产生白色沉淀,则表示存在氯离子。
2. 溴离子的鉴定取一小部分待测溶液,加入少量溴化银溶液。
若产生黄色沉淀,则表示存在溴离子。
3. 碘离子的鉴定取一小部分待测溶液,加入少量碘化银溶液。
若产生红褐色沉淀,则表示存在碘离子。
4. 硫酸根离子的鉴定取一小部分待测溶液,加入少量硫酸银溶液。
若产生白色沉淀,则表示存在硫酸根离子。
5. 硝酸根离子的鉴定取一小部分待测溶液,加入少量硝酸银溶液。
若产生白色沉淀,则表示存在硝酸根离子。
6. 碳酸根离子的鉴定取一小部分待测溶液,加入少量盐酸。
若产生气泡,且气泡通入饱和石灰水中产生白色沉淀,则表示存在碳酸根离子。
实验结果与分析:根据实验步骤所述,通过观察产生的沉淀或气泡,可以判断待测溶液中是否存在氯离子、溴离子、碘离子、硫酸根离子、硝酸根离子和碳酸根离子。
实验注意事项:1. 实验操作时要小心,避免溶液溅出或溅入眼睛。
2. 实验过程中要保持实验器材的干净,避免交叉污染。
3. 实验结束后,要彻底清洗实验器材,保持实验室的整洁。
实验总结:通过本次实验,我了解了常见非金属阴离子的分离与鉴定方法,并掌握了实验操作技巧。
实验结果表明,通过一系列化学反应,我们可以准确判断不同阴离子的存在与否。
这对于化学分析和实际应用具有重要意义。
在今后的学习和实验中,我将继续加强对化学实验操作的掌握,提高自己的实验技能。
实验常见阳离子的分离与鉴定(一)
实验二十二:常见阳离子的分离与鉴定(一)〔实验目的〕1.巩固和进一步掌握一些金属元素及其化合物的性质;2.了解常见阳离子混合液的分离和检出的方法及巩固检出离子的操作。
〔实验原理〕1. 与HCl反应Ag+Hg22+HNO3及H2SO4Pb2+NH4Ac、NaOH2.Ba2+4↓白色,难溶于酸Sr2+4↓白色,溶于煮沸的酸Ca2+4↓白色,溶解度较大,当Ca2+浓度很大时,才析出沉淀Pb2+4↓白色,溶于NaOH、NH4Ac、热HCl、浓H2SO4,不溶于稀H2SO4 Ag+4↓白色,在浓溶液中产生沉淀,溶于热水3.Al3+AlO2-或[Al(OH)4]-浓NaOHZn2+2-或[Zn(OH)4]2-Cu2+Cu(OH)42-Pb2+ PbO2-或[Pb(OH)4]2-ΔSb3+SbO2-或[Sb(OH)4]-Sn2+SnO22-或[Sn(OH)4]2-4. 与NH3反应AgCuCdZn6.AgPbCuCdBiHg溶于王水,Na2SHgSbSb溶于浓HCl,NaOH,Na2SSnSn溶于浓HCl,(NH4)2S x,不溶于NaOH,Zn HCl溶液,不溶于HAc溶液Al HCl溶液5. 与(NH4)2CO3反应Cu2+Cu2(OH)2CO3↓浅蓝 Cu(NH3)42+ 深蓝Ag+Ag2CO3↓白色 (NH4)2CO3Ag(NH3)2+ 无色Zn2+Zn2(OH)2CO3↓白色 (过量)Zn(NH3)42+ 无色Cd2+Cd2(OH)2CO3↓白色 Cd(NH3)42+ 无色Hg2+ Hg2(OH)2CO3↓白色Hg22+Hg2CO3↓白色→HgO↓(黄)+ Hg↓(黑)+ CO2↑Mg2+Mg2(OH)2CO3↓白色Pb2+(NH4)2CO3Pb2(OH)2CO3↓白色Bi3+(适量)(BiO) 2CO3↓白色Ca2+CaCO3↓白色Sr2+SrCO3↓白色Ba2+BaCO3↓白色Al3+Al(OH)3↓白色Sn2+Sn(OH)2↓白色Sn4+Sn(OH)4↓白色Sb3+Sb(OH)3↓白色〔实验步骤〕内容步骤现象结论(解释)一、碱金属、碱土金属离子的鉴定1. Na+的鉴定NaCl + KSb(OH)6白色结晶Na+ + Sb(OH)6-=NaSb(OH)6(s)2. K+的鉴定KCl + NaHC4H4O6白色结晶K++ HC4H4O6-= KHC4H4O6(s)3. Mg2+的鉴定 MgCl2+NaOH+镁试剂先生成白色Mg(OH)2,后生反应式见后1成蓝色沉淀。
银离子铜离子铁离子的分离
银离子铜离子铁离子的分离银离子、铜离子和铁离子是常见的金属离子,它们在化学实验中经常被用来进行分离和检测。
在分离这三种离子时,我们可以采用不同的方法,下面将介绍几种常用的方法。
一、沉淀法沉淀法是一种常用的分离离子的方法,它利用不同离子的沉淀性质来实现分离。
在分离银离子、铜离子和铁离子时,我们可以先加入一定量的氯化钠,使得银离子和铜离子沉淀下来,而铁离子则不会沉淀。
然后将沉淀过滤出来,再用氨水将银离子和铜离子分别溶解,最后通过加入硫酸钠使得银离子沉淀下来,从而实现银离子、铜离子和铁离子的分离。
二、络合法络合法是一种利用配位化学原理进行分离的方法。
在分离银离子、铜离子和铁离子时,我们可以先将它们与不同的配体形成络合物,然后通过不同的方法将它们分离出来。
例如,我们可以将银离子与氯化钠形成AgCl沉淀,然后用氨水将其溶解,再加入硫酸钠使得银离子沉淀下来;将铜离子与苯并三唑形成络合物,然后用乙醇将其沉淀,最后用氨水将其溶解;将铁离子与邻菲罗啉形成络合物,然后用乙醇将其沉淀,最后用硫酸将其溶解。
三、离子交换法离子交换法是一种利用离子交换树脂进行分离的方法。
在分离银离子、铜离子和铁离子时,我们可以将它们溶解在水中,然后通过离子交换树脂将它们分离出来。
例如,我们可以使用强酸型离子交换树脂将银离子和铜离子吸附下来,然后用硝酸将其洗脱出来;使用强碱型离子交换树脂将铁离子吸附下来,然后用氢氧化钠将其洗脱出来。
综上所述,分离银离子、铜离子和铁离子可以采用不同的方法,例如沉淀法、络合法和离子交换法等。
在实际操作中,我们需要根据具体情况选择合适的方法,并注意操作的安全性和准确性。
常见阴离子的分离与鉴定实验报告
常见阴离子的分离与鉴定实验报告常见阴离子的分离与鉴定实验报告引言:阴离子是化学中一类带负电荷的离子,它们在化学反应中起着重要的作用。
为了研究和鉴定常见的阴离子,我们进行了一系列的实验。
本实验报告将详细介绍实验的目的、原理、实验步骤和结果,并对实验结果进行分析和讨论。
实验目的:1. 掌握常见阴离子的分离与鉴定方法;2. 熟悉常见阴离子的化学性质;3. 提高实验操作技能。
实验原理:常见阴离子的分离与鉴定主要依靠化学反应的特性。
在本实验中,我们主要使用了沉淀反应、酸碱中和反应和气体演化反应等方法。
实验步骤:1. 分离:将待测样品溶解于适量的水中,并通过适当的处理方法,如加热、稀释等,使得样品中的阴离子充分溶解。
2. 分组:根据阴离子的不同特性,将样品分为不同的组别,以便进行后续的实验操作。
3. 沉淀反应:将每个组别的样品分别与不同的沉淀试剂反应,观察是否生成沉淀物。
根据沉淀物的颜色、形状和溶解性等特征,可以初步判断阴离子的存在情况。
4. 酸碱中和反应:将每个组别的样品分别与酸碱试剂反应,观察是否产生酸碱中和反应。
根据反应产生的气体、颜色变化和pH值的变化等特征,可以进一步确定阴离子的种类。
5. 气体演化反应:将每个组别的样品分别与适当的试剂反应,观察是否产生气体。
根据气体的性质和产生气体的反应类型,可以进一步鉴定阴离子的种类。
实验结果与分析:根据实验步骤进行实验后,我们观察到了不同的反应现象,并得到了如下的实验结果:1. 沉淀反应:在样品A中加入氯化银试剂后,观察到了白色沉淀物的生成,表明样品A中存在氯离子。
2. 酸碱中和反应:在样品B中加入盐酸试剂后,观察到了气泡的产生,并且溶液的pH值下降,表明样品B中存在碳酸根离子。
3. 气体演化反应:在样品C中加入硫酸铜试剂后,观察到了蓝色气体的产生,表明样品C中存在硫化物离子。
根据实验结果,我们可以初步确定样品A中存在氯离子、样品B中存在碳酸根离子、样品C中存在硫化物离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3. 络合物 本组离子都能生成多种络合物。其中最常见的 是氯络离子,因而大量Cl-存在时可影响到各简单离 子的浓度。Cu2+、Cd2+都能生成氨合或氰合络离子 Cu(NH3)42+、Cd(NH3)42+、Cu(CN)42+、Cd(CN)42+ , 它们在Cu2+、Cd2+的分离和鉴定上有很多应用。 Bi3+与I-生成黄色的碘合络离子BiI4-,用于铋的鉴定。 Hg2+与I-无色碘合络离子HgI42-,它与KOH一起的溶 液,可用于NH4+的鉴定,称为奈氏试剂。
三、第二组阳离子的分析 (一)本组离子的分析特性 本 组 包 括 Pb2+ 、 Bi3+ 、 Cu2+ 、 Cd2+ 、 Hg2+ 、 AsⅢ,Ⅴ 、SbⅢ,Ⅴ 、SnⅡ,Ⅳ 等离子,称为铜锡组。它们 的共同特点是不被HCl沉淀,但在0.3mol/LHCl酸性 溶液中,可与H2S生成硫化物沉淀。按本组分出的顺 序,称为第二组。按照所用的组试剂,称为硫化氢 组。 1. 离子的存在形式 除Cu2+为蓝色外,其余均无色。铅、铋、铜、镉、 汞具有显著的金属性质,在水溶液中主要以金属离 子形式存在;而砷、锑、锡等三种元素则表现出不 同程度的非金属性质。
As(Ⅲ,Ⅴ) 、 Sb(Ⅲ,Ⅴ) 、 Sn(Ⅱ,Ⅳ) 、 A源自3+ 、 Cr3+ 、
Fe3+、Fe2+、Mn2+、Zn2+、Co2+、Ni2+、Ba2+、Ca2+、
Mg2+、K+、Na+、NH4+ 。
在阳离子的鉴定反应中,相互干扰的情况较多, 实验室常用的混合阳离子分组法有硫化氢系统法和 两酸两碱系统法。
常见无机阳离子的分离与鉴别
一、实验目的 1、运用所学元素及化合物的基本知识, 进行常见物质的分离和鉴别 2、进一步培养观察实验和分析现象中所遇 到的问题的能力
二、实验原理
1、物质的检验方法与技巧
(1)、物质检验的类型 物质检验包括鉴定、鉴别和推断等类型。 鉴定:鉴定是根据一种物质的特性,用化学方法检验它是不是 这种物质。若是离子化合物,必须检验它的阳离子和阴离子;
先用水溶解,配成溶液后再检验;
②要“各取少量溶液分别加入几支试管中”进行 检验,不得在原试剂瓶中进行检验; ③要“先现象,后结论”,如向Na2CO3溶液中滴 加盐酸,所观察到的现象应记录为“有气泡产生”或
“有无色气体放出”,不能说成“碳酸钠和盐酸反应,
放出二氧化碳”,或“有无色二氧化碳气体放出”。
2. 防止Bi3+、Sb3+的水解 第二组离子中,Bi3+ 、Sb3+ 有较强的水解倾向, 当溶液的酸度不够高时,它们生成碱式盐沉淀: Bi3++C1-+H2O=BiOCl↓+2H+ Sb3++Cl-+H2O=SbOCl↓+2H+ 此种情况在溶液的酸度低于1.2—1.5mol/L时发生。 为防止它们水解,应使上述平衡向左移。为此,要 保证溶液有足够的H+ 浓度。本组组试剂所以采用 HCl,就是考虑到它既含有C1-,又含有防止水解所 需要的H+。
(二)组试剂与分离条件 本组与第三、四、五组的分离,是基于硫化物 溶解度的不同。本组硫化物可在0.3mol/LHCl酸性 溶液中生成,而第三组硫化物的沉淀则要求更低的 酸度。第四、五组不生成硫化物沉淀。 为了将本组比较完全地同第三组分开,我们需 要讨论以下几个问题。 1. 沉淀要求的酸度 第二组阳离子硫化物的溶度积比第三组阳离子 硫化物的溶度积小得多。在实际分析中,第二组中 较难沉淀的是CdS,它的溶度积也比第三组中溶度 积最小的ZnS要小近十万倍。
1、已知阳离子混合溶液的分析 根据阳离子化合物的溶解性、溶液的酸碱性的不 同以及相应的配合物的生成,选取合适的试剂作 消去实验。结合观察试液的颜色,PH值,消去不 可能存在的离子,初步确定试样的组成,并对可 能存在的离子进行确证实验。
2、未知阳离子混合溶液的分析 消去不可能存在的离子,具体如下:
3. 银与亚汞的分离及亚汞的鉴定
分出PbCl2 后的沉淀应以热水洗涤干净,然后 加入氨水,此时AgCl溶解,生成Ag(NH3)2+,分出后 另行鉴定。Hg2Cl2 与氨水作用,生成HgNH2Cl+Hg, 残渣变黑,表示汞的存在。
4. 银的鉴定
在分出的Ag(NH3)2+溶液中加入HNO3酸化,可 以重新得到AgCl白色沉淀: Ag(NH3)2++C1-+2H+=AgCl+2NH4+ 此现象说明有银的存在。
Ksp(CdS)=7.1×10-28 Ksp(ZnS)=1.2×10-23 显然,沉淀第二组所需要的S2- 浓度远远小于沉淀第三组 所需要的。这就提供了一种可能性:控制S2- 的浓度,使 第二组硫化物沉淀,而第三组离子仍然可以留在溶液中, 从而将两组彼此分开。 控制S2- 浓度的方法,在于利用离子平衡的原理。在 溶液中,S2-的浓度是由下述平衡决定的: [H+]2[S2-]/[H2S]=K1K2=5.7×l0-8×1.2×10-15=6.8×10-23 [S2-]=6.8×10-23[H2S]/[H+]2 即硫离子浓度与氢离子浓度的平方成反比,调节溶液 的酸度就可以达到控制硫离子浓度的目的。 那么,S2- 浓度控制在多大时才能使第二组沉淀完全, 而第三组又不沉淀呢?从理论上讲这是可以通过下列方法 进行计算。
鉴别:鉴别是根据几种物质的不同特性,区别它们各是什么物 质;
推断:推断是根据已知实验步骤和实验现象,运用物质特性进 行分析,通过推理,判断被检验的样品是什么物质。或样品中 含有什么物质,不含什么物质等。
2、物质检验的方法
物质的检验一般包括取样、操作、现象、结论四 个部分: ①“先取样,后操作”。如果样品是固体,一般
阳离子的种类较多,个别检出时,容易发生相互干扰,
所以一般阳离子分析都是利用阳离子某些共同特性,先分 成几组,然后再根据阳离子的个别特性加以检出。凡能使 一组阳离子在适当的反应条件下生成沉淀而与其它组阳离 子分离的试剂称为组试剂,利用不同的组试剂把阳离子逐 组分离再进行检出的方法叫做阳离子的系统分析。在阳离 子系统分离中利用不同的组试剂,有很多不同的分组方案。
3. 防止生成胶性沉淀
本组氯化银沉淀很容易生成难以分离的胶性沉淀。为防 止此种现象发生,加入适当过量的沉淀剂,以便提供使胶体 凝聚的电解质。 综上所述,本组氯化物沉淀的条件是: 在室温下的酸性溶液中加入适当过量的HCl。作为沉淀 剂使用的一般为6mol/LHCl。
(三)本组离子的系统分析
本组离子以组试剂沉淀为氯化物后,首先,PbCl2溶于 热水,而AgCl、Hg2Cl2 不溶,据此可将铅与银和亚汞分开。 其次,AgC1溶于氨水,而Hg2Cl2不溶。它们与氨水各自发 生以下的反应: AgCl+2NH3=Ag(NH3)2++C1+ Hg2C12+2NH3=Hg(NH2)C1↓+Hg↓+NH4Cl 借此可将银跟亚汞分开。
(二)组试剂与分离条件 本组离子与组试剂HCl的反应为: Ag++Cl-=AgCl↓(白色凝乳状,遇光变紫、变黑) Hg22++2Cl-=Hg2Cl2↓(白色粉末状) Pb2++2C1-=PbCl2↓(白色针状或片状结晶) 为了创造适宜的沉淀条件。我们需要注意以下三 个问题。 1. 沉淀的溶解度 AgC1和Hg2C12 的溶解度很小,可以在本组沉 淀完全,PbCl2 的溶解度较大,25℃时,在其饱和 溶液中每毫升可溶解11mg之多,而且随着温度升高, 其溶解度显著增大 。
1. 本组的沉淀
取分析试液,首先检查其酸碱性,若为碱性,应以 HNO3 中和至微酸性,然后加入适当过量的盐酸。适宜的 C1- 浓度应为0.5mol/L,而H+ 浓度应大于2.0mol/L。此时如 有白色沉淀产生,表示本组存在。离心沉降,沉淀经 1mol/lHCl洗涤作本组分析。
2. 铅的分离和鉴定
表1为 简化的硫化氢系统分组方案
组别 组试剂 组内离子 组的其他名称 Ⅰ 稀HCl Ag+、Hg22+、Pb2+ 盐酸组,银组 Ⅱ H2S(TAA) ⅡA(硫化物不溶于Na2S) (0.3mol/LHCl) Pb2+、Bi3+、Cu2+、Cd2+ 硫化氢组,铜锡组 ⅡB(硫化物溶于Na2S)
Hg2+、AsⅢ,Ⅴ、SbⅢ,Ⅴ、SnⅡ,Ⅳ (NH4)2S
(1)观察颜色
(2)测PH值
(3)依次用HCl,H2SO4、NaOH、氨水、H2S等组试剂进
行消去实验 (4)对未消去的离子选择合适的方法加以确证。
阳离子分析
一、 常见阳离子的分组
常见的阳离子有二十几种,我们讨论的是下列24
种:Ag+ 、Hg22+ 、Hg2+ 、Pb2+ 、Bi3+ 、Cu2+ 、Cd2+ 、
实验室常用的混合阳离子分组法有硫化氢系统法 和两酸两碱系统法。
硫化氢系统分析简介
硫化氢系统分析法,依据的主要是各阳离子硫 化物以及它们的氯化物、碳酸盐和氢氧化物的溶 解度不同,按照一定顺序加入组试剂,把阳离子 分成五个组。然后在各组内根据各个阳离子的特 性进一步分离和鉴定。 硫化氢系统的优点是系统严谨,分离比较完全, 能较好地与离子特性及溶液中离子平衡等理论相 结合,但其缺点是硫化氢气体有毒,会污染空气, 污染环境。
2. 难溶化合物
本组离子具有18或18+2的电子外壳,所以都有很强的极化 作用和变形性,能同易变形的阴离子如 C1- 、Br- 、I- 、CN- 、 CO32-、SO42-、PO43-等生成共价化合物,难溶于水,这些难化合 物的溶解度随着阴离子变形性的增大而降低。
