2020年山东省高考化学试题
2020年山东省新高考化学试卷 (解析版)

2020年山东省新高考化学试卷 (解析版) 2020年山东省新高考化学试卷一、单选题(本大题共12小题,共28.0分)1.下列试剂的存放方法错误的是()A.浓硝酸应存放在棕色试剂瓶中。
B.溴水应存放在带玻璃塞的试剂瓶中。
C.白磷应浸在盛有CS2的试剂瓶中。
D.金属钠应保存在盛有煤油的试剂瓶中。
2.下列变化不涉及氧化还原反应的是()A.粮食酿醋。
B.煅烧石灰石。
C.湿法炼铜。
D.炸药爆炸。
3.X,Y,Z,W,R为原子序数依次增大的五种短周期主族元素。
X原子的最外层电子数是其内层电子数的2倍,W+与Y2−具有相同的电子层结构,R与Y可形成化合物RY2、RY3.下列说法正确的是()A。
W2Y,W2Y2中阴、阳离子个数比均为1:2.B。
沸点:Y的氢化物一定高于X的氢化物。
C。
最高正化合价:Z>Y=R>X>W。
D。
将XY2通入W单质与水反应后的溶液中,生成的盐只有一种。
4.钾和钠的性质相似,下列说法中能较好地解释这个事实的是()A。
都是金属元素。
B。
最外层电子数相同。
C。
原子半径相差不大。
D。
最高化合价相同。
5.用下列装置进行实验,能达到实验目的的是()A。
①配制250mL0.1mol/L的盐酸。
B。
②用稀盐酸滴定氢氧化钠溶液。
C。
③海带灼烧成灰。
D。
④鉴别KNO3溶液和NaCl溶液。
6.某有机物的结构简式为。
有关下列说法错误的是() A。
可以与Br2水发生取代反应。
B。
可以与NaHCO3溶液反应,放出CO2.C。
可以与乙酸发生酯化反应。
D。
该物质不可以发生水解反应。
7.已知S6、S8的结构如图所示。
下列说法中错误的是() A。
硫单质S原子间都以σ键结合。
B。
S6、S8分子中所有S原子都发生了sp3杂化。
C。
S6和S8互为同位素。
D。
熔点的高低:S8>S6>S4.8.下列实验能达到目的的是()A。
实验室制Fe(OH)2.B。
实验室制氨气。
C。
检验装置气密性。
D。
验证浓H2SO4的脱水性、强氧化性。
2020年高考化学【真题母题解密】物质结构与性质综合题(山东卷)(解析版)

『高考真题·母题解密』『分项汇编·逐一击破』专题11 物质结构与性质综合题【母题来源】2020年高考山东卷第17题【母题题文】CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。
常温常压下SnCl4为无色液体,SnCl4空间构型为,其固体的晶体类型为。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为(填化学式,下同),还原性由强到弱的顺序为,键角由大到小的顺序为。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。
一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有mol,该螯合物中N的杂化方式有种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。
四方晶系CdSnAs2的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标x y z原子Cd000Sn000.5As0.250.250.125一个晶胞中有 个Sn ,找出距离Cd(0,0,0)最近的Sn(用分数坐标表示)。
CdSnAs 2晶体中与单个Sn 键合的As 有 个。
【答案】(1)正四面体形;分子晶体(2)NH 3、AsH 3、PH 3;AsH 3、PH 3、NH 3;NH 3、PH 3、AsH 3(3)6;1(4)4;(0.5,0,0.25)、(0.5,0.5,0);4【试题解析】【分析】(1)利用价层电子对数确定SnCl 4的分子构型;由于常温下SnCl 4为液体,故SnCl 4为分子晶体;(2)结构相似的分子,相对分子质量越大物质的熔沸点越高,另外分子间能形成氢键的物质,熔沸点则较高,键角的大小取决于中心原子的杂化类型、孤电子对数、成键电子对与成键电子对之间的斥力大小;(3)由该物质的结构简式可知,螯合作用配位成环,故1个该配合物中通过螯合作用形成的配位键有6个,Cd—NO 2那个不算;该螯合物中N 原子的杂化方式为sp 2杂化;(4)结合部分原子的分数坐标,结合晶胞结构图,确定各原子在晶胞中位置,找出相应原子。
2020年全国新高考Ⅰ卷(山东卷)化学试题解析

2020年普通高中学业水平等级性考试化学试卷(全国新高考Ⅰ卷)一、单选题1.实验室中下列做法错误的是( ) A.用冷水贮存白磷B.用浓硫酸干燥二氧化硫C.用酒精灯直接加热蒸发皿D.用二氧化碳灭火器扑灭金属钾的燃烧【答案】D【解析】白磷着火点比较低,为防止其自燃,通常将其贮存在冷水中,A 项正确;浓硫酸具有吸水性,且不与2SO 反应,可用于干燥2SO ,B 项正确;蒸发皿可直接用酒精灯加热,C 项正确;金属钾燃烧生成的22K O 、2KO 等产物均能和2CO 反应并放出2O ,2O 又能促进金属钾的燃烧,因此不能用二氧化碳灭火器扑灭佥属钾的燃烧,可直接用于燥的沙土盖灭,D 项错误。
2.下列叙述不涉及氧化还原反应的是( ) A.谷物发酵酿造食醋 B.小苏打用作食品膨松剂 C.含氯消毒剂用于环境消毒 D.大气中2NO 参与酸雨形成【答案】B【解析】谷物发酵酿造食醋过程中32CH CH OH 转化为3CH COOH 属于氧化还原反应,A 项不符合题意;小苏打用作食品膨松剂利用的是3NaHCO 受热分解会放出2CO 的性质,不涉及氧化还原反应,B 项符合题意;含氯消毒剂具有较强的氧化性,消毒时发生氧化还原反应,C 项不符合题意;大气中的2NO 形成酸雨时发生反应2233NO H O 2HNO NO +===+,该反应属于氧化还原反应,D 项不符合题意。
3.短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,基态X 原子的电子总数是其最高能级电子数的2倍,Z 可与X 形成淡黄色化合物22Z X ,Y 、W 最外层电子数相同。
下列说法正确的是( ) A.第一电离能:W>X>Y>Z B.简单离子的还原性:Y>X>W C.简单离子的半径:W>X>Y>Z D.氢化物水溶液的酸性:Y>W 【答案】C【解析】根据第一电离能递变规律,可知其相对大小顺序为:F>O>Cl> Na ,A 项错误;根据非金属性:F>O>Cl ,可知简单离子的还原性:2Cl F O --->>,B 项错误;根据离子半径的变化规律,可知简单离子半径:2F Cl O Na ---+>>>,C 项正确;氢化物水溶液的酸性:HF<HCl ,D 项错误。
2020年高考化学试卷-(Ⅱ卷及答案)
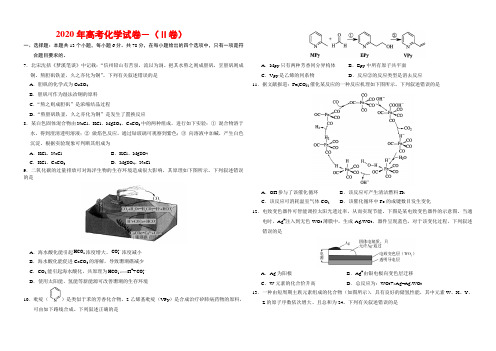
2020年高考化学试卷-(Ⅱ卷)一、选择题:本题共13个小题,每小题6分。
共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。
挹其水熬之则成胆矾,烹胆矾则成铜。
熬胆矾铁釜,久之亦化为铜”。
下列有关叙述错误的是 A .胆矾的化学式为CuSO 4 B .胆矾可作为湿法冶铜的原料 C .“熬之则成胆矾”是浓缩结晶过程D .“熬胆矾铁釜,久之亦化为铜”是发生了置换反应8.某白色固体混合物由NaCl 、KCl 、MgSO 4、CaCO 3中的两种组成,进行如下实验:① 混合物溶于水,得到澄清透明溶液;② 做焰色反应,通过钴玻璃可观察到紫色;③ 向溶液中加碱,产生白色沉淀。
根据实验现象可判断其组成为 A .KCl 、NaClB .KCl 、MgSO 4C .KCl 、CaCO 3D .MgSO 4、NaCl9.二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。
下列叙述错误的是A .海水酸化能引起3HCO -浓度增大、23CO -浓度减小B .海水酸化能促进CaCO 3的溶解,导致珊瑚礁减少C .CO 2能引起海水酸化,共原理为3HCO-H ++23CO -D .使用太阳能、氢能等新能源可改善珊瑚的生存环境10.吡啶()是类似于苯的芳香化合物,2-乙烯基吡啶(VPy )是合成治疗矽肺病药物的原料,可由如下路线合成。
下列叙述正确的是A .Mpy 只有两种芳香同分异构体B .Epy 中所有原子共平面C .Vpy 是乙烯的同系物D .反应②的反应类型是消去反应11.据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。
下列叙述错误的是A .OH -参与了该催化循环B .该反应可产生清洁燃料H 2C .该反应可消耗温室气体CO 2D .该催化循环中Fe 的成键数目发生变化12.电致变色器件可智能调控太阳光透过率,从而实现节能。
2020年新高考全国卷Ⅰ化学(山东)高考真题

山东省2020年普通高中学业水平等级考试化学可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 Fe 56一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题目要求。
1.实验室中下列做法错误的是A.用冷水贮存白磷B.用浓硫酸干燥二氧化硫C.用酒精灯直接加热蒸发皿D.用二氧化碳灭火器扑灭金属钾的燃烧2.下列叙述不涉及氧化还原反应的是A.谷物发酵酿造食醋B.小苏打用作食品膨松剂C.含氯消毒剂用于环境消毒D.大气中NO2参与酸雨形成3.短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。
下列说法正确的是A.第一电离能:W>X>Y>Z B.简单离子的还原性:Y>X>WC.简单离子的半径:W>X>Y>Z D.氢化物水溶液的酸性:Y>W4.下列关于C、Si及其化合物结构与性质的论述错误的是A.键能C C>Si Si——,因此C2H6稳定性大于Si2H6——、C H>Si HB.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-p π键5.利用下列装置(夹持装置略)进行实验,能达到实验目的的是A.用甲装置制备并收集CO2B.用乙装置制备溴苯并验证有HBr产生C.用丙装置制备无水MgCl2D.用丁装置在铁上镀铜6.从中草药中提取的calebin A(结构简式如下)可用于治疗阿尔茨海默症。
下列关于calebin A的说法错误的是A .可与FeCl 3溶液发生显色反应B .其酸性水解的产物均可与Na 2CO 3溶液反应C .苯环上氢原子发生氯代时,一氯代物有6种D .1mol 该分子最多与8molH 2发生加成反应7.B 3N 3H 6(无机苯)的结构与苯类似,也有大π键。
2020年高考化学化学山东卷试题及解析
山东省2020年普通高中学业水平等级考试化 学可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 Fe 56一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题目要求。
1.实验室中下列做法错误的是A .用冷水贮存白磷B .用浓硫酸干燥二氧化硫C .用酒精灯直接加热蒸发皿D .用二氧化碳灭火器扑灭金属钾的燃烧 2.下列叙述不涉及氧化还原反应的是 A .谷物发酵酿造食醋 B .小苏打用作食品膨松剂 C .含氯消毒剂用于环境消毒 D .大气中NO 2参与酸雨形成3.短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,基态X 原子的电子总数是其最高能级电子数的2倍,Z 可与X 形成淡黄色化合物Z 2X 2,Y 、W 最外层电子数相同。
下列说法正确的是 A .第一电离能:W>X>Y>Z B .简单离子的还原性:Y>X>W C .简单离子的半径:W>X>Y>Z D .氢化物水溶液的酸性:Y>W 4.下列关于C 、Si 及其化合物结构与性质的论述错误的是A .键能C C>Si Si ——、C H>Si H ——,因此C 2H 6稳定性大于Si 2H 6B .立方型SiC 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度 C .SiH 4中Si 的化合价为+4,CH 4中C 的化合价为-4,因此SiH 4还原性小于CH 4D .Si 原子间难形成双键而C 原子间可以,是因为Si 的原子半径大于C ,难形成p-p π键 5.利用下列装置(夹持装置略)进行实验,能达到实验目的的是A .用甲装置制备并收集CO 2B .用乙装置制备溴苯并验证有HBr 产生C .用丙装置制备无水MgCl 2D .用丁装置在铁上镀铜6.从中草药中提取的 calebin A (结构简式如下)可用于治疗阿尔茨海默症。
2020年山东省新高考化学试题及答案

机密*启用前山东省2020年普通高中学业水平等级考试化学注意事项:l .答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位罣。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮掠干净后,再选涂其他答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质盎:H 1 C 12 0 16 Na 23 Cl 35.5 Fe 56一、选择题:本题共IO 小题,每小题2分,共20分。
每小题只有一个选项符合题目要求。
1.实验室中下列做法错误的是A.用冷水贮存白磷C.用酒精灯直接加热蒸发Jl ll2.下列叙述不涉及氧化还原反应的是A.谷物发酵酿造食醋B.小苏打用作食品膨松剂C.含氯消毒剂用于环境消毒D.大气中N02参与酸雨形成3.短周期主族元素X、Y 、Z、W的原子序数依次增大,基态X原子的电子总数是其最商能级电子数的2倍,Z可与X形成淡黄色化合物Z 2X 2,y、W最外层电子数相同。
下列说法正确的是A.第一电离能:W>X >Y>ZC.简单离子的半径:W>X >Y>Z B.用浓硫酸千燥二氧化硫D.用二氧化碳灭火器扑灭金屈钾的燃烧B.简单离子的还原性:Y>X>W D.氢化物水溶液的酸性:Y >W4.下列关于C、Si及其化合物结构与性质的论述错误的是A.键能C-C>Si —Si 、C —H>Si —H,因此C 2比稳定性大于Si2H 6B .立方型SiC 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度C.Si比中Si的化合价为+4,C几中C的化合价为-4,因此Si H 还原性小于CH 4D. Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C ,难形成p-p兀键化学试题第1页(共8页)。
2020年高考化学化学全国Ⅰ卷试题及解析

2020年普通高等学校招生全国统一考试化学(全国卷Ⅰ)试题可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 P 31 S 32 Cl 35.5 V 51 Fe 56一、选择题:本题共13个小题,每小题6分。
共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH 3COOOH)、氯仿等均可有效灭活病毒。
对于上述化学药品,下列说法错误的是A .CH 3CH 2OH 能与水互溶B .NaClO 通过氧化灭活病毒C .过氧乙酸相对分子质量为76D .氯仿的化学名称是四氯化碳 8.紫花前胡醇可从中药材当归和白芷中提取得到,能提高人体免疫力。
有关该化合物,下列叙述错误的是A .分子式为C 14H 14O 4B .不能使酸性重铬酸钾溶液变色C .能够发生水解反应D .能够发生消去反应生成双键9.下列气体去除杂质的方法中,不能实现目的的是10.铑的配合物离子[Rh(CO)2I 2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是A .CH 3COI 是反应中间体B .甲醇羰基化反应为CH 3OH+CO=CH 3CO 2HC .反应过程中Rh 的成键数目保持不变D .存在反应CH 3OH+HI=CH 3I+H 2O11.1934年约里奥–居里夫妇在核反应中用α粒子(即氦核42He )轰击金属原子W Z X ,得到核素30Z+2Y ,开创了人造放射性核素的先河: W Z X +42He →30Z+2Y +10n其中元素X 、Y 的最外层电子数之和为8。
下列叙述正确的是 气体(杂质) 方法 A SO 2(H 2S ) 通过酸性高锰酸钾溶液 B Cl 2(HCl ) 通过饱和的食盐水 C N 2(O 2) 通过灼热的铜丝网 D NO (NO 2) 通过氢氧化钠溶液A .W Z X 的相对原子质量为26B .X 、Y 均可形成三氯化物C .X 的原子半径小于Y 的D .Y 仅有一种含氧酸12.科学家近年发明了一种新型Zn −CO 2水介质电池。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
12020年山东省化学高考试题一、单选题(每小题2分,共20分)1.实验室中下列做法错误的是A .用冷水贮存白磷B .用浓硫酸干燥二氧化硫C .用酒精灯直接加热蒸发皿D .用二氧化碳灭火器扑灭金属钾的燃烧2.下列叙述不涉及氧化还原反应的是A .谷物发酵酿造食醋B .小苏打用作食品膨松剂C .含氯消毒剂用于环境消毒D .大气中NO 2参与酸雨形成 3.短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,基态X 原子的电子总数是其最高能级电子数的2倍,Z 可与X 形成淡黄色化合物Z 2X 2,Y 、W 最外层电子数相同。
下列说法正确的是A .第一电离能:W>X>Y>ZB .简单离子的还原性:Y>X>WC .简单离子的半径:W>X>Y>ZD .氢化物水溶液的酸性:Y>W4.下列关于C 、Si 及其化合物结构与性质的论述错误的是A .键能C C>Si Si —— 、C H>Si H —— ,因此C 2H 6稳定性大于Si 2H 6B .立方型SiC 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度C .SiH 4中Si 的化合价为+4,CH 4中C 的化合价为-4,因此SiH 4还原性小于CH 4D .Si 原子间难形成双键而C 原子间可以,是因为Si 的原子半径大于C ,难形成p p π— 键5.利用下列装置(夹持装置略)进行实验,能达到实验目的的是A.用甲装置制备并收集CO2B.用乙装置制备溴苯并验证有HBr产生C.用丙装置制备无水MgCl2D.用丁装置在铁上镀铜6.从中草药中提取的calebin A(结构简式如下)可用于治疗阿尔茨海默症。
下列关于calebin A的说法错误的是A.可与FeCl3溶液发生显色反应B.其酸性水解的产物均可与Na2CO3溶液反应C.苯环上氢原子发生氯代时,一氯代物有6种D.1mol该分子最多与8molH2发生加成反应7.B3N3H6(无机苯)的结构与苯类似,也有大π键。
下列关于B3N3H6的说法错误的是A.其熔点主要取决于所含化学键的键能B.形成大π键的电子全部由N提供C.分子中B和N的杂化方式相同D.分子中所有原子共平面8.实验室分离Fe3+和Al3+的流程如下:3知Fe 3+在浓盐酸中生成黄色配离子(FeCl 4),该配离子在乙醚(Et 2O ,沸点34.6℃)中生成缔合物+-24Et O H FeCl ﹒﹒[] 。
下列说法错误的是A .萃取振荡时,分液漏斗下口应倾斜向下B .分液时,应先将下层液体由分液漏斗下口放出C .分液后水相为无色,说明已达到分离目的D .蒸馏时选用直形冷凝管9.以菱镁矿(主要成分为MgCO 3,含少量SiO 2,Fe 2O 3和A12O 3)为原料制备高纯镁砂的工艺流程如下:已知浸出时产生的废渣中有SO 2,Fe(OH)3和Al(OH)3。
下列说法错误的是A .浸出镁的反应为4232MgO+2NH Cl=MgCl +2NH +H OB .浸出和沉镁的操作均应在较高温度下进行C .流程中可循环使用的物质有NH 3、NH 4ClD .分离Mg 2+与Al 3+、Fe 3+是利用了它们氢氧化物K sp 的不同10.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。
现以NaCl 溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含 CH 3COO -的溶液为例)。
下列说法错误的是A .负极反应为 -+-322CH COO +2H O-8e =2CO +7HB .隔膜1为阳离子交换膜,隔膜2为阴离子交换膜C .当电路中转移1mol 电子时,模拟海水理论上除盐58.5gD .电池工作一段时间后,正、负极产生气体的物质的量之比为2:111.α-氰基丙烯酸异丁酯可用作医用胶,其结构简式如下。
下列关于α-氰基丙烯酸异丁酯的说法错误的是A .其分子式为 C 8H 11NO 2B .分子中的碳原子有3种杂化方式C .分子中可能共平面的碳原子最多为6个D .其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子12.采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图所示。
忽略温度变化的影响,下列说法错误的是A .阳极反应为222H O 4e 4H O -+-=+↑B .电解一段时间后,阳极室的pH 未变C .电解过程中,H +由a 极区向b 极区迁移D .电解一段时间后,a 极生成的O 2与b 极反应的O 2等量二、多选题(每小题4纷纷,共20分)13.下列操作不能达到实验目的的是A.A B.B C.C D.D14.1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子();第二步Br -进攻碳正离子完成1,2-加成或1,4-加成。
反应进程中的能量变化如下图所示。
已知在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。
下列说法正确的是5A .1,4-加成产物比1,2-加成产物稳定B .与0℃相比,40℃时1,3-丁二烯的转化率增大C .从0℃升至40℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小D .从0℃升至40℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度 15.25℃时,某混合溶液中()()133CH COOH CH COO 0.1mol L c c --+=⋅,1gc( CH 3COOH)、1gc(CH 3COO -)、lgc(H +)和1gc(OH -)随pH 变化的关系如下图所示。
K a 为CH 3COOH 的电离常数,下列说法正确的是A .O 点时,()()33CH COOH CH COOc c -=B .N 点时,a pH=-lgKC .该体系中,()()()+-13+a 0.1c H c CH COOH =mol L K +c H ⋅ D .pH 由7到14的变化过程中, CH 3COO -的水解程度始终增大三、推断题(共60分)16.(12分)化合物F 是合成吲哚-2-酮类药物的一种中间体,其合成路线如下:+3H O A B −−−→①醇钠② ()-3OH ΔH O −−−−→①,②7知:Ⅰ.+3H O −−−→①醇钠②Ⅰ. 2SOCl ∆−−−→ ,2R NH −−−→Ⅰ. 2+33/NH (l)NaNH H O −−−−−−→①②Ar 为芳基;X=Cl ,Br ;Z 或Z ′=COR , CONHR ,COOR 等。
回答下列问题:(1)实验室制备A 的化学方程式为___________,提高A 产率的方法是______________;A 的某同分异构体只有一种化学环境的碳原子,其结构简式为_______________。
(2)C →D 的反应类型为____________;E 中含氧官能团的名称为____________。
(3)C 的结构简式为____________,F 的结构简式为____________。
(4)Br 2和的反应与Br 2和苯酚的反应类似,以和为原料合成,写出能获得更多目标产物的较优合成路线(其它试剂任选)________。
四、工业流程17.(12分)用软锰矿(主要成分为MnO 2,含少量Fe 3O 4、Al 2O 3)和BaS 制备高纯MnCO 3的工艺流程如下:已知:MnO 2是一种两性氧化物;25℃时相关物质的K sp 见下表。
回答下列问题(1)软锰矿预先粉碎的目的是____________,MnO 2与BaS 溶液反应转化为MnO 的化学方程式为________。
(2)保持BaS 投料量不变,随MnO 2与BaS 投料比增大,S 的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是________。
(3)滤液I 可循环使用,应当将其导入到________操作中(填操作单元的名称)。
(4)净化时需先加入的试剂X 为________(填化学式)。
再使用氨水调溶液的pH ,则pH 的理论最小值为_______(当溶液中某离子浓度511.010mol L c --⨯⋅时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为______________________。
五、综合题18.(12分)CdSnAs 2是一种高迁移率的新型热电材料,回答下列问题:(1)Sn 为ⅣA 族元素,单质Sn 与干燥Cl 2反应生成SnCl 4。
常温常压下SnCl 4为无色液体,SnCl4空间构型为_____________,其固体的晶体类型为_____________。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为_____________(填化学式,下同),还原性由强到弱的顺序为____________,键角由大到小的顺序为_____________。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。
一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有_________mol,该螯合物中N的杂化方式有__________种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。
四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
9一个晶胞中有_________个Sn ,找出距离Cd(0,0,0)最近的Sn_________(用分数坐标表示)。
CdSnAs 2晶体中与单个Sn 键合的As 有___________个。
19.(12分)探究CH 3OH 合成反应化学平衡的影响因素,有利于提高CH 3OH 的产率。
以CO 2、H 2为原料合成CH 3OH 涉及的主要反应如下:Ⅰ. 2232CO (g)3H (g)CH OH(g)H O(g)++ 1149.5kJ mol H -∆=-⋅Ⅰ. 23CO(g)2H (g)CH OH(g)+ 1290.4kJ mol H -∆=-⋅ Ⅰ. 222CO (g)H (g)CO(g)H O(g)++ 3H ∆回答下列问题: (1)3Δ=H _________1kJ mol -⋅。
(2)一定条件下,向体积为VL 的恒容密闭容器中通入1 mol CO 2和3 mol H 2发生上述反应,达到平衡时,容器中CH 3OH(g)为ɑ mol ,CO 为b mol ,此时H 2O(g)的浓度为__________mol ﹒L -1(用含a 、b 、V 的代数式表示,下同),反应Ⅰ的平衡常数为___________。
(3)不同压强下,按照n(CO 2):n(H 2)=1:3投料,实验测定CO 2的平衡转化率和CH 3OH 的平衡产率随温度的变化关系如下图所示。
