第六讲,离子浓度大小比较
离子浓度比较

NH+H2O NH3·H2O+H+ Mg+2H+===Mg2++H2↑
③多元弱酸溶液,根据多步电离分析,如在 H3PO4 的溶液中: + - - 2- c(H )>c(H2PO4 )>c(HPO4 )>c(PO3 ) 4 (2)不同溶液中同一离子浓度的比较, 要看溶液中其他离子对其影响 的因素。 (3)混合溶液中各离子浓度比较,根据电离程度、水解程度的相对大 小综合分析。 ①分子的电离程度大于对应离子的水解程度 在 0.1 mol· - 1NH4Cl 和 0.1 mol· - 1 的氨水混合溶液中:由于 L L NH3· 2O 的电离程度大于 NH+的水解程度,导致溶液呈碱性。溶 H 4 液中各离子浓度的大小顺序为:c(NH+)> 4 - - + c(Cl )>c(OH )>c(H ) 。 常 见 的 还 有 一 组 : CH3COOH 与 CH3COONa。 ②分子的电离程度大于对应离子的水解程度 -1 -1 在 0.1 mol· 的 HCN 和 0.1 mol· 的 NaCN 混合溶液中:由于 L L HCN 的电离程度小于 CN-的水解程度,导致溶液呈碱性。溶液中 + - - + 各离子浓度的大小顺序为:c(Na )>c(CN )>c(OH )>c(H )。
答案:D
- + + - - + - - +
(1)已知 25℃时 0.1 mol/L 醋酸溶液的 pH 约为 3,向其中加入醋酸钠晶体,等晶体溶解 后发现溶液的 pH 增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱 性,增大了 c(OH ),因而溶液的 pH 增大;乙同学认为醋酸钠溶于水电离出大量醋酸 根离子,抑制了醋酸的电离,使 c(H )减小,因此溶液的 pH 增大。 ①上述两种解释中________(填“甲”或“乙”)正确。 ②为了验证上述哪种解释正确,继续做如下实验:向 0.1 mol/L 的醋酸溶液中加入少量 下列物质中的________(填写编号),然后测定溶液的 pH。 A.固体 CH3COOK B.固体 CH3COONH4 C.气体 NH3 D.固体 NaHCO3 ③若________(填“甲”或“乙”)的解释正确, 溶液的 pH 应________(填“增大”“减 小”或“不变”)。(已知 25℃时 CH3COONH4 溶液呈中性) (2)有甲、乙两同学做了如下实验:甲同学在制得的 Mg(OH) 2 沉淀中加入浓的 NH4Cl 溶液,结果沉淀溶解;乙同学在制得的 Mg(OH)2 沉淀中加入浓 CH3COONH4 溶液,结 果沉淀也完全溶解。对此甲、乙两同学用学过的有关知识各自解释了上述实验事实:
离子浓度大小的比较方法及规律

离子浓度大小比较的方法和规律一、离子浓度大小比较的方法和规律1、紧抓住两个“微弱”:a 弱电解质的电离是微弱的 b 弱根离子的水解是微弱的。
2、酸式酸根离子既能电离又能水解,若电离能力大于水解能力则酸式盐溶液呈酸性,否则呈碱性。
常见呈酸性的是H2PO42-、、HSO3-对应的可溶盐的溶液。
3、不同溶液中同一离子浓度大小的比较,要看溶液中其它离子对其产生的影响。
如在相同物质的量浓度的下列溶液中:①NHCI②NHHSO③CHCOON④NH?HO。
c (NH+)由大到小的顺序为②〉①'③〉④4、混合溶液中离子浓度大小的比较,首先要分析混合过程中是否发生化学反应,若发生反应,则要进行过量判断(注意混合后溶液体积的变化);然后再结合电离、水解等因素进行分析。
5、对于等体积、等物质的量浓度的NaX和弱酸HX混合求各微粒的浓度关系题,要由混合后溶液的PH大小判断电离和水解的关系。
常见的CHCOO与CHCOON等体积、等物质的量浓度混合、NH?HO与NH4CI 等体积、等物质的量浓度的混合都是电离大于水解。
6、三个重要的守恒关系①电荷守恒电解质溶液中,无论存在多少种离子,溶液总呈电中性,即阳离子所带的正电荷总数一定等于阴离子所带的负电荷总数。
如NaCQ溶液:c (Nh) + c( H) =cC( HCO) +2c( CO2')+c( OH) ② 物料守恒如NaCQ溶液,虽C&-水解生成HCO, HCO进一步水解成HCQ,但溶液中n (Nsj) : n (C) = 2:1 ,所以有如下关系:c (N6) =2{c( HCQ-)+c( CQ 32-)+c( H 2CQ)}③质子守恒即水电离出的QH的量始终等于水电离出的H+的量。
如NaCQ 溶液,水电离出的H—部分与CG2-结合成HCQ,—部分与CG2- 结合成H2CQ, —部分剩余在溶液中,根据c (^)水=c (QH)水,有如下关系:c (QH)= c( HCQJ+ 2c(H 2C0+ c (H+)二、技巧1、在解题过程中,若看到选项中有“ =”,则要考虑3 个守恒关系:2、若守恒关系中只有离子,则考虑电荷守恒关系,若守恒关系中同时出现分子和离子,则考虑物料守恒和质子守恒;3、若选项中离子浓度关系以“ >”连接,则主要考虑弱电解质的电离、弱根离子的水解以及各离子之间的相互影响等。
离子浓度大小的比较

三.离子浓度大小比较的题型 1.单一溶质溶液中离子浓度大小关系:
A、酸溶液或碱溶液 (1)H2SO3溶液中,各离子浓度大小关系为 。
H+>HSO3—>Байду номын сангаасO32—>OH— (2)在0.1 mol/L的NH3·H2O溶液中,NH3·H2O、 NH4+、 OH-、 H+的浓度由大到小的顺序是
C(NH3·H2O)>C(OH-)>C(NH4+)>C(H+)
BD 4ABDC.、、、在、ccc0c(((.(NNN1Naaama++++o))))+> =l=·Lcccc-(((1(HHH的H+CCCN)OO=Oa33H3c--))-()C>+H>OCccc3((O(溶HHO3+2液-HC))+>-O中)>cc3)(,(+OcO(下HHHc(-+-列C)))+O关232c系-()C式O正32-确) 的是:
3.物料守恒: 电解质溶液中由于电离或水解因素,离子会发
生变化变成其它离子或分子等,但离子或分子中某 种特定元素的原子的总数是不会改变的。
如NaHCO3溶液中 c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3)
4.质子守恒: 例如在Na2CO3溶液中
c(OH—)=c(H+)+2c(H2CO3)+c(HCO3-)
2.把0.02 mol·L-1 HAc溶液与0.01 mol·L-1NaOH溶液等体 积混合,则混合液中微粒浓度关系正确的是( A D) A、c(Ac-)>c(Na+) B、c(HAc)>c(Ac-) C、2c(H+)=c(Ac-)-c(HAc) D、c(HAc)+c(Ac-)=0.01 mol·L-1
专题六___离子浓度大小比较(教师版)

专题六离子浓度大小比较考纲解读:1、它能掌握强弱电解质、电离平衡、水的电离、溶液的pH、离子反应、盐类水解等基本概念。
2、掌握程度及对这些知识的综合运用能力。
知识精讲:一、掌握有关知识要点1、弱电解质的电离2、水的电离3、盐类水解二、理解四种守恒关系以0.1mol/LNa2CO3溶液为例,分析在存在的反应有(写离子方程式)存在的离子有:。
1、电荷守恒:。
2、物料守恒:考虑水解前后C元素守恒,。
3、质子守恒:由水电离出的c(H+)水=c(OH―)水。
得质子守恒关系为:专练1、NaHCO3 溶液中存在如下关系:电荷守恒:物料守恒:质子守恒:专练2、NaHS溶液中存在如下关系:电荷守恒:物料守恒:质子守恒:专练3、Na2S溶液中存在如下关系:电荷守恒:物料守恒:质子守恒:专练4、写出CH3COONa溶液中三个守恒关系式电荷守恒:物料守恒:质子守恒:专练5、写出Na 2SO3溶液中三个守恒关系式电荷守恒:物料守恒:质子守恒:]三、考虑两个特定的组合:(1)当C(NH4Cl)≤C(NH3·H2O)、C(NaAC)≤C(HAC)时,电离大于水解,水解忽略不计。
(2)电离大于水解的NaHSO3(3)水解大于电离的NaHCO3四、分析思路:典型例题类型:一、单一溶液离子浓度比较:例1:在0.1 mol/l的CH3COOH溶液中,下列关系正确的是()A.C(CH3COOH)>C(H+)>C(CH3COO-)>C(OH-)B.C(CH3COOH)>C(CH3COO-)>C(H+)>C(OH-)C.C(CH3COOH)>C(CH3COO-)=C(H+)>C(OH-)D.C(CH3COOH)>C(CH3COO-)>C(OH-)>C(H+)例2:在氯化铵溶液中,下列关系正确的是()A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)C.c(NH4+)=c(Cl-)>c(H+)=c(OH-)D.c(Cl-)=c(NH4+)>c(H+)>c(OH-)例3:在0.1 mol·L-1的NaHCO3溶液中,下列关系式正确的是()A.c(Na+)>c(HCO3-)>c(H+)>c(OH-) B.c(Na+)+c[H+]=c(HCO3-)+c(OH-)+2c(CO32-)C.c(Na+)=c(HCO3-)>c(OH-)>c(H+) D.c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)例4、在0.1mol/L的Na2CO3溶液中,pH=12,离子浓度从大到小的顺序是:水电离出的[OH-]= ,写出电荷守恒的式子:,写出物料守恒的式子:,写出体现水电离出氢离子和氢氧根离子浓度相等的式子:。
离子浓度大小比较
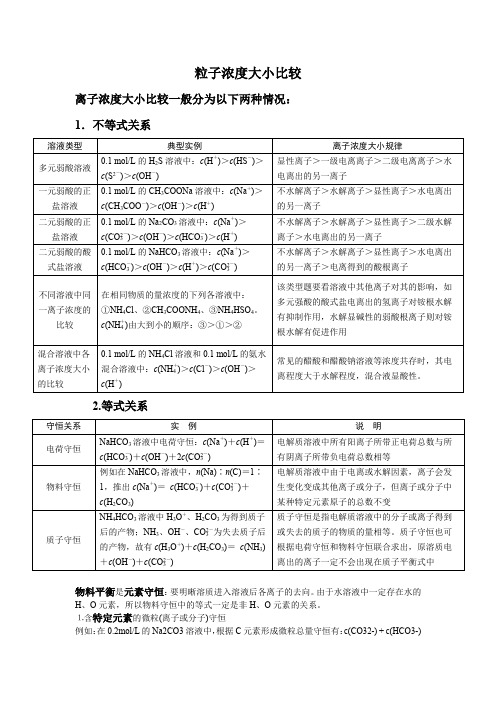
粒子浓度大小比较离子浓度大小比较一般分为以下两种情况:1.不等式关系2.等式关系物料平衡是元素守恒:要明晰溶质进入溶液后各离子的去向。
由于水溶液中一定存在水的H、O元素,所以物料守恒中的等式一定是非H、O元素的关系。
⒈含特定元素的微粒(离子或分子)守恒例如:在0.2mol/L的Na2CO3溶液中,根据C元素形成微粒总量守恒有:c(CO32-) + c(HCO3-)+ c(H2CO3) = 0.2mol/L。
⒉不同元素间形成的特定微粒比守恒例如:在Na2CO3 溶液中,根据Na与C形成微粒的关系有:c(Na+) = 2[c(CO32- ) + c(HCO3- ) + c(H2CO3 )]分析:上述Na2CO3 溶液中,C原子守恒,n(Na) : n(C)恒为2:13.混合溶液中弱电解质及其对应离子总量守恒例如:相同浓度的HAc溶液与NaAc溶液等体积混合后,混合溶液中有:2c(Na+ )=c(Ac-)+c(HAc)分析:上述混合溶液中,虽存在Ac-的水解和HAc的电离,但也仅是Ac-和HAc两种微粒间的转化,其总量不变。
质子守恒规律:水电离的特征是c(H)=c(OH-),只不过有些会水解的盐会导致氢离子、氢氧根可能会有不同的去向,我们需要把它们的去向全部找出来。
例如:NaHCO3溶液,初始H+ 来源于HCO3- 和H2O的电离,c初(H+) = c(CO32- ) + c(OH- );伴随着的水解的发生,一部分H+转化到H2CO3中,因此,c初(H+) = c现(H+) + c(H2CO3 ),从而得出,溶液中离子浓度的关系如下:c(CO32- ) + c(OH- ) = c(H+) +c(H2CO3 )对同一溶液来说:质子守恒=电荷守恒-物料平衡快速书写质子守恒的方法第一步:确定溶液的酸碱性,溶液显酸性,把氢离子浓度写在左边,反之则把氢氧根离子浓度写在左边。
第二步:根据溶液能电离出的离子和溶液中存在的离子,来补全等式右边。
微专题——离子浓度大小比较(教师版)

微专题——离子浓度大小比较知识点一:溶液中的三种守恒:以Na2S和NaHS溶液为例:1、电荷守恒:Na2S水溶液:[Na+]+[H+]=2[S2-]+[HS-]+[OH-]NaHS水溶液:[Na+]+[H+]=2[S2-]+[HS-]+[OH-]意义:溶液呈电中性,因此阴阳离子所带正负电荷总数相等。
写法:将溶液中所有阳离子浓度相加,等于溶液中所有阴离子浓度相加,其中每个离子浓度前的系数等于其所带电荷电量的绝对值。
特点:电荷守恒式只与溶液中离子种类相关,与浓度无关。
2、物料守恒:Na2S水溶液:[Na+]=2([S2-]+[HS-]+[H2S])NaHS水溶液:[Na+]=[S2-]+[HS-]+[H2S]意义:加入的物质中各种原子进入溶液后只是存在形态发生的改变,但数目守恒。
写法:观察加入的物质中非H、O元素的原子比例,将溶液中某原子的所有存在微粒浓度相加表示该原子的总浓度,再根据原加入物质中原子数目之比配平系数。
特点:不能以H、O原子书写物料守恒,因为水中有大量的H、O原子。
3、质子守恒:Na2S水溶液:[OH-]=[HS-]+2[H2S]+[H+]NaHS水溶液:[OH-]+[S2-]=[H2S]+[H+]意义:溶液中各微粒得质子(即H+)总数等于失去的质子总数。
写法:①将电荷守恒与物料守恒联立,约去[Na+]即可得到质子守恒式。
②将溶液中得到质子后形成的微粒浓度乘以得到质子的数目再相加,相当于于得质子总数;所有失去质子后得到的微粒浓度乘以失去的质子数再相加,相当于失去的质子总数;二者相等即可。
物理意义写法:(Na2S为例)得到的质子总数=n(HS -)+2n(H 2S)+n(H +),失去的质子数=n(OH -),二者相等。
再除以溶液体积即可得到质子守恒式知识点二:溶液中离子的浓度大小比较:1、弱酸溶液:0.1mol/L 的HAc 溶液中离子浓度由大到小的排列顺序是:([HAc] >)[H +] >[Ac -] >[OH -]0.1mol/L 的H 2S 溶液中离子浓度由大到小的排列顺序是:([H 2S] >)[H +] >[HS -] >[OH -]>[S 2-](说明:H 2S 的二级电离常数太小,导致[OH -]>[S 2-],如果是碳酸,则是[CO 32-]>[OH -])2、一元弱酸的正盐溶液:0.1mol/L 的CH 3COONa 溶液中离子浓度由大到小的排列顺序是:[Na +] >[Ac -] >[OH -]>[H +]3、二元弱酸的正盐溶液:0.1mol/L 的Na 2CO 3溶液中离子浓度由大到小的排列顺序是:[Na +]>[CO 32-]>[OH -]>[HCO 3-](>[H 2CO 3])>[H +](一步水解后产生等量OH -和HCO 3-,但后者还要水解,浓度会减小,故[OH -]>[HCO 3-],溶液碱性,[H +]最小) (关于碳酸与氢离子浓度大小比较可以由1323[][][]k H HCO H CO +-=进行讨论,常温下k 1数量级是10-7,而[HCO 3-]接近[OH -],一般大于这个值,因此整个分数小于1,故[H 2CO 3])>[H +])4、二元弱酸的酸式盐溶液:0.1mol/L 的NaHCO 3溶液中离子浓度由大到小的排列顺序是:[Na +]>[HCO 3-]>[OH -](>[H 2CO 3])>[H +]>[CO 32-](水解大于电离,故水解产物(H 2CO 3、OH -)浓度大于电离产物(CO 32-、H +)浓度,水也电离,故[H +]>[CO 32-])0.1mol/L 的NaHSO 3溶液中离子浓度由大到小的排列顺序是:[Na +]>[HSO 3-]>[H +]>[SO 32-] >[OH -](>[H 2SO 3])(电离大于水解,因此电离产物(SO 32-与H +)浓度大于水解产物(OH -)浓度,水电离导致,[H 2SO 3]最小)5、常见的混合溶液情况分析:① 混合后若反应,则先弄清反应后溶液中的溶质以及各溶质浓度,计算浓度时不要忘记体积的稀释效果; ② 混合溶液中物料守恒可能等式的一边以具体的浓度出现,要能看出来。
粒子浓度大小比较

(3)强酸弱碱盐溶液: 【例3】在氯化铵溶液中,下列关系正确的是 A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(Cl-)> c(H+) > c(OH-) C. c(NH4+) =c(Cl-)> c(H+) = c(OH-) D.c(Cl-)= c(NH4+) > c(H+) > c(OH-)
“离子浓度大小比较”试题归类解析: 1、单一溶质溶液:根据电离、水解情况分析 (1)弱酸溶液: 【例1】在0.1mol/L的H2S溶液中,下 列关系错误的是 A.c(H+)=c(HS-)+c(S2-)+c(OH-) B.c(H+)=c(HS-)+2c(S2-)+c(OH-) C.c(H+)>[c(HS-)+c(S2-)+c(OH-)] D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L
2、两种物质恰好完全反应: 【例2】100mL0.1 mol· L-1 醋酸与 50mL0.2 mol· L-1 NaOH溶液混合,在所 得溶液中 A、[Na+]>[CH3COO-]>[OH-]>[H+] B、[Na+]>[CH3COO-]>[H+]>[OH-] C、[Na+]>[CH3COO-]>[H+]=[OH-] D、[Na+]=[CH3COO-]>[OH-]>[H+]
(5)强碱弱酸的酸式盐溶液: 【例5】草酸是二元弱酸,草酸氢钾溶液呈 酸性0.1mol/LKHC2O4溶液中,下列正确的是 A.c(K+) +c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-) B.c(HC2O4-) + c(C2O42-) =0.1mol/L C.c(C2O42-) >c(H2C2O4) D.c(K+) = c(H2C2O4)+ c(HC2O4-) + c(C2O42-)
离子浓度大小比较教学课件

05 离子浓度比较的应用
CHAPTER
在化学平衡中的应用
总结词
理解化学平衡的移动
详细描述
离子浓度的大小比较在化学平衡中有 着重要的应用。通过比较不同离子浓 度,可以理解化学平衡的移动,从而 更好地掌握化学反应的原理。
在电化学中的应用
总结词
分析电极反应
总结词
pH值对电解质的电离和存在形式有重要影响,通常随着pH值的改变,离子浓度也会发 生变化。
详细描述
在酸性环境中,一些弱酸根离子如碳酸根、碳酸氢根等会转化为更难电离的形式,导致 相应的离子浓度降低。在碱性环境中,一些弱酸根离子如磷酸根、亚磷酸根等会转化为 更易电离的形式,导致相应的离子浓度增加。此外,pH值的变两种:一种是基于实验测定的方法,即通过实验测定 离子的实际浓度,然后进行比较;另一种是理论计算的方法,即根据化学反应的 原理和相关化学常数进行计算。
在比较离子浓度时,需要注意离子的来源和去路,以及溶液中其他组分对离子浓 度的影响。
离子浓度比较的步骤
比较离子浓度的步骤一般包括:收集 相关信息、列出电荷守恒和物料守恒 的方程式、计算离子的浓度、比较离 子的浓度、得出结论。
丰度,计算离子的浓度。
02 离子浓度比较方法
CHAPTER
离子浓度比较的原理
离子浓度比较的原理是电荷守恒和物料守恒。电荷守恒是指 溶液中阳离子所带的正电荷总数等于阴离子所带的负电荷总 数,物料守恒是指溶液中某一组分的原始浓度应该等于它在 溶液中各种存在形式的浓度之和。
离子浓度比较的原理也可以从化学平衡的角度来解释,即在 一定条件下,溶液中的离子会达到平衡状态,平衡状态下离 子的浓度也会保持相对稳定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、两种物质恰好完全反应: [例]等体积等浓度的醋酸与 NaOH溶液相混合,所得溶液中离子浓度由大到小 的顺序是( ) A、c(Na+)>c(Ac-)>c(OH-)>c(H+);B、c(Na+)=c(Ac-)>c(OH-)>c(H+) C、c(Na+)>c(OH-)>c(Ac-)>c(H+);D、c(Na+)>c(OH-)>c(H+)>c(Ac-) 如果一定量的醋酸和氢氧化钠混合后,溶液的pH=7,则各离子浓度的 关系为____________ [练1]在甲酸溶液中加入一定量 NaOH溶液,恰好完全反应,对于生成的溶液,下 列判断一定正确的是( )
质子守恒
练1.常温下0.1摩/升硫酸铜溶液里各离子浓度关系正确的是 A.[OH-]<[Cu2+]<[H+]<[SO42-];B.[OH-]<[H+]<[SO42-]<[Cu2+] C.[OH-]<[H+]<[SO42-]=[Cu2+];D.[OH-]<[H+]<[Cu2+]<[SO42-] 练2.表示0.1摩/ 升的碳酸氢钠溶液中有关微粒浓度的关系正确的是
[例]把0.02 mol· L-1 HAc溶液与0.01 mol· L-1NaOH溶液等体积混合,则混合液中 微粒浓度关系正确的是( ) A、c(Ac-)>c(Na+); B、c(HAc)>c(Ac-); C、2c(H+)=c(Ac-)-c(HAc) D、c(HAc)+c(Ac-)=0.01 mol· L-1
D、c(CH3COO-)+c(OH-)=0.1 mol· L-1
[练1]CH3COOH与CH3COONa等物质的量混合配制成稀溶液,pH值为4.7,下 列说法错误的是( )
A、CH3COOH的电离作用大于CH3COONa的水解作用 B、CH3COONa的水解作用大于CH3COOH的电离作用 C、CH3COOH的存在抑制了CH3COONa的水解 D、CH3COONa的存在抑制了CH3COOH的电离
2. Na2S溶液
以0.1mol/LNa2S溶液为例:
溶液中多量离子: Na+、 S2- 微量离子: OH- 、H+ 、 HS电中性: [Na+]+[H+]=[OH-]+[HS-]+2[S2-] 考虑硫元素水解前后守恒:物料守恒关系: [S2-] +[HS-]+[H2S]=0.1mol/L 考虑钠元素与硫元素的定组成关系:定组成守恒关系: 1/2[Na+]=[S2-]+[HS-]+[H2S] 由水本身电离出的[H+]=[OH-];质子守恒: [OH-]= [H+] +[HS-] +2[H2S] 水解或电离程度不同,使离子间形成的大小关系不同: [Na+] >[S2-]> [OH-]> [HS-]> [H+]
A、c(HCOO-)<c(Na+);B、c(HCOO-)>c(Na+) C、c(OH-)>c(HCOO-);D、c(OH-)<c(HCOO-)
2.把氨水加入盐酸中,当盐酸溶液中的pH=7时,溶液的情况是 A.一水合氨过量 B.盐酸过量 C.氨水与盐酸的物质的量相等 D.[H+]=[OH-]
3、两种物质反应,其中一种有剩余:
考虑电离
弱离子
考虑水解
有反应先考虑反应;然后考虑电解质的电离; 最后考虑盐的水解. 其中氢离 子与氢氧根离子浓度可以从溶液的酸碱性判断其大小。
பைடு நூலகம்
电 解 质 溶 液
单一 溶液
酸或碱溶液
盐溶液 不反应
考虑电离 考虑水解 同时考虑水解和电离
混合 溶液
不过量
反应 过量
单一溶液考虑
同时考虑水解和电离
1.盐类水解的规律
相等,这里OH -全部游离存在,而H +由于水解的原因有三种存在形式,所以根据
物料平衡有: 质子守恒: [OH-]=[H+]+[HCO -]+2[H CO ] 3 2 3 阳离子水解的盐,如三氯化铝溶液,则水电离的H +全游离存在,而OH -由于水解以
OH
-
和Al(OH)
3
两种形式存在.
+
所以:[H
相同实验条件:
正盐>酸式盐
多元弱酸根离子水解:分步水解
2.溶液中离子间水解反应的相互影响
逐级减弱
①相互促进的水解: (NH4)2CO3 ②相互抑制的水解: (NH4)2Fe(SO4)2 3.电解质溶液中粒子之间的三种定量关系 电荷守恒:溶液中阴、阳离子所带的正、负电荷数值相等,电解质溶液呈电中性。 物料守恒:指电解质溶液中某一部分的原始浓度c应等于它在溶液中各种存在形 式的浓度c 之和。 质子守恒:水电离出的c(H+)、c(OH-)离子数相等。 例1: 在碳酸钠溶液中H +与OH -都来自于水的电离,而H +与 OH -的总量应该
B.[A-]>[B+]>[H+]>[OH-] D.[B+]>[A-]>[H+]>[OH-]
V1 mL C1 mol· L-1 ?= ? V2 mL C2 mol· L- 1
6、pH之和等于14的酸和碱溶液的混合: [ 例 ] 将 pH = 3 的盐酸和 pH = 11 的氨水等体积混合后溶液呈 ___ 性,溶液中 c(NH4+)与c(Cl-)的大小关系是___________________;
第三课时
水溶液中微粒浓度的大小比较 学习目标 1,了解电离平衡和水解平衡对水溶液中粒子浓度大小的影响; 2,学会应用电荷守恒、物料守恒、质子守恒之间的关系,并学会 应用三种守恒关系分析水溶液中粒子浓度的大小关系。
判断溶液中离子浓度大小的一般思路为:
两种物质混合
单一物质溶液
综合分析
相互反应
生成物和 剩余物
[练] 2.将pH=3的盐酸溶液和pH=11的氨水等体积混和后,溶液中离子浓度 关系正确的是 A.[NH4+]>[Cl-]>[H+]>[OH-] ; B.[NH4 + ]>[Cl-]>[OH-]>[H+] C.[Cl-]>[NH4+]>[H +]>[OH-];D.[Cl-]>[NH4+]>[OH-]>[H+]
A.[R2-]>[HR-]>[H2R] B.[H2R]>[HR-]>[R2-]
C.[H2R]>[HR-]>[R2-] D.[HR-]>[H2R]>[R2-] 3.0.1mol/LNa2CO3溶液中各粒子 浓度之间的关系: 电荷守恒: 物料守恒: 质子守恒: 4.0.1mol/LNaHCO3溶液中各粒子浓度之间 的关系: 物料守恒 电荷守恒
2.重要一元弱碱:NH3· H 2O
1) NH3· H2O是弱电解质,在溶液中存在电离平衡:
NH4+ + OH2) 在NH3· H2O溶液中存在的主要微粒 NH3· H2O、NH4+、H2O、OH-、H+等 3)各微粒浓度间的关系:电荷守恒 物料守恒 粒子浓度大小关系 a、[NH4+] + [H+] = [OH-] 电荷守恒 物料守恒 NH3· H2O
思考:质子守 恒的关系式
[Cl-]>[NH4+] >[H+]>[ OH-]
[练]常温下关于0.1mol/LNH4Cl溶液的说法正确的是: ①c(NH4+)=0.1mol· L-1
②溶液中c(H+)· c(OH-)=1.0×10-14
③水电离出来的c(H+)=c(OH-)
④溶液的pH=1 ⑤c(OH-)=c(NH4+)+ c(H+)-c(Cl-)
1、两种物质混合不反应: [例]用物质的量都是 0.1 mol的CH3COOH与CH3COONa配成1 L混合溶液,已知其 中c(CH3COO-)大于c(Na+),对该混合溶液下列判断正确的是( )
A、c(H+)>c(OH-)
B、c(CH3COOH)+c(CH3COO-)=0.2 mol· L-1 C、c(CH3COOH)>c(CH3COO-)
b、C(NH3· H2O)总 = [NH3· H2O] + [NH4+] c、[NH3· H2O] >[OH-]>[NH4+]>[H+]
二、可水解盐溶液中离子浓度的大小 1. 氯化铵溶液:
NH4Ac
H2O
+ OH- +
NH4+
+ Cl
-
H+
微粒种类有:
NH3 • H2O
分子: NH3· H2O 、H2O 离子: NH4+、OH-、 H+、Cl微粒间存在的等式关系有: 电荷: [NH4+] +[H+] =[Cl-] +[ OH-] 物料: [Cl-]= [NH4+]+[NH3· H2O] 离子浓度由大到小的顺序为:
[练1].在硫化钠溶液中存在着多种离子和分子,下列关系正确的是 A. [OH-]=[HS-]+[H+]+[H2S] B. [OH-]=[HS-]+[H+]+2[H2S] C. [Na+]=[HS-]+[S2-]+[H2S] D. [Na+]=2[HS-]+2[S2-]+2[H2S] 利用电荷守恒和物料守恒判断溶液中粒子浓度的关系 [练2].已知0.1摩/升的某酸式盐溶液NaHR的水溶液的pH约为9, 在此 溶液中, 下列微粒浓度大小关系正确的是
