植物体内过氧化氢的产生及其生理作用
植物生理学-过氧化氢酶的活性的测定
过氧化氢酶的活性的测定-紫外线吸收法一、原理H2O2在240nm波长下有强烈吸收,过氧化氢酶能分解过氧化氢,使反应溶液吸光度(A240)随反应时间而降低。
根据测量率的变化速率即可测出过氧化氢酶的活性。
二、材料与设备植物材料:植物的叶实验材料:紫光分光光度计、离心机、研钵、250ml容量瓶、0.5ml 吸管1支、10ml试管1支试剂:0.2mol/LpH7.8磷酸缓冲液0.1mol/ H2O2(用0.1mol/L高锰酸钾标定)三、操作步骤1、酶提取液:称取叶片0.5g置于研钵中,加入pH7.0的磷酸缓冲液研磨成为匀浆,并用缓冲溶液清洗研钵数次(共用6ml磷酸缓冲液,缓冲液分几次加入),取上部澄清液在4000rpm下离心15min,上清液即为过氧化氢酶粗提液。
保存备用。
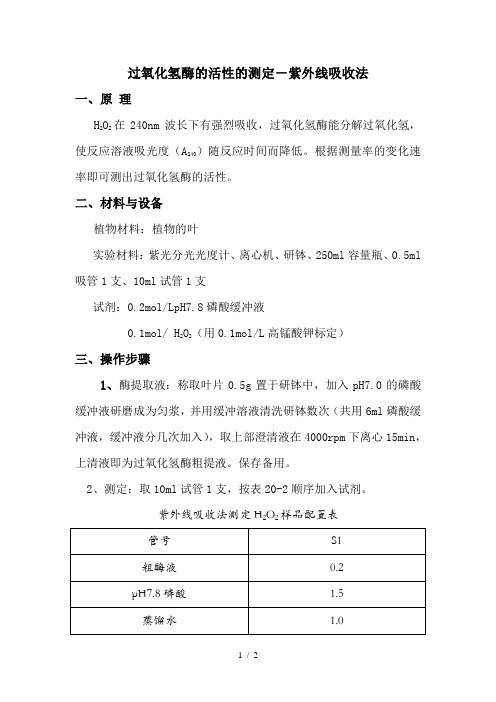
2、测定:取10ml试管1支,按表20-2顺序加入试剂。
紫外线吸收法测定H2O2样品配置表在管中加入0.3ml0.1mol/L的H2O2,加完后立即计时,并迅速倒入石英比色杯中,240nm下测定吸光度,每隔一分钟读数一次,共测三分钟,测完后,按下式计算酶活性。
四、结果计算以1min内减少0.1的酶量为一个酶活单位(u)△A240×V T过氧化氢酶活性(u/gFW/min)=0.1×V×t×FW=0.043×4.6÷0.1÷0.2÷0.3÷3 =10.99五、实验反思1、影响过氧化氢酶活性测定的因素有哪些?过氧化氢酶提取自植物的新鲜叶片中,新叶与旧叶的酶活性存在差异,所以叶片的选择会影响酶活性的测定。
温度的变化也会引起酶活性的测定研磨是否充分,洗涤是否洗干净也会影响。
2、实验测得的吸光度较小(吸光度的起始值较低),酶活性较小,可能是选取的叶片较老,实验中的失误,用滴定管滴定时,滴定的蒸馏水超过了1ml,造成了过氧化氢酶的浓度偏低,用紫外线吸收法测定时造成吸光度值偏低。
植物叶片中过氧化氢含量测定方法的改进

5、离心:将反应后的离心管放入离心机中,离心10分钟,分离出上层清液。 6、检测:将上层清液滴加到光电倍增管上,记录光子数。
7、结果计算:根据光子数计算过氧化氢浓度。
三、注意事项
1、实验过程中要保持温度和pH值的稳定,以免影响实验结果。 2、选取的植物组织要健康、无病虫害,以保证实验结果的可靠性。
二、实验步骤
1、准备试剂和设备:准备好过氧化物酶、底物、缓冲液、离心管、离心机、 光电倍增管等。
2、样品处理:选取健康的植物组织,用蒸馏水冲洗干净,然后用滤纸吸干 表面水分。将组织切成小块,放入离心管中。
3、添加试剂:向离心管中加入适量的缓冲液、过氧化物酶和底物,充分混 合均匀。
4、反应:将离心管放入37℃恒温摇床中反应30分钟。
本次演示旨在探讨一种快速测定植物叶片叶绿素含量的方法,为相关研究提 供参考。
方法介绍
目前,测定植物叶片叶绿素含量的方法主要包括分光光度法、光谱法、荧光 法等。其中,分光光度法是最常用的方法之一。本实验采用分光光度法中的 Arnon-Noory公式,通过测量叶片在663nm和645nm处的吸光度来计算叶绿素含量。 该公式已被广泛应用于叶绿素含量的快速测定。
3、测量吸光度:将研磨好的匀浆倒入比色杯中,加入适量的80%丙酮溶液, 充分摇匀后,在分光光度计上分别测量663nm和645nm处的吸光度。
4、数据处理:根据Arnon-Noory公式计算叶绿素含量。
1、不同植物的叶绿素含量存在 差异
2、不同部位的叶片叶绿素含量 也有所不同
结论
通过实验,我们探讨了一种快速测定植物叶片叶绿素含量的方法,并发现不 同植物及不同部位叶片的叶绿素含量存在差异。这些差异可能是由植物本身的生 物学特性、环境因素等共同作用的结果。
植物体内过氧化氢的产生及其生理作用

植物体内过氧化氢的产生及其生理作用宋喜贵;佘小平【摘要】文章概述了过氧化氢(H2O2)在植物体内的产生及其作用机制的研究进展.H2O2作为活性氧之一在许多生命活动中有着广泛的影响,许多生物和非生物胁迫均能导致植物体产生H2O2.多年来,研究一直注重H2O2对植物生长发育方面的影响,它作为信号分子的重要作用直到近几年才越来越多地受到关注.【期刊名称】《连云港师范高等专科学校学报》【年(卷),期】2010(027)004【总页数】5页(P99-103)【关键词】过氧化氢;活性氧;生理作用;植物【作者】宋喜贵;佘小平【作者单位】陕西师范大学,生命科学学院,陕西,西安,710062;陕西师范大学,生命科学学院,陕西,西安,710062【正文语种】中文【中图分类】Q945过氧化氢(hydrogen peroxide,H2O2)是活性氧(reactive oxygen species,ROS)重要的代表之一,激素等信号以及生物、非生物胁迫刺激均可诱导植物细胞内H2O2的产生和积累。
H2O2化学性质比较稳定,寿命较长,具有较高的跨膜通透性并能在植物细胞间迅速扩散,外界刺激能迅速地刺激其合成和分解,这些特点均符合细胞间信号分子所具有的重要标准。
越来越多的证据表明,H2O2在植物面临环境胁迫反应中发挥着重要的作用,比如应对逆境产生抗病防御反应、调控植物的生长发育、参与保卫细胞气孔运动等诸多生理过程。
H2O2还与其他信号特别是植物激素相互作用,影响一些蛋白激酶与蛋白磷酸酶等一系列下游信号分子的产生和参与。
本文就H2O2在植物体内产生的途径及其作用机制的研究进展综述如下。
植物在正常的生理代谢过程中都可能会有活性氧(reactive oxygen species,ROS)的产生,如光合成、光呼吸、脂肪酸氧化和衰老等过程中都能自然产生ROS。
尤其在干旱、高温、低温、机械损伤、强光照、气体污染、真菌浸染等外界环境胁迫下会产生大量的活性氧。
植物在低温胁迫下的过氧化氢代谢及信号转导

( PHT /1999 /081 ) ; 公益性行业科学专项
© 1994-2010 China Academic Journal Electronic Publishing House. All rights reserved.
1702
园 艺 学 报
© 1994-2010 China Academic Journal Electronic Publishing House. All rights re迫下的过氧化氢代谢及信号转导
1703
量显著下降 。由于 APX和 CAT对 H2 O2 的亲和力不同 , 有人认为 APX可能对 H2 O2 信号调控起作用 , 而 CAT才是胁迫条件下针对 H2 O2 的过量产生起调节作用的物质 (M ittler, 2002) 。郝晶等 ( 2007) 研究表明 , 低温下 ( 6 ℃) 大豆幼苗 H2 O2 含量呈上升趋势 , 胁迫初期低浓度 H2 O2 诱导了 CAT、 POD 等保护酶活性的提高 。张立军等 (2007) 在低温下采用不同浓度的外源 H2 O2 处理大豆种子 , 结 果也表明适宜浓度的 H2O2 可以诱导 CAT、 POD 等保护酶活性增加 。
Key words: hydrogen peroxide; low temperature stress; signal transduction; cold resistant
过氧化氢 (Hydrogen peroxide, H2 O2 ) 是生物细胞代谢过程中产生的一种活性氧 。正常情况下 , 植物体内 ROS清除系统能够使其含量保持在伤害水平之下 ; 但是逆境胁迫下 , 活性氧的产生量会超 过系统清除能力 , 由此造成氧化损伤 。在过去的很长一段时间 , 人们将 H2 O2视为一种有害的细胞代 谢产物 。然而 , 越来越多的研究证明 , 植物可以利用 H2 O2并将其放大作为信号分子 , 进而调控生长 发育过程和对各种生物和非生物刺激的应答 。各种生物和非生物胁迫均能在一定水平上诱导细胞中 H2 O2的产生 , 进而调控一系列胁迫应答的信号转导 。
《植物生理学》名词解释

植物的矿质营养及其吸收、运输、同化1. 灰分:将在105 摄氏度下烘干的植物材料在600摄氏度下高温烘烤,剩余的不能挥发的灰白色残渣称为植物的灰分。
2. 灰分元素/矿质元素:构成植物灰分的元素称为植物的灰分元素,由于它们直接或间接地来自土壤矿质,故又称为矿质元素。
3. 必需元素:是指植物正常生长发育必不可少的元素。
4. 大量元素:包括C H O N P K Ga Mg S 9 种,此类元素分别占植物体干重的0.01%-10%。
5. 微量元素:包括Fe Cu B Zn Mn Mo Ni Cl 8 种,此类元素分别占植物体干重的0.00001%-0.01%。
6. 溶液培养法/水培法:是在含有全部或部分营养元素的溶液中培养植物的方法。
7. 砂基培养法:是在洗净的石英砂等基质中加入营养液、利用砂基作为固定植物根系的支持物来培养植物的方法,与溶液培养法并无实质性的不同。
8. 有氧溶液培养法/ 气培法/雾培法:是将植物根系臵于营养液气雾中培养植物的方法,植物根系并不直接浸入营养液。
9. 有益元素:有些元素并非是植物的必需元素,但这些元素对植物的生长发育,或对植物生长发育过程中的某些环节有积极影响,这些元素被称为植物的有益元素。
10. 有害元素:有些元素少量或过量存在时均对植物有不同程度的毒害作用,将这些元素称为有害元素。
11. 质外体/自由空间:植物组织中细胞质膜外部的细胞壁部分在组织内构成一连续的结构空间被称为质外体。
土壤溶液中的各种矿质元素可顺着电化学势梯度自由扩散进入质外体空间,固有时又将质外体称为自由空间。
12. 相对自由空间(RFS:活组织自由空间的体积大小可通过某种离子的扩散平衡实验来估算,这个估算值称为相对自由空间。
13. 共质体运输:溶质通过跨膜运转进入原生质,并通过活细胞间的胞间连丝或连续不断的跨膜运转而从一个活细胞运输至另一个活细胞的过程称为共质体运输。
14. 生理碱性盐:将这类由于植物对离子的选择性吸收而使环境PH升高的盐类称为生理碱性盐,硝酸盐类(硝酸铵例外)一般均属于生理碱性盐。
植物过氧化氢酶的研究进展_南芝润

植物过氧化氢酶的研究进展南芝润 范月仙3(山西农业大学文理学院,山西太谷 030801)摘 要:过氧化氢酶是生物体内主要的抗氧化酶之一。
其功能是催化细胞内过氧化氢的分解,从而使细胞免于遭受过氧化氢的毒害。
几乎所有的生物体都存在过氧化氢酶。
在植物中过氧化氢酶主要清除光呼吸、线粒体电子传递以及脂肪酸β-氧化等过程中产生的H2O2。
本文主要介绍了过氧化氢酶的生理功能,过氧化氢酶基因的克隆以及在基因工程上的应用,论述了过氧化氢酶基因在转基因植物中的应用前景。
关键词:过氧化氢酶;生理功能;基因工程中图分类号 Q554.6 文献标识码 A 文章编号 1007-7731(2008)05-27-03Advance of Researches on Ca t a l a se i n Pl an tsNan zh i run fan yuex i a n3 (Depart m ent of art and science,shanxi agriculture of university,taigu030801)Abstract:Catalase is one of the main anti oxidant enzy mes in O rganis m s1Catalases can catalyse the decompositi on of the cel2 lular hydr ogen-per oxide and thus p r otect cells fr om hydr ogen per oxide by the pois on1Catalases al m ost exist in all living or2 ganis m s1H2O2p r oduced in the light breathing,electr on trans port in m it ochondrial and fatty acidβ-oxidati on p r ocess was mainly re moved by catalase in the p lant1This paper briefly intr oduced the physi ol ogical functi ons of the catalases,gene cl o2 ning and app lying of p lant catalase;and t olerances t o bi otic and abi otic stresses of transgenic catalase gene p lants als o are advised as s ome good traits in p lant breeding1Key words:catalase,Physi ol ogical functi on,Genetic Engineering 过氧化氢酶又称触酶(CAT),是一类广泛存在于动物、植物和微生物体内的酶。
植物生理学 过氧化氢酶的活性的测定
过氧化氢酶的活性的测定-紫外线吸收法一、原理H2O2在240nm波长下有强烈吸收,过氧化氢酶能分解过氧化氢,使反应溶液吸光度(A240)随反应时间而降低。
根据测量率的变化速率即可测出过氧化氢酶的活性。
二、材料与设备植物材料:植物的叶实验材料:紫光分光光度计、离心机、研钵、250ml容量瓶、0.5ml 吸管1支、10ml试管1支试剂:0.2mol/LpH7.8磷酸缓冲液0.1mol/ H2O2(用0.1mol/L高锰酸钾标定)三、操作步骤1、酶提取液:称取叶片0.5g置于研钵中,加入pH7.0的磷酸缓冲液研磨成为匀浆,并用缓冲溶液清洗研钵数次(共用6ml磷酸缓冲液,缓冲液分几次加入),取上部澄清液在4000rpm下离心15min,上清液即为过氧化氢酶粗提液。
保存备用。
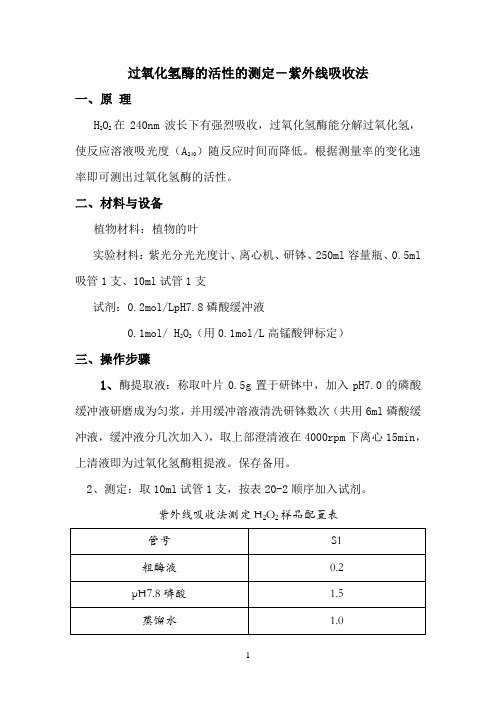
2、测定:取10ml试管1支,按表20-2顺序加入试剂。
紫外线吸收法测定H2O2样品配置表在管中加入,加完后立即计时,并迅速倒入石英比色杯中,240nm下测定吸光度,每隔一分钟读数一次,共测三分钟,测完后,按下式计算酶活性。
四、结果计算以1min内减少0.1的酶量为一个酶活单位(u)△A240×V T过氧化氢酶活性(u/gFW/min)=0.1×V×t×FW=0.043×4.6÷0.1÷0.2÷0.3÷3 =10.99五、实验反思1、影响过氧化氢酶活性测定的因素有哪些?过氧化氢酶提取自植物的新鲜叶片中,新叶与旧叶的酶活性存在差异,所以叶片的选择会影响酶活性的测定。
温度的变化也会引起酶活性的测定研磨是否充分,洗涤是否洗干净也会影响。
2、实验测得的吸光度较小(吸光度的起始值较低),酶活性较小,可能是选取的叶片较老,实验中的失误,用滴定管滴定时,滴定的蒸馏水超过了1ml,造成了过氧化氢酶的浓度偏低,用紫外线吸收法测定时造成吸光度值偏低。
实验40--植物组织中过氧化氢含量及过氧化氢酶活性测定
实验40 植物组织中过氧化氢含量及过氧化氢酶活性测定植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积。
H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。
过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。
因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。
本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。
一、过氧化氢含量的测定【原理】H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定。
在一定范围内,其颜色深浅与H2O2浓度呈线性关系。
【仪器和用具】研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×7个,离心管5ml×8支;离心机;分光光度计。
【试剂】100μmol/L H2O2丙酮试剂:取30%分析纯H2O2 57μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(W/V)硫酸钛;丙酮;浓氨水。
【方法】1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。
待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml刻度,415nm波长下比色。
2.样品提取和测定:(1)称取新鲜植物组织2~5g(视H2O2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管3000 r/min下离心10min,弃去残渣,上清液即为样品提取液。
(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。
沉淀用丙酮反复洗涤3~5次,直到去除植物色素。
(3)向洗涤后的沉淀中加入2mol 硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
由基 ( O 、 线 态 氧 (0 ) 脂 氢 过 氧化 物 ( O H) ・ H)单 2、 RO
氧化 和 叶绿体 通 过 光 化 学 反 应 、 乙醛 酸 循 环 体 脂 肪
C a pl研究 表 明 , 哺 乳 动 物 细 胞 的有 氧 代谢 中 , hpe l 在 酸 口一氧化 等 均 可 产 生 H 2 2 。现 在 了解 到 H 2 O 2 产 N D H氧 化 酶作 为 一 种 嗜 中性 氧化 酶 起 着 非 常 重 0 AP
寿命 较 长 , 有 较 高 的 跨 膜 通 透 性 并 能 在 植 物 细胞 具 间迅 速扩 散 , 外界 刺激 能 迅速 地 刺 激其 合 成 和 分解 ,
产生 H 2…另 一 条 途 径 是 在 缺 铁 状 态 下 , 氧 化 2 。 O 过 物酶 ( D 活 性 下 降 ,e o r ) F3 还原 生 成 ,e F2 质 与
信 号 以及 生物 、 生 物 胁 迫 刺 激 均 可 诱 导 植 物 细胞 非
酸脱 氢酶催 化 细 胞 产 生 苹 果 酸 的 同 时 , A N D+被 还
原 为 N D 质膜 N D A H, A H氧化 酶催 化 N D A H与 氧反应
内 H 2的产 生 和 积 累 。 H 2 学 性 质 比 较 稳 定 , 2 O 2 化 O
,一 这些特 点 均 符 合 细 胞 间信 号 分 子 所 具 有 的 重 要 标 膜外 表 面 电子 传 递 还 原 氧 生 成 的 0 在 超 氧 化 物
准 。越来越 多 的证 据 表 明 , 2 2 H ( 在植 物 面 临环 境 胁 歧化 酶 ( O ) 与 下 发 生 歧 化 反 应 生 成 H 0 ; 可 ) SD参 22也
许 多生命活动 中有 着广泛的影响 , 多生物和 非生物胁 迫 均能导 致植 物体 产生 } 【 。 多年 来, 究一 直注 重 许 1) 22 研
对 植 物 生 长 发 育方 面 的 影 响 , 它作 为信 号 分 子 的 重要 作 用 直 到 近 几 年 才越 来 越 多地其 作 用 机 制 的 研 究 2 在 O
进 展综 述 如下 。 1 植物 体 内 H 2 2 的产 生 0
0 ’ 反 应 形 成 H 2 另 外 , 绿 体 中 光 系 统 I 2一 2 。 0 叶 I (SI产生 的活 性 氧 之 间可 以通 过 酶促 或 非 酶促 反 PI )
是 植 物激 素相 互 作 用 , 响一 些 蛋 白激 酶 与 蛋 白磷 应 相互 转换 ( 下 图 ) 影 见 。
/ 1・
\ ( l PS }
薹
植 物在 正 常 的生 理 代谢 过 程 中都 可 能会 有 活 性 氧 (ecv ye ei , o ) r t e xgns c s R s 的产 生 , ai o p e 如光 合 成 、 光 呼吸 、 肪 酸 氧 化 和 衰 老 等 过 程 中都 能 自然 产 生 脂 RS O 。尤 其 在 于 旱 、 温 、 温 、 械 损 伤 、 光 照 、 高 低 机 强 气体 污染 、 菌 浸染 等外 界 环 境 胁 迫 下 会 产 生 大量 真
生 的酶 促 途 径 方 面 , 膜 氧 化 还 原 酶 系 统 ( l m 质 pa a s
m m r er o s m, M S 比较 重要 , 胞壁 苹 果 e ba e xs t P R ) n d ye 细
ateoye ei ,R S 重 要 的代 表 之 一 , 素 等 c v xgns c s O ) i p e 激
植 物 体 内 过 氧 化 氢 的 产 生 及 其 生 理 作 用
宋喜 贵 , 小平 佘
( 陕西师范大学 生命科 学学院 , 陕西 西安 706 ) 102 [ 摘 要 ]文章概述 了过氧化氢 ({ 2在植 物体 内的 产生及 其作 用机 制的研 究进展 。 ( }0 ) 2 = 为活性氧 之一 在 】 2作
的 活性氧 。 R S包 括 超 氧 阴离 子 自由基 0 ‘ 、 自 O 2 羟
√
活 性 氧 之 间 相 互 转 换 的 途 径 及 防 御 应 激 机 制
H 2的产生 与质 膜 N D H氧 化 酶 ( MR 2 O AP P S的一 及 H 2 。植 物 细 胞 有 多 种 途 径 能产 生 H ( , 2 等 O 22如 个 重要 成 分 ) 有 很大 关 系 。N D H氧 化 酶 普 遍 存 ) 也 AP 通 过线 粒 体呼 吸 电子 传 递 链 、 氧 化 物 酶 体 乙醇 酸 在 于 原 核 生 物 及 所 有 动 、 物 体 内。 H n e o 过 植 edr n和 s
[ 关键词 】过氧化 氢; 活性氧 ; 生理作 用; 植物 [ 中图分类号 ]Q 4 9s [ 文献标识码 ]A [ 文章编号 ]09—74 (000 10 702 1)4一O9 —0 O9 5
过 氧化氢 (ymgnp r i , 2 2 是 活性 氧 (e hd e eo d H 0 ) xe r
迫反 应 中发挥 着 重 要 的 作 用 , 比如 应 对 逆 境 产 生 抗 以先 由 F2 e 与 O 2反 应 生 成 ( ’ , 后 F2 ) 2 然 e 再 与
病 防御 反应 、 控植 物 的生 长发 育 、 与 保卫 细胞 气 调 参 孔运 动 等 诸 多 生 理 过 程 。 H 2还 与 其 他 信 号 特 别 2 O 酸酶 等一 系列 下游 信号 分子 的产 生 和参 与 。本 文 就
21 0 0年 1 2月
连 云港 师范 高 等 专科 学 校学 报
J u a o in u g n e c e sC l g o r l fL a y n a gT a h r o l e n e
Ie e e’2 ) c mb ! 0J . 0
No. 4
第4 期
