钠的氧化物第二课时
《钠的氧化物》公开课优秀课件(经典、完美、值得收藏)

+1 -2 Na2O 白色固体
+1 -1 Na2O2 淡黄色固体
与H2O 与CO2
与盐酸 反应
特性
氧化物种 类
Na 2O +H 2O =2Na O H Na 2O +C O 2=Na 2C O 3
Na2O+2HCl =2NaCl+H2O
碱性氧化物
2Na 2O 2+2H 2O =4Na O H +O 2↑
从物质分类的角度分析: 氧化钠属于金属氧化物和碱性氧化物
碱性氧化 与水反应只生成碱
Na2O + H2O = 2NaOH
物的反应 与酸性氧化物反应只生成盐 Na2O + CO2 = Na2CO3
与酸反应只生成盐和水 Na2O + 2HCl= 2NaCl+H2O 氧化钠是一种比较典型的碱性氧化物
过氧化钠是一种金属氧化物,是否与氧化钠的性质完全相同?
2Na 2O 2+2C O 2=2Na 2C O 3+O 2
2Na2O2+4HCl= 4NaCl+O2↑+2H2O
强氧化性
过氧化物, 非碱性氧化物
用途
供氧剂、氧化剂、漂白剂
【学习方法】 物质性质的探究方法: 1)从物质分类的角度思考物质的通性; 2)注意物质的特性; 3)从结构推测性质,性质推测保存和用途; 4)运用实验证实推理。
气 生
? 不是,Na2O2是过氧化物
火
【讨论】如何理解Na2O、Na2O2性质上的差异?
在Na2O2中,氧是-1价,介于氧的两种较稳定化合价0和 -2之间,因此Na2O2既可以在一定条件下获得电子表现氧化性
又可以在一定条件下表现还原性,还可以在一定条件下发生
《钠的氧化物》课件

与其他氧化剂反应
总结词
多种反应可能,取决于具体氧化剂。
详细描述
钠的氧化物与其他氧化剂的反应取决于具体的氧化剂。有些氧化剂可能与钠的氧 化物发生剧烈反应,产生热量和光,而有些则可能只发生缓慢的化学反应。
钠的氧化物可能与其他物质发生反 应,产生有害物质,降低水质,对 人类和其他生物的健康造成威胁。
对土壤的影响
土壤酸化
钠的氧化物在土壤中溶解后,可 能导致土壤酸碱度失衡,影响土
壤肥力和植物生长。
土壤污染
钠的氧化物可能与其他物质发生 反应,产生有害物质,污染土壤 ,影响植物和土壤微生物的生存
。
降低土壤质量
钠的氧化物的制备
钠的氧化物可以通过钠与氧气在 高温下反应制备。
另一种制备方法是钠与过氧化钠 反应,生成过氧化钠和氧化钠。
在实验室中,也可以通过钠与氯 气反应,生成氯化钠和氧化钠。
钠的氧化物的用途
钠的氧化物在工业上可用于制 造其他钠的化合物,如硫化钠 、亚硝酸钠等。
钠的氧化物也用于生产玻璃、 陶瓷、肥皂等产品中作为添加 剂。
钠的过氧化物的特殊性质
总结词
强氧化性,不稳定,易分解。
详细描述
钠的过氧化物具有强氧化性,是一种不稳定的化合物,容易分解。在常温下,过氧化钠会与水或二氧化碳发生反 应,产生氧气。
03
钠的氧化物在日常生活中的应用
在食品工业中的应用
01
02
03
食品添加剂
钠的氧化物可作为食品添 加剂,用于改善食品的口 感和外观,如膨松剂、防 腐剂等。
食品加工助剂
在食品加工过程中,钠的 氧化物可作为助剂,帮助 食品加工顺利进行,如乳 化剂、稳定剂等。
钠的氧化物课件优秀课件

一、钠的氧化物
思考与交流:
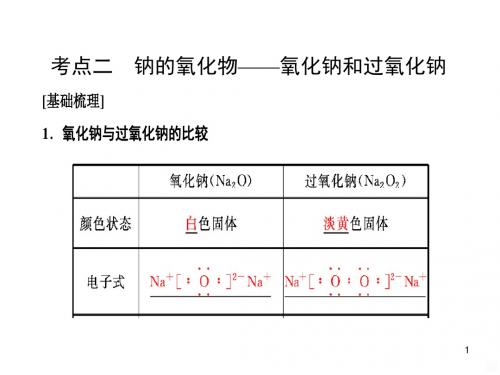
1、回忆前面做过的实验,描述Na2O和 Na2O2的颜色、状态。
化学式
化合价
颜色 状态
Na2O
+1 -2
Na2O
白色固体
Na2O2 +1 -1
Na2O2
淡黄色固体
• 一、氧化钠和过氧化钠 • 1. 氧化钠
• (1)物理性质:氧化钠是一种白___色__的固体。
A、都正确 B、②③④⑤ C、②③⑤ D√、④⑤
• (2)化学性质(与CaO相似)
•① 与水的反应,化学方程式为:
_____N__a_2O___+__H_2_O__=__2_N__a_O_H_____。
• ② 与盐酸的反应,化学方程式为:
_N__a_2_O__+__2_H__C_l_=__2_N__a_C__l _+__H_2_O_。
• ③ 与 CO2 的 反 应 , 化 学 方 程 式 为 :
______N__a_2_O__+__C_O__2_=__N__a_2_C_O__3________。
2、Na2O有哪些性质?
碱性氧化物+水→碱 碱性氧化物+酸→盐+水 碱性氧化物+酸性氧化物→含氧酸盐
3、Na2O 是哪种性质的氧化物?Fra bibliotek碱性氧化物
Na2O2有这些性质吗?
1、Na2O2与水的反应
实验3-5
合并得①+②*4
O 2Na2O2 + 4HCl = 4NaCl + 2H2O + 2 ↑
思考:过氧化钠是碱性氧化物吗?
不是。因为过氧化钠与酸反应,除了生
钠的氧化物ppt课件

实验结论
失去2×e-
-1
-2
-2 0
2Na2O2 + 2CO2 ══ 2Na2CO3 + O2
得到2×e-
该反应与过氧化钠和水的反应一样,过氧化钠既是氧化剂, 又是还原剂。
三、Na2O2的化学性质
3、与HCl反应
拓展延伸
2Na2O2 + 4HCl == 4NaCl + 2H2O + O2↑
【思考】 Na2O2 是否属于碱性氧化物? 碱性氧化物的性质:① 碱性氧化物 + 水 → 碱
与水反应 Na2O + H2O = 2NaOH 与酸性氧化物反应 Na2O + CO2 = Na2CO3
与酸反应 Na2O + 2HCl = H2O + NaCl
二、Na2O的化学性质
拓展延伸
氧化钠不稳定,空气中加热会转化为过氧化钠:
2Na2O + O2 ═△═ 2Na2O2
白色
淡黄色
三、Na2O2的化学性质
实验操作
实验现象 试管外壁较热 产生气泡、带火星的木条复燃 溶液先变红色
溶液褪色
实验结论 反应放热 反应生成O2 反应生成NaOH Na2O2具有漂白性
三、Na2O2的化学性质
1、与水反应
失去2×e-
实验结论
-1
-2
-2
0
2Na2O2 + 2H2O ══ 4NaOH + O2↑
得到2×e-
该反应中,过氧化钠既是氧化剂,又是还原剂。
第一节 钠及其化合物
第2课时 钠的氧化物
一、Na2O和Na2O2的物理性质
思考与讨论
(1)回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
钠的氧化物PPT课件
[解析] 碳酸钠与酸反应分步进行,首先反应产生碳酸氢钠和氯化钠,然后 是碳酸氢钠与酸反应产生氯化钠、二氧化碳和水,产生气体,而碳酸氢钠中加入 酸马上放出气体,所以根据反应放出气体的快慢就可迅速得到判断,A正确;纯 碱和小苏打都是钠盐,焰色反应火焰都为黄色,所以无法区别二者,B错误;二 者都能与氢氧化钙溶液发生反应产生碳酸钙白色沉淀,无法区别它们,C错误; 碳酸钠稳定,受热不分解,碳酸氢钠不稳定受热分解产生碳酸钠、二氧化碳和 水,也有固体残留物,所以无法区分二者,D错误。
23
[题组集训] 题组一 Na2CO3、NaHCO3的性质及应用 1.关于NaHCO3性质的有关叙述不正确的是( ) A.既能与强酸反应,又能与强碱反应 B.医疗上可用于治疗胃酸过多 C.与足量的酸反应时放出的CO2比与等质量的Na2CO3要多 D.同温度时,NaHCO3的溶解度>Na2CO3的溶解度
28 g·mol-1×n(CO2),Δm(H2O)=2 g·mol-1×n(H2O)
17
考点三 碳酸钠与碳酸氢钠
[基础梳理]
1.物理性质
名称
碳酸钠
化学式 俗名
Na2CO3 纯碱或苏打
颜色、状态 白色粉末
水溶性
易溶于水
碳酸氢钠 NaHCO3 小苏打 细小白色晶体 水中易溶,但比Na2CO3的溶解度小
19
(3)与碱(NaOH溶液)反应
①Na2CO3:与NaOH溶液不反应。
②NaHCO3: NaHCO3+NaOH===Na2CO3+H2O
。
(4)相互转化
①Na2CO3―→NaHCO3
向Na2CO3溶液中通入CO2,化学方程式为
Na2CO3+H2O+CO2===2NaHCO3
钠的氧化物教案

第3节研究物质性质的基本方法(教学设计)
(3)通过实验探究,培养学生的化学兴趣。
3.情感态度价值观:
1、学生在实验过程中,培养对学习化学的兴趣。
2、通过钠的重要化合物的学习,使学生提高自身的思维能力和分析综合能力。
3、学生建立以实验验证猜想的科学思想,培养严谨的科学态度。
教学方法
启发式教学、实验探究式教学、分析对比法 教学媒体
板书、PPT 、实验用品 教学流程
V
演示实验
根据小组讨论结果,设 --------- => 计实验进行验证
।
A 得出结论
巩固应用
=A 小结 => 练习 =A 作业 V 结论
交流
教学过程
附表:
1、氧化钠与过氧化钠的性质比较
板书:
钠的氧化物(Na,、Na2O2)
氧化钠与过氧化钠
(1)过氧化钠与水的反应
现象:产生气泡、试管外壁发热、带火星木条复燃、滴入酚酞溶液后,溶液先变红后褪色
原理:2Na2O2+2H2O=4NaOH + 02 t
(2)过氧化钠与二氧化碳的反应
原理:2Na O+2CO =2Na CO+O
2 2 2 2
3 2
(3)氧化钠与过氧化钠的性质比较
作业:课后巩固区习题
课后反思:。
高中化学必修一-钠的氧化物第一二课时

第二节 几种重要的金属化合物(第1课时 钠的重要氧化物)【明确学习目标】1.掌握氧化钠、过氧化钠性质及相互转化方法。
2.钠的氧化物和水、二氧化碳反应中的质量、气体体积和电子转移规律。
(学习重点)课前预习案【知识回顾】1.钠元素是一种 的金属元素 在自然界中都以 态存在;NaOH 是一元 (填类别),俗称 、 、 ,有强烈的 性; 固体NaOH 久置在空气中的变化流程是:。
3.氯化钠俗称 ,生理盐水中溶质的质量分数为 。
【新课预习】阅读教材P55,思考:1.氧化钠和过氧化钠的性质及物质分类,并分析归纳二者性质的区别与转化及在生活、生产中的应用。
2.在草稿本上重点练习Na 2O 2与水、二氧化碳反应中的质量、气体体积变化及电子转移情况。
3. Na 2O 、Na 2O 2的水溶液的化学性质。
课堂探究案一.Na 2O 、Na 2O 2的结构、物理性质、稳定性和相互转化方法:①4Na+O 2==2Na 2O ②Na 2O 22O③10Na+2NaNO 32O+N 2 ④2Na 2O+O 22O 22最好用反应 ,是因为 。
二.Na 2O 的化学性质:氧化钠和其他极活泼金属的普通氧化物性质相似,都是典型的碱性氧化物练2.写出氧化钠与下列物质反应的化学方程式和离子方程式:H2O:酸: (H2SO4)酸性氧化物:(CO2,SO2)总结:Na2O的水溶液只具有,因此把Na2O投入酸或盐溶液中,其反应原理和NaOH与酸或盐反应一样。
练3.写出Na2O与CuSO4、NH4C l、 NaHCO3、FeCl2等溶液反应的化学方程式和离子方程式。
二.Na2O2的化学性质【实验探究一】与水的反应实验 1.用脱脂棉包裹少量的过氧化钠固体,用胶头滴管滴几滴水,或用细管连续不断的吹气,最终都发现脱脂棉。
实验 2.把水滴入盛有少量过氧化钠固体的试管中,立即把带火星的木条放在试管口,发现带火星的木条,用手轻轻触摸试管外壁,感觉,再在反应后的溶液中滴入酚酞溶液,。
第2课时钠的氧化物——氧化钠和过氧化钠(课件)

三、总结提升———Na2O2 的性质、用途
1.物理性质:淡黄色固体。
2.化学性质:Na2O2 不是碱性氧化物,但能与水、酸、酸 性氧化物等发生反应,具有强氧化性。
2Na2O2 +2H2O 4NaOH+O2↑ 2Na2O2 +2CO2 2Na2CO3+O2 2Na2O2 +4HCl 4NaCl+2H2O+O2↑ 3.用途:供氧剂、强氧化剂、漂白剂等。
固体增加的质量等于与CO2 等个数的CO的质量。
固体增加的质量等于与H2O等个数的H2的质量。
三、总结提升———Na2O2 的性质、用途
5. Na2O2 与CO2、H2O反应中的一些数量关系 (3)电子转移关系 在 Na2O2 与CO2 或 H2O的反应中,Na2O2 既是氧化剂又是还 原剂,每生成1个 O2 都 转移2个电子。
一、实验探究———Na2O2的化学性质
[问题思考2] Na2O2的水溶液为什么能使有色物质如品红溶液、酸 碱指示剂、湿润的有色布条褪色?
Na2O2与水的反应可认为有两个过程: ①Na2O2+2H2O 2NaOH+H2O2, ②2H2O2 2H2O+O2↑。
反应过程中有H2O2生成,H2O2有强氧化性,能使有色物质褪色。
三、总结提升———Na2O2 的性质、用途
小试牛刀 将 a g 由 CO 和 H2 组成的混合气体在足量的 O2 中充分燃烧后,将生 成的所有产物通过足量的 Na2O2 固体,充分反应后,固体增加的质量 为( A )
总结
氧化物 颜色、状态 氧元素的化合价
构成
所属类别 生成条件 热稳定性 与 H2O反应 与CO2 反应 与盐酸反应 主要用途
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
加入稀 HCl : Na CO 的反应速率比 NaHCO 慢 2- + 2H+=CO HCO3- + H+ = CO2↑+H HCl CO 2O 3 ↑+H O 2 3 3 2 2 - + OH- =CO 2-+H O HCO 3 3 2 NaOH 不反应
石灰水 BaCl2 CO2 Na2CO3+H2O+CO2=2NaHCO3 不反应 用途 用于玻璃,肥皂,造纸,洗涤剂 发酵剂,灭火剂,医疗上治胃酸过多
实验步骤: ①洗:将铂丝用稀HCl洗净 ②烧:放在酒精灯外焰灼烧至与火焰颜色相同(除杂 ③蘸:蘸取待检验的物质 ④烧:放在酒精灯外焰灼烧 ⑤观:火焰颜色 ⑥洗:将铂丝用稀HCl洗净(同①)
现象: 钠:黄色
钾:紫色(透过蓝色钴玻璃)
紫红色 黄色 紫色 绿色 紫色 砖红色 洋红色 黄绿色
结论:每种金属都有自己的焰色反应
C)
2.判断下列焰色反应实验操作的注意事项是否正确
错 B. 实验时最好选择本身颜色较强的火焰 错
A. 可用生锈的铁丝代替铂丝 C. 每次实验完毕后,要将铂丝蘸取稀盐酸灼烧干净对
3. 物质燃烧时,火焰呈紫色的一定含有( B ) A.钾原子 B.钾元素 C.钾离子 D.钾的化合物
课堂练习
下列各组物质混合后,不能生成NaOH的是 下列离子方程式正确的是( B ) ( Na ) 根据 D 2O,Na 2O2,Na2CO3,NaHCO 3的性质, + A. 钠与水反应: Na+2H2O==Na +2OH-+H2↑ 请设计不同方案对这四种物质进行鉴定 ++4OH -+O ↑ A. Na和H2O B.Na O 和 H O B. 过氧化钠与水反应 :2Na2O2+2H O == 4Na 2 2 2 2 2 +== D.Ca(OH) C.Ca(OH)2和Na: 2 2CO 3 2和NaCl C.氧化钠与盐酸反应 O2-+2H H2O D.小苏打与稀硫酸反应:CO32-+2H+==CO2↑+H2O
2+ CO32- + Ca2+ = CaCO ↓ 配成溶液滴加入 CaCl2 有沉淀生成的是 Na HCO (碱不足) 3溶液: 3 + Ca +OH = CaCO 3↓+H 2O 2CO 3 CO32- +Ba2+ = BaCO3↓ 不反应
转化
Na2CO3
CO2 + H2O (1)固体: 加热 (2)溶液: NaOH
碳酸钠与碳酸氢钠(归纳)
化学式 俗名 色态 溶解性 热稳定
Na2CO3 纯碱 ,苏打 NaHCO3 小苏打 溶解: Na2CO3比NaHCO3易溶于水 细小白色晶体 白色粉末
加热: Na2CO3稳定 NaHCO 易溶于水 较易溶于水 (比Na2CO3小) 3受热易分解
稳定,不易分解 2NaHCO3=Na2CO3+H2O+CO2 怎样鉴别碳酸钠和碳酸氢钠?
NaHCO3
碳 酸 钠 和 碳 酸 氢 钠 的 用 途
想一想?
除杂:
①除去Na2CO3固体中的NaHCO3: 加热 ②除去Na2CO3溶液中的NaHCO3: 加入适量NaOH溶液 ③除去NaHCO3溶液中的Na2CO3: 通入足量CO2
ቤተ መጻሕፍቲ ባይዱ
金 属 的 焰 色 反 应
焰色反应
金属或它们的化合物在燃烧或灼烧时呈现特 殊的颜色,这在化学上叫焰色反应。
课堂练习
Na2O,Na2O2,Na2CO3,NaHCO3 观察颜色 Na2O2 Na2O,Na2CO3,NaHCO3 (淡黄色固体) (白色固体) 加稀盐酸 Na2O Na2CO3 NaHCO3 (没现象) (有气体产生, (有气体产生, 但不剧烈) 反应剧烈)
焰色反应:
金属或它们的化合物在燃烧或灼烧时呈现特 殊的颜色,这在化学上叫焰色反应。 注意:
①焰色反应为元素性质,非单质或某种化合物性质, 与状态无关;
②用于鉴别物质,此方法为物理方法; ③观察K元素的火焰时,需通过蓝色钴玻璃观察,过滤 黄光,减少干扰。
1.下列关于焰色反应的表述正确的是( A.焰色反应是离子的特有性质 B. 焰色反应是单质的特有性质 C.焰色反应是元素的性质 D. 焰色反应是化合物的性质
