铝及其化合物转化关系化学方程式
铝及其化合物及化学方程式和离子方程式

铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO4Al 2(SO 4)3 +3H 2O Al 2O 3+6H+2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O34Al +3O 2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2OAl(OH)3 +OH-AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4↓SO 42-+Ba 2+BaSO 4↓2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3 +3H 2SO 4 Al 3++3H 2O Al(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH 3Na 2SO 4+2Al(OH)3↓Al 3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2OAl 3++4OH-AlO 2-+2H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3↓+3BaSO 4↓2Al 3++3SO 42-+3Ba 2++6OH-2Al(OH)3↓+3BaSO 4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:冰晶石电解Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO 2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
苏教版高中化学必修1化学方程式大全
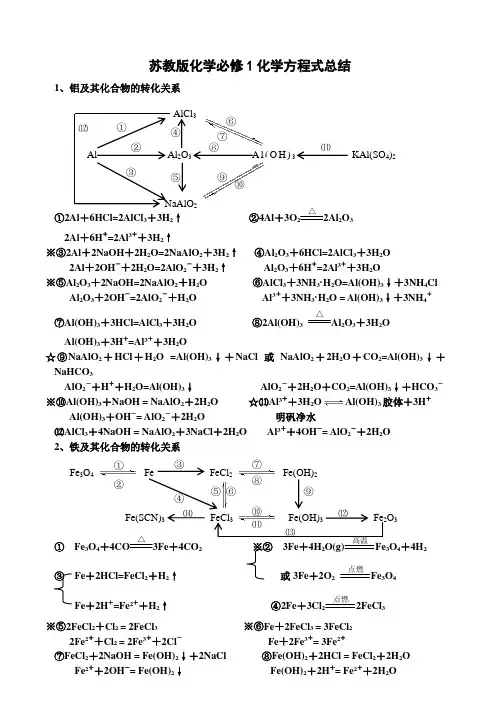
苏教版化学必修1化学方程式总结1、铝及其化合物的转化关系①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 2、铁及其化合物的转化关系 ① Fe 3O 4+4CO △ 3Fe +4CO 2 ※② 3Fe +4H 2O(g) Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2OFe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⒁ 2O 3 A l (O H )3 KAl(SO 4)22AlCl 3 ④ ⑤ ⑥⑦⑧ ⑨⑩⑾※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3 3、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 4、硫及其化合物的转化关系①S +O 2 点燃SO 2 ②2H 2S +SO 2=3S +2H 2O ※③SO 2+O 2 催化剂加热 2SO 3NaCl Na NaOH NaHCO Na 2Na 2① ② ③ ⑤⑾ ⑿ ⒁ ⒂④① S 4 ②④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2 △2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓)△CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClO6、氮及其化合物的转化关系 ※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦⑧ ⑨ ⑩ ① ⑨ ⑧⑦ ⑥ N 2 NH 3 NH 4Cl NO NO HNO 3 ② ③ 点燃或光照 光照光照 高温或放电 光照※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
铝及其化合物的化学方程式和离子方程式大全#精选.

铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O 8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2(SO 4)3 +3H 2O Al 2O 3+6H+2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓SO 42-+Ba 2+BaSO 4 ↓2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3 +3H 2SO 4 Al 3++3H 2O Al(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH3Na 2SO 4+2Al(OH)3 ↓Al 3++3OH-Al(OH)3 ↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2OAl 3++4OH-AlO 2-+2H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3 ↓+3BaSO 4 ↓2Al 3++3SO 42-+3Ba 2++6OH -2Al(OH)3 ↓+3BaSO 4 ↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:冰晶石电解Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓最新文件仅供参考已改成word文本。
铝及其化合物的化学方程式和离子方程式

铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al +3O 22Al 2O 32、铝在氯气中燃烧:2Al +3Cl 22AlCl 34、铝与稀硫酸反应:2Al +3H 2SO 4Al 2(SO 4)3 +3H 2 ↑ 2Al +6H+2Al 3++3H 2 ↑5、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O 2NaAlO 2+3H 2 ↑ 2Al +2OH -+2H 2O 2AlO 2-+3H 2 ↑8、铝和稀硝酸反应:Al +4HNO 3Al(NO 3)3 +NO ↑+2H 2OAl +4H ++NO 3-Al 3++NO ↑+2H 2O 12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2(SO 4)3 +3H 2O Al 2O 3+6H+2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓冰晶石电解SO42-+Ba2+BaSO4↓2、硫酸铝的水溶液呈酸性:Al 2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H 2O Al(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO 2+2H2O AI(OH)3+NaOHAlO 2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓金属钠的有关化学方程式1、钠在空气中放置 4Na + O2 === 2 Na2O2、钠在空气中点燃 2Na + O2 ===== Na2O23、钠和硫反应 2Na + S === Na2S4、钠和水反应 2Na + 2H2O === 2NaOH + H2↑5、钠和硫酸铜溶液反应 2Na + CuSO4 + 2H2O === Cu(OH)2 ↓+ Na2SO4 + H2 ↑6、钠和乙醇反应 2Na + 2CH3CH2OH === 2CH3CH2ONa +H2↑7、氧化钠和水反应 Na2O + H2O === 2NaOH8、氧化钠和二氧化碳反应 Na2O + CO2 === Na2CO39、氧化钠和盐酸反应 Na2O + 2HCl === 2NaCl + H2O10、过氧化钠和水反应 2Na2O2 + 2H2O === 4NaOH + O2↑11、过氧化钠和二氧化碳反应2Na2O2 + 2CO2 === 2Na2CO3 + O2 12、12、过氧化钠和盐酸反应 2Na2O2 + 4HCl === 4NaCl + 2H2O + O2↑13、碳酸氢钠受热分解 2NaHCO3 ==== Na2CO3 + CO2↑+ H2O14、碳酸钠和盐酸反应 Na2CO3 +2HCl === 2NaCl + CO2↑ +H2ONa2CO3 + HCl ==== NaCl + NaHCO315、碳酸氢钠和盐酸反应 NaHCO3 + HCl === NaCl + CO2↑ +H2O16、碳酸钠和氢氧化钙反应 Na2CO3 + Ca(OH)2 === CaCO3 ↓+ 2NaOH17、碳酸氢钠和氢氧化钠反应 NaHCO3 + NaOH === Na2CO3 + H2O18、足量的碳酸氢钠和氢氧化钙反应 2NaHCO3 + Ca(OH)2 === CaCO3↓+ Na2CO3 + 2H2O19、少量的碳酸氢钠和氢氧化钙反应 NaHCO3 + Ca(OH)2 === CaCO3↓+ NaOH + H2O。
03 铝及其重要的化合物高考重要的化学方程式

知识点2 氧化铝的性质
1.与酸溶液反应 (1)与盐酸反应 ①化学反应:Al2O3+6HCl 2AlCl3+3H2O ②离子反应:Al2O3+6H+ 2Al3++3H2O (2)与碳酸反应:不反应
知识点2 氧化铝的性质
2.与碱溶液反应 (1)与烧碱反应 ①化学反应:Al2O3+2NaOH+3H2O 2Na[Al(OH)4] 或 Al2O3+2NaOH 2NaAlO2+H2O ②离子反应:Al2O3+2OH-+3H2O 2[Al(OH)4]- 或 Al2O3+2OH- 2AlO2-+H2O (2)与氨水反应:不反应
4.热分解反应:2Al(OH)3 Al2O3+3H2O
知识点4
铝盐的性质
1.铝盐和强碱溶液反应 (1)量不同,反应不同 ①少量烧碱:Al3++3OH- Al(OH)3↓ ②过量烧碱:Al3++4OH- [Al(OH)4]- (2)滴加顺序不同,现象不同 ①向铝盐溶液中滴加强碱溶液:先产生白色沉淀,后沉淀溶解
↓ ②过量盐酸:[Al(OH)4]-+4H+ Al3++4H2O 或 AlO2-+4H+ Al3++4H2O
(2)滴加顺序不同,现象不同 ①向四羟基合铝酸盐溶液中滴加强酸溶液:先产生白色沉淀,后沉淀溶解
3 +3H +
●AB 段:[Al(OH)4]-+H+ Al(OH)3↓+H2O;●BD 段:Al(OH) Al3++3H2O ②向强酸溶液中滴加四羟基合铝酸盐溶液:先无沉淀产生,后产生白色沉淀
al及其化合物的化学方程式

al及其化合物的化学方程式aluminum (Al)是一种常见的金属元素,化学符号为Al,原子序数为13。
它是一种轻质、耐腐蚀和导电性能良好的金属,广泛应用于工业和日常生活中。
在化学方程式中,Al通常以离子的形式存在,即Al3+。
Al3+是一种具有3个正电荷的阳离子,它与其他阴离子或分子结合形成化合物。
其中,最常见的化合物是氧化铝(aluminum oxide,Al2O3)。
氧化铝是一种白色固体,具有高熔点和高硬度,被广泛用作陶瓷材料、砂纸和研磨剂等。
氧化铝的化学方程式为:2Al + 3O2 → 2Al2O3这个方程式表示了氧化铝的合成反应,其中2个Al原子与3个O2分子反应生成2个Al2O3分子。
这个反应是一个氧化反应,Al原子失去电子形成Al3+离子,而氧气分子接受电子形成氧化物离子(O2-)。
Al2O3是一种离子化合物,其中Al3+离子和O2-离子通过离子键结合在一起。
Al还可以与非金属元素形成其他化合物,如与氯(Cl)形成氯化铝(aluminum chloride,AlCl3)。
氯化铝是一种白色晶体,具有强烈的吸湿性,可用作催化剂和制造其他化学品的原料。
氯化铝的化学方程式为:2Al + 3Cl2 → 2AlCl3这个方程式表示了氯化铝的合成反应,其中2个Al原子与3个Cl2分子反应生成2个AlCl3分子。
这个反应是一个氧化还原反应,Al 原子失去电子形成Al3+离子,而氯气分子接受电子形成氯离子(Cl-)。
AlCl3是一种离子化合物,其中Al3+离子和Cl-离子通过离子键结合在一起。
Al还可以与氧气和盐酸等物质反应生成不同的化合物。
例如,当Al 与氧气反应时,可以生成氧化铝(Al2O3),而当Al与盐酸反应时,可以生成氯化铝(AlCl3)。
这些化合物在工业生产和实验室研究中都有广泛的应用。
总结起来,Al及其化合物的化学方程式描述了Al原子与其他元素或化合物之间的反应过程,通过失去或接受电子形成不同的离子化合物。
铝及其化合物的化学方程式和离子方程式
铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑ 2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O 8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO4Al2(SO4)3+3H2OAl2O3+6H+2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑ 三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH )3 +3H 2SO 4Al 2(SO 4)3 +6H 2OAl(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOHNaAlO 2+2H 2O Al (OH)3 +OH-AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH )3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O2Al(OH )3 +3H 2SO 4Al 3++3H 2OAl(OH)3 +3H +2、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH 3Na 2SO 4+2Al(OH )3 ↓Al 3++3OH-Al(OH)3 ↓3、向硫酸铝溶液中加足量的氢氧化钠溶液:Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2OAl 3++4OH-AlO 2-+2H 2O4、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al 2(SO 4)3 +3Ba(OH)2 2Al (OH )3 ↓+3BaSO 4 ↓2Al 3++3SO 42-+3Ba 2++6OH-2Al (OH)3 ↓+3BaSO 4 ↓5、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al 2(SO 4)3 +4Ba(OH)2Ba(AlO 2)2 +3BaSO 4 ↓+4H 2O冰晶石电解2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O6、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+7、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑8、向硫酸铝溶液中加入碳酸氢钠溶液(灭火器原理):Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑9、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓六、明矾1、明矾净水:Al3++3H2O Al(OH)3(胶体)+3H+2、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO4 3Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓3、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2O Al3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O。
铝及其化合物的化学方程式和离子方程式
铝及其化合物的化学方程式和离子方程式一、铝?1、铝在氧气中燃烧:4Al+3O2=2Al2O3?2、铝在氯气中燃烧:2Al+3Cl2=2AlCl3?3、铝和硫共热:2Al+3S=Al2S3?4、铝与稀硫酸反应:2Al+3H2SO4=Al2(SO4)3?+3H2?↑?2Al+6H+=2Al3++3H2?↑?5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2?↑?????????????????????????6、铝和浓硫酸共热:2Al+6H2SO4=Al2(SO4)3?+3SO2?↑+6H2O?7、铝和浓硝酸共热:Al+6HNO3=Al(NO3)3?+3NO2?↑+3H2O?8、铝和稀硝酸反应:Al+4HNO3=Al(NO3)3?+NO?↑+2H2O??9、铝和硝酸银溶液反应:Al+3AgNO3=Al(NO3)3?+3Ag?Al+3Ag10、铝与硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3?+3Cu?2Al+3Cu2?11、铝和氧化铁高温下反应:2Al+Fe2O3=Al2O3+2Fe?12、铝和四氧化三铁高温共热:8Al+3Fe3O4=4Al2O3+9Fe?13、铝和氧化铜高温共热:2Al+3CuO=Al2O3+3Cu?14、铝和二氧化锰高温共热:4Al+3MnO2=2Al2O3+3Mn?二、氧化铝?1、氧化铝与稀硫酸反应:Al2O3+3H2SO4=Al2(SO4)3?+3H2O?Al2O3+6H2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2O?Al2O3+2OH3、电解氧化铝的熔融液:2Al2O3=4Al+3O2?↑?三、氢氧化铝?1、氢氧化铝与稀硫酸反应:2Al(OH)3?+3H2SO4=Al2(SO4)3?+6H2O?2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3?+NaOH=NaAlO2+2H2O????????????????????????????3、加热氢氧化铝:2Al(OH)3=?Al2O3+3H2O?四、硫酸铝?1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3?+3BaCl2=2AlCl3+3BaSO4?↓??2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O=2Al(OH)3?+3H2SO4??3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3?+6NaOH=3Na2SO4+2Al(OH)3?↓?4、向硫酸铝溶液中加足量的氢氧化钠溶液?Al2(SO4)3?+8NaOH=2NaAlO2+3Na2SO4+4H2O?5、向硫酸铝溶液中加入少量的氢氧化钡溶液:?Al2(SO4)3?+3Ba(OH)2?=2Al(OH)3?↓+3BaSO4?↓?6、向硫酸铝溶液中加入足量的氢氧化钡溶液:??冰晶石??电解?Al2(SO4)3?+4Ba(OH)2?=Ba(AlO2)2?+3BaSO4?↓+4H2O?7、向明矾溶液中加入少量的氢氧化钡溶液:?3Ba(OH)2?+2KAl(SO4)2?=2Al(OH)3?↓+3BaSO4?↓+K2SO4?? 8、向明矾溶液中加入足量的氢氧化钡溶液:?????KAl(SO4)2?+2Ba(OH)2?=KAlO2+2BaSO4?↓+2H2O?9、向硫酸铝溶液中加入氨水:Al2(SO4)3?+6NH3·H2O=2Al(OH)3?↓+3(NH4)2SO4?10、向硫酸铝溶液中加入碳酸钠溶液:?Al2(SO4)3?+3Na2CO3+3H2O=2Al(OH)3?↓+3Na2SO4+3CO2?↑?11、向硫酸铝溶液中加入碳酸氢钠溶液:?Al2(SO4)3?+6NaHCO3=2Al(OH)3?↓+3Na2SO4+6CO2?↑?12、向硫酸铝溶液中加入硫化钠溶液:?Al2(SO4)3?+3Na2S+6H2O=2Al(OH)3?↓+3Na2SO4+3H2S?↑?13、向硫酸铝溶液中加入硫氢化钠溶液:?Al2(SO4)3?+6NaHS+6H2O=2Al(OH)3?↓+3Na2SO4+6H2S?↑?14、向硫酸铝溶液中加入硅酸钠溶液:?Al2(SO4)3?+3Na2SiO3+6H2O=2Al(OH)3?↓+3Na2SO4+3H2SiO3?↓?15、向硫酸铝溶液中加入偏铝酸钠溶液:?Al2(SO4)3?+6NaAlO2+12H2O=3Na2SO4+8Al(OH)3?↓?五、偏铝酸钠?1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O=AI(OH)3?+NaOH??2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O=Al(OH)3?↓+NaCl??3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl=NaCl+AlCl3+2H2O?4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O=2Al(OH)3?↓+Na2CO3?5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O=Al(OH)3?+NaHCO36、向偏铝酸钠溶液中加入硫酸铝溶液:?Al2(SO4)3?+6NaAlO2+12H2O=3Na2SO4+8Al(OH)3?↓?7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O=Al(OH)3?↓+NaCl+NH3?↑?????????????????????????????8、向偏铝酸钠溶液中加入氯化铁溶液:?3NaAlO2+FeCl3+6H2O=3Al(OH)3?↓+Fe(OH)3?↓+3NaCl?。
铝及其化合物的化学方程式和离子方程式
铝及其化合物的化学方程式和离子方程式文件编码(008-TTIG-UTITD-GKBTT-PUUTI-WYTUI-8256)铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O2=2Al2O32、铝在氯气中燃烧:2Al+3Cl2=2AlCl33、铝和硫共热:2Al+3S=Al2S34、铝与稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑2Al+6H+=2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4=Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3=Al(NO3)3+3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3=Al(NO3)3+NO↑+2H2O9、铝和硝酸银溶液反应:Al+3AgNO3=Al(NO3)3+3AgAl+3Ag10、铝与硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu2Al+3Cu211、铝和氧化铁高温下反应:2Al+Fe2O3=Al2O3+2Fe12、铝和四氧化三铁高温共热:8Al+3Fe3O4=4Al2O3+9Fe13、铝和氧化铜高温共热:2Al+3CuO=Al2O3+3Cu14、铝和二氧化锰高温共热:4Al+3MnO2=2Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO4=Al2(SO4)3+3H2OAl2O3+6H2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2OAl2O3+2OH3、电解氧化铝的熔融液:2Al2O3=4Al+3O2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH=NaAlO2+2H2O3、加热氢氧化铝:2Al(OH)3=Al2O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl2=2AlCl3+3BaSO4↓2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O=2Al(OH)3+3H2SO43、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH=3Na2SO4+2Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液Al2(SO4)3+8NaOH=2NaAlO2+3Na2SO4+4H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:冰晶石电解Al2(SO4)3+4Ba(OH)2=Ba(AlO2)2+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)2=2Al(OH)3↓+3BaSO4↓+K2SO48、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO410、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O=2Al(OH)3↓+3Na2SO4+3CO2↑Al2(SO4)3+6NaHCO3=2Al(OH)3↓+3Na2SO4+6CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O=2Al(OH)3↓+3Na2SO4+3H2S↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O=2Al(OH)3↓+3Na2SO4+6H2S↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O=2Al(OH)3↓+3Na2SO4+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O=3Na2SO4+8Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O=AI(OH)3+NaOH2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl=NaCl+AlCl3+2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO35、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O=Al(OH)3+NaHCO36、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O=3Na2SO4+8Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O=Al(OH)3↓+NaCl+NH3↑3NaAlO2+FeCl3+6H2O=3Al(OH)3↓+Fe(OH)3↓+3NaCl。
铝及其化合物的化学方程式和离子方程式
铝及其化合物的化学方程式和离子方程式1、铝和硫共热:2Al+3S Al2S32、铝与稀硫酸反应:2Al+3H2SO 4Al2(SO4)3+3H2↑2Al+6H +2Al3++3H2↑3、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑4、铝与硫酸铜溶液反应:2Al+3CuSO 4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu5、铝和氧化铁高温下反应:2Al+Fe2O 3Al2O3+2Fe6、铝和二氧化锰高温共热:4Al+3MnO 22Al2O3+3Mn7、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O8、电解氧化铝的熔融液:2Al2O 34Al+3O2↑9、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O10、加热氢氧化铝:2Al(OH)3Al2O3+3H2O11、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓12、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O 13、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓14、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O15、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+16、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓17、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓18、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O19、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-20、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-冰晶石电解铝及其化合物的化学方程式和离子方程式1、铝和硫共热:2、铝与稀硫酸反应:3、铝和氢氧化钠溶液反应:4、铝与硫酸铜溶液反应:5、铝和氧化铁高温下反应:6、铝和二氧化锰高温共热:7氧化铝与氢氧化钠溶液反应:8、电解氧化铝的熔融液:9、氢氧化铝与氢氧化钠溶液反应:10、加热氢氧化铝:11、硫酸铝溶液中加入少量的氢氧化钠溶液:12、向硫酸铝溶液中加足量的氢氧化钠溶液:13、向明矾溶液中加入少量的氢氧化钡溶液:14、向明矾溶液中加入足量的氢氧化钡溶液:15、向硫酸铝溶液中加入氨水:16、向硫酸铝溶液中加入偏铝酸钠溶液:17、偏铝酸钠溶液滴入少量盐酸:18、向偏铝酸钠溶液加入足量盐酸:19、向偏铝酸钠溶液通入少量二氧化碳气体:20、向偏铝酸钠溶液通入足量二氧化碳气体:铝及其化合物的化学方程式和离子方程式1、铝和硫共热:2、铝与稀硫酸反应:3、铝和氢氧化钠溶液反应:4、铝与硫酸铜溶液反应:5、铝和氧化铁高温下反应:6、铝和二氧化锰高温共热:7氧化铝与氢氧化钠溶液反应:8、电解氧化铝的熔融液:9、氢氧化铝与氢氧化钠溶液反应:10、加热氢氧化铝:11、硫酸铝溶液中加入少量的氢氧化钠溶液:12、向硫酸铝溶液中加足量的氢氧化钠溶液:13、向明矾溶液中加入少量的氢氧化钡溶液:14、向明矾溶液中加入足量的氢氧化钡溶液:15、向硫酸铝溶液中加入氨水:16、向硫酸铝溶液中加入偏铝酸钠溶液:17、偏铝酸钠溶液滴入少量盐酸:18、向偏铝酸钠溶液加入足量盐酸:19、向偏铝酸钠溶液通入少量二氧化碳气体:20、向偏铝酸钠溶液通入足量二氧化碳气体:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铝及其化合物转化关系相关化学或离子方程式
姓名
1、铝与稀硫酸反应
2、铝与稀硝酸反应
3、铝与氢氧化钾溶液反应
4、铝与四氧化三铁混合加热
5、铝与氯化铜溶液反应
6、氧化铝与硫酸反应
7、氧化铝与氢氧化钾溶液反应
8、电解熔融的氧化铝
9、氢氧化铝与稀硝酸反应
10、氢氧化铝与氢氧化钾溶液反应
11、氢氧化铝加热分解
12、氯化铝溶液中通入过量氨水
13、氯化铝溶液中加入少量氢氧化钾溶液
14、氯化铝溶液中加入过量氢氧化钾溶液
15、氯化铝溶液中加入偏铝酸钠溶液
16、氯化铝溶液和碳酸钠溶液混合
17、氯化铝溶液和硫化钠溶液混合
18、氯化铝溶液和碳酸氢钠溶液混合
19、偏铝酸钠溶液与少量盐酸混合
20、偏铝酸钠溶液与过量盐酸混合
21、偏铝酸钠溶液中通入少量二氧化碳
22、偏铝酸钠溶液中通入过量二氧化碳。
