高中化学-铝及其化合物
高中化学《铝及其化合物性质》教学设计
《铝及其化合物性质》教学设计
学科化学教师姓名 xxxxxx 指导教师 xxx
课后作业尾声呼应苹果手机处理办法
氯化钾溶液中腐蚀速率;
对比铝在等氢离子浓度
盐酸和硫酸中反应速率
大小。
不能用酸性、碱性试剂处
理,可以选择有机溶剂或中
性洗涤剂清理
学以致用
形成性练习能力提升:教材51页,提到铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的东西。
请用离子方程式解释不宜存放酸性和碱性食物的原因,并设计实验验证NaCl中哪种离子对铝的腐蚀有加速作用。
课后提升:由于铍与铝都位于元素周期表金属与非金属的分界线附近,推测二者化学性质相似,请根据所学铝及其化合物的性质,写出铍、氧化铍、氢氧化铍分别与酸、碱反应的化学方程式和离子方程式。
板书设计
课后反思1、本节课的重点是介绍铝及其化合物的“两性”,由于这个概念不好理解,所以
借助了大量生活常识和实验现象作为副证,希望学生能够自己得出结论,而不是记住一个结论。
大部分同学接受得不错,但由于学生差异化的存在,可能还有部分同学存在疑问,未能在本堂课中解决。
2、本节课尝试分组做不同实验,最后汇总得到结论的方式。
效果很好,既节省课
堂时间,又增强同学间的协作和本身的责任感,也对同学们汇总实验数据和现象的能力有所帮助。
3、课堂练习主要以探究题为主,没有涉及计算和性质判断等方面的题型。
人教版高中化学必修1[知识点整理及重点题型梳理]_铝及其化合物_提高
![人教版高中化学必修1[知识点整理及重点题型梳理]_铝及其化合物_提高](https://uimg.taocdn.com/0318cb5cddccda38376baf7d.webp)
人教版高中化学必修一知识点梳理重点题型(常考知识点)巩固练习铝及其化合物【学习目标】1、铝的性质;2、铝的重要化合物及其相互转化。
【要点梳理】 要点一、铝12.化学性质 Al-3e -=Al 3+(1)与非金属反应: a 、铝与氧气的反应。
【铝及其化合物】实验探究:加热有氧化膜和无氧化膜的铝箔b 、与其它非金属反应: 2Al+3S Al 2S 3 2Al+3Cl 2 2AlCl 3(2)与酸反应:(3)与碱反应2Al+2H 2O+2NaOH =2NaAlO 2+3H 2↑ 2Al+2H 2O+2OH -=2AlO 2-+3H 2↑ 要点诠释:①铝是一种较活泼的金属,它并不直接与碱反应,铝与氢氧化钠溶液的反应,实际分两步进行:首先要铝与水反应:2Al+6H2O=2Al(OH)3↓+3H2↑……①由于生成的Al(OH)3覆盖在Al的表面,故看不到H2的生成;其次是生成的Al(OH)3是两性氢氧化物,它溶于NaOH:Al(OH)3+NaOH=NaAlO2+2H2O……②所以铝与NaOH溶液反应可以看到有气体产生。
将两反应式按①+②×2合并,即得总反应式:2Al+2H2O+2NaOH=2NaAlO2+3H2↑。
所以在上述反应中Al是还原剂,H2O是氧化剂。
其电子转移情况可表示如下:②Al与酸、碱反应产生同量的H2,消耗Al的物质的量之比为1∶1,消耗盐酸和NaOH的物质的量之比为3∶1。
③酸、碱、盐可直接侵蚀铝的保护膜(氧化铝也能与酸或碱反应)以及铝制品本身,因此铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。
④铝热反应:Al+M x O y Al2O3+xM铝热反应的应用:冶炼高熔点金属,如Fe、V、Cr、Mn等或焊接钢轨。
3.用途:铝主要用来制轻合金。
要点二、铝的化合物1.氧化铝(Al2O3)(1)物理性质:白色难熔固体、不溶于水。
(2)化学性质:Al2O3是典型的两性氧化物,既能与酸反应又能与强碱溶液反应。
高中化学-铝及其化合物(人教版必修一精编讲义 习题)
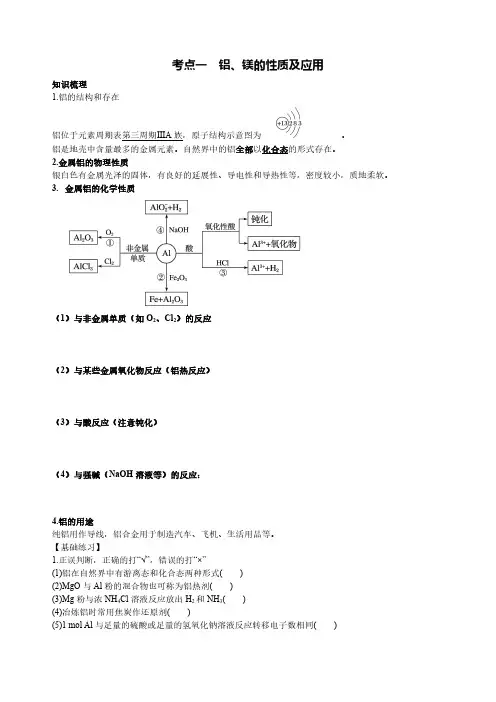
考点一铝、镁的性质及应用知识梳理1.铝的结构和存在铝位于元素周期表第三周期ⅢA族,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
3.金属铝的化学性质(1)与非金属单质(如O2、Cl2)的反应(2)与某些金属氧化物反应(铝热反应)(3)与酸反应(注意钝化)(4)与强碱(NaOH溶液等)的反应:4.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
【基础练习】1.正误判断,正确的打“√”,错误的打“×”(1)铝在自然界中有游离态和化合态两种形式()(2)MgO与Al粉的混合物也可称为铝热剂()(3)Mg粉与浓NH4Cl溶液反应放出H2和NH3()(4)冶炼铝时常用焦炭作还原剂()(5)1mol Al与足量的硫酸或足量的氢氧化钠溶液反应转移电子数相同()(6)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐()题组一对比掌握铝、镁的性质1.镁粉是焰火、闪光粉、鞭炮中不可缺少的原料。
工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气、②CO2、③Ar、④H2、⑤N2,其中可作为冷却气体的是A.①和②B.②和③C.③和④D.④和⑤2.下列关于铝单质的叙述中正确的是A.由于铝在空气中不会锈蚀,所以铝制品的使用寿命都很长B.由于铝具有强还原性,所以常用铝来冶炼某些高熔点金属C.常温下,铝被浓硫酸钝化,所以可用浓硫酸除去铝表面的铜镀层D.由于铝的导电性能比铜强,所以常用铝制造电线、电缆题组二铝与酸或碱反应的计算3.(2016·河北衡水中学高三模拟)将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是A.3mol/L HClB.4mol/L HNO3C.8mol/L NaOHD.18mol/LH2SO44.铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。
铝及其化合物说课稿

铝及其化合物说课稿一、说教材(一)作用与地位“铝及其化合物”是高中化学教学的重要组成部分,它既是对金属元素学习的一个延伸,也是对化合物知识的一个拓展。
本文在教材中的作用主要体现在:一是通过对铝及其化合物的学习,使学生掌握金属铝的性质、用途及其化合物的形成和变化规律;二是培养学生的实验操作能力和观察能力,提高学生的科学素养。
(二)主要内容本文主要内容包括:铝的物理性质、化学性质;铝的冶炼方法;铝的重要化合物,如氧化铝、氢氧化铝等;铝及其化合物的应用领域。
(三)教材特色本文教材特色在于:一是紧密结合实际,以铝及其化合物在生产生活中的应用为例,激发学生的学习兴趣;二是注重实验探究,通过设计一系列实验,引导学生主动探究铝及其化合物的性质和变化规律。
二、说教学目标(一)知识与技能目标1. 了解铝的物理性质、化学性质及其应用。
2. 学会铝的冶炼方法,理解其原理。
3. 掌握氧化铝、氢氧化铝等铝的重要化合物的性质和制备方法。
4. 能够运用所学知识解决实际问题。
(二)过程与方法目标1. 通过实验探究,培养学生的观察能力、动手操作能力和问题解决能力。
2. 通过小组合作学习,提高学生的交流与表达能力。
(三)情感态度价值观目标1. 培养学生对化学学科的兴趣,激发学习热情。
2. 增强学生的环保意识,认识到铝及其化合物在环境保护中的重要作用。
三、说教学重难点(一)教学重点1. 铝的物理性质、化学性质。
2. 铝的冶炼方法及其原理。
3. 氧化铝、氢氧化铝等铝的重要化合物的性质和制备方法。
(二)教学难点1. 铝的冶炼方法及其原理的理解。
2. 氧化铝、氢氧化铝等铝的重要化合物性质的掌握。
在教学过程中,要注意引导学生通过实验探究,深入理解铝及其化合物的性质和变化规律,突破教学难点。
同时,注重培养学生的实验操作能力和问题解决能力,提高教学质量。
四、说教法(一)启发法在教学过程中,我采用启发式教学法,引导学生主动思考问题。
通过设计一系列具有启发性的问题,激发学生的求知欲,促使他们积极参与课堂讨论。
高中化 专题二 物质性质的研究 课题1 铝及其化合物的性质案 苏教6

课题1铝及其化合物的性质一、铝的性质及实验注意事项1.铝与氧气反应实验的注意事项(1)铝片要薄,使用前用细砂纸轻轻打磨掉氧化膜,可用香烟盒或纸制电容器上的铝箔。
(2)反应放出大量热,生成的固体温度较高,集气瓶瓶底盛有少量水或放入细沙,起隔热作用,防止集气瓶炸裂。
(3)铝箔不易直接点燃,火柴有引燃作用,也可改用镁条引燃。
(4)待火柴快要燃烧完时,将铝条伸入盛有氧气的集气瓶.若插入过早或直接将铝箔插入瓶底,会因火柴燃烧消耗较多的氧气或将部分氧气排出瓶外,使铝箔不能充分燃烧。
2.Al3+、Al(OH)3、Al(OH)错误!间的相互转化由于Al(OH)3具有两性,在不同情况下Al3+、Al(OH)3、Al(OH)错误!间能相互转化,其转化关系如下:此转化有许多重要应用如选择制备Al(OH)3的最佳途径,判断离子共存问题,用于物质的推断、检验,还经常涉及定量计算。
3.铝热反应的实验注意事项注意事项:①Fe2O3粉末与Al粉要选干燥的,Al粉要用未被氧化的,否则,反应难以进行.②Fe2O3与Al的物质的量之比要控制在1∶2,且二者要混合均匀,以保证Fe2O3与Al都完全反应。
③玻璃漏斗内的纸漏斗要厚一些(如四层纸),并要用水润湿,以防损伤玻璃漏斗。
④承接反应物的蒸发皿内要垫适量细沙,一是防止蒸发皿炸裂,二是防止熔融的固体溅出伤人。
⑤实验装置不要距离人群太近,或将实验在玻璃通风橱内操作,防止人体受伤。
【例1】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如下图所示。
反应中镁和铝的( )A.物质的量之比为3∶2B.质量之比为3∶2C.摩尔质量之比为2∶3D.反应速率之比为2∶3解析:由图像可知,两个反应中生成的氢气一样多,说明两种金属提供的电子数目一样多,则镁、铝的物质的量之比为3∶2,质量之比为4∶3,A项正确,B项错误。
镁、铝的摩尔质量之比为8∶9,C项错误。
由图像可知,镁、铝与硫酸反应需要的时间之比为2∶3,则二者的速率之比为3∶2,D项错误。
铝及其化合物 2

《铝 金属材料》 之《铝及其化合物》
考纲要求 1.了解金属铝的主要性质及应用。 2.了解铝的重要化合物的主要性质及 应用。
高考热点 1.铝及其化合物之间的转化关系。 2.Al(OH)3 的两性。 3.有关 Al(OH)3 生成和溶解的图像分 析。
Ⅰ.判断对错,并说明原因
1.(2014· 福建卷)铝罐可久盛食醋。( × )
(4)你认为哪种工艺流程有需要改进的地方?
重点1 重点2
2013 大纲版全国卷29
课堂探究二
有关氢氧化铝沉淀的图像分析
下列各图中的纵坐标表示沉淀的物质的量,横坐标表示加入x的物质的量,请 从图中选出选项所对应的图象并将字母填入括号内。
E
B
D
F
C
A
A.AlCl3溶液中滴入氨水 B.AlCl3溶液中滴入NaOH溶液 C.在盐酸酸化的AlCl3溶液中,滴入KOH溶液 D.AlCl3、MgSO4的混合溶液中加入过量NaOH溶液 E.Na[Al(OH)4]溶液中通入HCl F.AlCl3溶液中滴入Na[Al(OH)4]溶液
随堂巩固
一、铝及其化合物的转化关系及应用
突破点:Al、Al2O3、 Al(OH)3都能与强碱反应
二、有关氢氧化铝沉淀的图像分析
n[Al(OH)3]
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=Al(OH)4突破点:Al(OH)3溶解的一段
n(NaOH)
合作学习
课堂探究一 铝及其化合物的转化关系及应用
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化 铝的两种工艺流程如下:
请回答下列问题: (1)流程甲加入盐酸后生成Al3+的离子方程式为______________。流程 乙加入烧碱后生成SiO32-的离子方程式为_____________。 (2)滤液E、K中溶质的主要成分是__________(填化学式)。 (3)从铝土矿中分离出Al2O3,利用了Al2O3的什么性质?
高中化学铝及其化合物基础练习题(含答案解析)
高中化学铝及其化合物基础练习题一、单选题1.下列对化学物质的应用描述错误的是()A.硬铝常用于制造飞机的外壳Fe O常用作油漆、涂料、油墨和橡胶的颜料B.34C.液氯可以储存在钢瓶中H为燃料的汽车D.储氢合金可用于以22.常温下,下列溶液能用铝制容器盛装的是()A.稀硫酸 B.浓硝酸 C.盐酸D.氢氧化钠的溶液3.下列关于物质检验的说法错误的是()A.用水可以鉴别苯、四氯化碳和乙醇B.向某溶液中滴加氯水,溶液变黄色,原溶液一定含有Fe2+C.向溶液中滴加少量的盐酸,产生白色沉淀,则原溶液可能含有AlO2-D.向溶液中加氯化钡溶液和稀硝酸,产生白色沉淀,则原溶液可能含SO32-4.下列关于金属铝的叙述中,不正确的是()A.铝的化学性质很活泼,但在空气中不易锈蚀B.铝箔在空气中受热可以熔化,且发生剧烈燃烧C.等质量的铝分别与足量盐酸、氢氧化钠溶液反应放出的气体物质的量相等D.铝的熔点比氧化铝低5.收藏的清末铝制艺术品至今保存完好,该艺术品未被锈蚀的主要原因是()A.铝不易被氧化B.铝的氧化物在空气中易变成铝C.铝的密度小,是一种轻金属D.铝易被氧化,形成的氧化膜有保护作用6.下列金属冶炼的反应原理,错误的是()A.2NaCl(熔融)电解2Na+Cl2↑B.Al2O3+3H2高温2Al+3H2OC.Fe3O4+4CO高温3Fe+4CO2D.2HgOΔ2Hg+O2↑7.下列有关物质的性质与用途正确且具有对应关系的是()A.SO2具有氧化性,可用于漂白纸浆B.NH4HCO3受热易分解,可用作氮肥C.金属钠具有还原性,可从硫酸铜溶液中置换出铜D.Al2O3熔点高,可用作耐高温材料8.下列物质性质与应用对应关系正确的是()A.氨气具有还原性,可用作制冷剂B.Na2O2呈浅黄色,可用作潜水艇中的供氧剂C.明矾水解形成Al(OH)3胶体,可用作水处理中的净水剂D.碳酸钠溶液显碱性,可用作锅炉除垢时CaSO4沉淀的转化剂9.如表所示,关于物质的分类,下列组合不正确...的是()A.A B.B C.C D.D10.下列关于金属铝及其化合物的叙述中,不正确的是()A.铝的化学性质很活泼,但在空气中不易锈蚀B.氧化铝能与氢氧化钠溶液反应,故氧化铝为酸性氧化物C.Al、Al2O3均能与酸、碱反应,因此铝制炊具不宜用来蒸煮酸性或碱性食物D.在酒精灯上加热打磨过的铝箔,铝箔熔化,但熔化的铝不滴落下来11.镁、铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是()A.二者物质的量之比为3:2B.二者质量之比为2:3C .二者分别与足量的氢氧化钠溶液,产生气体体积仍然相等D .二者消耗H 2SO 4的物质的量之比为2:312.下图是铝热反应(2Al +Fe2O3Al2O3+2Fe)的实验装置,有关该反应的下列说法中正确的是 ( )A .a 为镁条B .2 mol 氧化剂参与反应则电子转移6NA 个C .b 为氧化铁与铝粉的混合物D .还原剂与氧化产物的物质的量之比为1∶2二、填空题13.分析下列氧化物的类别,判断下列转化能否实现。
高中化学铝及其化合物知识点
高中化学铝及其化合物知识点
高中化学铝及其化合物知识点
一、铝的基本性质
铝是一种具有典型金属性的轻金属,具有许多良好的物理化学性质,例如具有较高的导热性和电导率,低密度和良好的可塑性等。
二、铝的制备方法
1. 金刚砂法
2. 电解法
三、铝的氧化物——氧化铝
氧化铝是一种常见的氧化物,也是铝的重要产物。
它具有很高的熔点和硬度,在高温环境下能保持极好的稳定性。
四、铝的氢氧化物——氢氧化铝
氢氧化铝是一种白色无定形粉末,容易吸收水分,也是很常见的铝的化合物。
它常用于制备其他铝化合物,如氧化铝等。
五、铝与酸、碱的反应
铝在一定的条件下与酸发生反应,会产生氢气和相应的铝盐。
与碱的反应则会生成相应的铝盐和氢氧化铝。
六、铝的应用领域
1. 金属材料——铝合金
2. 化工领域——氢氧化铝生产
3. 医疗领域——生物医学器械制造
4. 轻工业——食品包装、建筑材料
七、铝在环境中的影响
铝的大量排放对环境和生态系统造成了很大的负担,铝在水体中的存在会导致生态系统的异常变化和动植物死亡。
同时,铝的废弃物也会污染土地和空气,对人类健康造成不良影响。
八、铝及其化合物的安全问题
铝及其化合物存在一定的安全问题,长期接触铝化合物会对人体神经系统产生影响,增加患上老年痴呆症等疾病的概率。
总之,对于高中化学学生而言,学习铝及其化合物的知识点是非常重要的,理解这些知识将有助于他们更好地掌握化学基础理论,从而为未来更深入地研究化学打下坚实的基础。
高中化学铝及其重要化合物
非氧化性酸 2Al+6H+==2Al3++3H2
3.用途 纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
返回导航页
结束放映
【思考与探究】
1.金属铝是活泼的金属,能与酸反应,为什么能用铝槽储 运浓H2SO4或浓HNO3? 常温下浓H2SO4、浓HNO3能使铝钝化(在表面形成一层致密 的氧化膜),阻止反应的继续进行。
(3)制得Al(OH)3的最大质量是________。
返回导航页
结束放映
考点三 用数形结合思想理解Al3+、Al(OH)3、AlO2-之间转化 量的关系
【知识梳理】 1.用转化图探究Al3+、AlO、Al(OH)3的转化关系
写出转化(2)、(5)、(6)离子方程式:
返回导航页
结束放映
2.用数轴探究可溶性铝盐与强碱(如NaOH溶液)反应,铝元 素的存在形式
(1)Al3++4OH-===AlO+2H2O 3AlO+Al3++6H2O===4Al(OH)3↓
(2)
返回导航页
结束放映
题型一
【题型建模】
1.下列各组物质,前者逐滴滴加到后者中直至过量,先出
现白色沉淀,后来沉淀又消失的是( A )
A.H2SO4滴入NaAlO2溶液中 B.Ba(OH)2溶液滴入Al2(SO4)3溶液中 C.Al2(SO4)3溶液滴入NaOH溶液中 D.氨水滴入Al2(SO4)3溶液中
【思考与探究】 1.下列变化可通过一步化学反应直接完成的是___①_____。 (1)Al(OH)3→Al2O3 (2)Al2O3→Al(OH)3 (3)Al→Al(OH)3 2.既能与盐酸反应,又能与NaOH溶液反应的物质有哪些?
高中化学铝及其化合物知识点总结
铝及其化合物知识点总结铝及其化合物一、铝的结构:1、原子结构示意图:2、周期表中位置:第三周期ⅢA族镁原子核外有三个电子,在化学反应中,容易失去最外层的三个电子,显+3价。
二、铝单质的性质1、物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2、化学性质:(1)与非金属单质反应:A、2Al+3Cl22AlCl3B、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O2 2Al2O3思考:在金属活泼性顺序中铝排在铁的前面,那为什么铁在空气中易生锈而铝在空气中不易被腐蚀呢?铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
(2)与盐溶液反应:2Al+3CuSO4=3Cu+Al2(SO4)3(3)与某些氧化物反应—铝热反应:2Al + Fe2O32Fe + Al2O3铝热剂[现象]:发出耀眼的光芒、放出大量的热、有熔融物生成。
铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、Mn O2等。
②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
③要使用没有氧化的铝粉,氧化铁粉末要烘干。
④KClO3作为引燃剂,也可以用Na2O2代替。
实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。
[试一试]:写出Al分别与MnO2、V2O5的反应方程式(4)与沸水微弱反应:2Al+6H2O2Al(OH)3+ 3H2↑(5)与酸反应::2Al+6HCl ====== 2AlCl3+H2↑2Al+3H2SO4====== Al2(SO4)3+ 3H2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铝及其化合物每识每课传说在古罗马,一天,一个陌生人去拜见罗马皇帝泰比里厄斯(Tiberius),献上一只金属杯子,杯子象银子一样闪闪发光,但是分量很轻。
它是这个人从粘土中提炼出的新金属。
但这个皇帝表面上表示感谢,心里却害怕这种光彩夺目的新金属会使他的金银财宝贬值,就下令把这位发明家斩着。
从此,再也没有人动过提炼这种"危险金属"的念头,这种新金属就是现在大家非常熟悉的铝。
在19世纪以前,铝被认为是一种希罕的贵金属,价格比黄金还要贵。
当一个欧洲君主买了一件有铝钮扣的衣服时,他就瞧不起那些买不起这种奢侈品的其它君主。
而没有铝钮扣衣服的君主,又是多么渴望有朝一日自己也能穿上这种带铝钮扣的衣服。
在法国拿破仑三世统治时期,就曾经发生过现在看来很好笑的一件事情。
在一个国王举办的盛宴上,只有王室成员和贵族来宾才能荣幸地用铝匙和铝叉用餐。
当然,被伤了脸面的客人们是无论如何吃不好这顿盛餐的了。
此外,为了让其他国王对自己产生羡慕和妨忌,他花了大量资金让他的警卫部队的卫士穿上铝胸甲,因备有铝铠甲的确太昂贵了,其他国王无能为力。
俄罗斯作家车尔尼雪夫斯基(Chernyshevsky)曾在他的小说《怎么办》1863年中写到:终有一天,铝将代替木材,甚至可能代替石头。
看,这一切是多么奢侈,到处都是铝。
1889年,当门捷列夫在伦敦时,为了表彰他的伟大勋业,他被赠予一件贵重奖品──用金和铝制作的天平。
其实,这些都不足为奇,因为铝的价值贵贱,完全取决于炼铝工业的水平。
随着铝产量的增加,铝价也就下降。
1854年,1公斤铝需1200卢布,而到了十九世纪末就降到1卢布。
显然,珠宝商人已经对铝完全失去了兴趣,但是,铝却立即吸引了整个工业界。
1818年,用铝合金造出了第一架飞机,从此以后,铝的命运就牢固地与飞机制造业联系在一起了。
铝被誉为"带翼的金属"。
一、金属铝的物理性质铝为_______色金属,熔点为660.4℃,沸点为2467℃,密度为2.7g·cm-3,导电性仅次于银、铜和金,质地柔软。
地壳中含量最多的金属元素是_______,在地壳中以___________的形式存在。
【思考】请你根据铝的用途写出对应的铝的物理性质。
铝的物理性质→用途___________________易加工成各种形状,包装装饰工艺___________________制成合金,用在飞机航天器上___________________铝锅、铝壶等加热器皿___________________铝芯电线、电缆答案:银白铝化合物良好的延展性密度小,硬度大导热性导电性二、金属铝的化学性质铝是比较活泼的金属,在化学反应中较容易失去3个电子变成带3个单位正电荷的阳离子。
1.铝的氧化反应(1)点燃的条件下,Al与O2反应。
课堂实验1:把2cm×5cm铝箔的一端固定在粗铁丝上,另一端裹一根火柴。
点燃火柴,待火柴快燃尽时,立即把铝箔伸入盛有氧气的集气瓶中(集气瓶底部要放一些细沙),观察现象。
现象:______________________________________________方程式:_______________________________________________(2)常温下,铝被空气里的氧气氧化,在表面生成一层致密的氧化物薄膜,阻止内部的金属继续与氧气反应。
学生活动:观看“毛刷实验”视频新知精讲课堂实验2:用砂皮擦去铝条表面的氧化膜,把铝条插入硝酸汞溶液里。
稍后,取出铝条,用滤纸轻轻地把表面吸干,再把铝条放在干燥的滤纸上。
观察与分析:_________________________________________________ 结论:______________________________________________________ 答案:(1)铝箔在氧气中剧烈燃烧,放出大量的热河耀眼的白光。
4Al + 3O 2−−→−点燃 2Al 2O 3(2)铝在硝酸汞溶液中发生置换反应,有汞生成。
放在空气中的铝条与空气中的氧气反应生成氧化铝,变成毛刷状。
硝酸汞溶液处理铝片使铝片覆盖汞,防止生成致密的氧化膜,可使铝片不断被氧化。
毛刷的成分是氧化铝。
【思考1】铝是活泼金属,为什么铝制品常用来作为各种材料、具有一定的防腐蚀能力? 答案:因为铝易与空气中的氧气反应生成保护膜,保护着内部金属不易被腐蚀。
2.铝与氯气的反应课堂实验3:取一条铝箔,下端用小孔系住一根火柴,然后用镊子夹住上端,引燃后,迅速伸入盛有氯气的集气瓶中。
实验现象:_________________________________________________ 化学方程式:____________________________________________________ 答案:发出耀眼的光芒,放出大量的热2Al + 3Cl 2 点燃−−−→ 2AlCl 33.铝热反应学生活动:观看“铝热反应”视频课堂实验4:用两张圆形滤纸折成漏斗,把5g 氧化铁粉 末和2g 铝粉混合均匀,放在纸漏斗中,在底部剪一个 孔,用水润湿后,放在用硬纸做成的三角漏斗里,把漏 斗架在铁圈上,下面放置一个盛砂的蒸发皿。
在纸漏 斗中再加入少量氯酸钾,在混合物中间插上一根镁带,用小木条引火点燃镁带。
实验现象:_________________________________________________ 化学方程式:____________________________________________________答案:镁条剧烈燃烧,放出一定的热量,使氧化铁粉末与铝粉在较高温度下发生剧烈的反应。
反应放出大量的热,并发出耀眼的光芒。
我们还可以看到,纸漏斗的下部被烧穿,有熔融物落如沙中。
(待熔融物冷却后,除去外层熔渣,仔细观察,可以发现落下的是铁珠。
)−−−→Al2O3+2Fe2Al+Fe2O3高温【思考2】铝热反应中氯酸钾、镁条是什么作用?答案:铝热反应的装置中铝热剂在最下面,上面铺层氯酸钾,中间插根镁条,反应时先点燃镁条,镁条燃烧放出的热量使氯酸钾分解产生氧气,氧气的产生又促进了镁条的燃烧放出大量的热,因为铝热反应的条件是高温,这样反应得以进行。
注意:(1)铝粉和氧化铁的混合物叫做_____________。
当加热反应时,反应中会放出大量的热,使混合物达到很高的温度,生成氧化铝与液态铁,这个反应叫做铝热反应。
(2)还有一些金属氧化物和氧化铁相似也能发生铝热反应,这些氧化物有_________________。
(3)工业上常利用铝热反应冶炼某些难熔的金属(如钒、铬、锰)。
答案:(1)铝热剂铝热反应(2)V2O5、Cr2O3、MnO24.铝与热水反应反应方程式:____________________________________________【注意】Al(OH)3是白色胶状沉淀。
−−→2Al(OH)3 + 3H2↑答案:2Al + 6H2O∆5.铝与酸反应(1)与弱氧化性酸反应:稀硫酸:________________________________________盐酸:________________________________________离子方程式:________________________________________(2)与强氧化性酸反应①常温下,铝、铁遇浓硫酸、浓硝酸发生____________。
因此________(填“可以”或“不可以”)用铝制容器盛放和运输浓H2SO4、浓HNO3。
②加热时,铝与热浓硫酸、浓硝酸会发生反应。
【注意】钝化属于化学变化,铝与稀硝酸反应不产生H2。
答案:(1)2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑2Al + 6HCl → 2AlCl3 + 3H2↑2Al+6H+→2Al3++3H2↑(2)钝化可以6.铝与碱反应课堂实验5:用砂纸擦去铝条表面的物质,将铝条浸入6mol/L的氢氧化钠溶液中。
观察与现象:_________________________________________________________本质探讨:铝与碱反应的本质:①铝和溶液中的水反应:_______________________________________①生成的氢氧化铝和氢氧化钠反应:_______________________________________反应①不易进行的原因:a._______________________________________b._______________________________________铝与氢氧化钠反应的化学方程式:_______________________________________可简写为:_______________________________________【注意】(1)铝与NaOH溶液反应时,水作为__________参加反应。
(2)铝与碱的反应过程中,Al(OH)3起_________(填酸或碱)的作用。
(3)铝制品不能用来存放酸性和碱性的物质。
答案:铝条溶解,且有气体产生①2Al+6H2O→2Al(OH)3+3H2↑②Al(OH)3+NaOH→NaAlO2+2H2Oa.Al的金属性相对较弱b.产生的Al(OH)3不溶于水覆盖在金属表面而阻止反应的进一步进行。
2Al+2NaOH+6H2O→2NaAlO2+4H2O+3H2↑2Al+2NaOH+2H2O→2NaAlO2+3H2↑注意:反应物酸【思考3】请标出Al和NaOH反应时的电子转移方向和数目。
在该反应中,还原剂是______,氧化剂为______,还原剂与氧化剂的物质的量之比为_______。
答案:2Al+2NaOH+6H2O→2NaAlO2+4H2O+3H2↑(铝指向水中的氢,转移6个电子)Al H2O 1:3三、氧化铝1.物理性质氧化铝是_______色固体,高熔点(2045①),______溶于水,是__________氧化物,可用作______材料。
还可以制作各种宝石。
2.化学性质(1)与酸反应(盐酸,稀硫酸,稀硝酸)反应方程式:______________________________________________(2)与强碱反应(氢氧化钠溶液)反应方程式:______________________________________________答案:白难两性耐火Al2O3+3H2SO4→Al2(SO4)3+3H2O Al2O3+2NaOH→2NaAlO2+H2O四、氢氧化铝1.物理性质氢氧化铝是几乎______溶于水的_______色胶状物质,能凝聚水中的悬浮物,又能吸附色素,因此可用于水的净化。
