ellman测巯基
Ellman’s assay

5,5-二硫二硝基苯甲酸 DTNB 现货供应产品描述:DTNB为Ellman试剂。
它用于比色法测定生物样品中巯基。
它易溶于水。
在巯基化合物的存在下,无色的DTNB将被转变成黄色的5-巯基-2-硝基苯甲酸。
由于5-巯基-2-硝基苯甲酸在412 nm处具有最大吸收,DTNB的吸收光谱并不干扰巯基的测定。
配置方法:准确称取0.198gDTNB用50mMNa2HPO4(pH=7.0)配制成50ml溶液,存放于棕色瓶中,于暗处低温保存备用。
应该注意的是配置缓冲、浓度,储存时要避免见光。
应用举例:半胱氨酸中自由巯基的定量检测方法一、试剂的配制:1、Tris-HCL缓冲液(0.25M):DDW准确配制后,用盐酸调节pH=8.3;2、半胱氨酸标准溶液(1mM):准确称取0.017563gL-半胱氨酸(175.63),用1ml甲酸溶解,以DDW定容至100ml;3、DTNB(分子量:396.35)标准溶液(10mM):准确称取0.198175gDTNB用50mMNa2HPO4(pH=7.0)配制成50ml溶液,存放于棕色瓶中,于暗处低温保存备用4、DTNB分析溶液(0.1mM):由1体积10mMDTNB标准液加99体积0.25M的Tris缓冲液配制而成,现用现配。
二、标准曲线的制作;1、25℃条件下,用Tris缓冲液稀释半胱氨酸标准液配成梯度的稀释液(5.0ml),其浓度分别为:0.00mM、0.025mM、0.05mM、0.1mM、0.15mM、0.2mM;2、取上述各浓度溶液1ml分别加入到5ml预先恒温于25℃水中的DTNB分析溶液,摇匀,准确静止10min,立即于波长412nm处测定吸光度值(A)。
根据目的蛋白的吸光度在标准曲线上读出对应的浓度即可Product Name:DTNBProduct Number:D8130Product Brand:SigmaCAS Number:69-78-3Molecular Formula:[-SC6H3(NO2)CO2H]2 Molecular Weight:396.35Ordering Information。
Ellman方法说明书Word版

Ellman试剂介绍、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、1页半胱氨酸作为巯基基团的标准品、、、、、、、、、、、、、、、、、、、、、、2页巯基基团的摩尔吸光度、、、、、、、、、、、、、、、、、、、、、、、、、、2页故障排除、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、3页相关的赛默飞世尔科技产品、、、、、、、、、、、、、、、、、、、、、、、、3页附加信息、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、4页参考文献、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、4页半胱氨酸作为巯基基团的标准品A.原料制备·反应缓冲液:0.1M磷酸钠缓冲液,PH=8.0,包含1mM EDTA·半胱氨酸一水合盐酸盐,分子量175.6·Ellman试剂溶液:1mL反应缓冲液溶解4mgDTNBB.步骤2、取若干试管,每个试管中包含50μL的Ellman试剂液和2.5ml的缓冲液。
3、在各试管中加入250μL各浓度的标准工作液或待测物溶液。
注:对于未知的样品需要稀释,以便使其浓度标准曲线的工作范围之内(理想的浓度为0.1-1.0)。
4、室温下反应15min。
5、测试412nm紫外吸收。
6、根据得到数值生成一个标准曲线,测定待测样品由标准曲线计算SH含量基于摩尔吸光系数精确测量巯基的基团A.原料制备·反应缓冲液:0.1M磷酸钠缓冲液,PH=8.0,包含1mM EDTA·Ellman试剂溶液:1mL反应缓冲液溶解4mgDTNBB.吸光度测试1、对于每一个未知样本进行测试,准备一个包含50μL的Ellman试剂液和2.5ml的缓冲液。
2、加入250μL待测样品,空白添加250μL反应缓冲液。
3、室温下反应15min。
4、测试412nm紫外吸收。
5、根据TNB的摩尔消光系数(14,150M-1cm-1)计算巯基含量。
ELLMAN试剂法测定自由巯基和二硫键

E L L M A N试剂法测定自由巯基和二硫键This manuscript was revised by the office on December 22, 2012E L L M A N试剂测定自由巯基试验基于的原理:5,5’-dithiobis-2-nitrobenzoicacid(DTNB)5,5-二硫基-双(2-硝基苯甲酸)5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB)[1]。
TNB2-在412nm有很强的吸收,可以用于对肽段的自由巯基进行定量分析[2]。
DTNBTNB2-根据文献记载,TNB的吸光系数在13.6*103M-cm-~14.25*103M-cm-之间[3,4]。
吸光度测量的最灵敏范围在0.2-0.7之间。
A=εbc,其中A为吸光度,ε是摩尔吸收光系数或消光系数,ε单位为升/(摩尔·厘米)[L/(mol·cm)]。
以吸光度下限0.2来计算(吸光系数取14.15*103M-cm-),需要TNB的浓度为c=0.2/(14.15*103LM-cm-*1cm)=1.4*10-5mol/L(1.4*10-8mol/ml),需要蛋白浓度为1.4*10-5mol/L*18790g/mol=0.2631g/L=0.2631mg/ml.我们的条件可以达到这个检测限度。
ELLMAN试剂法测定自由巯基主要的影响因素有:1.EDTA的适量加入有助于TNB显色的稳定和成梯度线性关系[5]。
2.在不同缓冲液中,TNB的最大吸收波长略微不同,所以它们在412nm的吸收也不3.同,要根据选择的缓冲液来确定[5]。
另外,TNB的分光光度法分析对SDS很敏感[6]。
4.DTNB随着pH的升高,降解速度加快。
在pH7.0,其降解速度为0.02%/h,在5.pH值8.0,其降解速度为0.2%/h,随着pH值得升高,降解速度加快,在pH12时,15min之内会完全降解[7,8]。
ELLM试剂法测定自由巯基和二硫键

E L L M试剂法测定自由巯基和二硫键Prepared on 22 November 2020ELLMAN试剂测定自由巯基试验基于的原理:5,5’-dithiobis-2-nitrobenzoicacid(DTNB)5,5-二硫基-双(2-硝基苯甲酸)5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB)[1]。
TNB2-在412nm有很强的吸收,可以用于对肽段的自由巯基进行定量分析[2]。
DTNBTNB2-根据文献记载,TNB的吸光系数在*103M-cm-~*103M-cm-之间[3,4]。
吸光度测量的最灵敏范围在之间。
A=εbc,其中A为吸光度,ε是摩尔吸收光系数或消光系数,ε单位为升/(摩尔·厘米)[L/(mol·cm)]。
以吸光度下限来计算(吸光系数取*103M-cm-),需要TNB的浓度为c=(*103LM-cm-*1cm)=*10-5mol/L*10-8mol/ml),需要蛋白浓度为*10-5mol/L*18790g/mol=L=ml.我们的条件可以达到这个检测限度。
ELLMAN试剂法测定自由巯基主要的影响因素有:1.EDTA的适量加入有助于TNB显色的稳定和成梯度线性关系[5]。
2.在不同缓冲液中,TNB的最大吸收波长略微不同,所以它们在412nm的吸收也不3.同,要根据选择的缓冲液来确定[5]。
另外,TNB的分光光度法分析对SDS很敏感[6]。
4.DTNB随着pH的升高,降解速度加快。
在,其降解速度为%/h,在5.pH值,其降解速度为%/h,随着pH值得升高,降解速度加快,在pH12时,15min之内会完全降解[7,8]。
6.摩尔吸收光系数在不同的温度下不同,随温度的升高而下降[4].试验方案主要材料:1.材料PEG-G-CSF批号:080229浓度mlG-CSF批号:080126浓度ml10k超滤膜PALL2.试剂SequencingGradeModifiedTrypsin,Promega,lot#237826。
ELLMAN试剂法测定自由巯基和二硫键

ELLMAN试剂测定自由巯基试验基于的原理:5,5’-dithiobis-2-nitrobenzoic acid (DTNB) 5,5-二硫基-双(2-硝基苯甲酸) 5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB)[1]。
TNB2-在412nm有很强的吸收,可以用于对肽段的自2-吸光度0.2来计算-*1cm)1.4*101.2.不3.同,要根据选择的缓冲液来确定[5]。
另外,TNB的分光光度法分析对SDS很敏感[6]。
4.DTNB随着pH的升高,降解速度加快。
在pH7.0,其降解速度为0.02%/h,在5.pH值8.0,其降解速度为0.2%/h,随着pH值得升高,降解速度加快,在pH 12时,15min之内会完全降解[7,8]。
6.摩尔吸收光系数在不同的温度下不同,随温度的升高而下降[4].试验方案主要材料:1.材料PEG-G-CSF 批号:080229 浓度4.32mg/mlG-CSF 批号:080126 浓度6.9mg/ml小瓶。
NOB液:0.1%TFA/90%乙腈/H2O3.仪器质谱仪:BRUKER DALTONICS MALTI-TOF-TOF autoflexⅢ(厂内编号KC2007-011)Beckman 22R台式离心机(厂内编号AM-039)Beckman DU-800 紫外分光光度计(厂内编号KC2007-005)恒温循环仪:JULABO F12-ED(厂内编号KC2008-003)反相柱:Symmetry C18 5um 300à高压液相仪器:,(UV/Visible Detector)试验过程:一、缓冲液替换PEG-G-CSF和G-CSF进行缓冲液替换,超滤替换缓冲液为50mM NH4HCO3,稀释中加入G-CSF+DTT相分离收样:SF+DTT相分离集到之间的交由崔文喜冻干四、ELLMAN试剂测定自由巯基由于收集到的PEG肽段已经是自由巯基,所以可以跳过还原二硫键这一步。
ELLMAN试剂法测定自由巯基和二硫键

E L L M A N试剂法测定自由巯基和二硫键标准化工作室编码[XX968T-XX89628-XJ668-XT689N]E L L M A N试剂测定自由巯基试验基于的原理:5,5’-dithiobis-2-nitrobenzoicacid(DTNB)5,5-二硫基-双(2-硝基苯甲酸)5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB)[1]。
TNB2-在412nm有很强的吸收,可以用于对肽段的自由巯基进行定量分析[2]。
DTNBTNB2-根据文献记载,TNB的吸光系数在13.6*103M-cm-~14.25*103M-cm-之间[3,4]。
吸光度测量的最灵敏范围在0.2-0.7之间。
A=εbc,其中A为吸光度,ε是摩尔吸收光系数或消光系数,ε单位为升/(摩尔·厘米)[L/(mol·cm)]。
以吸光度下限0.2来计算(吸光系数取14.15*103M-cm-),需要TNB的浓度为c=0.2/(14.15*103LM-cm-*1cm)=1.4*10-5mol/L(1.4*10-8mol/ml),需要蛋白浓度为1.4*10-5mol/L*18790g/mol=0.2631g/L=0.2631mg/ml.我们的条件可以达到这个检测限度。
ELLMAN试剂法测定自由巯基主要的影响因素有:1.EDTA的适量加入有助于TNB显色的稳定和成梯度线性关系[5]。
2.在不同缓冲液中,TNB的最大吸收波长略微不同,所以它们在412nm的吸收也不3.同,要根据选择的缓冲液来确定[5]。
另外,TNB的分光光度法分析对SDS很敏感[6]。
4.DTNB随着pH的升高,降解速度加快。
在pH7.0,其降解速度为0.02%/h,在5.pH值8.0,其降解速度为0.2%/h,随着pH值得升高,降解速度加快,在pH12时,15min之内会完全降解[7,8]。
ELLMAN试剂法测定自由巯基和二硫键
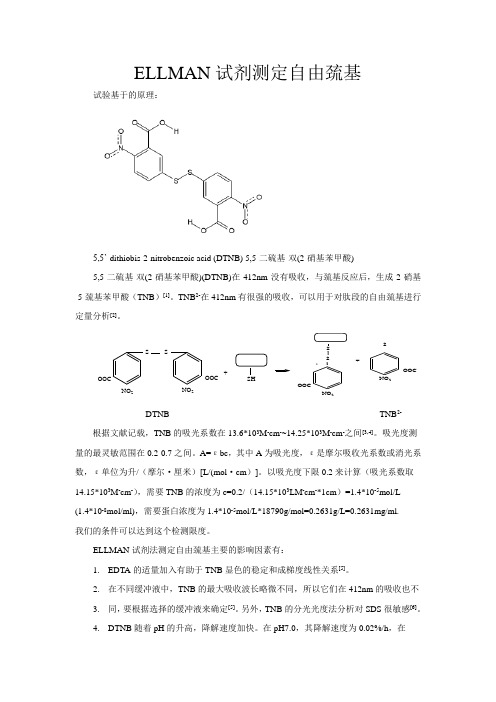
ELLMAN 试剂测定自由巯基试验基于的原理:5,5’-dithiobis-2-nitrobenzoic acid (DTNB) 5,5-二硫基-双(2-硝基苯甲酸)5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm 没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB )[1]。
TNB 2-在412nm 有很强的吸收,可以用于对肽段的自由巯基进行定量分析[2]。
SS NO 2NO 2-OOC-OOC+SH S -SNO 2NO 2-OOC-OOC+SDTNB TNB 2- 根据文献记载,TNB 的吸光系数在13.6*103M -cm -~14.25*103M -cm -之间[3,4]。
吸光度测量的最灵敏范围在0.2-0.7之间。
A=εbc ,其中A 为吸光度,ε是摩尔吸收光系数或消光系数,ε单位为升/(摩尔·厘米)[L/(mol ·cm )]。
以吸光度下限0.2来计算(吸光系数取14.15*103M -cm -),需要TNB 的浓度为c=0.2/(14.15*103LM -cm -*1cm )=1.4*10-5mol/L (1.4*10-8mol/ml),需要蛋白浓度为1.4*10-5mol/L*18790g/mol=0.2631g/L=0.2631mg/ml. 我们的条件可以达到这个检测限度。
ELLMAN 试剂法测定自由巯基主要的影响因素有:1. EDTA 的适量加入有助于TNB 显色的稳定和成梯度线性关系[5]。
2. 在不同缓冲液中,TNB 的最大吸收波长略微不同,所以它们在412nm 的吸收也不3. 同,要根据选择的缓冲液来确定[5]。
另外,TNB 的分光光度法分析对SDS 很敏感[6]。
4. DTNB 随着pH 的升高,降解速度加快。
在pH7.0,其降解速度为0.02%/h ,在5.pH值8.0,其降解速度为0.2%/h,随着pH值得升高,降解速度加快,在pH 12时,15min之内会完全降解[7,8]。
6-氮杂-2-硫代胸腺嘧啶还原

6-氮杂-2-硫代胸腺嘧啶(Ellman's reagent)是一种常用的生物化学试剂,广泛用于蛋白质还原和巯基含量的测定。
它的分子式为C9H9N3O2S,具有类似于Elliott's reagent B的结构。
在生物化学实验中,Ellman's reagent可用于测定蛋白质中的巯基含量,也可以作为生物分子的还原剂。
本文将对Ellman's reagent的化学性质、用途、合成方法以及注意事项进行系统总结。
1. 化学性质Ellman's reagent,又称5,5'-二硫代二硫代酸戊二醛(5,5'-dithiobis(2-nitrobenzoic acid),DTNB)是一种黄色晶体,不溶于水,但溶于乙醇和氢氧化钠溶液。
它在乙醇中呈现出橙黄色,而在碱性条件下呈现出明显的红色。
Ellman's reagent具有很强的吸光性,其在pH8.0条件下的吸光峰为412nm。
2. 用途Ellman's reagent主要用于测定蛋白质中的巯基含量。
在这种测定方法中,Ellman's reagent与蛋白质中的巯基反应生成硫醇盐,从而产生黄色溶液。
通过测定溶液的吸光度,可以计算出蛋白质中巯基的含量。
Ellman's reagent还可作为生物分子的还原剂,参与生物化学实验中的还原反应。
3. 合成方法Ellman's reagent的合成方法相对简单,通常采用以下步骤:- 将硝基苯酚和二氯丙酮反应制备二硝基二苯醚;- 将二硝基二苯醚与硫化氢反应,生成芳香二硫醚;- 将芳香二硫醚与溴乙酸酰乙酯反应,生成Ellman's reagent。
4. 注意事项在使用Ellman's reagent进行巯基含量测定时,需注意以下事项:- 操作需在洁净的实验室条件下进行,避免其受到杂质的污染;- 测定过程中需控制好pH值,否则可能影响测定结果的准确性;- 暴露于光线下会导致Ellman's reagent失去活性,使用过程中需避光保存。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
埃尔曼的试剂,5,5'二硫代双-(二硝基苯甲酸),5克分子量:396.35CAS号:69-78-3使用半胱氨酸标准精确量化巯基程序材料的制备1 反应缓冲液:0.1M的磷酸钠,pH 8.0,含有1 mM的EDTA半胱氨酸标准品,分子量136.2 :配成一定浓度梯度3 Ellman试剂溶液:1mL反应缓冲液4毫克溶解DTNB程序3在各试管中加入250μL各浓度的标准工作液或待测物溶液注:对于未知的样品需要稀释,以便使其浓度标准曲线的工作范围之内(理想的浓度为0.1-1.0)。
4在室温混合和反应15分钟。
在412 nm处测量吸光度。
根据得到数值生成一个标准曲线,测定待测样品由标准曲线计算SH含量摩尔吸光系数的程序精确量化的巯基的材料的制备1 反应缓冲液:0.1M的磷酸钠,pH 8.0,含有1 mM的EDTAEllman试剂溶液:1mL反应缓冲液4毫克溶解DTNB测量吸光度去若干试管,每管加入50μL的Ellman试剂溶液和2.5mL反应缓冲液。
加入250μL待测样品,空白添加250μL反应缓冲液在室温混合和反应15分钟。
分光光度计412nm测定吸光度。
根据TNB的摩尔消光系数(14,150)计算巯基含量该国能在412nm的合成,有一个相对比较激烈的吸光度同时二硫化物。
由于蛋白质的巯基,以国能形成化学计量为1:1,国能形成可以用来评估硫醇数目。
在变性剂的情况下,唯一能够找到的硫醇的反应,而残留的chaotropic代理人在场的总数减少胱氨酸目前可以衡量的。
经处理后减少的蛋白质与chaotropes及DTNB能够产生的半胱氨酸总数(半胱氨酸巯基加半胱氨酸-β-半胱氨酸)。
- -反应是敏感的碱性pH值(俄亥俄州)与RS竞争),酸性pH值(二硫化物可以打破),氧(R的巯基再氧化),以及温度(热致变色)。
因此,通常的反应是进行了过多的DTNB的蛋白质,在中性pH值固定的温度,erature,有时在厌氧条件。
此外,国能是敏感的各种离子的缓冲,所以采用消光系数硫醇数量计算必须正确匹配的反应条件。
这也是进行了存在的真实反应尿素或盐酸胍的变性剂(盐酸胍)。
下表概述在DTNB的和国能在各种条件下的一些有用的数据:-------------------------------------------------- ------------------------复方最大的lambda(pH值?7)灭绝:(以磷酸盐)(以磷酸三)(以盐酸胍)--------- ----------------- -------------------- ---- ------ ----------DTNB的324纳米17780 16600 ----国能---- 412纳米14,150 13,700-------------------------------------------------- ------------------------消光系数以每摩尔每厘米长度的路径,30degC单位国能在降低盐酸胍存在的灭绝是由于在移位拉姆达从412到422最大纳米。
在DTNB的灭绝是在412纳米212/M/cm,规模虽小但可衡量的。
=-=-=-=-=-=-=-==协议==-=-=-=-=-=-=-=联合解决方案:蛋白质溶液(本地或以前减少,脱盐)(?5 - 0.1M的磷酸钾缓冲液,pH值7.4 40uM)DTNB的股票(20毫米0.1M的KPO4,pH值7.4,分子量396.35; 7.93毫克/mL)(DTNB的很慢进入的解决办法;涡定期在2-3小时内实现完整的解决方案,这将是很轻,颜色黄色)尿素或盐酸胍(高纯度,结晶固体)主要设备:双光束分光光度计动力学模式设置在412nm恒温细胞,30degreesC程序:示例1 = 1.0mL细胞蛋白质溶液+ 50μL20毫米DTNB的引用单元1 = 1.0mL+ 50μL DTNB的缓冲区记录吸光度前,DTNB的除了“零”。
跟随在412 nm的反应在30degC不断。
记录过去的时候,反应达到最大值。
如果任何被视为重要的下坡最大吸收后到达,这将需要更正为了获得可访问硫醇的正确数目。
在第二个实验中,添加结晶盐酸胍到您的蛋白质溶液,以达到最终浓度约4米。
请注意体积变化以及由此产生的蛋白显着的稀释解决方案!示例2 = 1.0mL细胞蛋白质溶液(4 M盐酸胍)+ 20 mM的DTNB的50μL 引用单元2 = 1.0mL缓冲液(4 M盐酸胍)+ 50μL20毫米DTNB的同样,在30摄氏度的纪录外径412纳米,跨越高峰吸收。
本实验将产生硫醇总数减少。
样品细胞3 = 1.0mL预变性,减少,蛋白质和透析+ 50μL20毫米DTNB的引用单元3 = 1.0mL缓冲液(4 M盐酸胍)+ 20 mM的DTNB的50μL同样,记录OD值随时间在30degC 412 nm到峰值吸收和超越。
本实验将产生的蛋白质的半胱氨酸残基的总数。
=-=-=-=-=-=-=-=-=-=数据分析= ==-=-=-=-=-=-=-=-=-=计算硫醇数修改(或浓度除外)使用在412 nm的最大吸收测量(或修正值除外)啤酒的法律,以及适当的消光系数;鸿沟这个值由精确已知的摩尔反应蛋白浓度比色皿三个实验的每一个。
这将使你获得硫醇,总半胱氨酸巯基,总半胱氨酸巯基以及半胱氨酸-β-半胱氨酸。
这样做,每个实验中重复或一式三份,平均分别复制。
如果您的数字统计整数,你就大功告成了。
如果不考虑重复该议定书,但采用厌氧(脱气)缓冲区的所有反应。
=-=-=-=-=-=-=-=-=-=-=一些参考= ==-=-=-=-=-=-=-=-=-=-=“甲硫醇为确定低浓度比色法”埃尔曼,吉尔(1958)拱。
生化。
Biophys。
74,443-450。
“重新评估埃尔曼的试剂”谜语,密码,布莱克利,汤顿和泽纳,二(1983)方法酶学。
91,49-60。
对兔血红素结合半胱氨酸残身份“研究肝微粒体细胞色素P - 450同工酶2“黑色,SD和库恩,美兆(1985)生物化学,Biophys。
水库。
Commun。
128,82-89。
Hi All,I had a couple of folks ask for my opinion and method for use of Ellmen'sreagent (DTNB) in the detemination of protein thiols (Cys-SH). Below, I've included a protocol, references, and general information that should behelpful to all who anticipate using this method. Best Regards, Shaun=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-== Use of Ellman's Reagent for Determination of Protein Thiols ==-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-=-==-=-=-=-=-=-=-== Background ==-=-=-=-=-=-=-=Ellman's reagent or 5,5'-dithiobis(2-nitrobenzoate) (DTNB) is a symmetricalaryl disulfide which readily undergoes the thiol-disulfide interchangereaction in the presence of a free thiol:- - -COO COO COO\___ ___/ \___/ \ / \ | - / \ |O N- O -S-S- O -N O + Cys-S ----> O N- O -S-S-Cys (Mixed2 \___/ \___/ 2 | 2 \___/ | disulfide)(Excess) +-COO\___/ \ -(2-nitro-5-O N- O -S thiobenzoate)\___/(TNB)The TNB dianion has a relatively intense absorbance at 412nm compared toboth disulfides. Because the stoichiometry of protein thiol to TNB formedis 1:1, TNB formation can be used to assess the number of thiols present.In the absence of denaturants, only accessible thiols will react, whereasin the presence of chaotropic agents the total number of reduced Cys residues present can be measured. Reduction of the protein followed by treatmentwith chaotropes and DTNB can yield the total number of cysteines (Cys-SHplus Cys-S-S-Cys).--The reaction is sensitive to alkaline pH ( OH) competes with R-S ),acidic pH (disulfides can be broken), oxygen (reoxidation of R-SH), and temperature (thermochromism). Consequently, the reaction is usuallycarried out with an excess of DTNB to protein, at neutral pH, fixed temp-erature, and sometimes under anaerobic conditions. Furthermore, TNB is sensitive to various buffer ions, so the extinction coefficient used tocalculate number of thiols must be properly matched to the reactionconditions. This is also true of reactions carried out in the presence ofthe denaturants urea or guanidine (GuHCl). The following table summarizes some useful data on DTNB and TNB under various conditions:--------------------------------------------------------------------------Compound lambda max (pH~7) Extinction: (in PO4) (in Tris) (in GuHCl) --------- ----------------- -------------------- ---------- ----------DTNB 324 nm 17,780 16,600----TNB 412 nm 14,150 ----13,700--------------------------------------------------------------------------Extinction coefficients are in units of per Molar per cm path length, 30degC Decreased TNB extinction in the presence of GuHCl is due to a shift in thelambda max from 412 to 422 nm. The extinction of DTNB at 412 nm is 212/M/cm, small but measurable.=-=-=-=-=-=-=-== Protocol ==-=-=-=-=-=-=-=Stock Solutions:Protein solution (native or previously reduced and desalted)(~5-40uM in 0.1M potassium phosphate buffer, pH 7.4) DTNB stock (20 mM in 0.1M KPO4, pH 7.4; MW 396.35; 7.93 mg/ml)(DTNB is very slow to go into solutions; vortex periodicallyover the period of 2-3 hours to achieve complete solution,which will be very light yellow in color)Urea or Guanidine-HCl (high purity, crystalline solids)Major Equipment:Dual beam spectrophotometer set in kinetic mode at 412nmThermostated cells, 30degreesCProcedure:Sample cell 1 = 1.0 mL protein solution + 50 uL 20mM DTNBReference cell 1 = 1.0 mL buffer + 50 uL DTNBRecord the absorbance before addition of the DTNB as "zero". Followthe reaction at 412 nm at 30degC continuously. Record past the time whenthe reaction reaches a maximum. If any significant down slope is seenafter the maximum absorbance is reached, this will need to be corrected forin order to get the correct number of accessible thiols.In the second experiment, add crystalline Guanidine-HCl to yourprotein solution to achieve a final concentration of about 4M. Note thevolume change and the resulting significant dilution of your proteinsolution!Sample cell 2 = 1.0 mL protein solution (+4M GuHCl) + 50 uL 20 mM DTNBReference cell 2 = 1.0 mL buffer (+4M GuHCl) + 50 uL 20mM DTNBAgain, record OD 412 nm at 30 degC up to and beyond peak absorbance.This experiment will yield the total number of reduced thiols.Sample cell 3 = 1.0 mL pre-denatured,reduced, and dialyzed protein+ 50 uL 20mM DTNBReference cell 3 = 1.0 mL buffer (+4M GuHCl) + 50 uL 20 mM DTNBAgain, record OD 412 nm at 30degC vs time to peak absorbance and beyond. This experiment will yield the total number of Cys residues in the protein.=-=-=-=-=-=-=-=-=-== Data Analysis ==-=-=-=-=-=-=-=-=-=Calculate the number of thiols modified (or concentration thereof) usingthe maximum absorbance at 412 nm measured (or the corrected value thereof), Beer's Law, and the appropriate extinction coefficient; divide this valueby the accurately known molar protein concentration in the reaction cuvettefor each of the three experiments. This will give you accessible thiols,total Cys-SH, and total Cys-SH plus Cys-SS-Cys. Do each experiment in duplicate or triplicate and average the respective replicates. If yournumbers are statistically integers, you're done. If not, consider repeatingthe protocol, but using anaerobic (degassed) buffers for all reactions.=-=-=-=-=-=-=-=-=-=-== Some References ==-=-=-=-=-=-=-=-=-=-="A colorimetric method for determining low concentrations of mercaptans" Ellman, G.L. (1958) Arch. Biochem. Biophys. 74, 443-450. "Reassessment of Ellman's reagent" Riddles, P.W., Blakeley, R.L., and Zerner, B. (1983) Methods Enzymol. 91, 49-60."Studies on the identity of the heme-binding cysteinyl residue in rabbitliver microsomal cytochrome P-450 isozyme 2" Black, S.D. and Coon, M.J. (1985) Biochem, Biophys. Res. Commun. 128, 82-89.。
