第8章 金属元素通论及配位化合物(课后习题及参考答案)Yao
有机化学课后习题参考答案完整版

有机化学课后习题参考答案完整版⽬录第⼀章绪论 0第⼆章饱和烃 (1)第三章不饱和烃 (5)第四章环烃 (13)第五章旋光异构 (23)第六章卤代烃 (28)第七章波谱法在有机化学中的应⽤ (33)第⼋章醇酚醚 (43)第九章醛、酮、醌 (52)第⼗章羧酸及其衍⽣物 (63)第⼗⼀章取代酸 (71)第⼗⼆章含氮化合物 (78)第⼗三章含硫和含磷有机化合物 (86)第⼗四章碳⽔化合物 (89)第⼗五章氨基酸、多肽与蛋⽩质 (100)第⼗六章类脂化合物 (105)第⼗七章杂环化合物 (114)Fulin 湛师第⼀章绪论1.1扼要归纳典型的以离⼦键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl 与KBr 各1mol 溶于⽔中所得的溶液与NaBr 及KCl 各1mol 溶于⽔中所得溶液是否相同?如将CH 4及CCl 4各1mol 混在⼀起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么?答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于⽔中所得溶液相同。
因为两者溶液中均为Na +,K +,Br -, Cl -离⼦各1mol 。
由于CH 4与CCl 4及CHCl 3与CH 3Cl 在⽔中是以分⼦状态存在,所以是两组不同的混合物。
1.3碳原⼦核外及氢原⼦核外各有⼏个电⼦?它们是怎样分布的?画出它们的轨道形状。
当四个氢原⼦与⼀个碳原⼦结合成甲烷(CH 4)时,碳原⼦核外有⼏个电⼦是⽤来与氢成键的?画出它们的轨道形状及甲烷分⼦的形状。
答案:C+624H CCH 4中C 中有4个电⼦与氢成键为SP 3杂化轨道,正四⾯体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电⼦式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4 答案:a.C C H H H HCC HH HH 或b.H C H c.H N Hd.H S H e.H O NOf.OC H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OS H H或1.5下列各化合物哪个有偶极矩?画出其⽅向。
普通化学全本部分习题答案

《普通化学》课程练习题使用教材 教材名称普通化学 编 者 史国纲出 版 社中国石油大学出版社第一章 物质及其变化的一些基本规律上交作业 3、7(1)(2)、8、113 NH 3的分压为: kpa n NH n p x p NH NH 47.3513370.018.032.032.0p )(333=⨯++=⨯==总 O 2的分压为:kpa n O n p x p O O 95.1913370.018.032.018.0p )(222=⨯++=⨯==总 N 2的分压为:kpa n N n p x p N N 95.1913370.018.032.018.0p )(222=⨯++=⨯==总7查出各物质及水合离子的标准生成焓标在反应方程式中各对应物质和水合离子化学式的下面,然后根据公式计算。
(1) )()(2)(2222g O g H l O H +=1/-⋅∆mol kJ H f θ -285.83 0 01122229866.577)83.285(200)](,[2)]}(,[)](,[2{--⋅=⋅-⨯-+=∆-∆+∆=∆mol kJ mol kJ l O H H g O H g H H H f f f θθθθ(2) )(4)()(4)(32432g H s O Fe l O H s Fe +=+1/-⋅∆mol kJ H f θ0 -285.83 -1118.4 011243229892.24]}0)83.285(4[)]4.1118(0{[)]}(,[3)](,[4{)]}(,[)](,[4{--⋅=⋅+-⨯--+=∆+∆-∆+∆=∆mol kJ mol kJ g Fe H l O H H g O Fe H g H H H f f f f θθθθθ8 )(21)(322g SO O g SO =+1/-⋅∆mol kJ H f θ -296.83 0 -395.721122329889.98)]83.296(0[72.395)]}(,[)](,[21{)](,[--⋅-=⋅-+--=∆+∆-∆=∆mol kJ mol kJ l O H H g O H g SO H H f f f θθθθ11 (1)反应速率表达式为:)()(22Cl c NO c k v ⋅⋅=(2)该反应对NO 为二级反应,对Cl 2的一级反应,总反应级数为3。
分析化学:第8章课后习题答案

第八章思考题与习题1.什么叫沉淀滴定法?沉淀滴定法所用的沉淀反应必须具备哪些条件?答:沉淀滴定法是以沉淀反应为基础的一种滴定分析方法。
沉淀滴定法所应的沉淀反应,必须具备下列条件:(1)反应的完全程度高,达到平衡的速率快,不易形成过饱和溶液。
,即反应能定量进行。
(2)沉淀的组成恒定,沉淀的溶解度必须很小,在沉淀的过程中不易发生共沉淀现象。
(3)有确定终点的简便方法。
2.写出莫尔法、佛尔哈德法和法扬斯法测定Cl-的主要反应,并指出各种方法选用的指示剂和酸度条件。
答:(1)莫尔法主要反应:Cl-+Ag+=AgCl↓指示剂:铬酸钾酸度条件:pH=6.0∽10.5(2)佛尔哈德法主要反应:Cl-+Ag+(过量)=AgCl↓Ag+(剩余)+SCN-=AgSCN↓指示剂:铁铵矾。
酸度条件:0.1∽1 mol/L(3)法扬斯法主要反应:Cl-+Ag+=AgCl↓指示剂:荧光黄酸度条件:pH=7∽10.53.用银量法测定下列试样:(1)BaCl2,(2)KCl,(3)NH4Cl,(4)KSCN,(5)NaCO3+NaCl,(6)NaBr,各应选用何种方法确定终点?为什么?答:(1)BaCl2用佛尔哈德法或法扬斯法。
因为莫尔法能生成BaCrO4沉淀。
(2)Cl-用莫尔法。
此法最简便。
(3)NH4Cl用佛尔哈德法或法扬斯法。
因为当、[NH4+]大了不能用莫尔法测定,即使[NH4+]不大酸度也难以控制。
(4)SCN-用佛尔哈德法最简便。
(5)NaCO3+NaCl用佛尔哈德法。
如用莫尔法、法扬斯法时生成Ag2CO3沉淀造成误差。
(6)NaBr 用佛尔哈德法最好。
用莫尔法在终点时必须剧烈摇动,以减少AgBr吸附Br-而使终点过早出现。
用法扬斯法必须采用曙红作指示剂。
4.在下列情况下,测定结果是偏高、偏低,还是无影响?并说明其原因。
(1)在pH=4的条件下,用莫尔法测定Cl-;(2)用佛尔哈德法测定Cl-既没有将AgCl沉淀滤去或加热促其凝聚,有没有加有机溶剂;(3)同(2)的条件下测定Br-;(4)用法扬斯法测定Cl-,曙红作指示剂;(5)用法扬斯法测定I-,曙红作指示剂。
2019安徽高中化学竞赛结构化学第八章金属的结构和性质习题答案不全语文

一选择题1、CsCl晶体中,每个铯离子周围紧靠着的氯离子数目是( c )(A)4个(B)6个(C)8个(D)12个2、在离子晶体中,决定正离子配位数的关键因素是( A)(A) 正负离子半径比 (B) 正负离子电价比 (C) 正负离子电负性之比3、对于二元离子晶体,下列哪一式成立:( B )(A) n+/n-=Z-/Z+=CN-/CN+ (B) n-/n+=Z-/Z+=CN-/CN+ (C) n+/n-=Z-/Z+=CN+/CN-4、马德隆(Madelung)常数与离子晶体的哪种因素有关:( B)(A) 化学组成 (B) 晶体结构型式 (C) 离子键长5、Ge晶体(A4,即金刚石结构)的空间利用率(堆积系数)小于W晶体(A2),它们的晶胞中的原子数目是( B )(A) Ge<W (B) Ge>W (C) Ge=W6. NaCl与CaF2晶体的相同之处是:( B)(A) 结构基元 (B) 负离子堆积方式 (C) 点阵型式7. 4:4是下列哪一种晶体的CN+/CN-:( C)(A) CsCl (B) NaCl (C) 六方ZnS8. 对于CaF2晶体,“简单立方”一词描述的是它的( B )(A) 负离子堆积方式 (B) 点阵型式 (C) 正离子堆积方式9. 某种离子晶体AB被称为NaCl型, 这指的是( B)(A) 它的化学组成 (B) 它的结构型式 (C) 它的点阵型式二简答题1.已知金属Ni为A1型结构,原子间最近接触距离为249.2pm试计算:(1)Ni立方晶胞参数;(2)金属Ni 的密度(以g×表示);(3)画出(100),(110),(111)面上原子的排布方式。
1. (1) 352.4pm(2) 8.91g·cm-32. 已知金属钛为六方最密堆积结构,金属钛原子半径为146pm,试计算理想的六方晶胞参数。
2. a=b=292pm, c=477pm3. 计算A2型体心立方密堆积的空间利用率。
初中化学第八单元金属和金属材料单元综合检测试卷习题(含答案) (183)

初中化学第八单元金属和金属材料单元综合检测试卷习题(含答案)A1、Fe 、Cu 是工农业常用到的三种金属。
(1)利用23232Al+Fe O Al O +2Fe 高温反应实现铁轨的焊接,该反应中Al 作________(填“氧化剂”或“还原剂”) ,此反应的基本反应类型是______。
(2)将Al 、Cu 的固体混合物放入一定量的FeSO 4溶液中充分反应后,过滤,下列说法正确的是______(填序号)。
A 滤渣中一定含有Fe 、Cu ,可能含有A1B 滤渣中一定含有Al 、FeC 滤液颜色一定是浅绿色D 滤液中一定含有A13+、Cu 2+(3)为探究A1、Fe 、Cu 的活动性强弱,除Al 、Fe 、Cu 丝外,还应选的一种试剂是______(填序号)。
A FeSO 4溶液B CuSO 4溶液C Al 2(SO 4)3溶液D 稀盐酸(4)将A1、Fe 固体混合物10g 加入到适量稀硫酸中,充分反应后,产生H 21g,向反应后的溶液中加入一定量的NaOH 溶液,恰好将溶液中的金属离子沉淀完,则生成Na 2SO 4的质量为______g 。
【答案】还原剂 置换反应 A AD 71g【详解】(1)在氧化还原反应中,得到氧的物质是还原剂,在该反应中23232Al+Fe O Al O +2Fe 高温,得到氧的物质是铝,还原剂是铝,该反应是由一种单质与一种化合物反应生成另一种单质与另一种化合物的反应,所以基本反应类型为置换反应;(2)在金属活动顺序中,铝的活动性大于铁大于铜,将Al 、Cu 的固体混合物放入一定量的FeSO 4溶液中充分反应,铝能与硫酸亚铁反应生成硫酸铝和铁,铜不能与硫酸亚铁溶液反应。
A 、滤渣中一定含有Fe 、Cu ,这是因为铜不能反应,铝和硫酸亚铁反应生成硫酸铝和铁,可能含有Al (铝过量时),故A 正确;B 、滤渣中一定含有Fe ,不一定含有铝(铝恰好完全反应或不足时不含有铝),故B 错误;C 、滤液颜色不一定是浅绿色,例如硫酸亚铁完全反应后溶液是无色的,故C 错误;D 、滤液中一定含有A13+、一定不含有Cu 2+,故D 错误。
配位化学答案

(四)配位化学答案一.(12分)配位化合物A 是单核配合物分子,由11个原子组成;微热后失重11.35%得到B ;B 进一步加热又失重26.66%(相对B )得到金属C ;B 极难溶于水,不溶于乙醇、乙醚,能溶于盐酸。
A 有2种异构体A 1、A 2,其中A 2能与草酸盐反应得到一种式量比A 略大的配合物分子D (A 1无相似反应)1.写出A 、B 、C 的化学式;2.写出B 溶于盐酸后产物的名称;3.试画出A 1、A 2、D 的结构,并比较A 1、A 2在水中溶解性的大小。
4.A 还有若干种实验式相同的离子化合物。
它们每个还满足如下条件:是由分立的、单核的离子配合物实体构成的;仅含1种阳离子和1种阴离子。
(1)符合上述条件的离子化合物的精确的分子式有多少种。
(2)其中1种与AgNO 3反应(摩尔比1︰2)得到两种组成不同的配合物,写出反应的化学方程式。
答案:1.A :Pt(NH 3)2Cl 2(1.5分) B :PtCl 2(1分) C :Pt (1分)2.四氯合铂(Ⅱ)酸(1分)3.A 1:PtNH 3H 3N Cl(1分) B :Pt Cl H 3N H 3N(1分) D :Pt O H 3N H 3N O O O (1.5分) 在水中溶解度较大的是A 2(1分)4.(1)4种([Pt(NH 3)4]重+、[Pt(NH 3)3Cl]+与[Pt(NH 3)Cl 3]-、[PtCl 4]2-组合)(1分)(2)[Pt(NH 3)4][PtCl 4]+2AgNO 3=Ag 2[PtCl 4]+[Pt(NH 3)4](NO 3)2(2分二.(7分)某Ⅷ族不活泼金属A 溶于足量的王水生成B 的溶液(A 的含量为47.60%);将SO 2通入B 的溶液中,得到C 的溶液(A 的含量为57.56%)。
已知B 、C 的组成元素完全相同,且阴离子所带电荷也相同。
1.通过计算推理,确定A 的元素符号;2.写出所涉及反应的化学方程式。
第8章 金属元素通论及配位化合物(课后习题及参考答案)Yao
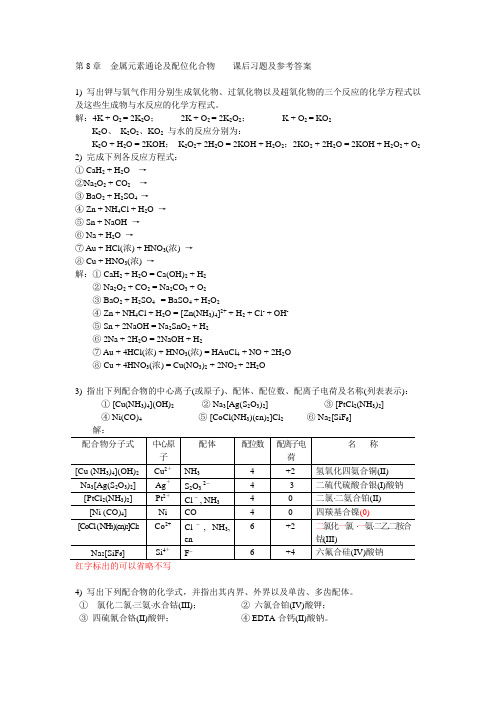
第8章金属元素通论及配位化合物课后习题及参考答案1) 写出钾与氧气作用分别生成氧化物、过氧化物以及超氧化物的三个反应的化学方程式以及这些生成物与水反应的化学方程式。
解:4K + O2 = 2K2O;2K + O2 = 2K2O2;K + O2 = KO2K2O、K2O2、KO2与水的反应分别为:K2O + H2O = 2KOH;K2O2+ 2H2O = 2KOH + H2O2;2KO2 + 2H2O = 2KOH + H2O2 + O22) 完成下列各反应方程式:① CaH2 + H2O →②Na2O2 + CO2 →③ BaO2 + H2SO4 →④ Zn + NH4Cl + H2O→⑤ Sn + NaOH →⑥ Na + H2O →⑦ Au + HCl(浓) + HNO3(浓) →⑧ Cu + HNO3(浓)→解:① CaH2 + H2O = Ca(OH)2 + H2② Na2O2 + CO2 = Na2CO3 + O2③ BaO2 + H2SO4 = BaSO4 + H2O2④ Zn + NH4Cl + H2O = [Zn(NH3)4]2+ + H2 + Cl- + OH-⑤ Sn + 2NaOH = Na2SnO2 + H2⑥ 2Na + 2H2O = 2NaOH + H2⑦ Au + 4HCl(浓) + HNO3(浓) = HAuCl4 + NO + 2H2O⑧ Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 + 2H2O3) 指出下列配合物的中心离子(或原子)、配体、配位数、配离子电荷及名称(列表表示):①[Cu(NH3)4](OH)2② Na3[Ag(S2O3)2]③ [PtCl2(NH3)2]④ Ni(CO)4 ⑤[CoCl(NH3)(en)2]Cl2⑥ Na2[SiF6]红字标出的可以省略不写4) 写出下列配合物的化学式,并指出其内界、外界以及单齿、多齿配体。
①氯化二氯⋅三氨⋅水合钴(III);②六氯合铂(IV)酸钾;③四硫氰合铬(II)酸钾;④ EDTA合钙(II)酸钠。
全套高中化学人教版课后习题答案

高一化学必修1 课后习题参考答案第一章第一节1.C 2.C 3.CD 4.略5.乳化原理或萃取原理6.利用和稀盐酸反应产生气体7.不可靠,因为碳酸钡也是白色沉淀,碳酸根干扰了硫酸根的检验。
由于硫酸钡是难溶的强酸盐,不溶于强酸,而碳酸钡是难溶弱酸盐,可溶于强酸,因此可先取样,再滴入氯化钡溶液和几滴稀硝酸或稀盐酸,如果出现白色沉淀,说明有硫酸根。
第一章第二节1.D 2.B 3.B 4.B5.65 mg/dL ~110mg/dL (1mmol=10-3mol)6.这种操作会使得结果偏低,因为倒出去的溶液中含有溶质,相当于容量瓶内的溶质有损失。
7.14mL8.n(Ca):n(Mg):n(Cu):n(Fe)=224:140:35:29.1)0.2mol 2)Cu2+:0.2mol Cl-:0.4mol10.40 (M=40 g/mol,该气体的相对分子质量为40。
)第一章复习题1.C 2.B 3.A 4.BC 5.C6.(1) 不正确。
(标况下)(2)不正确。
(溶液体积不为1L)(3)不正确。
(水标况下不是气体)(4)正确。
(同温同压下气体的体积比即为物质的量之比,也就是分子个数比)7.(1)5% (2)0.28mol/L8.铁粉过滤Fe、CuFeSO4溶液稀硫酸过滤FeSO4溶液蒸发结晶9.1.42 g,操作步骤略。
第二章第一节1.②⑧①④⑤⑥⑦⑩⑨ 2.树状分类法略5.7.胶体区别于其他分散系得本质特征是胶体粒子的大小在1~100nm范围。
胶体的应用,例如明矾净水、豆浆加石膏成豆腐、静电除尘、江河入海口易形成沙洲、血液透析、饱和氯化铁溶液用于应急性止血等。
第二章第二节1.水溶液熔融状态电离阴阳离子阳离子 H+ 阴离子 OH- 金属离子或铵根离子酸根离子 H+ + OH-=H2O2.两种电解质在溶液中相互交换离子的反应生成难溶物、易挥发物质、弱电解质3.C 4.C 5.C 6.B 7.D8.(1) NaOH=Na++OH- (2) CuCl2=Cu2++2Cl-(3) Fe2(SO4)3=2Fe3++3SO42- (4) Ba(NO3)2=Ba2++2NO3-9.(1) SO42-+Ba2+=BaSO4 (2) 2Al+3Hg2+=3Hg+2Al3+(3) CO32-+2H+=H2O+CO2 (4) 不反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第8章金属元素通论及配位化合物课后习题及参考答案1) 写出钾与氧气作用分别生成氧化物、过氧化物以及超氧化物的三个反应的化学方程式以及这些生成物与水反应的化学方程式。
解:4K + O2 = 2K2O;2K + O2 = 2K2O2;K + O2 = KO2K2O、K2O2、KO2与水的反应分别为:K2O + H2O = 2KOH;K2O2+ 2H2O = 2KOH + H2O2;2KO2 + 2H2O = 2KOH + H2O2 + O22) 完成下列各反应方程式:① CaH2 + H2O →②Na2O2 + CO2 →③ BaO2 + H2SO4 →④ Zn + NH4Cl + H2O→⑤ Sn + NaOH →⑥ Na + H2O →⑦ Au + HCl(浓) + HNO3(浓) →⑧ Cu + HNO3(浓)→解:① CaH2 + H2O = Ca(OH)2 + H2② Na2O2 + CO2 = Na2CO3 + O2③ BaO2 + H2SO4 = BaSO4 + H2O2④ Zn + NH4Cl + H2O = [Zn(NH3)4]2+ + H2 + Cl- + OH-⑤ Sn + 2NaOH = Na2SnO2 + H2⑥ 2Na + 2H2O = 2NaOH + H2⑦ Au + 4HCl(浓) + HNO3(浓) = HAuCl4 + NO + 2H2O⑧ Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 + 2H2O3) 指出下列配合物的中心离子(或原子)、配体、配位数、配离子电荷及名称(列表表示):①[Cu(NH3)4](OH)2② Na3[Ag(S2O3)2]③ [PtCl2(NH3)2]④ Ni(CO)4 ⑤[CoCl(NH3)(en)2]Cl2⑥ Na2[SiF6]红字标出的可以省略不写4) 写出下列配合物的化学式,并指出其内界、外界以及单齿、多齿配体。
①氯化二氯⋅三氨⋅水合钴(III);②六氯合铂(IV)酸钾;③四硫氰合铬(II)酸钾;④ EDTA合钙(II)酸钠。
解:① [CoCl2(NH3)3(H2O)]Cl 内界为[CoCl2(NH3)3(H2O)]+,外界为Cl-,单基配体Cl-、NH3、H2O;② K2[PtCl6] 内界为[PtCl6]-2,外界为K+,单基配体Cl-;③ K2 [Co(SCN)4] 内界为[Co(SCN)4]2- ,外界为K+,单基配体SCN-;④ Na2[Ca(EDTA)] 内界为[Ca(EDTA)]-2,外界为Na+,多基配体EDTA。
5) 无水CrCl3和NH3化合时,能生成两种含氨铬配合物。
它们的组成为CoCl3⋅6NH3和CoCl3⋅5NH3。
若用AgNO3溶液沉淀上述配合物中的Cl-离子,所得沉淀的含氯量依次相当于总含氯的33和23。
试根据这一实验事实确定这两种配合物的化学式。
解:① [Co(NH3)6]Cl3;② [CoCl(NH3)5]Cl26)试用价键理论解释:[Ni(CN)4]-2,[PdCl4]2-为平面正方形,而[Zn(NH3)4]2+, [HgI4]2-为正四面体形;解:Ni2+离子的价电子轨道中电子分布为:3d 4s 4p当4个CN-接近Ni2+时,Ni2+中的2个未成对电子合并到一个d轨道上,空出1个3d 轨道与1个4s轨道和两个4p轨道进行杂化,构成四个dsp2杂化轨道用来接受CN-中C原子提供的孤对电子。
由于四个dsp2杂化轨道指向平面正方形的四个顶点,所以具有平面正方形构型。
[Ni(CN)4]-2的中心离子Ni2+的价电子轨道中的电子分布为:[PdCl4]2-中Pd2+的价电子组态为4d8,同上,中心离子采取dsp2杂化,为平面正方形。
[Zn(NH3)4]2+中Zn2+的价电子组态为3d10,d轨道全满,有空的且能量相近的4s、4p轨道。
可以进行杂化构成4个sp3杂化轨道,用来接受4个NH3中N原子提供的孤对电子。
由于4个sp3杂化轨道指向正四面体的四个顶点,所以[Zn(NH3)4]2+配离子具有正四面体构型。
[HgI4]2-中Hg2+的价电子组态为5d10,d轨道全满,类似[Zn(NH3)4]2+,[HgI4]2-配离子具有正四面体构型。
7) 下面列出一些配离子磁矩的测定值,试按价键理论判断:①下列各配离子的价电子轨道电子分布和空间构型;②属于内轨型配合物还是属于外轨型配合物(列表表示)。
①[Co(NH3)6]3+,0 BM;②[Co(NH3)6]2+,4.26 BM;③[Mn(CN)6]4-,1.80 BM;④ [CuCl2]-,0BM。
8) 在50.0 mL 0.20 mol ⋅L 1-AgNO 3溶液中加入等体积的1.00 mol ⋅L 1-NH 3⋅H 2O ,计算达平衡时溶液中Ag +、[Ag(NH 3)2]+和NH 3的浓度。
解: 混合后总体积为100mL ,NH 3总浓度为0.5mol·L 1-,且Ag +总浓度为0.1mol·L 1-,设平衡时Ag +浓度为x ,则[Ag(NH 3)+2] 浓度为0.1-x ,NH 3浓度为0.3+2x 。
Ag ++2NH 3[Ag(NH 3)2]+x 0.3+2x 0.1-x因O 稳K 较大,Ag +几乎全部配合,则0.3+2x ≈ 0.3,0.1-x ≈ 0.1O 稳K =32+3[Ag(NH)]2NH Ag c c c c c c θθθ+()()= 1.12×1072)23.0(1.0x x x +-=O稳K = 1.12×107,解得 x = 9.92×108-平衡时,Ag c += 9.92×108- mol·L 1- , ()3[]Ag NH c += 0.1-x = 0.1 mol·L 1-3NH c = 0.3 + 2x = 0.3 mol·L 1- 9) 计算在1L 6.0 mol·L 1-氨水中能溶解多少mol 的AgCl 固体。
解:设在1L 6.0 mol·L 1-氨水中能溶解x mol 的AgCl 固体AgCl + 2NH 3[Ag(NH 3)2]++ Cl —平衡浓度 6.0—2x x xK O +32sp ,AgCl,[Ag(NH)]KK OO=∙稳=22(6.02)x x -=1.77×10-10×1.12×107=1.98×10-3解得x=0.25 mol10) 10 mL0.10 mol ⋅L 1-CuSO 4溶液与10 mL 6.0 mol ⋅L 1-氨水混合达平衡后,计算溶液中Cu +2、[Cu(NH 3)4]+2及NH 3的浓度各是多少?若向此溶液中加入1.0 mL 0.20 mol ⋅L 1-NaOH 溶液,问是否有Cu(OH)2沉淀生成? 解:混合后原始各离子浓度为: 2Cu c + = 0.1×2010= 0.05 mol ⋅L 1-, 3NH c = 6.0×2010= 3.0 mol ⋅L 1- 混合后由于NH 3大大过量,设溶液中铜离子几乎全部以[Cu(NH 3)4]+2存在,设溶液中Cu +2的浓度为x ,则[Cu(NH 3)4]+2的浓度为0.05-x ,NH 3的浓度为2.80+4x 。
Cu +2+ 4NH 3[Cu(NH 3)4]+2x 2.80+4x 0.05-x23423θ[Cu(NH)]θθ4NH Cu ()()c c c c c c ++ =O稳K = 2.09 × 10134)480.2(05.0x x x +-= 2.09 × 1013 解得: x = 3.89 × 1017-234[Cu(NH )]c += 0.05-x ≈ 0.05 mol·L 1-, 3NH c = 2.80 + 4x ≈ 2.80 mol·L 1-2Cu c += 3.89 × 1017-mol·L 1- 若向溶液中加入0.2 mol·L 1-的NaOH 1 mL ,忽略体积变化,则 OH c -= 0.2 ×201= 0.01 mol·L 1- J =2Cu c +OH c -2= 3.89 × 1017-× (0.01)2= 3.89 × 1021-∵Osp K [Cu(OH)2] = 2.2 × 1020-,∴无沉淀生成。
11) ①在0.10 mol ⋅L 1-K[Ag(CN)2]溶液中,分别加入KCl 或KI 固体,假设Cl -离子或I -离子的初浓度均为1.0×103- mol ⋅L 1-,问能否产生AgCl 或AgI 沉淀?②如果在 0.10 mol ⋅L 1-K[Ag(CN)2] 溶液中加入KCN 固体,使溶液中CN -离子的浓度为0.10 mol ⋅L 1-,然后分别加入KI 或Na 2S 固体,假设I -或S -2离子初浓度均为0.10 mol ⋅L 1-。
问是否会产生AgI 或Ag 2S 沉淀?解:① 设0.10mol·L 1-[Ag(CN)2]-溶液中能离解出的Ag +浓度为x mol·L 1- Ag ++ 2CN – = [Ag(CN)2]― x 2x 0.1-x ()2Ag CNK ⎡⎤⎣⎦-O稳, =2)2(1.0x x x -21103.1⨯= ,解得 x = 2.7×108-J = Ag c c +θ﹒Cl c -θ= 2.7×108-×0.001 = 2.7×1011- ∵O sp K (AgCl) = 1.77×1010-, O sp K (AgI) = 8.52×1017-∴有AgI 沉淀而无AgCl 沉淀。
② 加入CN -使CN c -为0.10mol·L 1-,此时Ag c +为x 。
Ag ++2 CN -= [Ag(CN)2]- x 0.1 0.1-x ()2Ag CNK ⎡⎤⎣⎦-O稳, =2)1.0(1.0x x -= 1.3 × 1021,解得 x = 7.7×1021-J =Ag c c +θ ﹒-I c c θ= 7.7×1021-×0.1 = 7.7×1022-J = (Ag c c +θ)2﹒(2-S c c θ)= (7.7×1021-)2×0.1 = 5.9×1042- ∵ O sp K (AgI) = 8.52×1017-, O sp K (Ag 2S) = 6.3×1050-∴有Ag 2S 沉淀而无AgI 沉淀。
