环烃
有机化学-4-环烃

多环烃
桥环烃:
二、脂环烃的命名
1、 单环脂环烃
(1)根据分子中成环碳原子数目称为“环某烷”;
(2)使取代基的位次尽可能最小(小基团位次最低); (3)环烯(或炔)烃编号时,双(三)键位次最小。
1,3-二甲基环戊烷
1-甲基-3-异丙基环己烷 1,3-二甲基环己烯
(4)对复杂的化合物,可把环看为取代基。
H H H H H H 1
4
6 5 3
H
5 4
2 1
H
H H H
3
6
2
H
5%
95%
(2) 多元取代环己烷中,e键多者为优势构象。
(3) 环上有不同取代基时,最大取代基处于e键上的构象最 稳定。
练习:写出1,2-二甲基取代环己烷的构象式,并排列其稳定性次序:
CH3 CH3
顺式 CH3
CH3 CH3 反式 CH3 CH3 CH3 (Ⅱ) CH3 (Ⅲ)
单环芳烃
H3C CH3
CH3
芳烃 多环芳烃
联苯
多苯代脂烃
CH2
稠环芳烃
2、 芳烃的命名
1) 烃基取代的苯 ①一元取代苯,以苯为母体,烷基为取代基,省略“基”字
甲苯
乙苯
异丙苯
②二元取代苯,可用邻、间、对来表明取代基位置:
CH3 CH3
CH3
H3C
CH3
CH3
邻二甲苯 1,2-二甲苯 O-
间二甲苯 1,3-二甲苯 m-
张力,它的能量比椅型高 30 kJ∙mol-1。
183pm 船 式 H 4 构 H 象
H H H
5 H 3 6
H
H H H
2
1
H H
环烃的概念

环烃的概念环烃是指由碳原子构成的环状结构的有机化合物。
它们是一类重要的有机化合物,具有丰富的化学性质和广泛的应用。
环烃的一大特点是碳原子形成了闭合的环状结构,这使得环烃具有相对稳定的分子结构和独特的性质。
首先,环烃的分类是按照碳原子的构型来划分的。
其中最简单的环烃就是苯,它由六个碳原子组成一个六元环结构,每个碳原子上有一个氢原子。
苯是一种无色液体,常用作溶剂、合成材料和燃料添加剂等。
除了苯之外,还有许多其他的环烃,包括多环芳烃、萜烯和冠醚等。
环烃的化学性质主要表现在它们的反应性和稳定性上。
由于环烃相比于直链烃内部的碳原子数量较少,使得环烃的结构更为紧密,分子间的相互作用较强,因此环烃通常比相应的直链烃更加稳定。
同时,环烃还具有较高的熔点和沸点,这使得它们在工业上配制有机溶剂、润滑油和防腐剂等方面具有广泛的应用。
环烃的反应性主要表现在它们与其他化合物进行反应时的性质上。
环烃的稳定性造成了环烃化合物的惯性较大,不容易发生化学反应。
但在适当的条件下,环烃也可以发生不同类型的反应。
其中最常见的反应是加成反应和取代反应。
加成反应是指环烃中的碳碳双键或三键断裂,与其他化合物中的原子或基团形成新的化学键。
取代反应则是指环烃中的一个或多个氢原子被其他原子或基团取代。
环烃的合成和利用涉及到许多重要的化学过程。
其中最重要的合成方法之一是通过烷基化反应来制备环烃化合物。
该反应是指将直链烃中的一个或多个氢原子取代为烷基基团,从而形成环烃。
这种反应可通过烷基卤化反应、烷基金属化反应或烷基化合反应等多种方法实现。
此外,环烃还可以通过环化反应来制备,该反应是指通过碳原子间的连接和断裂来形成环状结构。
环烃的应用广泛,例如苯可以用作溶剂、合成材料和燃料添加剂;多环芳烃具有良好的抗氧化性能,可用于制备防护材料和电子器件;冠醚在生物化学和有机合成中具有重要的应用价值等。
总的来说,环烃作为一类重要的有机化合物,具有独特的结构和性质。
它们的稳定性和反应性使得环烃在工业和科学研究中具有广泛的应用前景。
环烃的命名规则

环烃的命名规则一、什么是环烃环烃是指分子中含有环状碳骨架的有机化合物。
它们由碳原子和氢原子组成,碳原子形成一个或多个环状结构,并通过共用键连接在一起。
环烃是一类重要的有机化合物,广泛存在于自然界和人工合成中,具有多种生物活性和应用价值。
二、环烃的命名规则环烃的命名规则遵循有机化合物的命名原则,主要包括以下几个方面:1. 环烃的基本命名规则环烃的命名由两部分组成,分别是环烃前缀和环烃后缀。
环烃前缀表示环烃分子中环状结构的碳原子数目,环烃后缀表示环烃分子中没有参与环状结构的碳原子数目。
2. 环烃前缀的命名规则环烃前缀的命名规则如下: - 单环烃:根据碳原子数目,命名为环烷。
- 二环烃:根据碳原子数目,命名为环烷前缀+环烷前缀。
- 三环烃及以上:根据碳原子数目,命名为环烷前缀+环烷前缀+环烷前缀+…+环烷前缀。
3. 环烃后缀的命名规则环烃后缀的命名规则如下: - 单环烃:根据碳原子数目,命名为烷。
- 二环烃:根据碳原子数目,命名为烷后缀+烷。
- 三环烃及以上:根据碳原子数目,命名为烷后缀+烷后缀+烷后缀+…+烷。
4. 环烃的命名示例以下是几个环烃的命名示例: - 三环烷:环丙烷 - 四环烷:环戊烷 - 五环烷:环己烷 - 六环烷:环庚烷三、环烃的命名示例以下是一些常见环烃的命名示例:1. 单环烃•三环烷:环丙烷•四环烷:环戊烷•五环烷:环己烷2. 二环烃•三环烷二环烷:环丙烷环丙烷•三环烷四环烷:环丙烷环戊烷•四环烷四环烷:环戊烷环戊烷3. 三环烃•三环烷三环烷三环烷:环丙烷环丙烷环丙烷•三环烷四环烷三环烷:环丙烷环戊烷环丙烷•四环烷三环烷四环烷:环戊烷环丙烷环戊烷4. 更复杂的环烃•三环烷二环烷三环烷二环烷:环丙烷环丙烷环丙烷环丙烷•三环烷四环烷三环烷四环烷:环丙烷环戊烷环丙烷环戊烷•四环烷三环烷四环烷三环烷:环戊烷环丙烷环戊烷环丙烷四、总结环烃是一类具有环状结构的有机化合物,其命名规则遵循有机化合物的命名原则。
有机化学-第四章 环烃
环戊烷分子中,碳碳键的夹角为108°,接近sp3杂化轨 道间夹角,角张力很小,是比较稳定的环。
环己烷分子中6个碳原子不在同一平面上,碳原子之间的 键角为109°28′,分子中没有张力。
大环原子在不同的平面内,键角接近正常的键角,为
无张力环。
环三十烷
三、环己烷的构象
1 椅式构象和船式构象
六个碳原子均为sp3杂化,在保持键角109°28′不变的情况
H2SO4
NO2 NO2
甲苯硝化比苯容易,主要产物为邻位和对位取代产物。
CH3
HNO3 , H2SO4 30℃
CH3 NO2 +
CH3
NO2
(3) 磺化反应 苯与浓硫酸加热,或与发烟硫酸在室温下作用,生 成苯磺酸。苯磺酸也是强酸,酸性与硫酸接近。
浓 H2SO4 , 80℃ or H2SO4(SO3) , 室温
2 直立键和平伏键
椅式构象中的碳氢键可以分为两类,6个碳氢键与分
子的对称轴平行,叫做直立键或a键。
另外6个碳氢键指向环外,与直立键成109°28′的角, 平伏着向环外伸展,叫做平伏键或e键。
一个椅式构象的环己烷,可以通过碳碳单键的旋转变成 另一种椅式构象,叫做转环作用。
X
X
当环己烷上的氢原子被其它基团取代后,由于其它基团 都比氢原子大,所以取代基以e键和环相连占优势。
环己烷以上的环烷烃则很难发生加氢反应。
2 与溴的作用
环丙烷在室温下可以和溴进行亲电加成反应,生成开
链化合物。环丁烷要在加热条件下才能和溴加成。
+ Br2
BrCH2CH2CH2Br
1,3-二溴丙烷
+ Br2
Δ
BrCH2CH2CH2CH2Br
第四章 环烃

O + O2 V2O5 4000 CH CH C O C O + CO2 + H2O
返回
2.2.3 亲电取代反应历程
以傅氏反应为例,亲电反应历程如下: 首先 酰基与ALCl3作用形成酰基正离子: O O
R-C- Cl + AlCl3
O H Slow C-R Quick
R-C
+
AlCl4
O C R
O + R-C
2.2.1 苯的结构及芳香性的概念
化学分析证明苯的分子式为C6H6,碳氢比为1, 和乙炔一样。因此苯是一个非常不饱和的化合物。 按以前烯炔的经验,不饱和烃应该容易与Br2 或 HX 起加成反应,但苯却不容易起这些加成反应, 烯、炔容易被KMnO4 氧化,但苯却不容易,表 现对氧化剂有一定的稳定性;另外,苯容易与一 些试剂起取代反应,其中的H 被-NO2、-SO4H、 -X所取代,而烯、炔在同样的条件下是不起反应 和。苯环这些不容易起加成,不容易被氧化而容 易发生取代反应的特殊性质就叫苯的化学方面的 芳香性。
环烷烃
环烯烃
环炔烃
下面我们先讲异构 现象和命名的内容。
返回
1.1 异构现象和命名 环烷烃和烯烃具有相同的通式CnH2n。因此它们互 为异构,如环丙烷和丙烯,这是官能团异构。同样的环 烯烃具有和炔烃相同的通式。脂环烃的异构现象更加复 杂,如C6H12的环烃至少有下面几种异构体:
如果环上有两个以上的取代基时,如:
第四章 环烃
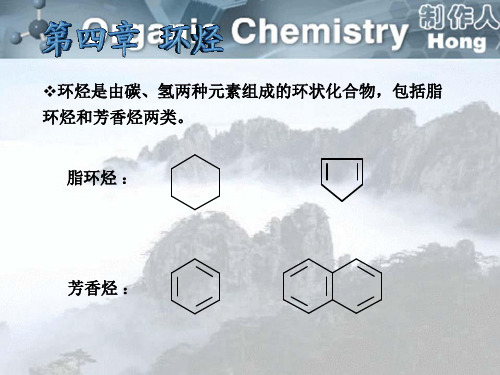
环烃是指分子中的碳架形成环状的碳 氢化合物。根据结构和性质我们把环烃分 成脂环烃和芳香烃两大类。
1. 2.
脂环烃 芳香烃
1.
脂环烃
1.1
异构现象和命名 1.2 环烷烃的结构 1.3 环烷烃的化学性质
有机化学第三章-环烃

2-甲基 -3苯基戊烷 2甲基 -3苯基戊烷 3-phenyl-2-methylpentane
苯乙烯 苯乙烯 phenylethene
2苯基 -2-丁烯 2苯基 -2-丁烯 2-phenyl-2-butene
6、芳香烃分子中去掉1个氢原子后剩下的原子团称 为芳基,常用“Ar-”来表示。
C6H5 苯基
影响脂环烃稳定性因素之一
角张力——由于与正常键角(109o28′) 的偏差而降低轨道重叠性所引起的张力 。
角张力 ,则环的稳定性 。
四. 脂环烃的构象(自学)
环烷烃的通式:CnH2n 环单烯烃的通式:CnH2n-2
第三章
1. 2.
环烃
脂环烃 芳香烃
1、何谓“芳香” ?
早期有机化学家把有机物分成脂肪族和芳香 族化合物两种,最初发现的芳香族化合物因 为都具有香味,芳香族化合物由此得名。后 来发现的该族一些化合物不但不香反而很臭, 但“芳香性”一词仍被沿用了下来。其实, “芳香”真正指的是由一种特殊结构所引起 的相关性质即芳香性。根据此定义,芳香烃 是具有“芳香性”的环状碳氢化合物。含有 苯环结构的芳香烃称为苯型芳香烃;不含有 苯环结构的芳香烃称为非苯型芳香烃。
CH2 环丙烷
CH2 CH2
环丁烷
环戊烷
② 若环上有多个取代基时,编号从较小的取代基 开始,且使取代基的位次最小;
CH3CH2 CH2 CH2
CH2 CH2CH3 CH2
4
3 2
或
5
1
1-甲基-3-乙基环戊烷
③ 若环烃中有双键时,编号应从双键开始,且 使编号的数值最小。
1
6 5 4 2 3
1,3-环己二烯
第三章
环烃知识点总结

环烃知识点总结一、基本概念环烃是碳原子通过共价键连接形成的碳环结构的有机化合物。
环烃分为脂环烷烃和萜环烷烃两大类。
脂环烷烃是由碳原子形成的单纯环状结构,如环丙烷、环戊烷等。
而萜环烷烃是由两个或多个碳环连接而成的环烃,如萜环庚烷、萜环癸烷等。
环烯烃是一类含有一个或多个碳—碳双键的环烃,环烯烃的通式为CnH2n,其中n为整数。
环烯烃分为单环烯烃和多环烯烃两种,单环烯烃是指一条环烯烃分子中只有一个碳—碳双键,如环丙烯、环戊烯等;多环烯烃是指一条环烯烃分子中含有两个或多个碳—碳双键,如萜环庚烯、萜环癸烯等。
环炔烃是一类含有一个或多个碳—碳三键的环烃,环炔烃的通式为CnH2n-2,其中n为整数。
环炔烃分为单环炔烃和多环炔烃两种,单环炔烃是指一条环炔烃分子中只有一个碳—碳三键,如环丙炔、环戊炔等;多环炔烃是指一条环炔烃分子中含有两个或多个碳—碳三键,如萜环庚炔、萜环癸炔等。
芳香烃是一类具有芳香性质的环烃,其分子中含有苯环结构。
芳香烃通常是稳定的化合物,具有特殊的化学性质和应用价值。
芳香烃有很多重要的代表物质,如苯、甲苯、二甲苯、苯酚等。
二、结构特点环烃的分子中含有碳—碳键构成的环状结构,这种环状结构使得环烃具有一些独特的结构特点。
首先,环烃分子中的碳原子呈现出sp3、sp2和sp杂化的特点。
在脂环烷烃中,碳原子呈现出sp3杂化的特点,其四个σ键的轨道构成外层的四个σ键,没有π键;在萜环烷烃、环烯烃和环炔烃中,碳原子呈现出sp2杂化的特点,其三个σ键的轨道构成外层的三个σ键,剩余的一个p轨道构成一个碳—碳双键或碳—碳三键;而在芳香烃中,碳原子呈现出sp2杂化和未杂化的p轨道的混成,其三个σ键的轨道构成外层的三个σ键,剩余的两个p轨道构成两个碳—碳双键。
其次,环烃分子中的碳原子排列有着一定的角度以及构型上的要求。
在脂环烷烃中,碳原子呈现出正四面体的构型,其中碳—碳键角为109.5°,这样可以使得碳原子之间的相互作用最小化,分子结构最稳定;在萜环烷烃中,由于两个碳环之间存在着共用碳原子,因此其构型更趋向平面结构,碳—碳键角为120°;在环烯烃和环炔烃中,由于碳—碳双键或碳—碳三键的存在,使得碳原子之间的角度有所变化,但总体上趋向于平面结构;在芳香烃中,由于苯环的存在,使得分子结构呈现出平面结构,其构型稳定性很高。
有机化学环烃

CH3
H3CH2C
CH3 CH3
H3C
1,3-二甲基环己烷
1,1 -二甲基 -3 -乙基环戊烷
复杂结构的环烷烃命名
CH3
CH3
CH3 CH2CH3
1,2–二甲基环丙烷
1–甲基环丁烯
5–异丙基– 1,3–环戊二烯
大学基础化学
7,7 –二甲基 二环[2.2.1]庚烷
NO2 +
H2SO4+ HNO3 50℃
NO2
O2N
CH3 NO2 +
CH3 NO2
NO2
CH3
H2SO4+ HNO3 100℃
O2N
NO2
NO2
2,4,6-三硝基甲苯
( TNT )
烷基苯比苯容易硝化,硝化的主要产 物是邻硝基甲苯、对硝基甲苯。
CH3
HNO3,H2SO4 30℃
CH3
NO2 +
CH3
和
环烯烃
性 不饱和脂环烃
分
环炔烃
桥环烃--- 共用两个 以上碳原子的多环脂 环烃。
2、环烷烃的命名
环丙烷 环丁烷 环戊烷
环已烷
大学基础化学
环烷烃的命名
同烷烃命名类似,只是在碳原子相同的烷烃
名称之前加上“环”字。环上取代基的编号原
则是使取代基位次或位次之和为最小。
如:
CH3
CH2CH3
甲基环丙烷
CH3
CH3
CH3
COOH
CH3CHCH2CCHH3CH3 C6H5 CCHH33
CCHH3CH CH2
CH3
H3C
OH
CH3
CH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章环烃(P76) 4.1解:
C H3
C H2C H3
环戊烷甲基环丁烷乙基环丙烷
H
H
C H3
C H3
H H
C H3
C H3C H
3
C H3
反-1,2-二甲基环丙烷顺-1,2-二甲基环丙烷1,1-二甲基环丙烷
4.2解:
C H2C H2C H3C H(C H3)2C H2C H3
C H3
C H2C H3
C H3
丙苯异丙苯邻甲乙苯间甲乙苯
C H2C H3
C H3
C H3
C H3
C H3
C H3
C H3
C H3C H3
C H3
C H3
对甲乙苯连三甲苯偏三甲苯均三甲苯
4.3解:
a. 1,1-二氯环庚烷
b. 2,6-二甲基萘
c. 1-甲基-4-异丙基-1,4-环已二烯
d. 对甲基异丙苯
e. 邻氯苯磺酸
f. 1,3-二甲基-1-仲丁基环丁烷
g. 1-乙基-3-异丙基-5-叔丁基环己烷
h.i.j.
C H3
C l
N O2
C6H5C H C C H C H2C H3
C H3
C H3
C H3
H
C H3
H
4.4 解:1、3、6号碳原子为sp2杂化;2、4、5、7号碳原子为sp3杂化
4.5 a.
b.
c.
d.
e.
O
O
C H O
4.6 解:
a. 1-甲基-1-乙基环丙烷
b. 1,1-二甲基-2-乙基环丙烷
c. 1,1-二甲基-2-乙基-2-丙基环丙烷
d. 1,2-二甲基-2-乙基-2-异丙基环丙烷 其中d 有几何异构:
C H 3
C 3H 7
-i
H 3C
H 5C 2
C H 3
C 3H 7-i
H 3C H 5C 2
顺式 反式
4.7解
:
a.
CH 3
HBr
CH 3Br
b.
+
Cl 2
Cl
c.
+
Cl 2
Cl
Cl
Cl
Cl
+
d.
CH 2CH 3
+
Br 2
3
C 2H 5
Br
+
Br
C 2H 5
e.
CH(CH
3)2
+
Cl 2
C(CH 3)2
Cl
f.
CH 3
Z n -pow der ,H 2O CHO
O
g.
CH 3
CH 3
OH
h.
+CH 2Cl 2
3
CH 2
i.
CH 3
+
HNO
3
CH 3
NO
2
+
CH 3
NO
2
j.
+
KMnO
4
+
COOH
k.
CH=CH
2
+
Cl 2
CH
CH 2Cl
Cl
4.8解:
反-1-甲基-3-异丙基环己烷
C H 3
C H(C H 3)2
C H 3
C H(C H 3)2
优势构象
顺-1-甲基-4-异丙基环己烷C H 3
C H(C H 3)2
C H 3
C H(C H 3)2
优势构象 4.9解:
邻二甲苯C H 3
C H 3
可以生成两种一溴代产物
C H 3
C H 3
B r
和
C H 3
C H 3
B r
间二甲苯
C H 3
C H 3
可以生成三种一溴代产物
B r
C H 3
C H 3
C H 3
C H 3
B r
(少量)
和 B r
C H 3
C H 3
对二甲苯
C H 3
C H 3
可以生成一种一溴代产物
H 3
C H 3
B r
4.10解:芳香性的判断:(1)平面环状共轭体系(2) π电子数符合4n+2。
上面四种化合物中b. d 具有芳香性。
4.11解:
a. KMnO 4/H + Ag +/NH 3
1,3-环己二烯 褪色 无 苯 无
1-己炔 褪色 白色沉淀 . KMnO 4/H + 环丙烷 无 丙烯 褪色
4.12解
:
a.
b.
H 3
c.
d.
e.
f.
2
O C H
3
4.13解:
a.
Br FeBr
3
Br
NO
2
HNO
3
H 2SO 4
Br
b.
H N O 3H 2SO 4
N O 223
N O 2
B r
c.
C H 3C H C O C l 3
C H 3
C O C H 3
23
C H 3
C O C H 3C l
d.
C H 3
2FeC l 3
C H 3
C l
4
C O O H
C l
e.
CH 3
KMnO
COOH
2FeCl
3
COOH
Cl
f.
HNO
3
H 2SO 4
NO
2
CH 3
H 3C
2
3
Br
CH 3
Br
NO
2
g.
2FeBr
3
CH 3
CH 3
Br
KMnO
COOH
Br
HNO
3
H 2SO 4
COOH
Br
NO
2
4.14解:
从A 分子式C 6H 10看,不饱和度为2,能使Br 2/CCl 4褪色,使KMnO 4褪色,应含不饱和键。
不与酸性汞盐作用,应不含叁键。
A
1. O
32C 6H
10O 2
碳数不变,应为环状烯烃,不带支链,说明环上饱和碳无支链,所
以:
可能
为
or
or
or
or
or
即环己烯及环烯双键碳上含非支链取代基的分子式为C 6H 10O 2的各种异构体,例如以上各种异构体。
4.15解;
K M nO 4
A
二元羧酸 A 为
C H 3
C H 2C H 3
,硝化生成两种一硝基产物
23
(两种)
H 2C H 3
(三种)
H 2C H 3
(四种)
所以:A 为H 3C
C 2H 5
4.16解:
Br
Br
A.
4.17解:
+
B r
C l
C l 2
3
+
B r
B r
C l
A B
3
B r
C l
B r 2
C l
B r
B r
+
C l
B r
B r
D C
+
C l
B r
B r
C l
B r
B r
B r
B r
C l
+
B r
B r
C l
B r 2B r
+
FeB r 3
C l
C。
