化合物溶解性全表
常用化合物在不同温度下的溶解度
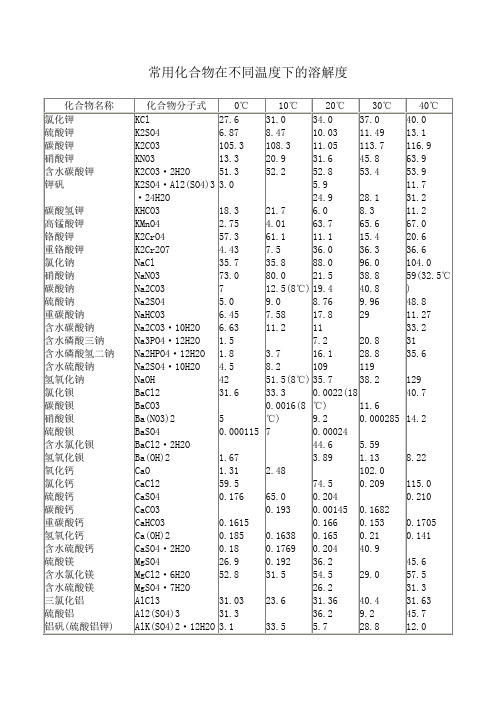
K2CrO4
25.9 31.2 36.2 41.1 45.2 50.5
K2Cr2O7
37.0 37.3 37.8 38.4 39.0 39.8
NaCl
114.0 124.0 135.0 148.0 162.0 180.0
NaNO3
45.4
Na2CO3
46.7 45.3 44.1 43.7 42.9 42.5
FeCl2
34.4
FeCl3
73.1
FeSO4
315.1
FeCl2·4H2O
48.6
FeCl3·6H2O
42.2
FeSO4·7H2O
75.9
CuSO4
32.3
CuSO4·5H2O
33.3
NH4Cl
25.1
NH4NO3
50.4
(NHห้องสมุดไป่ตู้)2SO4
NH4HCO3
(NH4)2HPO4
(NH3)2SO4·Al2
KNO3
85.5 110.0 138.0 169.0 202.0 246.0
K2CO3·2H2O
54.8 55.9 57.1 58.3 59.6 60.9
K2SO4·Al2(SO4)3
24.75
71.0 109.0
·24H2O
34.2 37.5
KHCO3
14.4 18.0
KMnO4
69.0 72.8
(SO4)3·24H2O
0.86 136.8 0.205
0.1750 0.116
55.0 61.0 35.5 31.73 59.2 26.1
37.1 78.3
57.0 43.9
35.5 40.0 28.1 55.2 421.0 88.0
常见有机溶剂的溶解性汇总

也有一定的刺激性。不同有机溶剂其作用的主要靶*****和作用的强弱也不同,这决定于每一种有机溶剂 的化学结构、溶解度、接触浓度和时间,以及机体的敏感性。 毒性 ①神经毒性。以脂肪烃(正己烷、戊烷、汽油)、芳香烃(苯、苯乙烯、丁基甲苯、乙烯基甲苯)、氯化烃(三 氯乙烯、二氯甲烷),以及二硫化碳、磷酸三邻甲酚等脂溶性较强的溶剂为多见。有机溶剂对神经系统的损 害大致有三种类型:第一种为中毒性神经衰弱和植物神经功能紊乱。病人可有头晕、头痛、失眠、多梦、 嗜睡、无力、记忆力减退、食欲不振、消瘦,以及多汗、情绪不稳定,心跳加速或减慢、血压波动、皮肤 温度下降或双侧肢体温度不对称等表现;第二种为中毒性末梢神经炎。大部分表现为感觉型,其次为混合 型。可有肢端麻木、感觉减退、刺痛、四肢无力、肌肉萎缩等表现;第三种为中毒性脑病,比较少见,见 于二硫化碳、苯、汽油等有机溶剂的严重急、慢性中毒。 ②血液毒性。以芳香烃,特别是苯最常见。苯达到一定剂量即可抑制骨髓造血功能,往往先有白细胞减少, 以后血小板减少,最后红细胞减少,成为全血细胞减少。个别接触苯的敏感者,可发生白血病。 ③肝肾毒性。多见于氯代烃类有机溶剂,如氯仿、四氯化碳、三氯乙烯、四氯乙烯、三氯丙烷、二氯乙烷 等中毒。中毒性肝炎的病理改变主要是脂肪肝和肝细胞坏死。临床上可有肝区痛、食欲不振、无力、消瘦、 肝脾肿大、肝功能异常等表现。有机溶剂引起的肾损害多见为肾小管型,产生蛋白尿,肾功能呈进行性减 退。 ④皮肤粘膜刺激。多数有机溶剂均有程度不等的皮肤粘膜刺激作用,但以酮类和酯类为主。可引起呼吸道 炎症、支气管哮喘、接触性和过敏性皮炎、湿疹、结膜炎等。 防治 生产和使用有机溶剂时,要加强密闭和通风,减少有机溶剂的逸散和蒸发。采用自动化和机械化操 作,以减少操作人员直接接触的机会。应使用个人防护用品,如防毒口罩或防护手套。皮肤粘膜受污染时, 应及时冲洗干净。勿用污染的手进食或吸烟。勤洗手、洗澡与更衣。应定期进行健康检查,及早发现中毒 征象时,进行相应的治疗和严密的动态观察。
溶解性表详解

部分酸、碱和盐的溶解性表(室温)
阳 离
阴离子 OH - (氢氧根) NO3 - (硝酸根) Cl- (盐酸根)
子
H+
NH
+ 4
1.写出所有的阳离子与CO32-结合所生成的
K+
化合物的化学式和名称。
Na + 2.生成的化合物有什么共性?什么是盐酸
Ba2+
盐?
Ca 2+ Mg2+
3.共有几种?几种可溶、几种微溶、几种 不溶?
Fe2+
3.除BaSO4不溶,CaSO4、Ag2SO4微
Fe3+
溶,11种硫酸盐可溶。
Cu2 +
Ag +
SO4 2- (硫酸根) CO32 - (碳酸根)
H2SO4 (硫酸) (NH4)2SO4(硫酸铵) K2SO4 (硫酸钾) Na2SO4 (硫酸钠) BaSO4 (硫酸钡) CaSO4 (硫酸钙) MgSO4 (硫酸镁) Al2(SO4)2 (硫酸铝) MnSO4 (硫酸锰) ZnSO4 (硫酸锌) Fe SO4 (硫酸亚铁) Fe2(SO4)3 (硫酸铁) CuSO4 (硫酸铜) Ag2SO4 (硫酸银)
Ag +
AgCl(氯化银)
SO4 2- (硫酸根) CO32 - (碳酸根)
2.它们的阴离子全部是Cl - , 酸根离子全部是Cl- 离子的 化合物叫盐酸盐。 3.除AgCl不溶,12种盐酸 盐可溶。
部分酸、碱和盐的溶解性表(室温)
阳 离
阴离子 OH - (氢氧根) NO3 - (硝酸根) Cl- (盐酸根)
NH
+ 4
K+
NH 3.H2O (铵水) KOH (氢氧化钾)
溶解性口诀总汇(附溶解性表)

溶 解 性硝酸盐,Fra bibliotekO₃~都易溶。
亚硝酸盐,NO₂ˉ
除AgNO₂难溶外都易溶。
醋酸盐,C₂H₃O₂ˉ
除Ag⁺,Hg₂²⁺,Bi³⁺⁵等盐难溶外都易溶。
氯化物,Cl⁻
除Ag⁺,Hg₂²⁺,Pb²⁺,Cu²⁺⁶等盐难溶外都易溶。
溴化物,Br⁻
除Ag⁺,Hg₂²⁺,Pb²⁺,Pt²⁺÷等盐难溶外都易溶。
碘化物,I⁻
除Ag⁺,Hg₂²⁺,Pb²⁺,Cu²⁺,Bi³⁺⁶等盐难溶外都易溶。
硫酸盐,so₄²⁻
除Pb²⁺,Ba²⁺,Sr²⁺,Ca²⁺等盐难溶外都易溶。
亚硫酸盐,so₃²⁻
除Na⁺,K⁺,NH₄⁺³等盐难溶外都易溶。
硫代硫酸盐,S₂O₃²⁻
除Ba²⁺,Pb²⁺,Ag⁺≤等盐难溶外都易溶。
硫化物,s²⁻
砷酸盐,AsO₄³⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
草酸盐,C₂O₄²⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
硫代氰酸盐,SCN⁻
除Pb²⁺,Cu²⁺Ag⁺,Hg₂²⁺,Cd²⁺等盐难溶外都易溶。
氧化物,o²⁻
除Na⁺,K⁺,Ba²⁺,Sr²⁺,Ca²⁺等盐难溶外都难溶。
氢氧化物, OH⁻
除Na⁺,K⁺,Ba²⁺,等的氢氧化物外都难溶, Sr²⁺,Ca²⁺的氢氧化物微溶。
除Na⁺,K⁺,NH₄⁺,Ca²⁺,sr²⁺,Ba²⁺⁵等盐难溶外都难溶。
磷酸盐,PO₄³⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
亚砷酸盐,AsO₄³⁻
除Na⁺,K⁺,NH₄⁺¹等盐难溶外都难溶。
碳酸盐,CO₃²⁻
除Na⁺,K⁺,NH₄⁺等盐难溶外都难溶。
(完整)初中化学溶解性表
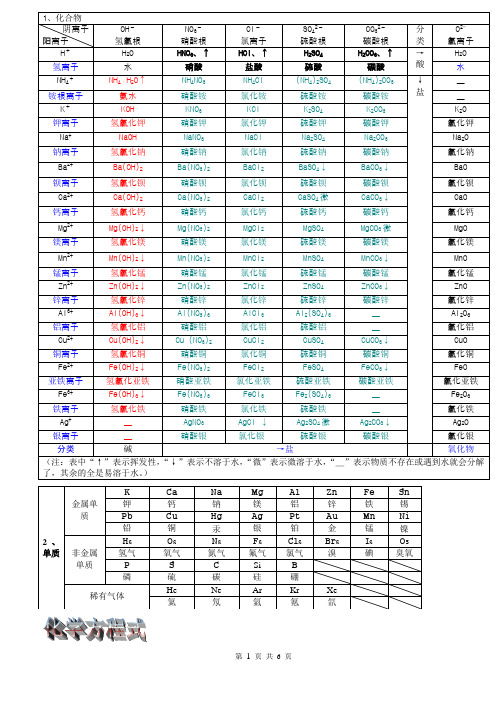
1.2Mg+O2点燃或Δ2MgO化学反应现象:剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟应用:白色信号弹2.2Hg+O2点燃或Δ2HgO化学反应现象:银白液体、生成红色固体应用:拉瓦锡实验3.4Al+3OΔ2Al2O3化学反应现象:银白金属变为白色固体4.3Fe+2O2点燃Fe3O4化学反应现象:剧烈燃烧、火星四射、生成黑色固体、放出大量热5.C+O2点燃CO2化学反应现象:剧烈燃烧、白光、放热、使石灰水变浑浊6.S+O2点燃SO2化学反应现象:剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰7.2H2+O2点燃2H2O化学反应现象:淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)应用:高能燃料8.4P+5O2点燃2P2O5化学反应现象:剧烈燃烧、大量白烟、放热、生成白色固体应用:证明空气中氧气含量9.CH4+2O2点燃2H2O+CO2化学反应现象:蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)应用:甲烷和天然气的燃烧10.2KClO3 MnO2Δ 2KCl +3O2↑化学反应现象:生成使带火星的木条复燃的气体应用:实验室制备氧气11.2KMnO4Δ K2MnO4+MnO2+O2↑化学反应现象:紫色变为黑色、生成使带火星木条复燃的气体应用:实验室制备氧气12.2HgOΔ2Hg+O2↑化学反应现象:红色变为银白、生成使带火星木条复燃的气体应用:拉瓦锡实验13.2H2O通电2H2↑+O2↑化学反应现象:水通电分解为氢气和氧气应用:电解水14.Cu2(OH)2CO3Δ2CuO+H2O+CO2↑化学反应现象:绿色变黑色、试管壁有液体、使石灰水变浑浊气体应用:铜绿加热15.NH4HCO3ΔNH3↑+ H2O +CO2↑化学反应现象:白色固体消失、管壁有液体、使石灰水变浑浊气体应用:碳酸氢铵长期暴露空气中会消失16.Zn+H2SO4=ZnSO4+H2↑化学反应现象:有大量气泡产生、锌粒逐渐溶解应用:实验室制备氢气17.Fe+H2SO4=FeSO4+H2↑化学反应现象:有大量气泡产生、金属颗粒逐渐溶解18.Mg+H2SO4 =MgSO4+H2↑化学反应现象:有大量气泡产生、金属颗粒逐渐溶解19.2Al+3H2SO4=Al2(SO4)3+3H2↑化学反应现象:有大量气泡产生、金属颗粒逐渐溶解20.Fe2O3+3H2Δ 2Fe+3H2O化学反应现象:红色逐渐变为银白色、试管壁有液体应用:冶炼金属、利用氢气的还原性21.2Na+Cl2Δ或点燃2NaCl化学反应现象:剧烈燃烧、黄色火焰应用:离子化合物的形成、22.H2+Cl2点燃或光照 2HCl化学反应现象:点燃苍白色火焰、瓶口白雾应用:共价化合物的形成、制备盐酸23.CuSO4+2NaOH=Cu(OH)2↓+Na2SO4化学反应现象:蓝色沉淀生成、上部为澄清溶液应用:质量守恒定律实验24.2C +O2点燃2CO应用:煤炉中常见反应、空气污染物之一、煤气中毒原因25.2CO+O2点燃2CO2化学反应现象:蓝色火焰应用:煤气燃烧26. C + CuO 高温2Cu+ CO2↑化学反应现象:黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体应用:冶炼金属27.2Fe2O3+3C 高温4Fe+ 3CO2↑Fe3O4+2C高温3Fe + 2CO2↑应用:冶炼金属28. C + CO2高温2CO29.CO2 + H2O = H2CO3化学反应现象:碳酸使石蕊变红应用:证明碳酸的酸性30.H2CO3ΔCO2↑+ H2O化学反应现象:石蕊红色褪去31.Ca(OH)2+CO2= CaCO3↓+ H2O化学反应现象:澄清石灰水变浑浊应用:应用CO2检验和石灰浆粉刷墙壁32.CaCO3+H2O+CO2 = Ca(HCO3)2化学反应现象:白色沉淀逐渐溶解应用:溶洞的形成,石头的风化33.Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑化学反应现象:白色沉淀、产生使澄清石灰水变浑浊的气体应用:水垢形成.钟乳石的形成34.2NaHCO3ΔNa2CO3+H2O+CO2↑化学反应现象:产生使澄清石灰水变浑浊的气体应用:小苏打蒸馒头35.CaCO3高温 CaO+ CO2↑应用:工业制备二氧化碳和生石灰36.CaCO3+2HCl=CaCl2+ H2O+CO2↑化学反应现象:固体逐渐溶解、有使澄清石灰水变浑浊的气体应用:实验室制备二氧化碳、除水垢37.Na2CO3+H2SO4=Na2SO4+H2O+CO2↑化学反应现象:固体逐渐溶解、有使澄清石灰水变浑浊的气体应用:泡沫灭火器原理38.Na2CO3+2HCl=2NaCl+ H2O+CO2↑化学反应现象:固体逐渐溶解、有使澄清石灰水变浑浊的气体应用:泡沫灭火器原理39.CuO +CO Δ Cu + CO2化学反应现象:黑色逐渐变红色,产生使澄清石灰水变浑浊的气体应用:冶炼金属40.Fe2O3+3CO高温 2Fe+3CO2应用:冶炼金属原理41.C2H5OH+3O2点燃2CO2+3H2O化学反应现象:蓝色火焰、产生使石灰水变浑浊的气体、放热应用:酒精的燃烧42.Fe+CuSO4=Cu+FeSO4化学反应现象:银白色金属表面覆盖一层红色物质应用:湿法炼铜、镀铜43.Mg+FeSO4= Fe+ MgSO4化学反应现象:溶液由浅绿色变为无色44.Cu+2AgNO3=2Ag+ Cu(NO3)2化学反应现象:红色金属表面覆盖一层银白色物质应用:镀银45.Zn+CuSO4= Cu+ZnSO4化学反应现象:青白色金属表面覆盖一层红色物质应用:镀铜46.Fe2O3+6HCl=2FeCl3+3H2O化学反应现象:铁锈溶解、溶液呈黄色应用:铁器除锈47.Al2O3+6HCl=2AlCl3+3H2O化学反应现象:白色固体溶解48.CuO+2HCl=CuCl2+H2O化学反应现象:黑色固体溶解、溶液呈蓝色49.MgO+2HCl=MgCl2+ H2OCaO+2HCl=CaCl2+ H2O共同的化学反应现象:白色固体溶解50.NaOH+HCl=NaCl+ H2O化学反应现象:白色固体溶解51.Cu(OH)2+2HCl=CuCl2+2H2O化学反应现象:蓝色固体溶解52.Mg(OH)2+2HCl=MgCl2+2H2O化学反应现象:白色固体溶解53.Al(OH)3+3HCl=AlCl3+3H2O化学反应现象:白色固体溶解应用:胃舒平治疗胃酸过多54.Fe(OH)3+3HCl=FeCl3+3H2O化学反应现象:红褐色沉淀溶解、溶液呈黄色55.Ca(OH)2+2HCl=CaCl2+2H2O56.HCl+AgNO3= AgCl↓+HNO3化学反应现象:生成白色沉淀、不溶解于稀硝酸检验Cl—的原理57.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O化学反应现象:铁锈溶解、溶液呈黄色铁器除锈58.Al2O3+3H2SO4= Al2(SO4)3+3H2O化学反应现象:白色固体溶解59.CuO+H2SO4=CuSO4+H2O化学反应现象:黑色固体溶解、溶液呈蓝色60.2NaOH+H2SO4=Na2SO4+2H2O61.Cu(OH)2+H2SO4=CuSO4+2H2O化学反应现象:蓝色固体溶解62.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O化学反应现象:白色固体溶解63.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O化学反应现象:红褐色沉淀溶解、溶液呈黄色64.Ba(OH)2+ H2SO4=BaSO4↓+2H2O化学反应现象:生成白色沉淀、不溶解于稀硝酸检验SO42—的原理65.BaCl2+ H2SO4=BaSO4↓+2HCl化学反应现象:生成白色沉淀、不溶解于稀硝酸检验SO42—的原理66.Ba(NO3)2+H2SO4=BaSO4↓+2HNO3化学反应现象:生成白色沉淀、不溶解于稀硝酸检验SO42—的原理67.CuO+2HNO3=Cu(NO3)2+H2O化学反应现象:黑色固体溶解、溶液呈蓝色68.NaOH+HNO3=NaNO3+ H2O69.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O化学反应现象:蓝色固体溶解70.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O化学反应现象:红褐色沉淀溶解、溶液呈黄色71.2NaOH+CO2=Na2CO3+ H2O化学反应现象:吸收CO、O2、H2中的CO2、72.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O处理硫酸工厂的尾气(SO2)73.FeCl3+3NaOH=Fe(OH)3↓+3NaCl化学反应现象:溶液黄色褪去、有红褐色沉淀生成74.AlCl3+3NaOH=Al(OH)3↓+3NaCl化学反应现象:有白色沉淀生成75.MgCl2+2NaOH = Mg(OH)2↓+2NaCl76.CuCl2+2NaOH = Cu(OH)2↓+2NaCl化学反应现象:溶液蓝色褪去、有蓝色沉淀生成77.CaO+ H2O = Ca(OH)2化学反应现象:白色块状固体变为粉末生石灰制备石灰浆78.Ca(OH)2+Na2CO3=CaCO3↓+2NaOH化学反应现象:有白色沉淀生成工业制烧碱、实验室制少量烧碱79.Ba(OH)2+Na2CO3=BaCO3↓+2NaOH化学反应现象:有白色沉淀生成80.Ca(OH)2+K2CO3=CaCO3↓ +2KOH化学反应现象:有白色沉淀生成81.CuSO4+5H2O= CuSO4·H2O化学反应现象:白色粉末变为蓝色检验物质中是否含有水82.CuSO4·H2OΔ CuSO4+5H2O化学反应现象:蓝色晶体变为白色粉末83.AgNO3+NaCl = AgCl↓+NaNO3化学反应现象:白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子84.BaCl2 + Na2SO4 = BaSO4↓+2NaCl化学反应现象:白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子85.CaCl2+Na2CO3= CaCO3↓+2NaCl化学反应现象:有白色沉淀生成86.MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓化学反应现象:有白色沉淀生成87.CaCO3+2HCl=CaCl2+H2O+CO2↑88.MgCO3+2HCl= MgCl2+H2O+ CO2↑89.NH4NO3+NaOH=NaNO3+NH3↑+H2O化学反应现象:生成使湿润石蕊试纸变蓝色的气体应用:应用于检验溶液中的铵根离子90.NH4Cl+ KOH= KCl+NH3↑+H2O化学反应现象:生成使湿润石蕊试纸变蓝色的气体。
常用试剂的溶解性

常用试剂的溶解性常用试剂的溶解性1 . 二甲胺:有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂,强烈刺激性。
2 . 石油醚:不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶,与低级烷相似。
3 . 乙醚:微溶于水,易溶与盐酸,与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶。
麻醉性4 . 戊烷:与乙醇、乙醚等多数有机溶剂混溶,低毒性。
5 .二氯甲烷:与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶。
低毒性,麻醉性强7 . 二硫化碳:微溶与水,与多种有机溶剂混溶。
麻醉性,强刺激性8 .丙酮:与水、醇、醚、烃混溶。
低毒,类乙醇,但较大9 . 1,1-二氯乙烷:与醇、醚等大多数有机溶剂混溶。
低毒、局部刺激性10 . 氯仿:与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶。
中等毒性,强麻醉性11 . 甲醇:与水、乙醚、醇、酯、卤代烃、苯、酮混溶。
中等毒性,麻醉性12 . 四氢呋喃:优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃。
吸入微毒,经口低毒。
13 . 己烷:与甲醇部分溶解,与比乙醇高的醇、醚、丙酮、氯仿混溶。
低毒,麻醉性,刺激性14 . 三氟代乙酸:与水、乙醇、乙醚、丙酮、苯、四氯化碳、己烷混溶,溶解多种脂肪族、芳香族化合物。
15 . 1,1,1-三氯乙烷:与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶。
低毒类溶剂16 . 四氯化碳:与醇、醚、石油醚、冰醋酸、二硫化碳、氯代烃混溶。
氯代甲烷中毒性最强。
17 . 乙酸乙酯:与醇、醚、氯仿、丙酮、苯等大多数有机溶剂互溶,能溶解某些金属盐。
低毒,麻醉性18 . 乙醇:与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶。
微毒类,麻醉性19 . 丁酮:与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶。
低毒,毒性强于丙酮20 . 苯:难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶。
化合物溶解性全表

HCl
不溶
HCl
HCl
HCl
HCl
略溶
HCl
HCl
微溶
水
水
水
水
水
水
水
水
水
水
水
水
水
略溶,HCl
略溶,HCl
Sr2+
HCl
HCl
HCl
HCl
HCl
HCl
HCl
略溶
HCl
HCl
不溶
略溶
水
水
水
水
水
水
水
水
水
水
水
水
HCl
略溶,HCl
Ba2+
HCl
HCl
略溶
HCl
HCl
HCl
HCl
HCl
HCl
HCl
不溶
HCl
-
-
-
-
-
HCl
水解,HCl
水解,HCl
水
-
略溶,HNO3
HNO3
HCl
Hg2+
HCl
HCl
水
HCl
HCl
HCl
HCl
-
-
HCl
略溶
HCl
王水
水
-
不溶
-
水
HCl
水
水
水
水
水
HCl
-
Pb2+
HNO3
HNO3
略溶,HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
HNO3
不同温度下常见无机化合物的溶解度

氯酸钡
Ba(ClO2)2
铬酸钡
BaCrO4
氰化钡
Ba(CN)2
亚铁氰化钡 Ba2Fe(CN)6
氟化钡
BaF2
氟硅酸钡
BaSiF6
甲酸钡
Ba(HCO2)2
磷酸氢钡
BaHPO4
亚磷酸氢钡 BaHPO3
氢氧化钡
Ba(OH)2· 8H2O
0°C
58.8 12.5 0.29
98 20.3 31.2 43.9
26.2
3.144×10-4
3.622×10-4
7.998×10-2
物质 一氧化氮 一氧化二氮
化学式 NO N2O
Dy2(CrO4)3 铬酸镝(III) ·10H2O
铒
0°C
10°C
20°C 5.6×10-3
0.112
0.663
物质 氢氧化铒 (III)
化学式 Er(OH)3
钒
物质
化学式
五氧化二钒 V2O5
135
135
2.2×10-2
8.736×10-5
4
11.1
14.4
2.697×10-4
9.7×10-2
84.7
136 6.046×10-3
180
188
6.235×10-6
68.4
64
76
76.6
1.292×10-12 4.642×10-2
124
130
123
130
220
硫酸铬 叠氮化亚汞 溴化亚汞 碳酸亚汞 氯化亚汞 铬酸亚汞 氰化亚汞 高氯酸亚汞 硫酸亚汞 乙酸汞
砷酸二氢钾 磷酸二氢钾 铁氰化钾 亚铁氰化钾 氟化钾 甲酸钾 碳酸氢钾 磷酸一氢钾 硫酸氢钾 氢氧化钾 碘酸钾 碘化钾 硝酸钾 亚硝酸钾 草酸钾 高氯酸钾 高碘酸钾 高锰酸钾 过二硫酸钾 磷酸钾 硒酸钾 硫酸钾 四苯硼钾 硫氰酸钾 硫代硫酸钾 钨酸钾 三氯化金 三碘化金 草酸金(V)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
陽離子
鹼 金 屬 鹼
H+ Na+ K+ Mg2+
反應
[1]
土
Ca2+
HCl
HCl
不溶
水
水
水
反應
[1]
微溶
HCl
水
HCl
HCl
HCl
略溶
HCl
HCl
水
水
水
水
水
水
水
水
略溶, HCl
略溶, HCl 略溶, HCl
解
水
水
水
金
Sr2+
HCl
HCl
Байду номын сангаас
HCl
水
水
水
微溶
[2]
不溶
HCl
水
HCl
HCl
HCl
略溶
HCl
水 - 不溶 不溶 水 不溶 不溶 - 不溶 不溶
水 水 水 水 水 水 水 不溶 HNO3 水
水 水 水 水 水 水 水 解 水 水
水 - 水 - 水 水 水 - 水 水
水 水 水 水 水 水 水 水 水 水
HCl HCl HCl HCl HCl HCl HCl HCl HCl HCl
HCl HCl HCl HCl HCl HCl HCl 不溶 HCl HCl
HCl HCl HCl HCl HCl HCl HCl - HCl HCl
HCl 水 略溶, HCl HCl 水 水 HCl - 水 HCl
HCl HCl 略溶, HCl 氧還 水 HCl HCl - 水 水
略溶, HCl HCl HCl 不溶 - HNO3 HNO3 不溶 HCl HCl
水 - HCl 不溶 不溶 不溶 不溶 - 不溶 不溶
HCl - 水 水 - 水 水 - - 水
HCl HCl HCl HCl HCl HCl HCl - HCl HCl
HCl - HCl HCl HCl HCl HCl - HCl HCl
HCl HCl HCl HCl HCl HCl HCl - HCl HCl
HCl HCl HCl HCl HCl HCl HCl - HCl HCl
陰離子
碳 CO32 − NH4+ 水 弱、揮 水 水 略溶 C2O42 − 水 水 水 水 水 水 弱、揮 水 水 HCl F− 水 溶、揮 水 水 水 Cl −
鹵素 Br − 水 溶、揮 水 水 水 水 水 水 水 水 I− 水 水 水 水 S2 − SO42 − 水 水 水 水 水
硫 SO32 − 水 水 水 水 水 S2O32 − 水 水 水 水 水 AsO43 − 水 水 水 水 HCl AsO33 − 水 水 水 水 HCl PO43 − 水 水 水 水 HCl BO2 − 水 水 水 水 HCl SiO32 − 水 水 水 水 HCl C4H4O62 − 水 水 水 水 水 CrO42 − 水 水 水 水 水 水 水 水 水 水 CN − [Fe(CN) [Fe(CN) 6]4 − 6]3 − 水 水 水 水 水 水 水 水 水 水 SCN − 水 水 水 水 水 CH3COO − 水 水 水 水 水 NO2 − 水 水 水 水 水 NO3 − 水 水 水 水 水 解 弱 水 水 HCl O2 − 水 弱 水 水 HCl OH − H− 本身不穩 定 不溶 解 解 解 ClO4 − 水 水 水 水 水 MnO4 − 略溶 水 水 水 水 N3 − 幾乎不溶 水 水 水 水
解 解 解 解 解 解 解
水 水 水 水 水 水 水 水 水 水
微溶 水
水 - HNO3 HNO3 HNO3 HNO3 HNO3 HNO3 HNO3 HNO3
氧還
[3] 水 水 水 水 水 水 水
金
Cu+ Cu2+ Zn2+
氧還
[4] 略溶, HCl HCl
水
水 水
[5]
水 HCl HCl
不溶
[6][7] - 解
HCl
略溶
水
水
水
水
水
水
水
HCl
解
水
水
水
屬 過 第 一 過 渡 渡 系
Ba2+ Cr3+ Mn2+ Fe2+ Fe3+ Co2+ Ni2+
HCl - HCl HCl 解 HCl HCl 不溶
HCl HCl HCl HCl HCl HCl HCl - HCl HCl
略溶 水 HCl 略溶, HCl 略溶, HCl HCl HCl
HCl[8]
HCl
屬
第 二 過 渡 第 三 過 渡 系 Hg22+ Hg2+ Al3+ HNO3 HCl 解 HNO3 HCl HCl 水 水 水 HNO3 水 水 HNO3 水 水 HNO3 HCl 水 王水 王水 水解, HCl 略溶 略溶 水 HNO3 HCl HCl - - 水 HNO3 HCl HCl HNO3 HCl - HNO3 HCl HCl - - HCl - - HCl 略溶, HNO3 HCl 水 HNO3 HCl - - 水 - - - - - 不溶 - HNO3 水 水 水 水 水 水 水 - 略溶, HNO3 水 水 HNO3 HCl HCl Au3+ 不溶 略溶 Cd2+ HCl HCl 略溶, HCl 水 水 水 HNO3 水 HCl 水 HCl HCl HCl HCl HCl HCl HCl HCl 不溶 不溶 HCl 水 水 水 HCl Ag+ HNO3 HNO3 水 不溶 不溶 不溶 HNO3 略溶 HNO3 HNO3 HNO3 HNO3 HNO3 HNO3 HNO3 HNO3 HNO3 不溶 不溶 不溶 不溶 略溶 熱水 水 HNO3
水
水
水
不溶
水
不溶
水
-
-
不溶
-
-
-
水
-
-
-
-
-
水
水
-
不溶
-
水
水
不溶
族 碳 金 族
Tl+ C4+ Sn2+ Sn4+
水
水
微溶 微溶 水解, HCl 水解, HCl 沸水 水解, HCl 水解, HCl 水解, HCl 略溶
微溶 微溶 水解, HCl 水解, HCl 不溶 水解, HCl 水解, HCl 水解, HCl 弱、揮
水 水 水 水 水 水 水 微溶 水 水
水 水 水 水 水 水 水 HCl 水 水
水 水 水 水 水 水 水 不溶 略溶 水
反應
[1] 水解, HCl HCl HCl HCl HNO3 HNO3 微溶, HCl HNO3 HCl
不溶 水 水 水 水 水 水
HCl - HCl HCl 解 HCl HCl
不溶
[9][10] HCl
不溶
水
解[11]
水
HNO3
-
水
HNO3
水
[12]
水
微溶
不溶
不溶
水
-
-
-
-
不溶
-
-
-
-
熱水
-
-
-
-
水
水
HCl
酸
- - HCl
[13]
-
水
水
-
不溶 - 解
水 水 水
水 水 水
- HNO3 不溶
主
硼
族
Ga3+
不溶
略溶
酸, 氧還
[14] 微溶 微溶 水 水 略溶, HNO3 [17]
