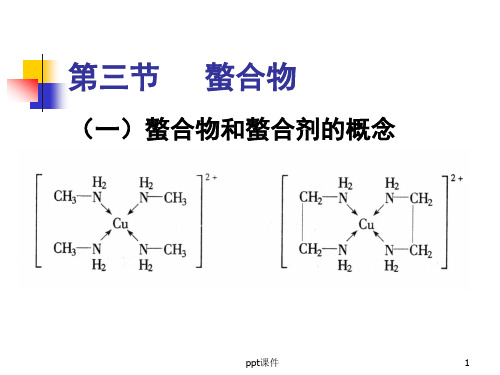
一螯合物和螯合剂的概念
螯合物的定义

螯合物的定义螯合物是一种具有一定稳定性的化合物,能将可溶或不可溶性金属离子、络合阴离子、络合阳离子等包括在分子内部而形成复杂的分子螯合体。
螯合物是目前发展最快、应用范围较广泛的络合剂之一,它被誉为“绿色”、“天然”、“安全”的稀土元素络合剂,在国防、航空航天、医疗卫生等领域均得到了极其重要的应用。
因此对其进行研究就显得尤为必要了。
在众多对镧系元素络合物的研究中,螯合剂的应用占据了相当大的比例。
因此螯合剂在镧系金属络合物的研究与开发上扮演着举足轻重的角色。
随着螯合理论研究和应用水平的不断提高,我们发现镧系元素络合物在络合物结构、电子结构、配位数及电荷数量等方面存在着较大差异,从而导致了镧系元素络合物的多样性,这也给研究者带来了新的挑战。
对于镧系元素络合物,已经做过许多研究工作。
然而由于对镧系元素的认识还只停留在实验阶段,故而没有任何关于镧系元素络合物的计算机模拟程序。
近年来有些学者运用各种数值计算软件进行了镧系元素络合物的数值计算。
这些研究使得大家认识到科学技术飞速发展所带来的巨大影响力,但是它们都是通过经验公式建立起来的,缺乏对实际计算结果的检验,同时又难免会受到实验条件的限制。
螯合剂的出现使得镧系金属络合物的结构和性质逐渐清晰明朗起来,并且随着镧系金属络合物的分析测试手段的不断完善和精密,研究者能够直接获取实验数据进行分析,从而为相关研究打开一扇大门。
近年来研究者在镧系元素络合物的研究上取得了许多突破,如控制加热温度可以增强络合反应的速率;控制反应时间则可以减小络合物中间态浓度;而控制螯合剂的摩尔组成和螯合物中所含阴离子则可以调整络合物的分解温度等。
在最近的研究中人们意外地发现铕- EDTA 络合物的稳定性超越了大多数 EDTA 络合物,不仅能长期稳定存在,而且在其后可以再次与镧系元素发生络合反应。
而且还发现在与钙、镁、铝三种镧系元素络合物的实验研究中,发现与钙络合物的稳定性更好。
此外,镧系金属络合物在液体中的保存期限也比传统的络合剂长。
螯合物知识点

螯合物知识点螯合物是指含有一个或多个配位基与中心金属离子形成稳定配位键的化合物。
螯合物在化学、环境科学和生物学等领域中具有重要应用。
本文将从基础概念、螯合物的形成与性质、应用以及未来发展等方面介绍螯合物的知识点。
1. 基础概念螯合物的概念最早由法国化学家阿尔弗雷德·文伯(Werner)于19世纪末提出。
螯合物由一个或多个配位基(通常是有机物分子或离子)与中心金属离子形成稳定的配位键,形成一个整体稳定的结构。
2. 螯合物的形成与性质螯合物的形成是通过配位键的形成而实现的。
配位基通常通过提供自由电子对与金属离子形成配位键。
螯合物具有以下几个特点:•稳定性:螯合物能够通过配位键的形成增加化合物的稳定性,使其在不同条件下保持稳定结构。
•水溶性:由于螯合物通常具有较大的极性,因此在水溶液中具有良好的溶解性。
•选择性:螯合物的形成可以导致与金属离子的高度选择性结合,从而实现对特定金属离子的识别和分离。
3. 螯合物的应用螯合物在许多领域中具有广泛的应用。
以下是几个重要的应用领域:3.1 化学分析螯合物可以用于分析化学中的金属离子的检测与定量。
通过选择合适的螯合剂,可以实现对特定金属离子的高度选择性识别和分离,从而实现对复杂样品中金属离子的分析。
3.2 医药领域螯合物在医药领域中有广泛应用。
例如,铁离子螯合物可以用作治疗贫血的药物,钙离子螯合物可以用于治疗骨质疏松症等。
3.3 环境科学螯合物在环境科学领域中也具有重要应用。
例如,螯合物可以用于处理废水中的金属离子,使其形成不溶性沉淀物,从而实现对金属离子的去除和废水的净化。
4. 螯合物的未来发展螯合物的研究和应用仍在不断发展。
随着对环境污染和资源稀缺的关注加大,对绿色和可持续发展的需求增加,螯合物的设计和合成也向着更高效、可再生和环境友好的方向发展。
总之,螯合物作为一种特殊的化合物,在化学、环境科学和生物学等领域中具有广泛的应用。
通过了解螯合物的基础概念、形成与性质、应用和未来发展,我们可以更好地理解和应用螯合物,为解决相关问题提供有效的解决方案。
螯合剂种类总结及其在不同pH下的对金属离子的螯合能力比较

螯合剂的种类及其在不同pH值条件下螯合剂的螯合常数一、螯合剂与螯合物具有可供配位孤电子对的分子、原子或离子的化合物能够与具有空轨道的金属离子形成配位键,该化合物称为络合物,如能与配位金属离子形成环状结构的化合物称为螯合剂,形成的络合物称为螯合物。
螯合剂中至少含有一对孤电子对,而金属离子必须有空的价电子轨道,孤电子对填充入金属离子空轨道,电子对属2个原子共享,形成配位键,中心金属离子空轨道杂化。
不同的提供孤电子对的配位体分别与不同金属离子形成正四面体、正六面体、正八面体的螯合物。
1.类型1.1无机类螯合剂聚磷酸盐螯合剂:主要是三聚磷酸钠(STPP)、六偏磷酸钠、焦磷酸钠为主,含磷酸基空间配位基团。
特点:高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,一般只适合在碱性条件下作螯合剂。
1.2有机类螯合剂形态分析表明螯合剂提取的重金属主要来源于可交换态或酸溶态、还原态和氧化态。
1.21羧酸型(1)氨基羧酸类:含羧基和胺(氨基)配位基团,如乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸(DTPA)及其盐等。
如:EDTA的4个酸和2个胺(—NRR′)的部分都可作为配体的齿,两个氮原子和四个氧原子可提供形成配位键的电子对。
特点:络合能力强,络合稳定常数大,耐碱性好,但分散力弱且不易被生物降解。
(2)羟基羧酸类含羟基、羧基配位基团这类羧酸主要是柠檬酸(CA)、酒石酸(TA)和葡萄糖酸(GA)。
特点:可生物降解,在酸性条件下羟基与羧基不会离解为氧负离子,因而络合能力很弱,不适宜在酸性介质中应用。
(3)羟氨基羧酸类这类酸用作螯合剂的典型代表是羟乙基乙二胺三乙酸(HEDTA)和二羟乙基甘氨酸(DEG)。
特点:大多易于生物降解,在pH=9的弱碱性条件下可螯合铁离子,但对其他离子螯合能力较差。
1.22有机多元膦酸羟基亚乙基-1,1-二膦酸(HEDP)、氨基三亚甲基膦酸(A TMP)、二乙烯三胺五亚甲基膦酸(HTPMP)、三乙烯四胺六亚甲(TETHMP)、双(1,6-亚己基)三胺五亚甲基膦酸(BNHMTPMP)、多氨基多醚基四亚甲基膦酸(PAPEMP)。
螯合剂知识

螯合剂知识一、螯合剂的概念由一个简单正离子(称为中心离子)和几个中性分子或离子(称为配位体)结合而成的复杂离子叫配离子(又称络离子),含有配离子的化合物叫配位化合物。
在配合物中中心离子与配位体通过配位键结合。
配位键是一种特殊的共价键,通常的共价键是由两个成键·原子绷出一个电子形成共同电子对的,而在配位键中是由一个原子提供电子对,另一原手提供攀删道形成的。
为了区别把共价键用“一”表示,如H·+·H =H:H(H—H),配位键奶删“←”表示,箭头指向提供空轨道的原子,如Cu+NH3=CuNH3(Cu←NH3)。
如果配位体中只有一个配位原子,则中心离子与配位体之间只能形成一个配位键。
而有些配位体分瑚中含有两个以上的配位原子而且这两个原子间相隔着两至三个其他非配位原子时,:这个硼体就可以与中心离子(或原子)同时形成两个以上的配位键,并形成一个包括两个配位剿五元或六元环的特殊结构,把这种配合物称为螯合物。
螯合物比一般配合物更稳定。
把能形成螯合物的配位体叫整合剂。
螯合剂包括无机和有机两类。
它们在清洗过程中蕉着重要用途。
二、无机金属离子螯合剂聚磷酸盐螯合剂的缺点是它们在高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,兰般只适合在碱性条件下作螯合剂。
一般说来这些无机螯合剂对重金属离子特别是铁离子的螯合能力较差。
由于以上缺点,使无机螯合剂的用途受到限制,通常只用于对钙、镁离子螯合,所以常作为硬水软化剂。
三、有机金属离子螯合剂能与重金属离子起螯合作用的有机化合物很多,如羧酸型、有机多元膦酸等。
1.羧酸型在清洗剂中使用的羧酸型螯合剂主要有氨基羧酸类和羟基羧酸类等。
(1)氨基羧酸类氨基羧酸用作螯合剂的有乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸及其盐等。
它们对钙、镁离子均有较强的螯合作用。
从单位质量的三种酸螯合钙离子的数量看,以NTA螯合最多,ZDTA其次,DTPA再次。
EDTA与螯合剂 ppt课件
ppt课件
10
溶液中螯合物的稳定性除决定于螯 合物稳定常数的大小外,还与溶液 的pH值有关。不同的金属离子与 EDTA生成的螯合物的稳定性不同, 滴定时所需溶液的pH值也不同。因 此,在两种以上金属离子的混合溶 液中,常可以通过调节溶液的pH值, 用EDTA进行选择滴定。
ppt课件
11
例如,在Mg2+离子和Zn2+离子的混合
测定水的总硬度时加NH3-NH4Cl缓 冲溶液调节pH ≈ 10,以铬黑T为指 示剂,用EDTA标准溶液滴定。溶液 中有关配合物的稳定性有如下顺序:
CaY2- > MgY2- >MgIn - > CaIn-
ppt课件
20
反应式如下:
加指示剂时:
Mg2+ + HIn2- ⇌ MgIn - + H+
蓝 紫红
ppt课件
18
可加入某种掩蔽剂(此试剂能与干 扰离子结合成更稳定的配合物,而 对被测离子无影响),把干扰离子 掩蔽起来,再滴定被测离子。例如 EDTA滴定Ca2+ Mg2+时,少量Fe3+, Al3+有干扰,可加入三乙醇胺消除 干扰。
ppt课件
19
(三)EDTA螯合滴定
示例-水的总硬度测定
水的总硬度是指水中Ca2 + , Mg2+ 的总硬度(以为mmol ·L-1单位)
12
(二)EDTA螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
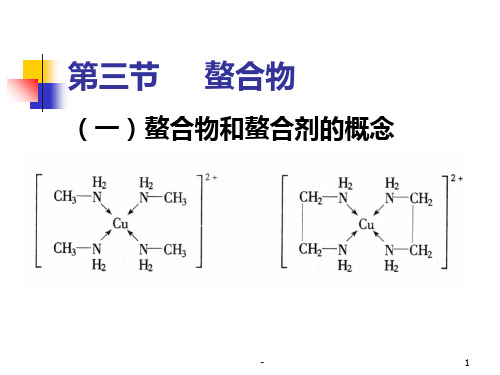
(一)螯合物和螯合剂的概念PPT课件
-
6
CaY2-的结构
-
7
EDTA与金属离子的配合有以下特点:
1.螯合能力强 除碱金属以外,能与 几乎所有的金属离子形成稳定的螯 合物。
2.与金属离子形成的螯合物大多带 有电荷,因此易溶于水。
-
8
3.简单的螯合比 不论几价的金属离子, 它们与EDTA总是1:1螯合。例如:
M2++H2Y2--MY2 - +2H + M3++H2Y2--MY - +2H + M4++H2Y2--MY +2H +
-
12
(二)EDTA螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
-
13
作为金属指示剂必须具备以下条件: 1.与金属离子形成的配合物的颜色 与其本身(即未配合时)的颜色有 明显不同;
Ca2++H2Y2- ⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
滴定终点时:
MgIn-+ H2Y2- ⇌MgY2- +HIn- +H+
紫红
蓝
-
21பைடு நூலகம்
水的总硬度按下式计算:
总硬度= 式中:
CEDTVAEDTA V水样 1000
CEDTA: EDTA 标准溶液的浓度( mol ·L-1 ) VEDTA : 消耗EDTA标准溶液的体积(L) V: 滴定时水样的体积(L)
螯合剂

螯合剂又名络合剂,是一种能和重金属离子发生螯合作用形成稳定的水溶性络合物,而使重金属离子钝化的有机或无机化合物。
这种化合物的分子中含有能与重金属离子发生配位结合的电子给予体,故有软化、去垢、防锈、稳定、增效等一系列特殊作用。
印染工艺中常见的螯合剂有以下几种:(1)磷酸盐类:主要有三聚磷酸钠、多聚磷酸钠、六偏磷酸钠、焦磷酸钠等。
此类螯合剂因有离子交换能力,是最早用于印染工业的水质软化剂,焦磷酸钠可与三价铁离子形成络合离子,故可用于双氧水稳定剂中。
但无机磷酸盐在一些地区已被禁用。
(2)氨基羧酸类:主要有乙二胺四乙酸’(ED—TA),即软水剂B;氮川三乙酸(NTA),即软水剂A。
此外还有二乙撑三胺五乙酸(DTPA)、N一羟乙基乙胺三乙酸(HEDTA)、乙二醇一双一(B一氨基乙醚)一N,N一四乙酸(EGTA)等。
氨基羧酸型螯合剂的配位体是氮原子和带负电荷的羧酸根离子(COO—)。
其配位体数目越多,与金属离子的络合作用越强。
其中DTPA和大多数金属离子络合作用最强,其次是EDTA和HEDTA,NTA最差。
其中DTPA 作为双氧水稳定剂效果最好。
但NTA、EDTA、DTPA等因螯合金属后生物降解性极差,近年来欧洲一些国家已严禁使用。
(3)有机膦酸型类:主要有氨基三亚甲基膦酸(ATMP)、1一羟乙叉一1,1一二膦酸(HEDP)、乙二胺四甲叉膦酸(EDTMP)、二乙烯三胺五甲叉膦酸(DTPMP)、氨基三甲叉膦酸(ATP)等。
此类螯合剂具有使污垢分散、悬浮的能力,在高温下不易水解,对防止产生锅垢效果优良,亦可作锅炉清洗剂。
DTPMP是一种比DTPA效果更好的双氧水稳定剂,DTPA 只是在有硅酸钠存在下,对Ca、Mg盐有较好稳定作用,而DTPMP在不加硅酸钠条件下,也能对双氧水起稳定作用。
这类螯合剂既有较好的螯合、除垢作用,又易于被生物降解,目前使用较多。
(4)羟基羧酸类:主要有葡萄糖酸、聚丙烯酸(PAA)、马来酸(MAO)等。
[总论]螯合剂常识
![[总论]螯合剂常识](https://img.taocdn.com/s3/m/36e9ed7959fafab069dc5022aaea998fcd22405f.png)
螯合剂知识一、螯合剂的概念由一个简单正离子(称为中心离子)和几个中性分子或离子(称为配位体)结合而成的复杂离子叫配离子(又称络离子),含有配离子的化合物叫配位化合物。
在配合物中中心离子与配位体通过配位键结合。
配位键是一种特殊的共价键,通常的共价键是由两个成键·原子绷出一个电子形成共同电子对的,而在配位键中是由一个原子提供电子对,另一原手提供攀删道形成的。
为了区别把共价键用“一”表示,如H·+·H=H:H(H—H),配位键奶删“←”表示,箭头指向提供空轨道的原子,如Cu+NH3=CuNH3(Cu←NH3)。
如果配位体中只有一个配位原子,则中心离子与配位体之间只能形成一个配位键。
而有些配位体分瑚中含有两个以上的配位原子而且这两个原子间相隔着两至三个其他非配位原子时,:这个硼体就可以与中心离子(或原子)同时形成两个以上的配位键,并形成一个包括两个配位剿五元或六元环的特殊结构,把这种配合物称为螯合物。
螯合物比一般配合物更稳定。
把能形成螯合物的配位体叫整合剂。
螯合剂包括无机和有机两类。
它们在清洗过程中蕉着重要用途。
二、无机金属离子螯合剂聚磷酸盐螯合剂的缺点是它们在高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,兰般只适合在碱性条件下作螯合剂。
一般说来这些无机螯合剂对重金属离子特别是铁离子的螯合能力较差。
由于以上缺点,使无机螯合剂的用途受到限制,通常只用于对钙、镁离子螯合,所以常作为硬水软化剂。
三、有机金属离子螯合剂能与重金属离子起螯合作用的有机化合物很多,如羧酸型、有机多元膦酸等。
1.羧酸型在清洗剂中使用的羧酸型螯合剂主要有氨基羧酸类和羟基羧酸类等。
(1)氨基羧酸类氨基羧酸用作螯合剂的有乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸及其盐等。
它们对钙、镁离子均有较强的螯合作用。
从单位质量的三种酸螯合钙离子的数量看,以NTA螯合最多,ZDTA其次,DTPA再次。
