2018年广东省普通高中化学学业水平测试复习-专题十-常见非金属元素
2018广东学业水平化学知识点总结

2018年广东省高中学业水平测试物理知识点归纳一、物质的量1.物质的量(1)物质的量的单位是摩尔(mol)。
(2)1 mol任何微粒所含的微粒数=0.012 kg一种碳原子(12C)所含的碳原子数=6.02×1023(3)阿伏加德罗常数(N A):约为6.02×1023 mol-1。
(4)物质的量(n)、阿伏加德罗常数(N A)与微粒数(N)之间的关系:n = NN A。
2.摩尔质量(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量(M),单位为g•mol-1。
(2)物质的摩尔质量数值上等于该物质的相对分子/原子质量。
(3)物质的量(n)、物质的质量(m)和物质的摩尔质量之间的关系:n = mM。
3.气体摩尔体积(1)定义:一定的温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积(V m),单位为L•mol-1。
(2)标准状况下,V m≈22.4 L•mol-1。
(3)物质的量(n)、气体的体积(V)和气体摩尔体积(V m)之间的关系:n =VV m。
4.物质的量浓度(1)定义:以单位体积的溶液中所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度(c B),单位为mol•L-1 。
(2)在一定物质的量浓度的溶液中,溶质B的物质的量(n)、溶液的体积(V)和溶质的物质的量浓度(c B)之间的关系:n = c B•V 。
(3)容量瓶:常用于配制一定体积、浓度准确的溶液。
二、胶体1.定义:分散质的微粒直径介于1~100 nm之间的分散系称为胶体。
2.溶液、浊液、胶体的本质区别:分散质粒子的大小不同。
3.丁达尔现象:当可见光束通过胶体时,在入射光侧面可观察到光亮的通路,这种现象称为丁达尔现象。
4.丁达尔现象可用于检验溶液和胶体。
5.聚沉:胶体形成沉淀析出的现象称为聚沉。
6.引起胶体聚沉的条件:加入可溶性盐、加热、搅拌等。
三、离子反应1.电解质:在水溶液里或熔融状态下能够导电的化合物称为电解质。
2018年广东省普通高中化学学业水平测试复习 专题十 常见非金属元素
注:(1)表示1月学业水平考题。
考点1 碳、硅元素单质及其化合物的主要性质与应用1.(2017·广东学业水平测试T25)广东是滨海砂矿储量最大的省份,滨海砂矿中含有丰富的石英砂(主要成分为SiO 2)。
关于SiO 2的说法正确的是( )A .能与水反应B .硬度小,熔点低C .能与盐酸反应D .能与NaOH 溶液反应 2.(2016·广东学业水平测试T19)碳素墨水是一种以炭黑为颜料的黑色墨水,签署需要长时间保存的重要文件时,通常要求使用碳素墨水。
这是利用了碳的( )A .导电性B .水溶性C .氧化性D .化学稳定性 3.(2015·广东学业水平测试T20)下列有关化合物的说法正确的是( ) A .干冰的主要成分是H 2O B .吸入CO 可导致人体中毒 C .SO 2可大量用于漂白食品 D .小苏打的主要成分是Na 2CO 3 4.(2013·广东学业水平测试T4)硅是无机非金属材料的主角,其元素符号是( ) A .S B .Si C .B D .Be1.二氧化硅二氧化硅又称石英,化学式为SiO 2。
SiO 2是酸性氧化物,化学性质很稳定,不溶于水也不跟水反应,不跟一般的酸起作用,能与氢氟酸反应生成四氟化硅气体:SiO 2+4HF===SiF 4↑+2H 2O 。
O3.硅酸H 2SiO 3是不溶于水的弱酸,根据元素周期律,硅酸酸性比碳酸还弱。
它很容易形成胶体溶液,制得的硅酸是胶冻状物质,沉淀析出。
将其干燥脱水,变成白色、透明、多孔的固体物质,一般称为硅胶,具有多孔结构,吸附力强,能吸收多种气体和蒸气,且吸附水分能力强,是实验室常用的干燥剂、吸附剂。
4.“水玻璃”硅酸钠的水溶液叫“水玻璃”,又称“泡花碱”。
“水玻璃”是无色、透明、黏稠的液体,久置的“水玻璃”吸收了空气中的CO 2发生反应:Na 2SiO 3+H 2O +CO 2===Na 2CO 3+H 2SiO 3↓,同时说明碳酸的酸性比硅酸强。
广东省高中化学学业水平考试知识点

广东省高中化学学业水平考试知识点一、元素化合物:(一)、卤族元素1. 遇淀粉变蓝的物质 I2(碘水、碘酒)2. 使淀粉—KI溶液变蓝的物质 Cl23. 最强的含氧酸 HClO44. 最稳定的气态氢化物 HF5. 描述下列实验现象:(1)铜丝在氯气中燃烧,产生棕黄色的烟(2)H2在Cl2中燃烧,产生苍白色的火焰(3)CH4与Cl2混合光照,黄绿色变浅,瓶内壁有油状液滴6. 漂白粉的有效成分: Ca(ClO)27. 检验Cl-先加稀HNO3酸化,再加入AgNO3溶液,有白色沉淀(二)、氧族元素1、能使品红褪色的气体 SO2(颜色可复现)、Cl2(颜色不可复现)2、能使澄清的石灰水变浑浊的气体 CO2、SO23、浓硫酸的特性吸水性、脱水性、氧化性、难挥发4、检查肠胃用作“钡餐”的 BaSO45、检验SO42—先加稀盐酸酸化,再加入BaCl2溶液,有白色沉淀(三)、氮族元素1、常用作金属焊接保护气、代替稀有气体填充灯泡、保存粮食水果的气体 N22、在放电情况下才发生反应的两种气体 N2与O23、遇到空气立刻变红棕色的气体 NO4、有颜色的气体 Cl2(黄绿色)、NO2(红棕色)、5、造成光化学烟雾的污染物 NO26、极易溶于水形成喷泉的气体 NH3、HCl7、溶于水显碱性的气体 NH3 8、能使湿润的红色石蕊试纸变蓝的气体 NH39、两种气体相遇产生白烟:NH3遇HCl10、某溶液加入NaOH溶液产生气体气体一定是NH3;溶液一定含NH4+11、检验某白色固体是铵盐的方法加入浓NaOH溶液并加热,产生刺激气味能使湿润的红色石蕊试纸变蓝的气体,则固体为铵盐。
12、浓硝酸的特性不稳定易分解、强氧化性、易挥发13、王水的成分及特性浓硝酸与浓盐酸1:3体积比混合具有极强的氧化性(溶解金、铂)14、能使蛋白质变黄的物质浓硝酸 15、火柴盒侧面的涂料红磷(四)、碳族1、制造计算机芯片和太阳能电池的是晶体硅2、制造光导纤维的原料 SiO23、不能贮存在有磨口玻璃塞的玻璃瓶中的是 NaOH、KOH、(Na2SiO3)(五)、碱金属1、 Na+的焰色:黄色; K+的焰色:紫色(隔蓝色钴玻璃观察)2、钠与水反应的现象钠漂浮.在水面上,熔.化成一个银白色小球,在水面到处游.动,发出咝咝的声响.,反应后滴入酚酞溶液变红.。
广东省高中化学学业水平考试知识点

适用标准文案广东省高中化学学业水平考试知识点一、元素化合物:(一 ) 、卤族元素1. 遇淀粉变蓝的物质I 2(碘水、碘酒)2. 使淀粉— KI 溶液变蓝的物质 Cl23. 最强的含氧酸HClO 44. 最稳固的气态氢化物HF5.描绘以下实验现象:( 1 )铜丝在氯气中焚烧,产生棕黄色的烟( 2 ) H 2在 Cl2中焚烧,产生苍白色的火焰( 3 ) CH 4与 Cl 2混淆光照,黄绿色变浅,瓶内壁有油状液滴6.漂白粉的有效成分 : Ca(ClO) 27.查验 Cl-先加稀 HNO 3酸化,再加入 AgNO 3溶液,有白色积淀(二)、氧族元素1 、能使品红退色的气体SO 2(颜色可复现 )、 Cl 2(颜色不行复现)2 、能使澄清的石灰水变污浊的气体CO 2、SO 23 、浓硫酸的特征吸水性、脱水性、氧化性、难挥发4 、检查肠胃用作“钡餐”的BaSO 45 、查验 SO 42—先加稀盐酸酸化,再加入BaCl 2溶液,有白色积淀(三)、氮族元素1 、常用作金属焊接保护气、取代罕有气体填补灯泡、保留粮食水果的气体N 22 、在放电状况下才发生反响的两种气体N 2与 O 23 、碰到空气马上变红棕色的气体NO4 、有颜色的气体Cl 2(黄绿色)、 NO 2(红棕色)、5 、造成光化学烟雾的污染物NO 26 、极易溶于水形成喷泉的气体NH 3、 HCl7 、溶于水显碱性的气体NH 3 8 、能使润湿的红色石蕊试纸变蓝的气体NH 39 、两种气体相遇产生白烟:NH 3遇 HCl文档大全10 、 某溶液加入 NaOH 溶液产生气体 气体必定是 NH 3 ;溶液必定含 NH 4 +11 、 查验某白色固体是铵盐的方法 加入浓 NaOH 溶液并加热,产生刺激气味能使润湿的红色石蕊试纸变蓝的气体,则固体为铵盐。
12 、 浓硝酸的特征 不稳固易分解、强氧化性、易挥发13 、 王水的成分及特征 浓硝酸与浓盐酸 1 :3 体积比混淆拥有极强的氧化性(溶解金、铂)14 、 能使蛋白质变黄的物质 浓硝酸15 、 火柴盒侧面的涂料红磷(四)、碳族1 、制造计算机芯片和太阳能电池的是晶体硅 2、制造光导纤维的原料 SiO 23 、不可以储存在有磨口玻璃塞的玻璃瓶中的是NaOH 、 KOH 、( Na 2 SiO 3)(五)、碱金属1 、 Na +的焰色:黄色; K + 的焰色:紫色(隔蓝色钴玻璃察看)2 、 钠与水反响的现象钠飘荡 在水面上,熔 化成一个银白色小球,在水面各处游 动,发出咝咝的声. . .响,反响后滴入酚酞溶液变红 。
09常见非金属元素(学业水平测试复习)

1△ 常见非金属元素(如H 、C 、N 、O 、Si 、S 、Cl 等)考点一:了解常见非金属元素单质及其重要化合物的主要性质,了解其应用。
1、C (1)CO 、CO 2A 、CO 是一种无色 毒气体,不溶于水,不与酸、碱溶液反应。
B 、CO 具有还原性,C O +CuO = Cu +C O 2C 、CO 2是一种无色无味 毒气体,能溶于水。
D 、CO 2是酸性氧化物、与碱性氧化物、碱反应。
CO 2+CaO= CaCO 3 ;CO 2+Ca(OH)2= CaCO 3↓+H 2O(2)H 2CO 3是二元弱酸,不稳定,易分解成水和二氧化碳。
例题1 可与人体血液中的物质结合导致中毒的空气污染物是A .H 2B .N 2C .CO 2D .CO2、N(1)N 2是无色无味的气体,性质稳定,难溶于水。
N 2 + O 2=2NO(2)NO 是无色有毒(同CO )气体,难溶于水,易于O 2反应生成NO 2;NO 2是 色有毒气体,易溶于水生成硝酸和NO 。
2NO + O 2=2 N O 23NO 2 + H 2O =2HNO 3 +NO 【“雷雨固氮”、“雷雨发庄稼”的反应】 (3)NH 3是无色刺激性气味气体,极易溶于水(1:700)(可做喷泉实验)。
水溶液呈弱 性。
NH 3与酸反应生成盐: NH 3+HCl =NH 4Cl (产生 )浓硝酸可以产生同样现象,浓硫酸不可以。
检.验.氨气..:.a ...湿润..的. 色石蕊试纸.....变. (.NH ..3.是唯一能使湿润的红.........色石蕊试纸变蓝的气体)...........b ...蘸浓.. 的玻璃棒产生白.......烟。
.. 氨气的实验室制法:2NH 4Cl +Ca(OH)2△2NH 3↑+Ca Cl 2+2H 2O(4)铵盐 均 于水,且都为 色晶体,受热易分解,加碱加热制氨气。
(4)硝酸(HNO 3) 挥发,浓硝酸和稀硝酸都是强 剂,能氧化大多数金属(除金、铂),但不放出 气,通常 硝酸产生NO 2, 硝酸产生NO ,如: Cu +4HNO 3(浓)=3Cu +8HNO 3(稀)=例题2 雷雨时,空气中的氮气和氧气可生成氮的氧化物,该氧化物进一步反应后遇水变成A .NO 2B .HNO 3C .H 2SO 4D .NH 3•H 2O例题3 施用碳酸氢铵、氯化铵等铵态氮肥能够促进农作物生长,但是铵态氮肥不能与碱性肥料如草木灰混合使用,其原因是铵态氮肥A .易溶于水B .能与碱反应C .受热易分解 D.在水中易发生电离例题4 不会造成空气污染的气体是A .N 2B .NH 3C .NO 2D .SO 2例题5 某化学活动小组欲制备一定量的氢气,下列方法不能达到目的的是A.Cu和稀硝酸反应B.Zn和稀盐酸反应C.Fe和稀硫酸反应D.A1和稀盐酸反应例题6 工业上合成NH3除了需要N2外,一定还需要A.H2B.O2C.CO2D.CO3、Si 硅元素在地壳中的含量排第二(1)单质硅(Si):有金属光泽的灰黑色固体用于太阳能电池、计算机芯片以及体材料等。
10常见非金属元素及其化合物

第16页
专题十
高考调研
高考总复习·二轮专题·化学
解析 粗硅提纯涉及的反应:Si+2Cl2=高==温==SiCl4、SiCl4 +2H2=高==温==Si+4HCl 都是氧化还原反应,B 项错误;硅与 氢氧化钠溶液反应中 NaOH 既不是氧化剂,也不是还原剂, 只是反应物,起氧化作用的是水,C 项错误;硅能与氢氟酸 反应,但不能与盐酸反应,D 项错误。
高考调研
高考总复习·二轮专题·化学
2.与金属反应 非金属单质与变价金属反应:若非金属单质的氧化性较强 (如 O2、Cl2、Br2 等),则金属被氧化成高价态化合物;若非金 属单质的氧化性较弱(如 I2、S 等),则金属被氧化成低价态化合 物。
第6页
专题十
高考调研
高考总复习·二轮专题·化学
3.与水反应 氧化性:2F2+2H2O===4HF+O2 歧化反应:X2+H2O===HX+HXO(X2=Cl2、Br2、I2) 还原性:C+H2O(g)=高==温==CO(g)+H2(g)
第14页
专题十
高考调研
高考总复习·二轮专题·化学
解析 A 选项,新制氯水显酸性,也具有漂白性,滴加 少量紫色石蕊试液,溶液先变红后褪色;B 选项,金刚石在 一定条件下能与氧气反应生成二氧化碳;C 选项正确;D 选 项,1 mol Cl2 与足量铁反应,只能转移 2 NA 个电子。
第15页
专题十Biblioteka 高考调研第7页专题十
高考调研
高考总复习·二轮专题·化学
4.与碱反应 歧化反应:X2+2OH-===X-+XO-+H2O(X2=Cl2、Br2、 I2);3S+6OH-===2S2-+SO23-+3H2O 还原性:Si+2OH-+H2O===SiO23-+2H2↑
2018年广东省普通高中学业水平合格性考试化学试卷 含答案

6. 分类是学习和研究化学的一种重要方法,下列分类合理的是:
A. K2CO3 和 K2O 都属于盐
B. KOH 和 Na2CO3 都属于碱
C. H2SO4 和 HNO3 都属于酸
D. Na2O 和 Na2SiO3 都属于氧化物
【答案】C
7. 《天工开物》中记载“铁器淬与胆矾水中,即成铜色也”,该过程中涉及的反应类型为
A. 用醋酸除去水垢
B. 用 KClO3 制备 O2
C. 用漂白粉漂白衣物
D. 用酒精清洁电子产品的油污
【答案】D
5. 下列化学用语正确 是( )
A. 镁离子: Mg
B. 氯原子: Cl2
1
C. S 原子的结构示意图:
HH ||
D. 乙醇的结构式: H- C - C -O-H || HH
【答案】D
A. 太阳能转化为电能
B. 存在键的断裂与生成
C. 化学能转化为太阳能
D. 光催化剂分解得到 H2 和 O2
【答案】B
19. 下列反应的离子方程式不正确的是( )
3
A. 铁与稀盐酸反应: 2Fe+6H+ =2Fe3+ +3H2 B. 氢氧化钠溶液与盐酸反应: OH− +H+ =H2O
C. 锌与硫酸铜溶液反应: Zn+Cu2+ =Zn2+ +Cu
物质 X 为
A. CO
B. O2
C. CS2 【答案】B 12. 有消毒作用的气体是
D. CaO
A. N2
B. H2
C. O3
D. CO2
2
【答案】C 13. 下列物质的用途不.正.确.的是
A. 单质硅制作芯片
2018年广东省普通高中化学学业水平测试复习模拟测试卷(二)含解析

广东省普通高中学业水平测试模拟测试卷(二)(时间:90分钟,满分:100分)一、单项选择题Ⅰ:本大题共30小题,每小题1分,共30分。
在每小题列出的四个选项中,只有一项最符合题意。
1.下列关于O的叙述正确的是( )A.质量数为8 B.质子数为8C.中子数为16 D.电子数为162.对于元素周期表和元素周期律的发现有突出贡献的科学家是( )A.拉瓦锡B.阿伏加德罗C.门捷列夫D.道尔顿3.下列物质属于化合物的是( )A.HCl B.O2C.Br2D.Ar4.下列物质中,N元素的化合价为+2价的是( )A.N2B.NOC.NO2D.HNO35.下列物质属于电解质的是()A.Cu B.N2C.KNO3D.C2H5OH6.关于CuSO4溶液和Fe(OH)3胶体描述正确的是( )A.两者都能产生丁达尔现象B.两者都不能产生丁达尔现象C.CuSO4溶液能产生丁达尔现象,Fe(OH)3胶体不能产生丁达尔现象D.CuSO4溶液不能产生丁达尔现象,Fe(OH)3胶体能产生丁达尔现象7.用pH试纸测定白醋的酸碱度时,如果先将试纸用蒸馏水润湿,再把白醋滴在试纸上,则测得的结果与白醋实际的pH比较( ) A.偏低B.偏高C.相等D.无法比较8.下列关系式中,错误的是()A.n=错误!B.n=错误!C.n=错误!(限气体) D.c=错误!9.将KSCN溶液加入到下列所指定的各溶液中,溶液不会显红色的是()A.加入足量的铁粉后的FeCl3溶液 B.铁丝在足量氯气中燃烧后,所得产物的水溶液C.长期暴露在空气中的绿矾溶液D.加入氯水后的FeCl2溶液10.在任何条件下,金属铜不能够与浓盐酸反应,却能够在加热条件下与浓硫酸反应,是因为浓硫酸具有( )A.脱水性B.吸水性C.强酸性D.强氧化性11.某化学活动小组欲制备一定量的氢气,下列方法不能达到目的的是( )A.Cu和稀硝酸反应B.Zn和稀盐酸反应C.Fe和稀硫酸反应D.Al和稀盐酸反应12.将粗盐溶于水后,其中的杂质可用过滤的方法除去的是( )A.Mg2+B.Ca2+C.SO错误!D.泥沙13.补硒能防癌抗癌,抑制肿瘤细胞的增殖并促进其凋亡,这里的硒应理解为( )A.金属单质B.非金属单质C.元素D.分子14.除去下列各物质中的少量杂质,所用方法不可行的是( )选项物质杂质除去杂质的方法A CuSO4溶液稀H2SO4加入足量氧化铜粉末充分反应后过滤B NaCl粉末MgCl2粉末加入饱和NaCl溶液C Cu粉Fe粉用磁铁吸出D Na2CO3粉末NaHCO3粉末加热15。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
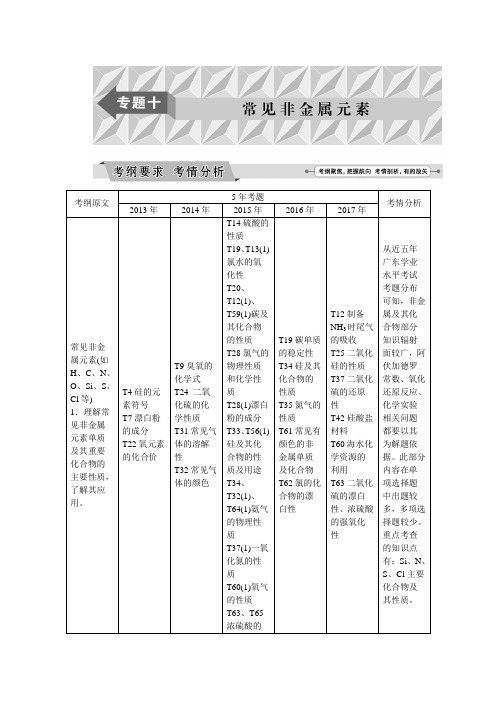
考纲原文5年考题考情分析2013年2014年2015年2016年2017年常见非金属元素(如H、C、N、O、Si、S、Cl等) 1.理解常见非金属元素单质及其重要化合物的主要性质,了解其应用。
T4硅的元素符号T7漂白粉的成分T22氧元素的化合价T9臭氧的化学式T24 二氧化硫的化学性质T31常见气体的溶解性T32常见气体的颜色T14硫酸的性质T19、T13(1)氯水的氧化性T20、T12(1)、T59(1)碳及其化合物的性质T28氯气的物理性质和化学性质T28(1)漂白粉的成分T33、T56(1)硅及其化合物的性质及用途T34、T32(1)、T64(1)氨气的物理性质T37(1)一氧化氮的性质T60(1)氧气的性质T63、T65浓硫酸的T19碳单质的稳定性T34硅及其化合物的性质T35氮气的性质T61常见有颜色的非金属单质及化合物T62氯的化合物的漂白性T12制备NH3时尾气的吸收T25二氧化硅的性质T37二氧化硫的还原性T42硅酸盐材料T60海水化学资源的利用T63二氧化硫的漂白性、浓硫酸的强氧化性从近五年广东学业水平考试考题分布可知,非金属及其化合物部分知识辐射面较广,阿伏加德罗常数、氧化还原反应、化学实验相关问题都要以其为解题依据。
此部分内容在单项选择题中出题较多,多项选择题较少。
重点考查的知识点有:Si、N、S、Cl主要化合物及其性质。
物理性质和化学性质2.了解常见非金属元素单质及其重要化合物对环境质量的影响。
T11二氧化硫的污染问题T61二氧化硫的污染问题T10二氧化硫和二氧化氮的污染问题注:(1)表示1月学业水平考题。
考点1碳、硅元素单质及其化合物的主要性质与应用1.(2017·广东学业水平测试T25)广东是滨海砂矿储量最大的省份,滨海砂矿中含有丰富的石英砂(主要成分为SiO2)。
关于SiO2的说法正确的是()A.能与水反应B.硬度小,熔点低C.能与盐酸反应D.能与NaOH溶液反应2.(2016·广东学业水平测试T19)碳素墨水是一种以炭黑为颜料的黑色墨水,签署需要长时间保存的重要文件时,通常要求使用碳素墨水。
这是利用了碳的() A.导电性B.水溶性C.氧化性D.化学稳定性3.(2015·广东学业水平测试T20)下列有关化合物的说法正确的是()A.干冰的主要成分是H2OB.吸入CO可导致人体中毒C.SO2可大量用于漂白食品D.小苏打的主要成分是Na2CO34.(2013·广东学业水平测试T4)硅是无机非金属材料的主角,其元素符号是() A.S B.SiC.B D.Be1.二氧化硅二氧化硅又称石英,化学式为SiO2。
SiO2是酸性氧化物,化学性质很稳定,不溶于水也不跟水反应,不跟一般的酸起作用,能与氢氟酸反应生成四氟化硅气体:SiO2+4HF===SiF4↑+2H2O。
物质二氧化硅二氧化碳化学式SiO2CO2主要物理性质硬度大,熔、沸点高,常温下为固体,不溶于水熔、沸点低,常温下为气体,微溶于水化学性质(1)与水反应不反应CO2+H2O H2CO3(2)与酸反应SiO2+4HF===SiF4↑+2H2O 不反应(3)与碱反应SiO2+2NaOH===Na2SiO3+H2O,盛碱液的试剂瓶用橡胶塞CO2+2NaOH===Na2CO3+H2O(4)与盐反应SiO2+Na2CO3=====高温Na2SiO3+CO2↑Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;CO2+Na2CO3+H2O===2NaHCO3(5)与碱性氧化物反应SiO2+CaO=====高温CaSiO3CO2+Na2O=====△Na2CO3 3.硅酸H2SiO3是不溶于水的弱酸,根据元素周期律,硅酸酸性比碳酸还弱。
它很容易形成胶体溶液,制得的硅酸是胶冻状物质,沉淀析出。
将其干燥脱水,变成白色、透明、多孔的固体物质,一般称为硅胶,具有多孔结构,吸附力强,能吸收多种气体和蒸气,且吸附水分能力强,是实验室常用的干燥剂、吸附剂。
4.“水玻璃”硅酸钠的水溶液叫“水玻璃”,又称“泡花碱”。
“水玻璃”是无色、透明、黏稠的液体,久置的“水玻璃”吸收了空气中的CO2发生反应:Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓,同时说明碳酸的酸性比硅酸强。
向硅酸钠溶液中加入盐酸,也可析出硅酸沉淀:Na2SiO3+2HCl===2NaCl+H2SiO3↓。
“水玻璃”有很大的实用价值,常作耐火材料、黏结剂、洗涤剂,木材、织物经“水玻璃”浸泡后有防腐、不易着火的性能,“水玻璃”涂在蛋壳上可防止蛋类因细菌浸入而引起腐败,作蛋类防腐剂。
[温馨提示](1)二氧化硅不与任何酸反应是错的,二氧化硅能与氢氟酸反应,是特性。
(2)二氧化硅不能溶于水,也不能与水反应,因此二氧化硅不能直接合成硅酸。
(多选)下列说法正确的是()A.SiO2溶于水显酸性B.CO2通入水玻璃中可得硅酸C.SiO2是酸性氧化物,它不溶于任何酸D.SiO2晶体中不存在单个SiO2分子[解析]二氧化硅是酸性氧化物,但它不溶于水,可以溶于氢氟酸;二氧化硅是原子晶体,故晶体中不存在分子。
[答案]BD[特别提醒]二氧化硅和二氧化碳都是酸性氧化物,但它们的结构、性质有较大的差别。
(2015·广东学业水平测试)水玻璃是建筑行业常用的粘合剂,并可用于木材防火和防腐处理。
水玻璃为()A.CaSiO3固体B.SiO2C.Na2SiO3水溶液D.H2SiO3[解析]水玻璃即Na2SiO3的水溶液,常用作木材防火剂等。
[答案] C考点2氮元素单质及其化合物的主要性质与应用1.(2017·广东学业水平测试T12)实验室制备NH3时,其尾气吸收装置正确的是()2.(2016·广东学业水平测试T35)汽车在剧烈碰撞后,安全气囊会弹出并充满一种保护气体。
该气体在空气中含量最高,其分子式为()A.O2B.COC.N2D.CO23.(2015·广东学业水平测试T34)下列气体对呼吸道有刺激作用的是()A.O2B.N2C.CO2D.NH34.(2014·广东学业水平测试T31)将贮满某种干燥气体的试管倒置于水中,轻轻摇晃后,水可以充满试管。
该气体可能是()A.O2B.N2C.H2D.NH31.氮气无色、有刺激性气味的气体,不溶于水,通常条件下不和氧气发生反应,但在雷雨天放电或者高温下能与氧气反应,化学方程式为N 2+O 2=====放电或高温2NO 。
氮气与氢气在高温、高压、催化剂存在下可合成氨气,这是工业合成氨的原理,化学方程式为N 2+3H 2高温、高压催化剂2NH 3。
2.一氧化氮无色、有毒的气体,极易和氧气反应,化学方程式为2NO +O 2===2NO 2。
3.二氧化氮红棕色、有刺激性气味的有毒气体,密度比空气大,易液化,溶于水时化学反应方程式为3NO 2+H 2O===2HNO 3+NO 。
4.氨无色、有刺激性气味的气体,比空气轻,易液化,是常用的制冷剂。
极易溶于水,与水反应生成NH 3·H 2O ,氨水是一种弱碱。
NH 3与HCl 相遇产生白烟(NH 4Cl 微粒)。
5.铵盐铵盐都为白色晶体,都易溶于水,受热易分解,分解产物为NH 3与对应酸。
6.硝酸(1)物理性质及保存无色、有刺激性气味的液体,浓硝酸易挥发。
应密闭保存于棕色玻璃塞瓶中,不可用无色试剂瓶和橡胶塞,以防见光分解。
(2)化学性质HNO 3具有强酸性、强氧化性,浓硝酸能与除Au 、Pt 等很不活泼金属外的所有金属反应。
遇冷浓HNO 3钝化的金属有Fe 、Al 。
稀硝酸氧化性比浓硝酸弱。
浓硝酸与浓盐酸以体积比1∶3混合而成“王水”,能溶解Au 、Pt 等不活泼金属。
[温馨提示] (1)大多数非金属氢化物的水溶液是酸性的,但氮的氢化物(NH 3)水溶液是碱性的。
(2)硝酸与金属反应得不到氢气。
Murad 等三位教授最早提出NO 分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授获得了1998年诺贝尔医学奖及生理学奖。
关于NO 的下列叙述不正确的是( )A .NO 能够与人体血红蛋白结合,造成人体缺氧中毒B .NO 是汽车尾气的有害成分之一C .NO 在人体的血管系统内具有传送信号的功能D .常温下,N 2和O 2化合可得NO[解析] 氮分子中有共价三键(N ≡N),当氮气参加化学反应时,必须打开(破坏)分子中的三键,这就需要吸收很高的能量。
因此,在通常情况下,氮气的性质很不活泼,很难跟其他物质发生化学反应。
只有在高温或放电条件下,氮分子获得了足够的能量,才能与H 2、O 2等发生化学反应。
[答案] D[特别提醒] 氮的氧化物特别是NO ,组成简单、性质多样、涉及面广、污染环境等,是考试命题的热点之一。
题目常以最新科技成果或社会生活实际问题为材料背景,考查其结构、性质及应用。
(2015·广东1月学业水平测试)(多选)易溶于水的气体有( )A .H 2B .N 2C .SO 2D .NH 3[解析] H 2、N 2均不溶于水,SO 2易溶于水生成H 2SO 3,NH 3易溶于水生成NH 3·H 2O 。
[答案] CD考点3 氧、硫元素单质及其化合物的主要性质与应用1.(2017·广东学业水平测试T37)能使酸性KMnO 4溶液褪色的是( ) A .H 2 B .CO 2 C .SO 2 D .CH 4 2.(2015·广东学业水平测试T14)下列关于硫酸的叙述正确的是( ) A .浓硫酸具有吸水性 B .稀硫酸可用铁罐贮存 C .稀硫酸能使蔗糖脱水D .SO 2溶于水,可得到稀硫酸 3.(2014·广东学业水平测试T9)复印机工作时会产生一种腥臭味的气体,该气体只由氧元素组成,其化学式为( )A .O 2B .NO 2C .O 3D .N 2O1.硫俗称硫黄,是一种浅黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,硫或含硫物质在空气中燃烧生成二氧化硫。
游离态的硫存在于火山喷口附近或地壳的岩层里。
硫在空气中燃烧发出淡蓝色火焰,其化学方程式为S +O 2=====点燃SO 2。
硫蒸气和氢气在加热条件下反应的化学方程式为S +H 2=====△H 2S 。
2.二氧化硫SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水生成亚硫酸。
SO2中的S为中间价态,具有氧化性和还原性;SO2能使某些有机色素与其本身结合变为无色,即SO2具有漂白性,但久放或日晒、加热,颜色会复现。
3.稀硫酸(1)稀硫酸中H2SO4的电离方程式为H2SO4===2H++SO2-4。
(2)具有酸的通性①能使紫色石蕊试液变红,不能使无色酚酞试液变色。
