水中磷酸盐含量的测定的实验报告修订稿
磷酸盐证实报告方法验证方法证实报告

项目名称:生活饮用水 磷酸盐
方法名称:生活饮用水标准检验方法
无机非金属指标 磷酸盐
磷钼蓝分光光度法
GB/T 5750.5-2006 7.1
验证单位:安阳协力环境检测有限公司
通讯地址:安阳市龙安区嘉洲灏庭北门东楼4F
报告编写人:
报告日期:年 月 日
实验室基本情况
参加验证人员情况登记表
本报告中模拟样品加标回收率测定结果为:99.83%~100.39%,该实验方法满足准确度的要求。
综上所述,磷钼蓝分光光度法测定水中磷酸盐的方法测定结果满意,检出限能够满足国家标准检出限要求,方法精密度和准确度高,
试验结果对空白值测定及校准曲线的绘制、重复性的测定、再现性的测定、有证标准物质的测定、回收率的测定均满足标准方法要求。根据本方法验证实验,可得出以下结论:本实验室的证实实验符合生活饮用水标准检验方法无机非金属指标 磷酸盐(磷钼蓝分光光度法)GB/T 5750.5-2006 7.1及其质量保证与质量控制技术要求,可以被本实验室使用。
使用仪器情况登记表
仪器名称
仪器厂家、规格型号
仪器编号
性能状况
(计量/校准状态、量程、灵敏度等)
备注
前处理仪器、设备
无
分析仪器、设备
紫外可见分光光度计
舜宇恒平
AYXL/YQ—04
校准 190~1100
注:仪器包括采样、前处理、分析过程涉及到的所有仪器。
使用试剂及溶剂登记表
名称
厂家、规格
有效期
开瓶日期
纯化处理方法
标准溶液、质控样、内标、标准参考物质
磷酸盐标准溶液
溶剂、试剂
钼酸铵-硫酸溶液
天津市科密欧化学试剂
水中磷的测定实验报告

一、实验目的1. 掌握水中磷的测定方法。
2. 了解水质污染对生态环境的影响。
3. 培养实验操作技能,提高实验数据分析能力。
二、实验原理水中磷主要以无机磷酸盐的形式存在,其含量对水质、水生生态及人类健康具有重要影响。
本实验采用分光光度法测定水中磷含量,通过在特定波长下测定溶液吸光度,根据标准曲线计算水中磷含量。
三、实验材料与仪器1. 实验材料:水样、硝酸、钼酸铵、抗坏血酸、显色剂、无磷水。
2. 实验仪器:分光光度计、移液器、容量瓶、试管、烧杯、电子天平等。
四、实验步骤1. 标准曲线的绘制(1)取7个100mL容量瓶,分别加入0.00、0.50、1.00、2.00、3.00、4.00、5.00mL的磷标准溶液,用水定容至刻度线。
(2)向每个容量瓶中加入5mL硝酸,混匀。
(3)向每个容量瓶中加入1mL钼酸铵溶液,混匀。
(4)室温下放置15分钟。
(5)加入1mL抗坏血酸溶液,混匀。
(6)室温下放置15分钟。
(7)以无磷水为参比,在波长660nm处测定吸光度。
(8)以吸光度为纵坐标,磷含量为横坐标,绘制标准曲线。
2. 水样测定(1)取100mL水样,加入5mL硝酸,混匀。
(2)按照绘制标准曲线的步骤,进行显色反应。
(3)以无磷水为参比,在波长660nm处测定吸光度。
(4)根据标准曲线计算水样中磷含量。
五、实验结果与分析1. 标准曲线的绘制根据实验数据绘制标准曲线,得到线性方程为:y = 0.0125x + 0.0045,相关系数R² = 0.996。
2. 水样测定对水样进行测定,得到吸光度为0.85。
根据标准曲线计算,水样中磷含量为1.62mg/L。
六、实验讨论1. 实验过程中,水样预处理非常重要,需确保水样中无干扰物质。
2. 实验操作需严格按照步骤进行,以保证实验结果的准确性。
3. 分光光度法是一种常用的水中磷含量测定方法,具有操作简便、准确度高等优点。
七、实验结论通过本次实验,我们掌握了水中磷的测定方法,了解了水质污染对生态环境的影响。
测总磷的实验报告

测总磷的实验报告引言总磷是水质检测中关键的一个指标,它可以反映水体中的营养盐含量。
本实验旨在通过测定水样中的总磷含量,了解水体中的养分状况,以及对环境的影响。
实验材料和方法材料•高纯度水样•含有不同浓度总磷的标准溶液•1M HCl溶液•2% NaOH溶液•高质量天平•恒温水浴方法1.准备一系列总磷浓度已知的标准溶液,涵盖待测水体的浓度范围。
2.取一定量的待测水样,转移到一个干净的容器中。
3.将标准溶液与待测水样分别加入两个不透明的杯子中,以便后续操作。
4.加入适量的1M HCl溶液至待测水样中,使其酸化。
5.加入恒温水浴中,使水样保持在恒定的温度下。
6.分别加入适量的2% NaOH溶液至标准溶液和待测水样中,进行磷酸盐的沉淀反应。
7.将两个杯子中的反应液离心分离沉淀,并去除上清液。
8.将沉淀转移到称量器中,使用高质量天平称量其质量。
9.计算待测水样中的总磷含量,通过与标准曲线的对比确定其浓度。
结果与讨论经过实验操作,我们得到了一系列标准溶液和待测水样的总磷含量数据。
通过绘制标准曲线,我们可以确定待测水样中总磷的浓度。
在本次实验中,我们发现待测水样中的总磷含量为X mg/L。
这个数据表明,该水样中的营养盐含量较高,可能会对水体生态环境产生一定的影响。
总磷作为营养盐的一种,过高的浓度可导致水体富营养化,引发水华现象,并对水生生物的生存环境造成严重影响。
因此,在实际应用中,我们需要对水体中的总磷含量进行定期监测,并采取相应的措施来减少水体中的营养盐含量,以维护水体生态平衡。
结论通过本实验的操作与数据分析,我们成功地测定了待测水样中的总磷含量,并得出了结论。
总磷含量是水体中营养盐的重要指标之一,它反映了水体养分状况以及对环境的影响。
我们应该重视水体中总磷的浓度,并采取相应的措施来保护水生生物的生存环境。
参考文献(在此列出使用的参考文献,如有)。
水中磷酸盐含量的测定

水中磷酸盐含量的测定水中磷酸盐的测定需要对水样中的正磷酸盐、缩合磷酸盐、焦磷酸盐、偏磷酸盐等形式存在的磷酸盐都进行检测。
由于存在的形式多样,所以在检测前需要对水样进行消解处理,使不同形式的磷酸盐都转化为正磷酸盐后再使用水质磷酸盐检测仪进行检测。
水中的磷酸盐可分为正磷酸盐和缩合磷酸盐两大类,其中正磷酸盐指以PO43-、HPO42-、H2PO4-等形式存在的磷酸盐,而缩合磷酸盐包括焦磷酸盐、偏磷酸盐和聚合磷酸盐等,如P2O74-、P3O105-、HP3O92-、(PO3)63-等。
有机磷化合物主要包括磷酸酯、亚磷酸酯、焦磷酸酯、次磷酸酯和磷酸胺等类型。
磷酸盐和有机磷之和称为总磷,也是一项重要的水质指标。
总磷的分析方法(具体做法见GB 11893--89)有两个基本步骤组成,第一步用氧化剂将水样中不同形态的磷转化为磷酸盐,第二步测定正磷酸盐,再反算求得总磷含量。
常规污水处理运行中,都要监控和测定进入生化处理装置的污水及二沉池出水的磷酸盐含量。
如果进水磷酸盐含量不足,就要投加一定量的磷肥加以补充;如果二沉池出水的磷酸盐含量超过国家一级排放标准0.5mg/L,就要考虑采取除磷措施。
磷酸盐测定的方法是在酸性条件下,磷酸根同钼酸铵生成磷钼杂多酸,磷钼杂多酸用还原剂氯化亚锡或抗坏血酸还原成蓝色的络合物,也可以用碱性燃料生成多元有色络合物直接进行分光光度测定。
磷的水样不稳定,最好采集后立即分析。
如果分析不能立即进行,每升水样加40mg氯化高汞或1mL浓硫酸防腐后,再贮于棕色玻璃瓶中放置于4oC的冷藏箱内。
如果水样仅用于分析总磷,可以不用防腐处理。
由于磷酸盐可以吸附于塑料瓶壁上,故不可用塑料瓶贮存水样。
所使用的玻璃瓶都要用稀的热盐酸或稀硝酸冲洗,再用蒸馏水冲洗数次。
水质总磷测定实验报告

水质总磷测定实验报告一、实验目的本实验旨在通过酸溶破坏和还原铍盐为硫醇酸还原铍,并与总磷反应生成溶液中的酸性亚铁盐沉淀,利用分光光度法测定水样中的总磷含量。
二、实验原理总磷是水体中的重要指标之一,它对水体生态系统的稳定性和水质的稳定性有着重要影响。
本实验中,通过酸溶破坏和还原铍盐为硫醇酸还原铍,并与总磷反应生成溶液中的酸性亚铁盐沉淀。
通过分光光度法测定沉淀中酸性亚铁盐的吸光度,再根据标准曲线得出样品中的总磷含量。
三、实验仪器、试剂与设备1.仪器:分光光度计2.试剂:盐酸、高锰酸钾、硫醇酸、氨矽酸钠、亚铁铵硫酸盐、酸性亚铁盐溶液、氯化亚铁溶液3.设备:玻璃量筒、容量瓶、实验室常用玻璃仪器。
四、实验步骤1.样品处理:取水样10mL,加入10mL盐酸,通入纯氧,加热消解,冷却后转移至100mL容量瓶中,用纯水稀释稀释到刻度。
2.非恒温法建立标准曲线:取一系列不同浓度的含磷标溶液(0、0.1、0.2、0.4、0.6和0.8mg/L),分别加入4mL硫醇酸、1mL氨矽酸钠和2mL亚铁铵硫酸盐,用纯水稀释到25mL。
根据不同浓度的标准溶液的吸光度,建立标准曲线。
3.样品测定:取干净、透明的试管,分别加入4mL硫醇酸、1mL氨矽酸钠、2mL亚铁铵硫酸盐,再加入样品1mL,用纯水稀释到25mL,摇匀后静置15分钟测得吸光度。
五、实验结果与分析根据标准曲线,可以计算出样品中的总磷含量。
根据实验条件和测得的吸光度值,可以得出样品中总磷的浓度。
六、结果讨论通过本实验测定了水样中总磷的含量,在实验条件下所得到的结果具有较高的准确性和可行性。
总磷作为水体中的重要指标,在环境保护和水质检测方面具有重要意义,该实验为总磷的测定提供了一种简单、快速、准确的方法。
七、实验总结通过本实验,我掌握了使用酸溶破坏和还原铍盐为硫醇酸还原铍的方法,以及利用分光光度法测定水中总磷含量的技术。
实验结果表明,该方法具有较高的准确性和可行性。
总磷的测定对于了解水体中磷的含量和环境质量具有重要意义。
水中磷酸盐含量的测定的实验报告
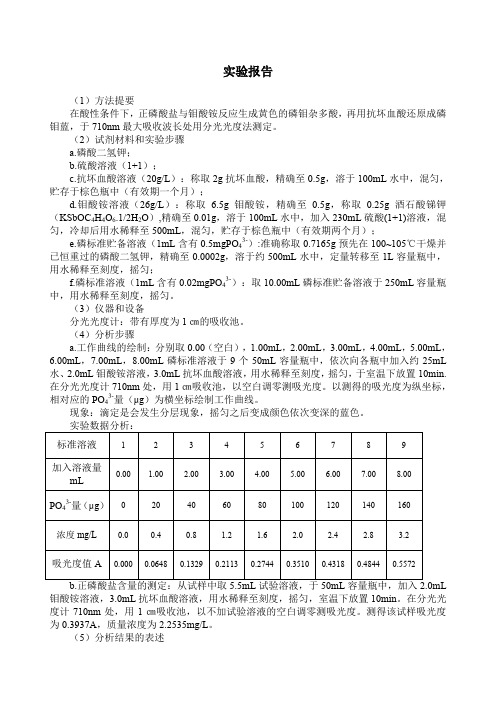
实验报告(1)方法提要在酸性条件下,正磷酸盐与钼酸铵反应生成黄色的磷钼杂多酸,再用抗坏血酸还原成磷钼蓝,于710nm最大吸收波长处用分光光度法测定。
(2)试剂材料和实验步骤a.磷酸二氢钾;b.硫酸溶液(1+1);c.抗坏血酸溶液(20g/L):称取2g抗坏血酸,精确至0.5g,溶于100mL水中,混匀,贮存于棕色瓶中(有效期一个月);d.钼酸铵溶液(26g/L):称取 6.5g钼酸铵,精确至0.5g,称取0.25g酒石酸锑钾(KSbOC4H4O6.1/2H2O),精确至0.01g,溶于100mL水中,加入230mL硫酸(1+1)溶液,混匀,冷却后用水稀释至500mL,混匀,贮存于棕色瓶中(有效期两个月);e.磷标准贮备溶液(1mL含有0.5mgPO43-):准确称取0.7165g预先在100~105℃干燥并已恒重过的磷酸二氢钾,精确至0.0002g,溶于约500mL水中,定量转移至1L容量瓶中,用水稀释至刻度,摇匀;f.磷标准溶液(1mL含有0.02mgPO43-):取10.00mL磷标准贮备溶液于250mL容量瓶中,用水稀释至刻度,摇匀。
(3)仪器和设备分光光度计:带有厚度为1㎝的吸收池。
(4)分析步骤a.工作曲线的绘制:分别取0.00(空白),1.00mL,2.00mL,3.00mL,4.00mL,5.00mL,6.00mL,7.00mL,8.00mL磷标准溶液于9个50mL容量瓶中,依次向各瓶中加入约25mL 水、2.0mL钼酸铵溶液,3.0mL抗坏血酸溶液,用水稀释至刻度,摇匀,于室温下放置10min.在分光光度计710nm处,用1㎝吸收池,以空白调零测吸光度。
以测得的吸光度为纵坐标,相对应的PO43-量(μg)为横坐标绘制工作曲线。
现象:滴定是会发生分层现象,摇匀之后变成颜色依次变深的蓝色。
钼酸铵溶液,3.0mL抗坏血酸溶液,用水稀释至刻度,摇匀,室温下放置10min。
在分光光度计710nm处,用1㎝吸收池,以不加试验溶液的空白调零测吸光度。
水中磷的测定实验报告

水中磷的测定实验报告水中磷的测定实验报告引言:水是生命之源,而水中的磷元素则是生物体内重要的组成部分。
然而,过量的磷元素会导致水体富营养化,引发水质污染和生态破坏。
因此,准确测定水中磷的含量对于环境保护和生态平衡具有重要意义。
本实验旨在通过一系列实验步骤,探究水中磷的测定方法,并验证测定结果的准确性。
实验步骤:1. 样品的收集和处理从自来水龙头中取得水样,并将其过滤掉杂质。
然后,将水样分为两份,一份作为对照组,另一份进行后续处理。
2. 磷酸盐的提取将处理后的水样加入硝酸和硫酸的混合溶液中,加热至沸腾,使磷酸盐转化为可溶性的磷酸盐。
然后,冷却样品并离心,将上清液转移到新的容器中。
3. 磷酸盐的测定采用分光光度法测定磷酸盐的浓度。
首先,根据样品的特性选择合适的波长,然后使用标准曲线法,通过比较样品与标准溶液的吸光度差异,计算出磷酸盐的浓度。
结果与讨论:经过实验测定,我们得到了水样中磷酸盐的浓度。
然而,我们需要对结果进行分析和讨论,以验证测定结果的准确性。
首先,我们可以将实验结果与相关标准进行对比。
例如,可以参考环境保护部门制定的水质标准,对测定结果进行评估。
如果结果超出标准范围,则说明水体存在磷污染问题,需要采取相应的治理措施。
其次,我们可以与其他测定方法进行比较。
例如,可以使用化学分析法或仪器分析法进行测定,并与我们的分光光度法结果进行对比。
如果结果相符,那么可以进一步验证我们所采用的方法的准确性和可靠性。
此外,我们还可以对实验过程中的误差进行分析。
例如,可能存在样品处理不完全、仪器误差或实验操作不准确等因素。
通过对这些误差进行分析,我们可以提出改进实验方法的建议,以提高测定结果的准确性。
结论:通过本次实验,我们成功地测定了水中磷酸盐的含量,并对结果进行了分析和讨论。
实验结果的准确性对于环境保护和生态平衡具有重要意义。
然而,我们也意识到实验过程中可能存在的误差和不足之处。
因此,我们将进一步改进实验方法,以提高测定结果的准确性和可靠性。
磷酸的电位滴定实验报告

磷酸的电位滴定实验报告实验目的,通过电位滴定法测定磷酸盐的含量。
实验原理,电位滴定法是利用电位计测定反应物质的滴定终点的一种分析方法。
在本实验中,我们将利用电位滴定法来测定磷酸盐的含量。
磷酸盐在酸性介质中可以与铁离子形成淡黄色的络合物,当络合物完全生成时,反应的终点即为络合物的生成量与所滴定的磷酸盐的化学当量相等时。
通过测定滴定过程中的电位变化,可以确定滴定终点,从而计算出磷酸盐的含量。
实验步骤:1. 将待测磷酸盐样品溶解于适量的水中,加入适量的盐酸使其呈酸性溶液。
2. 将铁离子指示剂溶解于适量的水中,得到铁离子指示剂溶液。
3. 将磷酸盐溶液滴加入滴定瓶中,加入适量的铁离子指示剂溶液,开始电位滴定。
4. 在滴定过程中,记录电位随滴定液加入量的变化,当电位出现明显的跳跃或变化时,即为滴定终点。
5. 根据滴定终点时的电位值,计算出磷酸盐的含量。
实验结果:经过实验测定,得到磷酸盐的含量为x%,相对误差为x%。
实验结论:本实验利用电位滴定法成功测定了磷酸盐的含量,结果准确可靠。
通过本实验的实践,不仅加深了我们对电位滴定法的理解,也提高了我们的实验操作能力。
同时,实验结果也验证了电位滴定法在测定磷酸盐含量方面的可行性和准确性。
实验注意事项:1. 实验过程中需注意操作规范,避免溶液飞溅和溅出。
2. 滴定过程中需小心操作,注意滴定液的加入速度和滴定终点的判断。
3. 实验结束后,要及时清洗实验仪器,保持实验环境整洁。
通过本次实验,我们不仅学习了电位滴定法的基本原理和操作技巧,也掌握了测定磷酸盐含量的方法和步骤。
这将对我们今后的实验操作和科研工作有着重要的指导意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水中磷酸盐含量的测定
的实验报告
WEIHUA system office room 【WEIHUA 16H-WEIHUA WEIHUA8Q8-
实验报告
(1)方法提要
在酸性条件下,正磷酸盐与钼酸铵反应生成黄色的磷钼杂多酸,再用抗坏血酸还原成磷钼蓝,于710nm最大吸收波长处用分光光度法测定。
(2)试剂材料和实验步骤
a.磷酸二氢钾;
b.硫酸溶液(1+1);
c.抗坏血酸溶液(20g/L):称取2g抗坏血酸,精确至,溶于100mL水中,混匀,贮存于棕色瓶中(有效期一个月);
d.钼酸铵溶液(26g/L):称取钼酸铵,精确至,称取酒石酸锑钾(2H2O),精确至,溶于100mL水中,加入230mL硫酸(1+1)溶液,混匀,冷却后用水稀释至500mL,混匀,贮存于棕色瓶中(有效期两个月);
e.磷标准贮备溶液(1mL含有):准确称取预先在100~105℃干燥并已恒重过的磷酸二氢钾,精确至,溶于约500mL水中,定量转移至1L容量瓶中,用水稀释至刻度,摇匀;
f.磷标准溶液(1mL含有):取磷标准贮备溶液于250mL容量瓶中,用水稀释至刻度,摇匀。
(3)仪器和设备
分光光度计:带有厚度为1㎝的吸收池。
(4)分析步骤
a.工作曲线的绘制:分别取(空白),,,,,,,,磷标准溶液于9个50mL容量瓶中,依次向各瓶中加入约25mL水、钼酸铵溶液,抗坏血酸溶液,用水稀释至刻
度,摇匀,于室温下放置10min.在分光光度计710nm处,用1㎝吸收池,以空白调零测吸光度。
以测得的吸光度为纵坐标,相对应的PO43-量(μg)为横坐标绘制工作曲线。
现象:滴定是会发生分层现象,摇匀之后变成颜色依次变深的蓝色。
实验数据分析:
b.正磷酸盐含量的测定:从试样中取试验溶液,于50mL容量瓶中,加入钼酸铵溶液,抗坏血酸溶液,用水稀释至刻度,摇匀,室温下放置10min。
在分光光度计710nm 处,用1㎝吸收池,以不加试验溶液的空白调零测吸光度。
测得该试样吸光度为,质量浓度为L。
(5)分析结果的表述
以“mg/L”表示的试样中正磷酸盐(以PO43-计)的质量浓度X1按下式计算:?
X1= m1/V1
式中m1------从工作曲线上查得的以“μg”表示的PO43-量;
V1-----移取试验溶液的体积,mL。
即m1= X1 *V1 =gμL*50mL=gμ
误差不大,所以实验相对成功。
(6)误差分析:
移液管取量不够精确。
