根据物质名称写化学式
常用物质名称及化学式

氢化物:磷化氢PH3甲烷CH4硅烷SiH4氨气NH3氢化钠NaH
氢化钙CaH2氢化钾KH氢化锂LiH
硝酸盐:硝酸铵NH4NO3硝酸钾KNO3硝酸锂LiNO3硝酸钠NaNO3
硝酸银AgNO3硝酸钡Ba(NO3)2硝酸铍Be(NO3)2硝酸镁Mg(NO3)2硝酸铝Al(NO3)3硝酸锰Mn(NO3)2硝酸锌Zn(NO3)2硝酸亚铁Fe(NO3)2硝酸铋Bi(NO3)3硝酸铁Fe(NO3)3硝酸铜Cu(NO3)2硝酸钙Ca(NO3)2硝酸锡Sn(NO3)2硝酸镉Cd(NO3)3硝酸铅Pb(NO3)2硝酸镍Ni(NO3)2硝酸钴Co(NO3)2
硫化盐:硫化锂Li2S硫化钠Na2S硫化钾K2S硫化铍BeS
硫化镁MgS硫化钙CaS硫化钡BaS硫化锰MnS硫化锌ZnS
硫化亚铁FeS二硫化亚铁FeS2硫化铜CuS二硫化铜CuS2硫化银Ag2S
硫化铅PbS硫化铵(NH4)2S硫化镉CdS硫化亚铜Cu2S
硫化锡SnS硫氰铵NH4SCN
硫酸酸式盐:硫酸氢钠NaHSO4硫酸氢钾KHSO4
硫酸氢铵NH4HSO4硫酸氢镁Mg(HSO4)2硫酸氢铜Cu(HSO4)2硫代硫酸钠Na2S2O3联硫代硫酸钠Na2S2O4
亚硫酸酸式盐:亚硫酸氢钠NaHSO3亚硫酸氢钾KHSO3
亚硫酸氢铵NH4HSO3亚硫酸氢镁Mg(HSO3)2亚硫酸氢钙Ca(HSO3)2
硫氢盐:硫氢钠NaHS硫氢钾:KHS硫氢铵NH4HS硫氢镁Mg(HS)2硫氢铜Cu(HS)2
氯化亚锡SnCl2氯化磷:PCl5氯化铬CrCl3氯化钴:CoCl2
溴盐:溴化钾:KBr溴化锂LiBr溴化钠:NaBr溴化镁:MgBr2
溴化银AgBr溴化铅:PbBr2
高中化学物质名称及化学式

高中化学物质名称及化学式一、无机纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。
铝热剂:Al + Fe2O3或其它氧化物。
尿素:CO(NH2) 2二、有机氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔) TNT:三硝基甲苯酒精、乙醇:C2H5OH氟氯烃:是良好的制冷剂,有毒,但破坏O3层醋酸:冰醋酸、食醋CH3COOH裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。
初中常见物质的化学式及化学方程式
混合物 物质 单质
金属
如:K、Ca、Na、Mg、Al、Zn、Fe、Cu等;
纯净物
稀有气体 如: He、 Ne、 Ar、 Kr、Xe、Rn等; 非金属 如:O2、H2 、Cl2、C、S、P、Si等;
化合物 氧化物 如H2O、FeO、Fe2O3、CaO、CO 等; *酸 如: H2CO3 HCl H2SO4 CH3COOH HNO3; *碱 如: KOH NaOH Ca(OH)2 Ba(OH)2; *盐 如: KCl NaCl CuSO4 AgNO3 。
Ba(OH)2 Mg(OH)2 Al(OH)3 NH3H2O K2CO3 Na2CO3 CaCO3 BaCO3 MgCO3 (NH4)2CO3 NH4HCO3 H2O2
硫酸铜 硫酸钡 硫酸镁 硫酸钾 硫酸锌 硫酸钠 硫酸铝 硫酸铁 硫酸亚铁 硫酸铵 盐酸 硫酸
CuSO4 BaSO4 MgSO4 K2SO4 ZnSO4 Na2SO4 Al2(SO4)3 Fe2(SO4)3 FeSO4 (NH4)2SO4 HCl H2SO4
H2CO3 HNO3 H3PO4 CH3COOH CaO Ca(OH)2 Ca(OH)2 CaO CO2 NaOH NaOH NaOH
食盐食盐 纯碱纯碱 苏打苏打 小苏打 小苏打 草木灰 草木灰 石灰石 石灰石 大理石 大理石 沼气沼气
NaCl Na2CO3 Na2CO3 NaHCO3 K2CO3 CaCO3 CaCO3 CH4
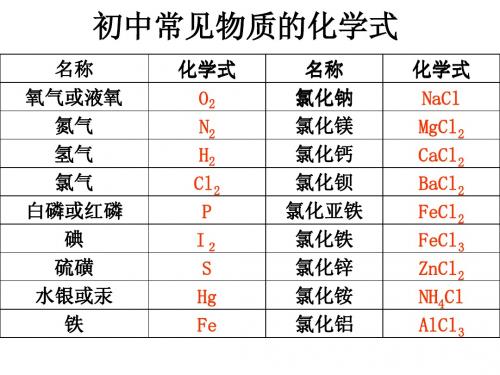
初中常见物质的化学式
名称 氧气或液氧 氮气 氢气 氯气 白磷或红磷 碘 硫磺 水银或汞 铁 化学式 O2 N2 H2 Cl2 P I2 S Hg Fe 名称 氯化钠 氯化镁 氯化钙 氯化钡 氯化亚铁 氯化铁 氯化锌 氯化铵 氯化铝 化学式 NaCl MgCl2 CaCl2 BaCl2 FeCl2 FeCl3 ZnCl2 NH4Cl AlCl3
初中化学常见物质名称及化学式

初中化学常见物质名称及化学式金属单质:非金属单质:氢气 氧气 氮气 氯气 臭氧 液溴 碘 碳 硅 硫 磷H 2 O 2 N 2 Cl 2 O 3 Br 2 I 2 C Si S P稀有气体:氦气 氖气 氩气He Ne Ar金属氧化物:氧化镁 氧化钙(生石灰) 氧化铝 氧化铜 氧化钠MgO CaO Al 2O 3 CuO Na 2O氧化铁(三氧化二铁) 氧化亚铁 四氧化三铁 二氧化锰Fe 2O 3 FeO Fe 3O 4 MnO 2非金属氧化物:水 双氧水(过氧化氢) 二氧化碳 一氧化碳 二氧化硫 五氧化二磷H 2O H 2O 2 CO 2 CO SO 2P 2O 5钾 钙 钠 镁 铝 锌 铁 锡 铅 铜 汞 银 铂 金 钡 锰 K Ca NaMgAl Zn Fe Sn Pb CuHg AgPt Au Ba Mn酸:盐酸 硫酸 碳酸 硝酸 亚硫酸 磷酸HCl H 2SO 4 H 2CO 3 HNO 3 H 2SO 3 H 3PO 4碱:氢氧化钠 氢氧化钙 氢氧化铜 氢氧化镁 氢氧化铁 氢氧化亚铁 氢氧化钡 一水合氨 氨气NaOH Ca(OH)2 Cu(OH)2 Mg(OH)2 Fe(OH)3 Fe(OH)2 Ba(OH)2 NH 3·H 2O NH 3盐酸盐:氯化钠 氯化钾 氯化银 氯化钙 氯化铜 氯化铁 氯化亚铁NaCl KCl AgCl CaCl 2 CuCl 2 FeCl 3 FeCl 2硝酸盐:硝酸钠 硝酸钾 硝酸银 硝酸钡 硝酸铜NaNO 3 KNO 3 AgNO 3 Ba(NO 3)2 Cu(NO 3)2碳酸盐:碳酸钠 碳酸钾 碳酸钙 碳酸钡Na 2CO 3 K 2CO 3 CaCO 3 BaCO 3硫酸盐:硫酸钠 硫酸钾 硫酸钡 硫酸钙 硫酸铜 五水合硫酸铜Na 2SO 4 K 2SO 4 BaSO 4 CaSO 4 CuSO 4 CuSO 4·5H 2O其他盐:氯酸钾 锰酸钾 高锰酸钾KClO 3 K 2MnO 4 KMnO 4常见元素和原子团的化合价 • +1价:K 、Na 、Ag 、H 、NH 4 • +2价:Ca 、Mg 、Ba 、Zn 、Cu•+3价:Al•+2、+3价:Fe•-1价:F、Cl、OH、NO3•-2价:O、S、CO3、SO4•-3价:PO4化学式表示的意义宏观:①表示一种物质②表示该物质的元素组成微观:①物质的一个分子②物质的分子构成如:CO2表示•①二氧化碳这种物质•②二氧化碳由碳元素和氧元素组成•③一个二氧化碳分子•④一个二氧化碳分子由一个碳原子和两个氧原子构成说明下列符号表示的意义H:表示氢元素或一个氢原子。
常见物质的化学式

常见物质的化学式集团标准化小组:[VVOPPT-JOPP28-JPPTL98-LOPPNN]常见物质的化学式常见元素的化合价:+1价 K Na H NH4Ag+2价 Ca Mg Ba Hg Zn+3价 Al; Fe (+2,+3) Cu(+1,+2) 其中Fe、Cu显低价时读“亚铁、亚铜”负价:Cl (-1); O S(-2);原子团(根)的化合价:OH, NO3 (-1) ; SO4, CO3(-2)常见物质的名称及化学式:一、氯化物氯化钾 KCl 氯化钠 NaCl 氯化氢(溶于水为盐酸) HCl氯化铵 NH4Cl 氯化银 AgCl 氯化钙 CaCl2氯化镁MgCl2氯化钡 BaCl2氯化汞HgCl2氯化锌ZnCl2氯化铝AlCl3氯化亚铁FeCl2氯化铁FeCl3氯化亚铜CuCl氯化铜 CuCl2二、氧化物氧化钾K2O 氧化钠 Na2O 水 H2O 氧化银 Ag2O氧化钙CaO 氧化镁MgO 氧化钡 BaO 氧化汞HgO氧化锌ZnO 氧化铝Al2O3氧化亚铁FeO 氧化铁Fe2O3氧化亚铜Cu2O 氧化铜 CuO 三、硫化物硫化钾K2S 硫化钠 Na2S 硫化氢H2S 硫化银 Ag2S硫化钙 CaS 硫化镁MgS 硫化钡 BaS 硫化汞HgS硫化锌ZnS 硫化铝Al2S3硫化亚铁FeS 硫化铁Fe2S3硫化亚铜Cu2S 硫化铜 CuS 四、氢氧化物(碱)氢氧化钾KOH 氢氧化钠NaOH 氢氧化铵NH4OH (或NH3?H2O)氢氧化银 AgOH 氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化钡 Ba(OH)2 氢氧化汞Hg(OH)2氢氧化锌Zn(OH)2氢氧化铝Al(OH)3氢氧化亚铁Fe(OH)2氢氧化铁Fe(OH)3氢氧化亚铜CuOH氢氧化铜 Cu(OH)2五、带硝酸根的硝酸钾KNO3 硝酸钠NaNO3硝酸 HNO3硝酸铵NH4NO3硝酸银AgNO3 硝酸钙Ca(NO3)2硝酸镁Mg(NO3)2硝酸钡 Ba(NO3)2硝酸汞Hg(NO3)2硝酸锌Zn(NO3)2硝酸铝Al(NO3)3硝酸亚铁Fe(NO3)2硝酸铁Fe(NO3)3硝酸亚铜CuNO3硝酸铜 Cu(NO3)2六、带硫酸根的硫酸钾K2SO4硫酸钠Na2SO4硫酸 H2SO4硫酸铵(NH4)2SO4硫酸银Ag2SO4硫酸钙CaSO4硫酸镁MgSO4硫酸钡 BaSO4硫酸汞HgSO4硫酸锌ZnSO4硫酸铝Al2(SO4)3硫酸亚铁FeSO4硫酸铁Fe2(SO4)3硫酸亚铜Cu2SO4硫酸铜 CuSO4七、带碳酸根的碳酸钾K 2CO 3 碳酸钠Na 2CO 3 碳酸 H 2CO 3 碳酸铵(NH 4)2CO 3 碳酸银Ag 2CO 3 碳酸钙CaCO 3 碳酸镁MgCO 3 碳酸钡 BaCO 3碳酸汞HgCO 3 碳酸锌ZnCO 3 碳酸铝Al 2(CO 3)3 碳酸亚铁FeCO 3 碳酸铁Fe 2(CO 3)3 碳酸亚铜Cu 2CO 3 碳酸铜 CuCO 3初中化学常见化学方程式一、 A+ B+ …→ C1. 镁在空气(或氧气)中燃烧:2Mg + O 2 2MgO2. 铁在氧气中燃烧:3Fe + 2O 2Fe 3O 43.氢气在空气(或氧气)中燃烧:2H 2+O 22H 2O4.二氧化碳与水反应: H 2O+CO 2==H 2CO 35.生石灰与水反应生成熟石灰:CaO + H 20 = Ca(OH)2 二、分解反应 A →B+ C + … 1.电解水:2H 2O 2H 2↑+O 2↑2.氧气的实验室制法: 2H 2O 2 ====2H 2O+ O 2 ↑3.碳酸不稳定而分解:H 2CO 3 == H 2O + CO 2↑4.高温煅烧石灰石:CaCO 3 ==== CaO + CO 2↑三、置换反应 A+ BC →B+ AC 金属单质 + 酸 → 盐 + 氢气 1. 锌和 Zn + H 2SO 4 = ZnSO 4 + H 2↑ 2. 铁和 Fe + H 2SO 4 = FeSO 4 + H 2↑ 3. 镁和 Mg + H 2SO 4 = MgSO 4 + H 2↑ 4. 铁和稀盐酸 Fe + 2HCl == FeCl 2 + H 2↑ 5. 镁和稀盐酸 Mg+ 2HCl == MgCl 2 + H 2↑ 四、复分解反应 AB+ CD → AD+ CB (一)酸 + → 盐 + 水1. (除铁锈)(铁锈)和稀盐酸反应:Fe 2O 3 + 6HCl ==2FeCl 3 + 3H 2O2. (铁锈)和稀硫酸反应:Fe 2O 3 + 3H 2SO 4 == Fe 2(SO 4)3 + 3H 2O3. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl 2 + H 2O温高MnO 24. 氧化铜和稀硫酸反应:CuO + H2SO4== CuSO4+ H2O(二)酸 + 碱→盐 + 水()1.盐酸和起反应:HCl + NaOH == NaCl +H2O2. 盐酸和反应:2HCl + Ca(OH)2 == CaCl2+ 2H2O3. 药物治疗:3HCl + Al(OH)3 == AlCl3+ 3H2O4. 硫酸和反应:H2SO4+ 2NaOH == Na2SO4+ 2H2O5. 硫酸和反应(改良酸性土壤):H2SO4+ Ca(OH)2== CaSO4+ 2H2O(三)酸 + 盐→另一种酸 + 另一种盐1.二氧化碳的实验室制法:CaCO3 + 2HCl == CaCl2+ H2O + CO2↑2.与稀盐酸反应: Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑3. 硫酸和反应:H2SO4+ BaCl2== BaSO4↓+ 2HCl4.硝酸银溶液与稀盐酸反应:AgNO3+ HCl=== AgCl↓+ HNO3(四)碱 + 盐→另一种碱 + 另一种盐1.(烧碱的工业制法)与:Ca(OH)2 + Na2CO3== CaCO3↓+ 2NaOH2.硫酸铜与氢氧化钠: CuSO4+2NaOH==Na2SO4+Cu(OH)2↓3.氯化铜与氢氧化钠: CuCl2+ 2NaOH==2NaCl+Cu(OH)2↓五、其它碱 + →盐 + 水1.氢氧化钠暴露在空气中变质:2NaOH + CO2 == Na2CO3+ H2O2.氢氧化钠吸收气体:2NaOH + SO2 == Na2SO3+ H2O3.二氧化碳使石灰水变浑浊(鉴别二氧化碳):Ca(OH)2 + CO2== CaCO3↓+H2O4. 石灰水吸收:Ca(OH)2 + SO2== ↓+ H2O1,天然气(甲烷)在空气中燃烧:CH4 + 2O2CO2+ 2H2O2. 酒精在空气中燃烧:C2H5OH + 3O22CO2+ 3H2O。
常见物质名称 化学式
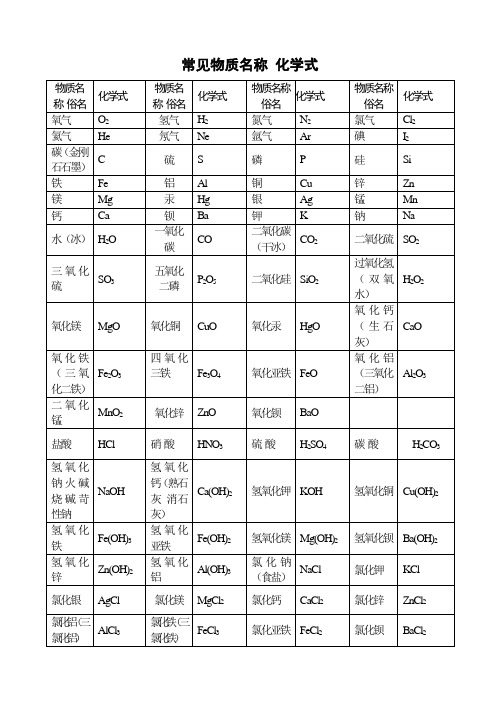
H2SO4
碳酸
H2CO3
氢氧化钠火碱烧碱苛性钠
NaOH
氢氧化钙(熟石灰消石灰)
Ca(OH)2
氢氧化钾
KOH
氢氧化铜
Cu(OH)2
氢氧化铁
Fe(OH)3
氢氧化亚铁
Fe(OH)2
氢氧化镁
Mg(OH)2
氢氧化钡
Ba(OH)2
氢氧化锌
Zn(OH)2
氢氧化铝
Al(OH)3
氯化钠(食盐)
NaCl
氯化钾
KCl
Ca3(PO4)2
氨气
NH3
氨水
NH3•H2O
氟化钠
NaF
氟化钙
CaF2
甲烷(天然气)
CH4
甲醇
CH3OH
乙醇(酒精)
C2H5OH
乙酸(醋酸)
CH3COOH
尿素
CO(NH2)2
硫化氢
H2S
硫化锌
ZnS
硫化钠
Na2S
氯化银
AgCl
氯化镁
MgCl2
氯化钙
CaCl2
氯化锌
ZnCl2
氯化铝(三氯化铝)
AlCl3
氯化铁(三氯化铁)
FeCl3
氯化亚铁
FeCl2
氯化钡
BaCl2
硫酸钠
Na2SO4
硫酸钾
K2SO4
硫酸钡
BaSO4
硫酸锌
ZnSO4
硫酸镁
MgSO4
硫酸铜
CuSO4
五水硫酸铜(胆矾蓝矾)
CuSO4•5H2O
硫酸铝
Al2(SO4)3
硫酸钙
CaSO4
硫酸亚铁
FeSO4
常见物质的化学式

常见物质的化学式常见元素的化合价:+1价K Na H NH4Ag+2价Ca Mg Ba Hg Zn+3价Al; Fe (+2,+3) Cu(+1,+2) 其中Fe、Cu显低价时读“亚铁、亚铜”负价:Cl (-1); O S(-2);原子团(根)的化合价:OH, NO3 (-1) ; SO4, CO3(-2)常见物质的名称及化学式:一、氯化物氯化钾KCl 氯化钠NaCl 氯化氢(溶于水为盐酸) HCl氯化铵NH4Cl 氯化银AgCl 氯化钙CaCl2氯化镁MgCl2氯化钡BaCl2氯化汞HgCl2氯化锌ZnCl2氯化铝AlCl3氯化亚铁FeCl2氯化铁FeCl3氯化亚铜CuCl氯化铜CuCl2二、氧化物氧化钾K2O 氧化钠Na2O 水H2O 氧化银Ag2O氧化钙CaO 氧化镁MgO 氧化钡BaO 氧化汞HgO氧化锌ZnO 氧化铝Al2O3氧化亚铁FeO 氧化铁Fe2O3氧化亚铜Cu2O 氧化铜CuO三、硫化物硫化钾K2S 硫化钠Na2S 硫化氢H2S 硫化银Ag2S硫化钙CaS 硫化镁MgS 硫化钡BaS 硫化汞HgS硫化锌ZnS 硫化铝Al2S3硫化亚铁FeS 硫化铁Fe2S3硫化亚铜Cu2S 硫化铜CuS四、氢氧化物(碱)氢氧化钾KOH 氢氧化钠NaOH 氢氧化铵NH4OH (或NH3•H2O) 氢氧化银AgOH 氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化钡Ba(OH)2 氢氧化汞Hg(OH)2氢氧化锌Zn(OH)2氢氧化铝Al(OH)3氢氧化亚铁Fe(OH)2氢氧化铁Fe(OH)3氢氧化亚铜CuOH氢氧化铜Cu(OH)2五、带硝酸根的硝酸钾KNO3 硝酸钠NaNO3硝酸HNO3 硝酸铵NH4NO3 硝酸银AgNO3 硝酸钙Ca(NO3)2硝酸镁Mg(NO3)2硝酸钡Ba(NO3)2硝酸汞Hg(NO3)2硝酸锌Zn(NO3)2硝酸铝Al(NO3)3硝酸亚铁Fe(NO3)2硝酸铁Fe(NO3)3硝酸亚铜CuNO3硝酸铜Cu(NO3)2六、带硫酸根的硫酸钾K2SO4 硫酸钠Na2SO4硫酸H2SO4 硫酸铵(NH4)2SO4硫酸银Ag2SO4 硫酸钙CaSO4硫酸镁MgSO4硫酸钡BaSO4硫酸汞HgSO4硫酸锌ZnSO4硫酸铝Al2(SO4)3硫酸亚铁FeSO4硫酸铁Fe2(SO4)3硫酸亚铜Cu2SO4硫酸铜CuSO4七、带碳酸根的碳酸钾K2CO3 碳酸钠Na2CO3碳酸H2CO3 碳酸铵(NH4)2CO3碳酸银Ag2CO3 碳酸钙CaCO3碳酸镁MgCO3 碳酸钡BaCO3碳酸汞HgCO3 碳酸锌ZnCO3碳酸铝Al2(CO3)3碳酸亚铁FeCO3 碳酸铁Fe2(CO3)3碳酸亚铜Cu2CO3碳酸铜CuCO3初中化学常见化学方程式一、化合反应 A+ B+ …→ C1、镁在空气(或氧气)中燃烧:2Mg + O22MgO2、铁在氧气中燃烧:3Fe + 2O2 Fe3O43、氢气在空气(或氧气)中燃烧:2H2+O22H2O4、二氧化碳与水反应: H2O+CO2==H2CO35、生石灰与水反应生成熟石灰:CaO + H20 = Ca(OH)2二、分解反应 A→B+ C + …1、电解水:2H2O2H2↑+O2↑2、氧气的实验室制法: 2H2O2====2H2O+ O2↑3、碳酸不稳定而分解:H2CO3== H2O + CO2↑4、高温煅烧石灰石:CaCO3 ==== CaO + CO2↑三、置换反应 A+ BC →B+ AC 金属单质 + 酸→盐 + 氢气1、锌与稀硫酸 Zn + H2SO4= ZnSO4+ H2↑2、铁与稀硫酸Fe + H2SO4= FeSO4+ H2↑3、镁与稀硫酸 Mg + H2SO4= MgSO4+ H2↑4、铁与稀盐酸 Fe + 2HCl == FeCl2 + H2↑5、镁与稀盐酸 Mg+ 2HCl == MgCl2 + H2↑四、复分解反应 AB+ CD → AD+ CB (一)酸 + 金属氧化物→盐 + 水1、 (除铁锈)氧化铁(铁锈)与稀盐酸反应:Fe2O3+ 6HCl ==2FeCl3+ 3H2O2、氧化铁(铁锈)与稀硫酸反应:Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O3、氧化铜与稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O4、氧化铜与稀硫酸反应:CuO + H2SO4== CuSO4+ H2O温高MnO2(二)酸 + 碱→盐 + 水(中与反应)1.盐酸与烧碱起反应:HCl + NaOH == NaCl +H2O2、盐酸与氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2+ 2H2O3、氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3+ 3H2O4、硫酸与烧碱反应:H2SO4+ 2NaOH == Na2SO4+ 2H2O5、硫酸与氢氧化钙反应(改良酸性土壤):H2SO4+ Ca(OH)2== CaSO4+ 2H2O(三)酸 + 盐→另一种酸 + 另一种盐1.二氧化碳的实验室制法:CaCO3 + 2HCl == CaCl2+ H2O + CO2↑2.碳酸钠与稀盐酸反应: Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑3、硫酸与氯化钡溶液反应:H2SO4+ BaCl2== BaSO4↓+ 2HCl4、硝酸银溶液与稀盐酸反应:AgNO3+ HCl=== AgCl↓+ HNO3(四)碱 + 盐→另一种碱 + 另一种盐1、(烧碱的工业制法)氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3== CaCO3↓+ 2NaOH2、硫酸铜与氢氧化钠: CuSO4+2NaOH==Na2SO4+Cu(OH)2↓3、氯化铜与氢氧化钠: CuCl2+ 2NaOH==2NaCl+Cu(OH)2↓五、其它碱 + 非金属氧化物→盐 + 水1.氢氧化钠暴露在空气中变质:2NaOH + CO2 == Na2CO3+ H2O2.氢氧化钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3+ H2O3.二氧化碳使石灰水变浑浊(鉴别二氧化碳):Ca(OH)2 + CO2== CaCO3↓+ H2O4、石灰水吸收二氧化硫:Ca(OH)2 + SO2== CaSO3↓+ H2O1,天然气(甲烷)在空气中燃烧:CH4 + 2O2CO2+ 2H2O2、酒精在空气中燃烧:C2H5OH + 3O22CO2+ 3H2O。
(完整版)初中化学常见物质名称化学式及离子化学式

初中化学常见物质名称及化学式金属单质:非金属单质:氢气氧气氮气氯气臭氧碘碳硅硫磷H 2O 2N 2Cl 2O 3I 2 C Si S P稀有气体:氦气氖气氩气He Ne Ar氧化物:氧化镁氧化钙(生石灰)氧化铝氧化铜(黑色)MgO CaO Al 2O 3CuO氧化铁(三氧化二铁,红色,铁锈主要成分)四氧化三铁(黑色) 二氧化锰(黑色,可做制氧催化剂) Fe 2O 3Fe 3O 4MnO 2水双氧水(过氧化氢)二氧化碳(温室效应) 一氧化碳(剧毒) 二氧化硫(酸雨) 五氧化二磷H 2O H 2O 2CO 2CO 血红蛋白结合SO 2P 2O 5酸:盐酸硫酸碳酸硝酸亚硫酸HCl H 2SO 4H 2CO 3HNO 3H 2SO 3碱:氢氧化钠(烧碱火碱苛性钠)氢氧化钙(熟石灰消石灰改良酸性土壤) 氢氧化铜(蓝色絮状沉淀)NaOH Ca(OH)2Cu(OH)2氢氧化镁(白色沉淀) 氢氧化铁(红褐色沉淀) 氢氧化钡一水合氨Mg(OH)2Fe(OH)3Ba(OH)2NH 3·H 2O盐酸盐:氯化钠(食盐)氯化钾氯化银(不溶于水和酸)氯化钙氯化铜(蓝色)NaCl KCl AgCl CaCl 2CuCl 2氯化铁(黄色)氯化亚铁(浅绿色)FeCl 3FeCl 2硝酸盐:硝酸钠硝酸钾硝酸银硝酸钡硝酸铜(蓝色)NaNO 3KNO 3AgNO 3Ba(NO 3)2Cu(NO 3)2碳酸盐:碳酸钠碳酸钾碳酸钙(白色沉淀,遇酸溶解放出气体)碳酸钡(同CaCO 3)Na 2CO 3K 2CO 3 CaCO 3BaCO 3硫酸盐:硫酸钠硫酸钾硫酸钡硫酸钙无水硫酸铜(白色,检验水) 五水硫酸铜(蓝色)Na 2SO 4K 2SO 4BaSO 4CaSO 4CuSO 4CuSO 4·5H 2O其他盐:氯酸钾锰酸钾碳酸氢钠(易溶于水,与酸反应放出气体)KClO 3K 2MnO 4 NaHCO 3高锰酸钾(紫黑色,溶于水得到紫色溶液,用于检验CO 实验现象是紫色褪去)KMnO 4 钾钙钠镁铝锌铁锡铅铜汞银铂金K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au二、常见的离子符号氢离子、钠离子、钾离子、镁离子、钙离子、铝离子H+、Na+、K+、Mg2+、Ca2+、Al3+氟离子、氯离子、氧离子、硫离子、铵根离子F-、Cl-O2-、S2-、NH4+氢氧根离子、硝酸根离子、硫酸根离子、碳酸根离子OH-、NO3-、SO42-、CO32-。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、根据物质名称写化学式姓名------------班级------------氢氧化铜-----------硝酸铜----------硫酸镁---------硫酸铜--------碳酸钡---------硫酸钡-------- 氯化钡--------氢氧化钠----------碳酸钾---------氢氧化钡---------硝酸银---------硫酸钾-------- 碳酸钠--------氢氧化钙---------稀盐酸--------硝酸-----------氯化铁---------碳酸钙---------氯化钠---------氯化钾----------碳酸氢钠--------硝酸铵----------氢氧化锌--------氧化铜--------- 氯化钙---------硫酸钠----------高锰酸钾--------氯酸钾----------二氧化锰--------硫酸铵--------- 氢氧化钾--------氢氧化铁-------氢氧化铝---------氢氧化镁---------碳酸钾---------氧化铁------- 氧化铝----------氧化锌----------五氧化二磷-----------二氧化碳----------二氧化硫---------一氧化碳---------氨气---------水---------双氧水----------过氧化氢----------硝酸钡---------硝酸铜---------氯化铜----------氯化亚铁----------硫酸亚铁-----------硫酸锌----------硫酸铁--------硫酸---------碳酸----------磷酸----------亚硫酸---------氢硫酸---------二、据物质的化学变化写化学方程式,注明基本反应类型(一)盐酸的化学性质:1、盐酸能使紫色石蕊变红2、盐酸与活泼金属(铁、锌、镁、铝)反应①②------------------------------------------------------------------------------------------------------------------- ③---------------------------------------------------------------------------------------------------------------- ④3、盐酸与金属氧化物(氧化铜、氧化铁、氧化铝、氧化镁)反应①②------------------------------------------------------------------------------------------------------------------- ③---------------------------------------------------------------------------------------------------------------- ④4、盐酸与碱(氢氧化铜、氢氧化钠、氢氧化镁、氢氧化钙)反应①②------------------------------------------------------------------------------------------------------------------- ③--------------------------------------------------------------------------------------------------------------- ④5、盐酸与某些盐(碳酸钠、碳酸钙、硝酸银、碳酸钾)反应①②------------------------------------------------------------------------------------------------------------------ ③--------------------------------------------------------------------------------------------------------------- ④(二)硫酸的化学性质:1、硫酸能使紫色石蕊变红2、硫酸与活泼金属(铁、锌、镁、铝)反应①②------------------------------------------------------------------------------------------------------------------- ③---------------------------------------------------------------------------------------------------------------- ④3、硫酸与金属氧化物(氧化铜、氧化铁、氧化铝、氧化镁)反应①②------------------------------------------------------------------------------------------------------------------- ③---------------------------------------------------------------------------------------------------------------- ④4、硫酸与碱(氢氧化铜、氢氧化钠、氢氧化镁、氢氧化钙)反应①②------------------------------------------------------------------------------------------------------------------- ③---------------------------------------------------------------------------------------------------------------- ④5、硫酸与某些盐(碳酸钠、氯化钡、硝酸钡、碳酸钾)反应①②------------------------------------------------------------------------------------------------------------------- ③--------------------------------------------------------------------------------------------------------------- ④(三)氢氧化钠的化学性质:1、氢氧化钠溶液能使紫色石蕊变蓝;能使无色酚酞变红。
2、氢氧化钠溶液能与酸性氧化物(二氧化碳、三氧化硫、二氧化硫)反应①②------------------------------------------------------------------------------------------------------------------- ③----------------------------------------------------------------------------------------------------------------3、氢氧化钠溶液能与酸(硫酸、盐酸、硝酸、亚硫酸)反应①②------------------------------------------------------------------------------------------------------------------- ③---------------------------------------------------------------------------------------------------------------- ④4、氢氧化钠溶液能与某些盐溶液(硫酸铜、氯化铁、硫酸镁、氯化铝)反应①②------------------------------------------------------------------------------------------------------------------ ③----------------------------------------------------------------------------------------------------------------- ④(四)氢氧化钙的化学性质:1、氢氧化钙溶液能使紫色石蕊变蓝;能使无色酚酞变红。
2、氢氧化钙溶液能与酸性氧化物(二氧化碳、三氧化硫、二氧化硫)反应①②------------------------------------------------------------------------------------------------------------------- ③---------------------------------------------------------------------------------------------------------------3、氢氧化钙溶液能与酸(硫酸、盐酸、硝酸、亚硫酸)反应①②-------------------------------------------------------------------------------------------------------------------③----------------------------------------------------------------------------------------------------------------④4、氢氧化钙溶液能与某些盐溶液(硫酸铜、氯化铁、硫酸镁、碳酸钠)反应①②-------------------------------------------------------------------------------------------------------------------③----------------------------------------------------------------------------------------------------------------④(五)盐的化学性质:1、盐(硫酸铜、硝酸银、氯化锌、硝酸汞)溶液与金属(镁、铁、铜、铝)反应①②------------------------------------------------------------------------------------------------------------------③---------------------------------------------------------------------------------------------------------------④2、盐(硫酸铜、氯化铁、氯化镁)溶液与碱(氢氧化钠、氢氧化钙、氢氧化钾)溶液反应①②-------------------------------------------------------------------------------------------------------------------③----------------------------------------------------------------------------------------------------------------④3、盐(硫酸铜、氯化铁、氯化镁、氯化钠)溶液与盐(硝酸银、氯化钙、碳酸钾、硝酸钡)溶液反应①②------------------------------------------------------------------------------------------------------------------③----------------------------------------------------------------------------------------------------------------④4、盐(硝酸银、氯化钡、碳酸钾、硝酸钡)溶液与酸(盐酸、硫酸、)溶液反应①②------------------------------------------------------------------------------------------------------------------③---------------------------------------------------------------------------------------------------------------④。
